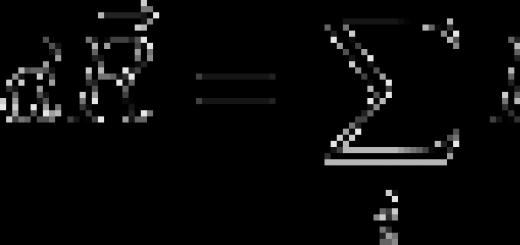التكافؤ.
الصياغة الصيغ الكيميائية
بالتكافؤ
الصف 8
نوع الدرس.مجموع.
طرق التدريس.البحث الجزئي ، الاستقصاء الإنجابي ، المبرمج ، المحادثة مع عناصر المحاضرة.
نقوش للدرس."كل مادة ، من الأبسط إلى الأكثر تعقيدًا ، لها ثلاثة جوانب مختلفة ولكنها مترابطة: الخصائص ، والتركيب ، والبنية ..." (BM Kedrov).
الأهداف.تعليمي: ضع في اعتبارك مفهوم "التكافؤ" على أنه ذرية عنصر ، وتعريف الطلاب بأنواع مختلفة من التكافؤ (أعلى وأدنى ، متغير وثابت).
نفسية: إثارة الاهتمام بالموضوع ، وتنمية القدرة على التفكير المنطقي ، والتعبير عن أفكار المرء بكفاءة.
تربوية: لتنمية القدرة على العمل الجماعي ، وتقييم إجابات رفاقهم.
معدات.عارضات ازياء جزيئات الماء، وثاني أكسيد الكربون ، ومجموعات لبناء نماذج من جزيئات من مواد مختلفة ، وبطاقات فردية للتحقق من الواجبات المنزلية والعمل المستقل للطلاب في مجموعة ، وأقراص الجناس الناقص للإحماء الكيميائي ، ومقياس لتحديد الحالة العاطفيةطالب علم.
أثناء الفصول
مرحلة التوجيه - التحفيز
الاحماء النفسي
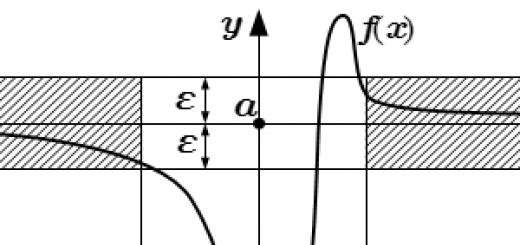
الغرض من الإحماء هو تحديد الحالة العاطفية للطلاب. كل طالب لديه لوحة من ستة وجوه ملصقة على الغلاف الداخلي للدفتر - مقياس لتحديد الحالة العاطفية (الشكل). يضع كل طالب علامة تحت وجهه ، يعكس تعبيرها مزاجه.
مدرس. سيكون من الرائع أن يتمكن الجميع في نهاية الدرس من تحريك العلامة على الأقل خلية واحدة إلى اليسار.
للقيام بذلك ، عليك التفكير في الأسئلة: هل يمكن لشخص أن يقع في حب موضوع لا يثير اهتمامه كثيرًا؟ ما الذي أنا بحاجة لفعله؟
الاحماء الكيميائي
يتم إعداد الإحماء وإجرائه من قبل الطلاب.
طالب علم. الجناس الناقصة هي الكلمات التي تم عكس ترتيب الحروف بها. حاول حل بعض الجناس الناقصة الكيميائية. أعد ترتيب الحروف في كل كلمة واحصل على اسم العنصر الكيميائي. انتبه للتلميح.
"أودوفرود" - يحتوي هذا العنصر على أصغر كتلة ذرية نسبية.
"Mailinuy" - يسمى هذا العنصر بالمعدن "المجنح".
"Tyurt" - الواردة في ميزان حرارة طبي.
"تسالكي" - لولاها لكانت عظامنا هشة وهشة.
"Rosfof" - مادة تتكون من ذرات هذا العنصر ، تم تلطيخها بشعر كلب Baskervilles.
مدرس. إذا كان يمكنك بسهولة تخمين كلمات الجناس الناقص ، قل لنفسك: "لقد انتهيت!"
العلامات الكيميائية والصيغ الكيميائية
(فحص الواجب المنزلي)
العمل الفرديعلى لوحة البطاقة.
الإملاء الرقمي
يتحكم الطلاب في تنفيذ الإملاء بطريقة التحقق المتبادل.
يمارس. ضع 1 بجانب العبارات الصحيحة و 0 بجانب العبارات الخاطئة.
1. العنصر الكيميائي هو نوع معين من الذرات.
2. في كل خلية من جدول D.I. Mendeleev ، بالإضافة إلى تسمية العنصر واسمه ، تمت كتابة رقمين: الأول هو الكتلة الذرية النسبية للعنصر ، والسفلي هو الرقم التسلسلي.
3. تم تسمية عنصر الغاليوم الكيميائي باسم فرنسا.
4. في جدول D.I. Mendeleev ، يتم ترتيب العناصر ، كقاعدة عامة ، بترتيب تنازلي من الكتل الذرية.
5. قيم الكتلة الذرية النسبية وكتلة الذرة معبراً عنها في أ. البريد م ، لا تتطابق عدديًا أبدًا.
6. تسمى المواد البسيطة بالمواد المكونة من ذرات عنصر واحد.
8. يوضح جزء الكتلة لعنصر ما الجزء (الحصة) الذي يمثل كتلة هذا العنصر من الكتلة الكلية للمادة.
9. الوزن الجزيئي النسبي للماء H 2 O هو 20.
10. الجزء الكتلي من الكالسيوم في أكسيد الكالسيوم CaO هو 71٪.
الإجابات الصحيحة: ١ - ١ ، ٢ - ٠ ، ٣ - ١ ، ٤ - ٠ ، ٥ - ٠ ، ٦ - ١ ، ٧ - ٠ ، ٨ - ١ ، ٩ - ٠ ، ١٠ - ١.
المرحلة التشغيلية والتنفيذية
مدرس. أنت تعلم أن الصيغ الكيميائية للمواد تُظهر النسب الكمية التي تتحد فيها الذرات مع بعضها البعض ، وتعلمت أيضًا كيفية حساب الكسر الكتلي لعنصر ما من الصيغة الكيميائية للمادة. على سبيل المثال ، في الماء H 2 O يوجد ذرتان هيدروجين لكل ذرة أكسجين أي 11٪ح و 89٪س. في ثاني أكسيد الكربونثاني أكسيد الكربون هناك ذرتان من الأكسجين لكل ذرة كربون.(عرض نماذج لجزيئات هذه المواد.)
التكافؤ
مدرس. التكافؤ هو قدرة الذرات على ربط عدد معين من الذرات الأخرى بنفسها.
تتحد ذرة واحدة من عنصر أحادي التكافؤ مع ذرة واحدة من عنصر أحادي التكافؤ (HF ، NaCl) . تتحد ذرتان أحاديتان مع ذرة عنصر ثنائي التكافؤ(H2O) أو ذرة ثنائية التكافؤ(كاو) . وسائل، عنصر التكافؤويمكن تمثيله كرقم يوضح عدد ذرات العنصر أحادي التكافؤ التي يمكن أن تتحد معها ذرة هذا العنصر.
قواعد تحديد التكافؤ
عناصر في الاتصالات
يتم أخذ تكافؤ الهيدروجين كما أنا (واحد). بعد ذلك ، وفقًا لصيغة الماء H 2 O ، يتم ربط ذرتين من الهيدروجين بذرة أكسجين واحدة.
يظهر الأكسجين في مركباته دائمًا التكافؤ II. لذلك ، الكربون في مركب CO 2 ( نشبع) لديه التكافؤ الرابع.
مدرس.كيفية تحديد تكافؤ عنصر بناءً على جدول D.I. Mendeleev؟
بالنسبة للمعادن في المجموعات أ ، فإن التكافؤ يساوي رقم المجموعة.
في غير المعادن ، يظهر تكافؤان بشكل أساسي: أعلى وأدنى (مخطط).

أعلى تكافؤ يساوي رقم المجموعة.
أدنى تكافؤ يساوي الفرق بين الرقم 8 (عدد المجموعات في الجدول) وعدد المجموعة التي يقع فيها هذا العنصر.
مدرس.على سبيل المثال: يحتوي الكبريت على تكافؤ أعلى VI وأقل تكافؤ (8-6) يساوي II ؛ يعرض الفوسفور التكافؤ الخامس والثالث.
يمكن أن تكون التكافؤ ثابتًا (لعناصر المجموعات الفرعية الرئيسية لجدول DI Mendeleev) أو متغيرًا (لعناصر المجموعات الفرعية الثانوية في الجدول) ، لكنك ستتعرف على هذه الظاهرة بعد قليل ، وإذا كنت مهتمًا ، فاقرأ كتاب الصف التاسع.
يجب معرفة تكافؤ العناصر من أجل تكوين الصيغ الكيميائية للمركبات. للقيام بذلك ، من الملائم استخدام الجدول التالي.
الطاولة
خوارزمية لتجميع صيغة المركب P و O
التسلسل |
صياغة أكسيد الفوسفور |
1. اكتب رموز العناصر |
|
2. تحديد التكافؤات للعناصر |
|
3. أوجد المضاعف المشترك الأصغر القيم العدديةالتكافؤ |
|
4. أوجد النسب بين ذرات العناصر بقسمة المضاعف الأصغر الموجود على التكافؤات المقابلة للعناصر |
10: 5 = 2, 10: 2 = 5; |
5. اكتب الفهارس في رموز العناصر |
|
6. صيغة المركب (أكسيد) |
مدرس. تذكر قاعدتين أخريين لتجميع الصيغ الكيميائية للمركبات غير المعدنية مع بعضها البعض.
1) يظهر التكافؤ الأدنى من خلال العنصر الموجود في جدول D.I. Mendeleev إلى اليمين وما فوق ، وأعلى تكافؤ هو العنصر الموجود على اليسار وأسفل. (عرض توضيحي لجدول دي منديليف.)
على سبيل المثال ، بالاقتران مع الأكسجين ، يُظهر الكبريت تكافؤًا أعلى VI ، بينما يُظهر الأكسجين أقل II. لذا فإن صيغة أكسيد الكبريت ستكون SO 3.
في مزيج من السيليكون والكربون ، يُظهر الأول تكافؤًا أعلى IV ، والثاني - IV أقل. إذن الصيغة هي SiC. إنه كربيد السيليكون ، أساس المواد المقاومة للحرارة والكاشطة.
2) في صيغ المركبات ، تأتي الذرة غير المعدنية ، التي تظهر أدنى تكافؤ ، دائمًا في المرتبة الثانية ، وينتهي اسم هذا المركب بالحرف "id".
على سبيل المثال ، تساو - أكسيد الكالسيوم،كلوريد الصوديوم - كلوريد الصوديوم، PbS - كبريتيد الرصاص.
الآن يمكنك أنت نفسك كتابة الصيغ الخاصة بأي مركبات من المعادن غير الفلزية.
نص العمل مكتوب مسبقًا على السبورة. طالبان يحلان المشكلة على ظهر اللوحة ، والباقي في دفاتر ملاحظات.
التمرين 1.
تحقق مما إذا كانت صيغ المركبات التالية مكتوبة بشكل صحيح: Na 2 S، KBr، Al 2 O 3،
Mg3N2 ، MgO.
المهمة 2. اكتب الصيغ لمركبات المعادن غير الفلزية: الكالسيوم بالأكسجين ، والألمنيوم بالكلور ، والصوديوم بالفوسفور. قم بتسمية هذه المركبات.
بعد الانتهاء من العمل ، يتبادل الطلاب دفاتر الملاحظات ، ويتم إجراء فحص متبادل. يمكن للمدرس أن يراجع بعض دفاتر الملاحظات بشكل انتقائي ، ويمدح الطلاب الذين أكملوا الأسرع وارتكبوا أقل أخطاء.
توحيد المواد المدروسة
محادثة مع الطلاب حول الأسئلة
1) ما هو التكافؤ؟
2) لماذا تسمى التكافؤ أحيانًا ذرية عنصر؟
3) ما هي تكافؤ الهيدروجين والأكسجين؟
4) ما قيمتا التكافؤ التي يمكن أن تظهرها اللافلزات؟
5) كيفية تحديد التكافؤات الدنيا والعليا من اللافلزات؟
6) كيف تجد المضاعف المشترك الأصغر بين القيم العددية للتكافؤ؟
7) هل يمكن للذرات في المركب أن يكون لها تكافؤات حرة؟
8) أي من المعدنين غير المعدنين في الصيغة الكيميائية لمركبهما يحتل المرتبة الأولى ، وأيهما -
الثاني؟ اشرح استخدام أكسيد NO 2 كمثال ، باستخدام جدول D.I. Mendeleev.
العمل الإبداعي في مجموعات
يمارس. باستخدام مجموعات النمذجة الجزيئية للمواد المختلفة ، قم بإنشاء صيغ ونماذج جزيئية للمركبات التالية:
المجموعة الأولى - النحاس والأكسجين ،
المجموعة الثانية - الزنك والكلور ،
المجموعة الثالثة - البوتاسيوم واليود ،
المجموعة الرابعة - المغنيسيوم والكبريت.
بعد انتهاء العمل ، يقوم طالب واحد من المجموعة بالإبلاغ عن المهمة المكتملة ويقدم مع الفصل تحليلاً للأخطاء.
واجب منزلي. وفقًا للكتاب المدرسي "Chemistry-8" L.S Guzeya: § 3.1 ، التخصيصات رقم 3 ، 4 ، 5 ، ص. 51. أولئك الذين يرغبون يمكنهم إعداد تقارير عنها عالم فرنسيجيه إل بروست و عالم إنجليزيدالتون.
مرحلة تأملية-تقييمية وتلخيص الدرس
إعلان درجات الدرس للطلاب الذين أجابوا ، وشكر الجميع على عملهم في الدرس. لتقييم الحالة العاطفية على مقياس (انظر الشكل). يقوم المعلم مرة أخرى بتذكير الأسئلة التي يجب مراعاتها للعمل الفعال في الدرس التالي.
المؤلفات
Guzey L.S.، Sorokin V.V.، Surovtseva R.P.الكيمياء -8 ، م: بوستارد ، 2000 ؛ Tyldsepp A.A.، Kork V.A.نحن ندرس الكيمياء. م: التنوير ، 1988 ؛ Bukreeva R.V. ، Bykanova T.A.دروس التقنيات الجديدة في الكيمياء. فورونيج ، 1997.
درس الكيمياء بالصف الثامن رقم 14
موضوعات: رسم صيغ المركبات بالتكافؤ.
الغرض من الدرس: لتعليم كيفية تطبيق المعرفة المكتسبة لإجراء العمليات الحسابية على تجميع الصيغ لتكافؤ المادة.
مخرجات التعلم المخطط لها:
يجب أن يكون الطلاب قادرين على صياغة تعريف "التكافؤ" ، ومعرفة تكافؤ ذرات الهيدروجين والأكسجين في المركبات ، وتحديد تكافؤ ذرات العناصر الأخرى في المركبات الثنائية منه ،
تكون قادرًا على شرح معنى مفهوم "التكافؤ" وتسلسل الإجراءات في تحديد تكافؤ ذرات العناصر وفقًا لصيغ المواد.
الأشكال التنظيمية: المحادثة والمهام الفردية والعمل المستقل.
وسائل التعليم: خوارزمية لتحديد التكافؤ بواسطة صيغ المواد وتجميع الصيغ الكيميائية للمركبات بواسطة تكافؤ العنصر
معدات العرض: العرض
تجهيزات للطلاب: "خوارزمية لتجميع الصيغ الكيميائية بالتكافؤ".
خلال الفصول
1. المرحلة التقريبية والتحفيزية.
.مدرس.اليوم سنقوم برحلة إلى بلاد هيملاند ، حيث يوجد أكثر من مائة ألف مختلف مواد كيميائية. سيكون هناك العديد من العوائق في الطريق ، لذلك عليك استخدام كل ما تبذلونه من القدرات العقليةالمعرفة المكتسبة في الدروس السابقة. قبل الخروج ، دعنا نحمي.
الاحماء الكيميائي
المهام على الموضوعات المغطاة
1. ابحث عن "مادة إضافية" ، أي مجموعة لا تشكل مجموعة متجانسة مع البقية: H 2 SO 2 Na Br 2 Al 2 O 3 N 2 O 5 (N a ذرة بين الجزيئات)
2- ابحث عن "مادة إضافية" ، أي مجموعة لا تشكل مجموعة متجانسة مع البقية: O 2 N 2 Ca O Mg Li Na (Ca O مادة معقدة ، من بين المواد البسيطة)
مدرس. الآن نحن بحاجة لحزم أمتعتهم للرحلة.
3. اختر أسماء الأجسام: ذهب ، بارافين ، عبوة ، زجاج ، كوب ، قلم رصاص ، مصباح يدوي ، ماء ، شمعة.
4. أختر مواد نقية: هواء، الزئبق، مياه البحر, الملح والفضة والهيدروجين، نفط، حديد،ضباب.
لدينا صخور في الطريق. نحن بحاجة لبناء جسر.
5. طابق الرمز الكيميائي لعنصر ما باسمه
الآن لدينا نهر في طريقنا. من أجل اجتيازها ، يجب عليك إكمال المهمة التالية.
6. كيف تنطق صيغ المواد التالية؟ CuO، ZnO، P 2 O 5، NO 2، SO 3، Al 2 O 3، H 2 O، SO 2.
أحسنت صنعًا ، علينا المرور عبر الغابة
عمل السبورة
1. حساب النسبي الوزن الجزيئي الغراميمن هذه المواد: Naأنا, CuO
2. احسب الوزن الجزيئي النسبي لهذه المواد:ال 2 ا 3 , MgO
( يؤدي الفصل في دفتر ملاحظات)
لقد أكملنا جميع المهام. أتقنه!
ثانيًا. المرحلة التشغيلية والتنفيذية.
تحديث المعرفة الأساسية
المرحلة الأخيرة هي جبل مرتفع. أمامنا ليست مهمة سهلة ، نحن بحاجة إلى الكثير من الجهد من أجل النهوض ، وستساعدنا معرفتنا.تذكر كيف ترتبط العناصر ببعضها البعض؟
حدد التكافؤ.
التكافؤ هو خاصية الذرات للاحتفاظ بعدد معين من الذرات الأخرى في مركب.
كيف يتم تعريف التكافؤ؟ (يشار إلى التكافؤ بالأرقام الرومانية)
ما هي أنواع التكافؤ؟ (ثابت ومتغير)
قبل الصعود الصعب للصعود ، دعنا نقوم بعملية إحماء أخرى.
تمرين: تحديد تكافؤ العناصر في المواد (كرة الثلج ، كل منها يحدد التكافؤ ويمرر الانتقال إلى الآخر)ال 2 ا 3 , ZnO, لذا 3 , ك 2 ا, كي, كو 2 , نا 2 ا, ص 2 ا 5
قل لي ، هل من الضروري معرفة تكافؤ العناصر الكيميائية؟ (لعمل الصيغ الكيميائية للمركبات).
رسالة الموضوع
دعنا نكتب موضوع الدرس في دفتر ملاحظات. ما هو هدفنا؟
لذا ، نحن الآن بحاجة إلى المرور بجبلنا بأمان وسليمة ، ولهذا نحتاج إلى تعلم القواعد.
خوارزمية لتجميع صيغة كيميائية بتكافؤ عنصر.
التسلسلصياغة أكسيد الفوسفور
1. اكتب رموز العناصر
ص
2. تحديد التكافؤات للعناصر
سابعا
ص
3. أوجد المضاعف المشترك الأصغر للقيم العددية للتكافؤ
5 2 = 10
4. أوجد النسب بين ذرات العناصر بقسمة المضاعف الأصغر الموجود على التكافؤات المقابلة للعناصر
10: 5 = 2, 10: 2 = 5;
P: O = 2: 5
لقد تعلمنا القواعد بالفعل ، سنبدأ في الصعود.
تمرين: كتابة الصيغ الكيميائية حسب تكافؤ العناصر. المهمة في المصنف (العمل مع الكتاب المدرسي)
ثالثا. المرحلة الانعكاسية التقييمية.
وصلنا إلى المكان بأمان ، يمكننا أن نرتاح.
الاختبار الأساسي لإتقان المعرفة.
أثناء ثلاث دقائقيجب عليك إكمال واحدة من ثلاث مهام اختيارية. اختر المهمة التي يمكنك التعامل معها فقط.
اصنع الصيغ الكيميائية حسب تكافؤ العناصر أ LCl,
KO,
CuO (
ثانيًا),
sns(
رابعا)
اصنع صيغ الأكاسيد:ن (
رابعا),
مينيسوتا (
سابعا) ,
س (
السادس),
نا (
أنا)
,
سجل تجاري (
ثالثا).
صحح الأخطاء التي حدثت في بعض الصيغ: لا 3, بو 3, MgO 2 , علي 2 , NaS
رابعا. تلخيص الدرس
اليوم قمنا برحلة ، أخبرني ، هل أعجبك ذلك؟ ما هي المعرفة التي جلبتها من الرحلة؟
الواجب المنزلي: فقرة الكتاب المدرسي.
بطاقات المهام
تكوين صيغ المواد
"3" NaO ، CO (IV) ، BO (III)
"4"SnO (IV) ، FeO (III) ، MnO (VI)
العقيدة الجزيئية الذرية. الذرات. جزيئات. التركيب الجزيئي وغير الجزيئي للمادة. الكتلة الذرية والجزيئية النسبية. قانون حفظ الكتلة ، أهميته في الكيمياء. الخلد هو وحدة كمية المادة. الكتلة المولية. قانون أفوجادرو والحجم المولي للغاز. الكثافة النسبية للمادة.
موضوع الكيمياء. الظواهر الكيميائية والفيزيائية.
الكيمياء هي علم المواد وتحولاتها. يدرس تكوين وبنية المواد ، واعتماد خواصها على التركيب ، وشروط وطرق تحويل مادة إلى أخرى.
الكيمياء ذات أهمية عملية كبيرة. منذ آلاف السنين ، استخدم الإنسان الظواهر الكيميائية في صهر المعادن من الخامات ، والحصول على السبائك ، وصهر الزجاج ، وما إلى ذلك في عام 1751. م. كتب لومونوسوف في كتابه الشهير "خطبة عن فوائد الكيمياء": "الكيمياء تنشر أيديها في الشؤون الإنسانية. أينما ننظر ، أينما ننظر إلى الوراء - في كل مكان تتحول نجاحات تطبيقه أمام أعيننا.
في عصرنا ، دور الكيمياء في حياة المجتمع لا يقاس. المعرفة الكيميائيةلقد وصلت الآن إلى هذا المستوى من التطور الذي ، على أساسها ، تتغير الأفكار حول طبيعة وآلية عدد من العمليات الطبيعية والتكنولوجية الهامة بشكل جذري. ساعدتنا الكيمياء في اكتشاف واستخدام ليس فقط خصائص المواد والمواد غير المعروفة سابقًا ، ولكن أيضًا لإنشاء مواد ومواد جديدة غير موجودة في الطبيعة.
المادة هي نوع من المواد التي لها خصائص فيزيائية ثابتة في ظل ظروف معينة.ومع ذلك ، مع تغير الظروف ، تتغير خصائص المادة.
أي تغييرات تحدث مع المادة تسمى ظواهر.الظواهر الفيزيائية والكيميائية على حد سواء.
تسمى الظواهر الفيزيائية مثل هذه الظواهر التي تؤدي إلى تغيير في الشكل وحالة التجميع ودرجة حرارة المادة دون تغيير تكوينها.لا يتغير التركيب الكيميائي للمادة نتيجة لظاهرة فيزيائية. على سبيل المثال ، يمكن أن يتحول الماء إلى جليد ، إلى بخار ، لكنه التركيب الكيميائيبينما تبقى على حالها.
تسمى الظواهر الكيميائية مثل هذه الظواهر التي يحدث فيها تغيير جذري في تكوين وخصائص المواد.نتيجة للظواهر الكيميائية ، تتحول بعض المواد إلى مواد أخرى ، أي يتغير تكوين الجزيئات ، تتشكل جزيئات مادة أخرى. ومع ذلك ، تبقى الذرات في التفاعلات الكيميائية دون تغيير. مثال على ذلك هو تحلل الحجر الجيري:
كربونات الكالسيوم CaCO3 → CaO + CO2
تسمى الظواهر الكيميائية بخلاف ذلك التفاعلات الكيميائية. السمات المميزةالظواهر الكيميائية (التفاعلات): إطلاق الحرارة ، والغاز ، والتساقط ، وتغير اللون ، والرائحة. في الظواهر الفيزيائيةهذا لا يمكن ملاحظته.
الأساس النظري للكيمياء الحديثة هو النظرية الذرية والجزيئية.
الذرات هي أصغر الجزيئات الكيميائية التي هي حد التحلل الكيميائي لأي مادة.
العنصر الكيميائي هو نوع من الذرات له نفس الشحنة النووية الموجبة.
لذلك، الذرة هي أصغر جسيم في عنصر كيميائي يحتفظ بجميع خواصه الكيميائية.حاليًا ، يُعرف 110 عنصرًا ، يوجد 92 منها في الطبيعة.
اعتمادًا على طبيعة الجسيمات التي تتكون منها المادة ، يتم تمييز المواد ذات التركيب الجزيئي وغير الجزيئي. الكل تقريبا المواد العضوية(أي الغالبية العظمى من المواد المعروفة) تتكون من جزيئات. ضمن مركبات غير عضويةحوالي 5٪ لها بنية جزيئية. وبالتالي ، فإن الشكل الأكثر شيوعًا لوجود المادة هو الجزيء.
الجزيء هو أصغر جزء من مادة يمكن أن يوجد بشكل مستقل ويحتفظ بخصائصه الكيميائية الأساسية.
في ظل الظروف العادية ، يمكن أن تكون المواد ذات التركيب الجزيئي صلبة أو سائلة أو الحالة الغازية. توجد المواد ذات التركيب غير الجزيئي فقط في الحالة الصلبة ، وفي الغالب في شكل بلوري. إن ناقلات الخواص الكيميائية لهذه المواد ليست جزيئات ، بل مجموعات من الذرات أو الأيونات التي تشكل هذه المادة.
يسمى السجل الرمزي لأبسط نسبة عددية حيث تشكل ذرات العناصر المختلفة مركبًا كيميائيًا معادلة.لذلك ، تعبر الصيغة عن تركيبة معينة (نوعية وكمية) للمركب. إذن ، SO2 ، N2 ، CO هي صيغ من مواد لها بنية جزيئية. تكوينها دائمًا ثابت تمامًا. كلوريد الصوديوم ، AlF3 ، ZnS - صيغ المواد التي ليس لها بنية جزيئية في ظل الظروف العادية. لا يكون تكوين هذه المواد دائمًا ثابتًا وغالبًا ما يعتمد على شروط تحضيرها. يمكن التعبير عن الانحراف عن النسبة الصحيحة بكتابة الصيغة: Fe0.9S، TiO0.7، ZrN0.69. تسمى المواد ذات التركيب الثابت دالتونيد ،مواد ذات تكوين متغير بيرثوليد.
كتل ذرات العناصر الكيميائية صغيرة للغاية. في الكيمياء ، لا يستخدمون قيمهم المطلقة ، بل القيم النسبية.
الكتلة الذرية النسبية للعنصر الكيميائي Ar هي القيمة ، يساوي النسبةمتوسط كتلة ذرات عنصر معين (مع مراعاة النسبة المئوية لنظائره في الطبيعة) إلى 1/12 من كتلة نظائر الكربون - 12. 1/12 من كتلة ذرة من نظير الكربون 12 تؤخذ على أنها وحدة كتلة ذرية(صباحًا) ، التعيين الدولي - ش.
الكتلة الذرية النسبية هي كمية بلا أبعاد.
الوزن الجزيئي النسبي M لمادة هو نسبة كتلة جزيئها إلى 1/12 من كتلة ذرة نظير الكربون 12.
منذ الأغلبية مواد غير عضويةفي ظل الظروف العادية لا تملك التركيب الجزيئي، في هذه الحالة يمكننا التحدث عنها وزن الصيغة F ،بمعنى أنه مجموع الكتل الذرية لجميع العناصر المدرجة في المركب ، مع مراعاة عدد ذرات كل عنصر في الصيغة.
وحدة قياس كمية المادة n (ν) في النظام الدولي للوحدات هي خلد.
الخلد - كمية مادة تحتوي على العديد من الوحدات الأولية الهيكلية (ذرات ، أيونات ، جزيئات ، إلكترونات ، مكافئات ، إلخ) حيث توجد ذرات في 0.012 كجم من نظير الكربون 12.
من السهل تحديد عدد ذرات NA في 0.012 كجم من الكربون (أي في 1 مول) ، مع معرفة كتلة ذرة الكربون. القيمة الدقيقة لهذه الكمية هي 6.02 10²³. هذه القيمة تسمى أفوجادرو المستمروهو من أهم الثوابت الكونية. إنه يساوي الرقم الوحدات الهيكليةفي 1 مول من أي مادة.
تسمى كتلة 1 مول من المادة X. الكتلة المولية M (X) ويمثل نسبة كتلة م لهذه المادة إلى كميتها ن.
قانون حفظ الكتلة: "كتلة المواد التي دخلت فيها تفاعل كيميائي، تساوي كتلة المواد المتكونة نتيجة التفاعل ، مع مراعاة الكتلة المقابلة للتأثير الحراري للتفاعل.صاغه العالم الروسي العظيم إم في لومونوسوف عام 1748. وأثبت تجريبيا بنفسه عام 1756. وبشكل مستقل عنه من قبل الكيميائي الفرنسي أل لافوازييه في عام 1789.
قانون ثبات تكوين المادة: "أي مادة معقدة ذات بنية جزيئية ، بغض النظر عن طريقة التحضير ، لها تركيبة كمية ثابتة."
قانون أفوجادرو: "أحجام متساوية من غازات مختلفة تحت نفس الظروف تحتوي على نفس عدد الجزيئات."
الآثار: 1. إذا كان عدد جزيئات بعض الغازات متساويًا ، فعند n.o. يشغلون أحجامًا متساوية.إذا كان عدد الجزيئات 6.02 10²³ ، فإن حجم الغاز هو 22.4 لترًا. هذا الحجم يسمى الحجم المولي.
1. الكثافة المطلقة للغاز تساوي نسبة وزنه الجزيئي إلى الحجم المولي
2. الكثافة النسبية للغاز (X) على غاز آخر (Y) تساوي نسبة الكتلة المولية للغاز (X) إلى الكتلة المولية للغاز (Y).
معادلة كلابيرون:
معادلة بويل ماريوت:
معادلة تشارلز جاي لوساك:
| |
عنصر كيميائي. مواد بسيطة ومعقدة. الصيغ الكيميائية.
يسمى نوع الذرة الذي له نفس الخصائص الكيميائية عنصر.يمكن أن تختلف ذرات نفس العنصر في الكتلة فقط. الخواص الكيميائيةلديهم نفس الشيء. هناك أنواع مختلفة من ذرات نفس العنصر تسمى النظائر.
يشير مفهوم "العنصر الكيميائي" بالتساوي إلى ذرات عنصر معين ، سواء في شكله الحر أو في المركبات.
تتكون الجزيئات من الذرات. اعتمادًا على ما إذا كان الجزيء يتكون من ذرات من نفس العنصر أو من ذرات من عناصر مختلفة ، يتم تقسيم جميع المواد إلى بسيطة ومعقدة.
المواد البسيطة هي تلك التي تتكون جزيئاتها من ذرات عنصر واحد.الجزيئات مواد بسيطةقد تتكون من واحد أو اثنين أو أكثرذرات عنصر واحد. في الوقت الحاضر ، حقيقة وجود نفس العنصر في حالة حرة في شكل عدد من الأشكال المختلفة أمر لا جدال فيه ، أي في شكل عدة مواد بسيطة.
يسمى وجود عنصر في شكل عدة مواد بسيطة التآصل.تسمى المواد البسيطة المكونة من نفس العنصر التعديلات المتآصلةهذا العنصر. تختلف هذه التعديلات في عدد وترتيب نفس الذرات في الجزيء.
المواد المعقدة أو المركبات الكيميائية هي تلك التي تتكون جزيئاتها من ذرات من عنصرين أو أكثر.الذرات التي تدخل في مركب كيميائي لا تبقى كما هي. هم يؤثرون على بعضهم البعض بشكل متبادل. الذرات في جزيئات مختلفة في حالات مختلفة.
الصيغة الكيميائية هي تمثيل لتكوين مادة من خلال العلامات الكيميائية.تشير الصيغ الكيميائية إلى جزيء المادة وتركيبها النوعي والكمي.
مفهوم مهم في الكيمياء التكافؤ . التكافؤ هو قدرة الذرة على الاندماج مع الذرات الأخرى بواسطة عدد معين من الروابط الكيميائية. يتم تحديد القيمة العددية للتكافؤ من خلال العدد الإجمالي للمدارات الذرية المشاركة في تكوين رابطة كيميائية:
| ↓ | |||
| ↓ | ↓ |
CO: C≡O C: 1s 2 2s 2 2p 2 التكافؤ: 3
O: 1s 2 2s 2 2p 4
كل ما سبق ينطبق على المركبات ذات الرابطة التساهمية. إذا كان العنصر يتشكل الرابطة الأيونيةثم يسمى التكافؤ متكافئ. لم تقل شيئًا عن عدد الاتصالات. أعلى تكافؤ يساوي عدد المجموعة التي يقع فيها العنصر ، ومع ذلك ، فإن N و O و F لها أعلى تكافؤ - 4. هذا يرجع إلى حقيقة أن ذرات هذه العناصر لا يمكن أن تدخل في حالة الإثارة بسبب عدم وجود مدارات شاغرة على التوربينات الريحية.
تعريف
تحت التكافؤإن خاصية ذرة عنصر معين لربط أو استبدال عدد معين من ذرات عنصر آخر. لذلك ، يمكن أن يكون مقياس التكافؤ هو عدد الروابط الكيميائية التي تشكلها ذرة معينة مع ذرات أخرى.
وهكذا ، في الوقت الحاضر ، يُفهم عادةً تكافؤ عنصر كيميائي على أنه قدرته (بمعنى أضيق ، مقياس لقدرته) على تكوين روابط كيميائية. في تمثيل طريقة سندات التكافؤ ، تتوافق القيمة العددية للتكافؤ مع الرقم روابط تساهميةالتي تشكل ذرة.
تجميع الصيغ الكيميائية بالتكافؤ
باستخدام العلامات الكيميائية لتكافؤ العناصر ، يمكنك عمل صيغة مادة معقدة. لهذا تحتاج إلى معرفة:
- العلامات الكيميائية للعناصر التي تتكون منها مادة معقدة ؛
- تكافؤ العناصر.
- القدرة على إيجاد المضاعف المشترك الأصغر لتكافؤات العناصر ؛
- لتحديد مؤشرات ذرات العناصر.
ضع في اعتبارك قواعد تجميع الصيغ الكيميائية للمركبات المعقدة عن طريق التكافؤ باستخدام مثال المواد غير العضوية من فئات مختلفة:
أ) أكاسيد
افترض أننا بحاجة إلى اشتقاق صيغة أكسيد الحديد (III). للقيام بذلك ، تحتاج إلى تنفيذ الخطوات التالية:
- نصور العلامات الكيميائية للعناصر التي تتكون منها المادة المعقدة:
- ضع تكافؤًا فوق علامة كل عنصر برقم روماني:
- ابحث عن المضاعف المشترك الأصغر لأعداد وحدات التكافؤ:
- نقسم المضاعف المشترك الأصغر على عدد وحدات التكافؤ لكل عنصر على حدة (ستكون الوحدات الخاصة الناتجة مؤشرات في الصيغة):
ب) القواعد والأملاح والأحماض
عند صياغة القواعد والأملاح ، يتم استخدام نفس الإجراءات عند تكوين الأكاسيد. الفرق الوحيد هو أنه بدلاً من ذرة الأكسجين ستكون هناك مجموعة هيدروكسو (OH) أو بقايا حمض (SO 4 ، SO 3 ، CO 3 ، NO 3 ، PO 4 ، SiO 3 ، S ، Cl ، إلخ).
لنفترض أننا بحاجة إلى اشتقاق صيغة هيدروكسيد الكالسيوم:
المضاعف المشترك II × I = 2
2/2 \ u003d 1 (لم يتم تعيين واحد) ؛
2/1 = 2 (يجب أن تكون OH بين قوسين) ؛
أمثلة على حل المشكلات
مثال 1
| يمارس | تحديد تكافؤ العناصر في المركبات التالية: أ) Mg 3 P 2 ؛ ب) Al 2 S 3 ؛ ج) Na 2 O ؛ د) AgCl ؛ ه) FeCl 3. |
| قرار | يجب أن يبدأ تحديد تكافؤ العناصر في مركب كيميائي بإشارة إلى تكافؤ عنصر معروف. في الخيار "أ" ، هذا هو المغنيسيوم ، لأن عناصر المجموعة IIA لها قيمة تكافؤ ثابتة تساوي رقم المجموعة ، أي ثانيًا. نكتب صيغة المادة ونشير بالأرقام الرومانية إلى تكافؤ العنصر المعروف: نجد أصغر مضاعف لعدد وحدات التكافؤ. للقيام بذلك ، نضرب قيمة تكافؤ المغنيسيوم في عدد ذرات هذا العنصر في المركب (3): لتحديد تكافؤ الفوسفور ، نقسم أصغر مضاعف لعدد وحدات التكافؤ على عدد ذرات الفوسفور في المركب (2): وهذا يعني أن تكافؤ الفوسفور هو III: Mg II 3 P III 2. وبالمثل ، نحدد تكافؤات العناصر في المركبات الأخرى: ب) Al III 2 S II 3 ؛ ج) Na I 2 O II ؛ د) Ag I Cl I ؛ ه) Fe III Cl I 3. |
| إجابه | أ) Mg II 3 P III 2 ؛ ب) Al III 2 S II 3 ؛ ج) Na I 2 O II ؛ د) Ag I Cl I ؛ ه) Fe III Cl I 3 |
مثال 2
| يمارس | تحديد تكافؤ العناصر في المركبات التالية: أ) CuO ؛ ب) Au 2 O ؛ ج) PbO 2 ؛ د) Li 3 N ؛ ه) AlF3. |
| قرار | يجب أن يبدأ تحديد تكافؤ العناصر في مركب كيميائي بإشارة إلى تكافؤ عنصر معروف. في الخيار "أ" - هذا هو الأكسجين ، لأن تكافؤه دائمًا يساوي II: ضع القيمة الناتجة على يمين علامة كيميائيةهذا العنصر المشار إليه بالأرقام العربية: الآن نقسم الرقم الإجماليوحدات التكافؤ لكل عدد من الذرات (الفهرس) لعنصر معروف التكافؤ: نضع حاصل القسمة الناتج (2) برقم روماني على العنصر المطلوب باعتباره التكافؤ: هذا يعني أن تكافؤ العناصر في مركب CuO هو: للنحاس - II وللأكسجين - II. وبالمثل ، نحدد تكافؤات العناصر في المركبات الأخرى: ب) Au I 2 O II ؛ ج) الرصاص الرابع O II 2 ؛ د) Li I 3 N II ؛ هـ) Al III F I 3. |
| إجابه | أ) Cu II O II ؛ ب) Au I 2 O II ؛ ج) الرصاص الرابع O II 2 ؛ د) Li I 3 N II ؛ هـ) Al III F I 3 |
موضوع الدرس: وضع الصيغ الكيميائية للمركبات الثنائية عن طريق التكافؤ.
"في دراسة علميةموضوعات هدفين رئيسيين أو نهائيين: البصيرة والاستفادة "
دي آي مينديليف
الأهداف:
تعليمي: ضع في الاعتبار مفهوم "التكافؤ" باعتباره ذرية عنصر ، وقم بتعليم الطلاب تحديد التكافؤ في المركبات الثنائية ، وتعريف الطلاب بأنواع مختلفة من التكافؤ ، وكرر مفاهيم مضاعف رقم معين ، والمضاعف المشترك الأصغر لعدة أرقام ، كرر قاعدة إيجاد المضاعف المشترك الأصغر لعدة أرقام وتطبيق هذه القاعدة ؛ لفت انتباه الطلاب إلى دمج مقررات الكيمياء والرياضيات.
النامية:طور الاهتمام المعرفييطور الطلاب القدرة على التفكير المنطقي ، وتطبيق المعرفة المكتسبة سابقًا والتعبير عن أفكارهم بكفاءة.
التعليمية:لتعزيز تعليم الاهتمام بالموضوع ، نتيجة لعملهم ، لتطوير القدرة على العمل في أزواج ، بشكل جماعي ، لتقييم إجابات رفاقهم.
مخرجات التعلم المخطط لها:
يجب أن يعرف الطلاب:
تعريف مفهوم التكافؤ؛
تكافؤ ذرات الهيدروجين والأكسجين في المركبات.
يجب أن يكون الطلاب قادرين على:
تحديد تكافؤ ذرات العناصر الأخرى في المركبات الثنائية بتكافؤ ذرات الهيدروجين والأكسجين ؛
تحديد تكافؤ ذرات العناصر وفقًا لصيغ المواد باستخدام خوارزمية لحل المشكلات.
مفاهيم أساسية:التكافؤ ، التكافؤ الثابت والمتغير ، المركبات الثنائية ، المضاعف المشترك الأصغر.
نوع الدرس: مشترك.
وسائل التعليم:خوارزمية لتحديد التكافؤ.
معدات:النظام الدوري للعناصر الكيميائية لـ D. I. Mendeleev ، نماذج الكرة والعصا للجزيئات ، جدول "خوارزمية لتحديد التكافؤ".
خلال الفصول
المرحلة التنظيمية: تحية الطلاب.
تحديث المعرفة الأساسية.
محادثة أماميةمدرس كيمياء مع الطلاب حول موضوع "الصيغة الكيميائية".
عند دراسة الكيمياء ، من المهم جدًا تعلم كيفية التأليف الصيغ الكيميائية.
ماذا تعبر الصيغة الكيميائية؟ (تكوين مادة معينة ، مأخوذة في شكلها النقي)
صيغة كيميائية- هذا هو التعيين التقليدي لمادة ، ذرة ، جزيء ، أيون باستخدام رموز العناصر ، العلامات العددية والمساعدة.
وفقًا للصيغة الكيميائية ، يمكننا تحديد:
نوع المادة
التركيب النوعي والكمي ،
الوزن الجزيئي النسبي ،
جزء الشاملعنصر كيميائي في مادة معينة ،
تكافؤ العناصر الكيميائية.
تتكون جميع المواد من ذرات. القدرة على التكون هي إحدى الخصائص الرئيسية للذرات روابط كيميائية. يمكن أن تشكل ذرات العناصر المختلفة عددًا معينًا من الروابط المميزة لها.
دعونا نقارن التركيب النوعي والكميفي الجزيئات: HCl ، H 2 O ، NH 3 ، CH 4.
ماذا تشترك الجزيئات؟ (وجود ذرات الهيدروجين)
كيف تختلف هذه المواد عن بعضها البعض؟ (تحتوي هذه المواد على عدد مختلف من ذرات الهيدروجين)
لا يمكن لذرة الهيدروجين أن تربط أكثر من ذرة من عنصر كيميائي آخر ، لذلك يتم أخذ تكافؤ الهيدروجين كواحد. وبالتالي ، تتم مقارنة تكافؤ جميع العناصر الأخرى بتكافؤ الهيدروجين.
أمثلة:
حمض الهيدروكلوريك - ذرة كلور مرتبطة بذرة هيدروجين واحدة ؛
H 2 O - ذرة أكسجين واحدة تربط ذرتين هيدروجين ؛
NH 3 - ترتبط ذرة نيتروجين واحدة بثلاث ذرات هيدروجين ؛
CH 4 - ترتبط ذرة كربون واحدة بأربع ذرات هيدروجين.
لماذا تحتوي الذرات المختلفة على أعداد مختلفة من ذرات الهيدروجين؟
(تشكل كل ذرة عددًا معينًا من الروابط مع الذرات الأخرى.
تسمى تكافؤ.
التكافؤهي خاصية الذرات للاحتفاظ بعدد معين من الذرات الأخرى في مركب.
تتم الإشارة إلى التكافؤ بالأرقام الرومانية.
ملاحظات على السبورة وفي أجهزة الكمبيوتر المحمولة:
| أنا | أنا II | I III | أنا رابعا |
يتم أخذ تكافؤ ذرة الهيدروجين كوحدة - I وللأكسجين - II.
رسالة الطالب عن التكافؤ.
في التاسع عشر في وقت مبكرالقرن ، صاغ دالتون قانون النسب المتعددة ، والذي تبعه أن كل ذرة من عنصر واحد يمكن أن تتحد مع واحد ، اثنان ، ثلاثة ، إلخ. ذرات عنصر آخر (كما هو الحال ، على سبيل المثال ، في مركبات الذرات مع الهيدروجين التي نعتبرها).
في منتصف القرن التاسع عشر ، عندما تم تحديد الأوزان النسبية الدقيقة للذرات (IYa. Berzelius وآخرون) ، أصبح من الواضح أن أكبر عددعدد الذرات التي يمكن أن تتحد بها ذرة معينة لا يتجاوز قيمة معينة ، حسب طبيعتها. هذه القدرة على ربط أو استبدال عدد معين من الذرات الأخرى أطلق عليها إ. فرانكلاند في عام 1853 "التكافؤ".
منذ ذلك الحين لم تكن هناك مركبات معروفة للهيدروجين حيث سيتم ربطه بأكثر من ذرة واحدة من أي عنصر آخر ، تم اختيار ذرة الهيدروجين كمعيار ، لها تكافؤ 1.
في نهاية الخمسينيات. القرن التاسع عشر A. S. Cooper و A. Kekule افترض مبدأ رباعي التكافؤ الثابت في الكربون مركبات العضوية. شكل مفهوم التكافؤ جزءًا مهمًا من النظرية التركيب الكيميائيأ.م بتليروف في عام 1861
القانون الدوريدي. كشف Mendeleev في عام 1869 عن اعتماد التكافؤ لعنصر ما على موقعه في النظام الدوري.
في. كوسيل ، أ. ويرنر ، ج. لويس ساهم في تطور مفهوم "التكافؤ" في سنوات مختلفة.
منذ الثلاثينيات. في القرن العشرين ، كانت الأفكار حول طبيعة وطبيعة التكافؤ تتوسع وتتعمق باستمرار. تم إحراز تقدم كبير في عام 1927 ، عندما أجرى دبليو هيتلر وف. لندن أول حساب كمي-كيميائي لجزيء الهيدروجين H 2.
مقابلة مع الطلاب:ما هو التكافؤ؟
يبدو تعريف التكافؤ في مصادر مختلفة مختلفًا. دعونا نفكر في أي من هذه التعريفات الثلاثة هو الأكثر كمالًا وما هي أوجه القصور في التعريفات الأخرى.
الصف الأول
"التكافؤ
عنصر كيميائي - قدرة ذراته على الاندماج مع ذرات أخرى بنسب معينة.
الصف الثاني
"التكافؤ
- قدرة ذرات عنصر ما على إلحاق عدد معين من ذرات عنصر آخر.
الصف الثالث
"التكافؤ
- ممتلكات الذرات ، الدخول فيها مركبات كيميائيةأو التبرع أو قبول عدد معين من الإلكترونات أو الجمع بين الإلكترونات لتشكيل أزواج إلكترونية مشتركة بين ذرتين.
مناقشة جماعية،توصلنا إلى استنتاج مفاده أن التعريف الثالث يعكس بدقة جوهر تعريف التكافؤ.
عرض مادة جديدة:
موضوع درسنا: رسم صيغ المركبات الثنائية عن طريق التكافؤ.
مواد جديدةمن الأسهل تذكر ما إذا كانت مرتبطة بالمعرفة المكتسبة بالفعل. لذلك ، علينا الآن العمل على استخراج هذه المادة من الذاكرة. هذا هو المكان الذي يمكن أن يساعدك فيه مدرس الرياضيات.
المعلم يتحدث مع الطلاب:
مدرس:اكتب بعض الأعداد التي تكون من مضاعفات العدد 12.
12, 24, 36, 48 ….
مدرس:اكتب عدة أعداد من مضاعفات العدد 18.
18, 36, 54, 72……
مدرس:قم بتسمية الأرقام التي تكون من مضاعفات 12 و 18.
36 و 72 وما إلى ذلك.
مدرس:ما هو المضاعف المشترك الأصغر للعددين 12 و 18.
مدرس:قم بصياغة تعريف المضاعف المشترك الأصغر لعدة أرقام.
المضاعف المشترك الأصغر لعدة أرقام هو الأصغر عدد طبيعي، والتي تقبل القسمة على كل من الأرقام المعطاة.
مدرس:صِغ قاعدة لإيجاد المضاعف المشترك الأصغر لرقمين أو أكثر.
لإيجاد المضاعف المشترك الأصغر لرقمين أو أكثر ، تحتاج إلى تحليل هذه الأعداد إلى عوامل أولية ، ثم أخذ تحليل أحدها ، واضربه في العوامل الأولية المفقودة من تحليلات الأعداد الأخرى.
يقترح المعلم التمرين التالي:
№1 . ابحث عن أ) NOC (48، 90) ؛ ب) شهادة عدم ممانعة (6 ، 15 ، 20)
قرار:
أ) 48/2 90/2 ب) 6/2 15/3 20/2
24/2 45/3 3/3 5/5 10/2
12/2 15/3 1/ 1/ 5\5
المضاعف المشترك الأصغر (48.90) = 2 4 * 3 * 3 * 5 م م (6.15.20) = 2 3 * 5 * 3
كرونة نرويجية (48.90) = 720 كرونة نرويجية (6.15.20) = 60
إجابه: أ) 720 ؛ ب) 60.
مدرس:ما هو المضاعف المشترك الأصغر لرقمين من جرائم حقوق الملكية؟
المضاعف المشترك الأصغر لرقمين من جرائم حقوق الملكية يساوي حاصل ضربهما.
№2. البحث عن شهادة عدم ممانعة (7.11)
مدرس:كما تتذكر ، هناك طريقة أخرى للعثور على المضاعف المشترك الأصغر للأرقام - هذه هي طريقة التحديد.
ابحث عن شهادة عدم ممانعةالأرقام التالية عن طريق الاختيار:
أ) 10 و 2 ب) 14 و 21 ج) 20 و 15 د) 2 ؛ 3 و 5
الإجابات:أ) 10 ب) 42 ج) 60 د) 30.
مدرس:يا رفاق ، كررنا معك كيف يمكنك العثور على المضاعف المشترك الأصغر لرقمين أو أكثر. والآن ستتعرف على كيفية تطبيق هذه المعرفة في الكيمياء في تحديد التكافؤ.
قال دبليو جوته ذات مرة: "إن المعرفة ليست كل شيء ، يجب أن تكون المعرفة قادرة على استخدامها".
تحديد تكافؤ العناصر بالصيغ في المركبات الثنائية.
يتذكر: في معادلات المركبات الثنائية ، يكون عدد وحدات التكافؤ لجميع ذرات عنصر واحد مساويًا لعدد وحدات التكافؤ لجميع ذرات عنصر آخر.
اكتب صيغة المادة. ص 2 يا 5
تشير الأرقام الرومانية إلى تكافؤ أحد العناصر. P 2 O 5 (II)
حدد تكافؤ عنصر كيميائي آخر. ص 2 يا 5
X * 2 \ u003d II * 5 X \ u003d V.
تجميع الصيغ الكيميائية للمركبات الثنائية حسب تكافؤ العناصر.
كتابة الرموزالعناصر الكيميائية التي تتكون منها الصيغة ، مع وضع قيم التكافؤ المقابلة فوقها:
CaO، B 2 O 3، CO 2،
نصنع صيغةمركبات التكافؤ:
أ) CaO: إذا كانت تكافؤ العناصر الكيميائية متساوية ، فإننا لا نضع مؤشرات.
ب) ب 2 يا 3: إذا لم يتم تقسيم قيم التكافؤ على بعضها البعض ، ضع قيم التكافؤ بالعرض.
ج) ثاني أكسيد الكربون: إذا كان تكافؤ عنصر ما مقسومًا على تكافؤ عنصر آخر ، فقم بتقسيم قيمة التكافؤ الأكبر على قيمة العنصر الأصغر ووضع الرقم الناتج في شكل مؤشر بجوار العنصر مع تكافؤ أقل.
تمرين: تحديد تكافؤ العناصر في المواد: يذهب الطلاب إلى السبورة في سلسلة. نحن نتوقع المهمة على السبورة.
SiH 4، CrO 3، H 2 S، CO 2، CO، SO 3، SO 2، Fe 2 O 3، FeO، HCl، HBr، Cl 2 O 5، Cl 2 O 7، PH 3، K 2 O، Al 2 O 3، P 2 O 5، NO 2، N 2 O 5، Cr 2 O 3، SiO 2، B 2 O 3، SiH 4، Mn 2 O 7، MnO، CuO، N 2 O 3.
المرحلة الانعكاسية التقييمية.
الاختبار الأساسي لإتقان المعرفة.لإكمال هذه المهمة ، يتلقى الطلاب "خوارزمية لتحديد التكافؤ" ومهام من ثلاثة مستويات. يختار كل طالب مستوى الواجب الخاص به.
مستوى التكاثر ("3").حدد تكافؤ ذرات العناصر الكيميائية وفقًا لصيغ المركبات: NH 3 ، Au 2 O 3 ، SiH 4 ، CuO.
طبقة التطبيق ("4").من السلسلة أعلاه ، اكتب فقط الصيغ التي تكون فيها ذرات المعدن ثنائية التكافؤ: MnO ، Fe 2 O 3 ، CrO 3 ، CuO ، K 2 O ، CaH 2.
المستوى الإبداعي ("5"). ابحث عن نمط في تسلسل الصيغ: N 2 O ، NO ، N 2 O 3 وضع التكافؤات فوق كل عنصر.
| خوارزمية لتحديد التكافؤ | مثال |
|
| 1. اكتب صيغة المادة. | ||
| 2. عيّن التكافؤ المعروف للعنصر | ||
| 3. أوجد عدد وحدات التكافؤ لذرات عنصر معروف بضرب تكافؤ العنصر في عدد ذراته | ||
| 4. قسّم عدد وحدات التكافؤ للذرات على عدد ذرات عنصر آخر. الإجابة المستلمة هي التكافؤ المطلوب | 2 | 2 |
| 5. قم بإجراء فحص ، أي عد عدد وحدات التكافؤ لكل عنصر | أنا II | أنا II |
نتحقق من المهمة المكتملة(تبادل الطلاب دفاتر الملاحظات).
استكشاف الأخطاء وإصلاحها: oالإجابات على السبورة.
تلخيص الدرس.
مقابلة مع الطلاب:
ما المشكلة التي طرحناها في بداية الدرس؟
ما النتيجة التي توصلنا إليها؟
عرّف "التكافؤ".
كيف يتم تحديد شهادة عدم الممانعة؟
ما هو تكافؤ ذرة الهيدروجين؟ الأكسجين؟
كيف نحدد تكافؤ الذرة في المركب؟
تقويم عمل الطالب.
الواجب المنزلي:الكتاب المدرسي جي إي رودزيتس ، إف جي فيلدمان §17 ، ص 60 ، مثال. 1 ، 2 ، 4 ، 6
سؤال المشكلة:لماذا الهيدروجين والليثيوم لهما تكافؤ ثابت بينما الهيليوم ليس له تكافؤ؟
"كيف يمكن للطلاب أن ينجحوا - اللحاق بالمتقدمين ولا تنتظر من هم وراءهم"
أرسطو
نتمنى لك أن تكون دائما في المقدمة.