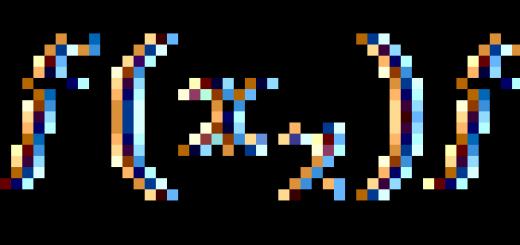محاضرة: مواد التركيب الجزيئي وغير الجزيئي. نوع الشبكة البلورية. اعتماد خصائص المواد على تكوينها وبنيتها
المواد الجزيئية وغير الجزيئية
حسب الهيكل مواد كيميائيةتنقسم إلى مجموعتين: تسمى تلك التي تتكون من جزيئات جزيئي، وتحتوي على ذرات وأيونات - غير جزيئي.
المواد الجزيئية لها نقاط انصهار / غليان منخفضة. يمكن أن تكون في ثلاث حالات مجمعة: سائلة ، صلبة ، غازية. هذه المجموعة تضم معظم مواد بسيطةغير المعادن ، وكذلك مركباتها مع بعضها البعض. الروابط بين ذرات المواد الجزيئية تساهمية.
المواد غير الجزيئية لها نقاط انصهار / غليان عالية. هم في حالة صلبة. هذه ، كما خمنت ، مواد بسيطة - معادن ، مركباتها مع اللافلزات ، اللافلزات تشمل البورون ، الكربون - الماس ، الفوسفور (الأسود والأحمر) ، السيليكون. تشكل المواد غير الجزيئية بلورات أيونية ، وذرية ، وجزيئية ، يكون لترتيب الجزيئات منها تسلسلًا واضحًا وتشكل شبكة.
أنواع المشابك البلورية
هناك أربعة أنواع من المشابك البلورية ، اعتمادًا على أنواع الجسيمات الموجودة في مواقع الشبكة:

1) أيونيالشبكة البلورية هي خاصية مميزة للمركبات ذات النوع الأيوني من الرابطة الكيميائية. في المواقع الشبكية توجد الكاتيونات والأنيونات. من أمثلة المواد التي تحتوي على هذا النوع من الشبكة البلورية الأملاح والأكاسيد وهيدروكسيدات المعادن النموذجية. هذه مواد صلبة ولكنها هشة. لديهم صلابة. تذوب في الماء وتكون موصلة للكهرباء.

2) النوويةتحتوي الشبكة على ذرات عند عقدها. تشكل الجسيمات روابط تساهمية غير قطبية وقطبية. من بين المواد البسيطة ، ينتمي هذا النوع من الشبكة البلورية إلى الكربون في حالة الجرافيت والماس والبورون والسيليكون والجرمانيوم. من مواد معقدةتمتلك الشبكة الذرية ، على سبيل المثال ، أكسيد السيليكون (الكوارتز ، البلور الصخري). هذه مواد شديدة المقاومة للحرارة ، غير موزعة على نطاق واسع في الطبيعة. لا تذوب في الماء.

3) الجزيئيةتتكون الشبكة البلورية من جزيئات مرتبطة ببعضها البعض بواسطة قوى ضعيفة من التجاذب بين الجزيئات. لذلك ، تتميز مواد هذا النوع من الشبكة بصلابة منخفضة وهشاشة وانصهار منخفض. على سبيل المثال ، إنه ماء في حالة جليدية. الأكثر صلابة مركبات العضويةلديك هذا النوع من شعرية. نوع الرابطة في المركب تساهمية.
التركيب الجزيئي وغير الجزيئي للمواد. هيكل المادة

في التفاعلات الكيميائيةلا تدخل الذرات أو الجزيئات الفردية ، ولكن المواد. تتميز المواد بنوع السند جزيئيو هيكل غير جزيئي. المواد المكونة من الجزيئات تسمى المواد الجزيئية. الروابط بين الجزيئات في مثل هذه المواد ضعيفة جدًا ، أضعف بكثير من تلك الموجودة بين الذرات داخل الجزيء ، وتتكسر بالفعل عند درجات حرارة منخفضة نسبيًا - تتحول المادة إلى سائل ثم إلى غاز (تسامي اليود). تزداد نقاط انصهار وغليان المواد المكونة من جزيئات بازدياد الوزن الجزيئي الغرامي. ل المواد الجزيئيةتشمل المواد ذات التركيب الذري (C ، Si ، Li ، Na ، K ، Cu ، Fe ، W) ، من بينها المعادن وغير المعدنية. على المواد هيكل غير جزيئيتشمل المركبات الأيونية. تحتوي معظم مركبات المعادن غير الفلزية على هذا الهيكل: جميع الأملاح (NaCl ، K 2 SO 4) ، وبعض الهيدرات (LiH) والأكاسيد (CaO ، MgO ، FeO) ، القواعد (NaOH ، KOH). المواد الأيونية (غير الجزيئية)لديها نقاط انصهار وغليان عالية.

المواد الصلبة: غير متبلور وبلوري
وتنقسم المواد الصلبة إلى بلوري وغير متبلور.
مواد غير متبلورةليس لديها نقطة انصهار واضحة - عند تسخينها ، فإنها تنعم تدريجياً وتصبح سائلة. في الحالة غير المتبلورة ، على سبيل المثال ، هي البلاستيسين والراتنجات المختلفة.
المواد البلوريةتتميز الموقع الصحيحتلك الجسيمات التي تتكون منها: الذرات والجزيئات والأيونات - في نقاط محددة بدقة في الفضاء. عندما يتم توصيل هذه النقاط بخطوط مستقيمة ، يتم تكوين إطار مكاني يسمى الشبكة البلورية. تسمى النقاط التي توجد بها جزيئات الكريستال بالعقد الشبكية. اعتمادًا على نوع الجسيمات الموجودة في عقد الشبكة البلورية وطبيعة الاتصال بينها ، يتم تمييز أربعة أنواع من المشابك البلورية: الأيونية والذرية والجزيئية والمعدنية.
تسمى المشابك البلورية أيونية، في المواقع التي توجد بها أيونات. تتشكل من مواد ذات رابطة أيونية ، والتي يمكن أن ترتبط بكل من الأيونات البسيطة Na + و Cl - و SO 4 المعقدة ، OH -. وبالتالي ، فإن الأملاح وبعض الأكاسيد وهيدروكسيدات المعادن لها شبكات بلورية أيونية. على سبيل المثال ، يتم بناء بلورة كلوريد الصوديوم من أيونات الصوديوم الإيجابية المتناوبة بالتناوب مع الكلور السالب ، مما يشكل شبكة مكعبة الشكل. الروابط بين الأيونات في مثل هذه البلورة مستقرة جدًا. لذلك ، تتميز المواد ذات الشبكة الأيونية بصلابة وقوة عالية نسبيًا ، فهي مقاومة للحرارة وغير متطايرة.
شعرية بلورية - أ) وشبكة غير متبلورة - ب).
 شعرية بلورية - أ) وشبكة غير متبلورة - ب).
شعرية بلورية - أ) وشبكة غير متبلورة - ب). المشابك البلورية الذرية
نوويتسمى المشابك البلورية ، في العقد التي توجد فيها ذرات فردية. في مثل هذه المشابك ، ترتبط الذرات ببعضها البعض روابط تساهمية قوية جدا. مثال على المواد مع هذا النوع من الشبكة البلورية هو الماس ، وهو أحد التعديلات المتآصلة للكربون. تحتوي معظم المواد ذات الشبكة البلورية الذرية على نقاط انصهار عالية جدًا (على سبيل المثال ، في الماس تزيد درجة حرارته عن 3500 درجة مئوية) ، فهي قوية وصلبة وغير قابلة للذوبان عمليًا.


المشابك البلورية الجزيئية
جزيئيتسمى المشابك البلورية ، في العقد التي توجد بها الجزيئات. يمكن أن تكون الروابط الكيميائية في هذه الجزيئات قطبية (HCl، H 2 O) وغير قطبية (N 2، O 2). على الرغم من حقيقة أن الذرات داخل الجزيئات مرتبطة بروابط تساهمية قوية جدًا ، تعمل قوى التجاذب بين الجزيئات الضعيفة بين الجزيئات نفسها. لذلك ، المواد ذات المشابك البلورية الجزيئية لها صلابة منخفضة ، ونقاط انصهار منخفضة ، ومتطايرة. تحتوي معظم المركبات العضوية الصلبة على شبكات بلورية جزيئية (النفثالين والجلوكوز والسكر).
 شعرية الكريستال الجزيئية ( نشبع)
شعرية الكريستال الجزيئية ( نشبع)
المشابك الكريستال المعدني
المواد ذات السندات معدنيةلديها مشابك بلورية معدنية. في العقد من هذه المشابك هي الذرات والأيونات(إما الذرات أو الأيونات التي تتحول إليها ذرات المعدن بسهولة ، مما يعطي إلكتروناتها الخارجية "للاستخدام العام"). تحدد هذه البنية الداخلية للمعادن خصائصها الفيزيائية المميزة: المرونة ، اللدونة ، التوصيل الكهربائي والحراري ، واللمعان المعدني المميز.

اوراق الغش


تحت التركيب الكيميائي (التركيب) يُفهم ترتيب الترتيب المتبادل في فضاء الذرات التي يتكون منها الجزيء ، وأنواع الروابط الكيميائية بينها. قام مبتكر نظرية هيكل المركبات العضوية أ.م. بتليروف (1828-1886). باختصار ، يمكن صياغة الأحكام الرئيسية لنظرية بتليروف على النحو التالي:
1) الخواص الكيميائيةلا يتم تحديد المركبات العضوية من خلال تكوينها بقدر ما يتم تحديدها من خلال هيكلها ؛
2) الذرات ومجموعات الذرات المختلفة في جزيء عضوي تؤثر بشكل متبادل على بعضها البعض ؛
3) يمكن تمثيل التركيب الكيميائي للجزيء بصيغة واحدة فقط تعبر عن جميع الخصائص الكيميائية لمادة معينة.
1.4 نظائر. أنواع التماثل
ايزومرية- ظاهرة وجود عدة مواد لها نفس التركيب الأولي والوزن الجزيئي.
نظائر- الجزيئات نفس التكوين، ولكن لهيكل مختلف ، وبالتالي بخصائص مختلفة.
ويرد مثال على اعتماد خصائص المواد على تركيبها الكيميائي في الجدول. 2.
الجدول 2
اعتماد الخصائص على التركيب الكيميائي
ولهذين الأيزومرين أيضًا تأثيرات بيولوجية مختلفة بشكل حاد على الكائنات الحية.
يشمل مفهوم "الهيكل" ثلاثة جوانب:
(لكن) المواد الكيميائية هيكل- نوع وترتيب تناوب الذرات في الجزيء ؛
(ب) الهيكل الإلكتروني- نوع الروابط الكيميائية بين الذرات (- ؛ = ؛ ) ؛
(في) الهيكل المكاني- طبيعة الترتيب المتبادل للذرات بالنسبة لبعضها البعض في الفضاء.
وفقًا لذلك ، هناك ثلاث مجموعات من مصادر التماثل.
فرق التركيب الكيميائي:
ايزومرية الهيكل العظمي سي
(أ) (ب) 


ن-بوتان

 أيزوبيوتان حلقي البنتان ميثيل سي البيوتان
أيزوبيوتان حلقي البنتان ميثيل سي البيوتان
مواقف مختلفة للمجموعات الوظيفية


OH [propanol-1] OH [propanol-2]
نوع مختلف من المجموعات الوظيفية (metamerism)
نظائر 



حمض] حمض أميني إيثانويك]
انظر أيضًا إلى مثال من الجدول. 2.
ب) الاختلاف في الهيكل الإلكتروني:
أنواع ومواقف مختلفة من السندات المتعددة
(نظائر 

[بوتادين -1،3] [بوتين -1] [بوتين -2]
تعكس الصيغ الهيكلية العادية هذين الجانبين (أ و ب) فقط من بنية الجزيئات.
ج) الأيزومرية المكانية (أو الأيزومرية الفراغية):
هذه الأيزومرات لها نفس ترتيب الرابطة بين الذرات ، لكنها تختلف في الترتيب المكاني للذرات المكونة لها أو مجموعات الذرات. يتم استخدام تقنيات خاصة لإظهار الهيكل المكاني.
وتشمل هذه:
(5) رابطة الدول المستقلة عبر الايزومرية- ترتيب مختلف للذرات بالنسبة للرابطة المزدوجة (أ) أو المستوى الحلقي (ب):
مثال (أ) - الأيزومرات الفراغية للبوتين -2:


[رابطة الدول المستقلة - بوتين - 2] [ترانس - بوتين - 2]
مثال (ب) - الأيزومرات الفراغية:

رابطة الدول المستقلة شكل عبر شكل
(6) التماثل البصري (المرآة)
ترجع هذه الظاهرة إلى وجود ذرات كربون غير متماثلة في الجزيئات ؛ تمت مناقشته في أقسام "الأحماض الهيدروكسية" و "الكربوهيدرات".
(7) التماثل التوافقي
تتميز معظم المواد بالقدرة ، اعتمادًا على الظروف ، على أن تكون في واحدة من ثلاث حالات للتجمع: صلبة أو سائلة أو غازية.
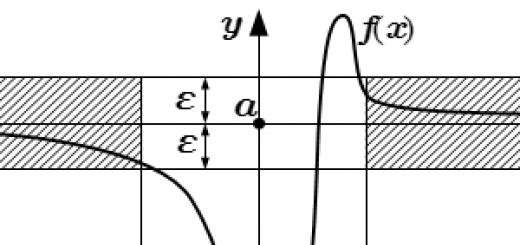
على سبيل المثال ، الماء عند الضغط العادي في نطاق درجة حرارة 0-100 درجة مئوية هو سائل ، عند درجات حرارة أعلى من 100 درجة مئوية يمكن أن يتواجد فقط في حالة غازية ، وفي درجات حرارة أقل من 0 درجة مئوية يكون صلبًا.
المواد في الحالة الصلبة تميز بين اللابلوري والبلوري.
السمات المميزة مواد غير متبلورةهو عدم وجود نقطة انصهار واضحة: تزداد سيولتها تدريجياً مع زيادة درجة الحرارة. تشتمل المواد غير المتبلورة على مركبات مثل الشمع والبارافين ومعظم البلاستيك والزجاج وما إلى ذلك.
ومع ذلك ، فإن المواد البلورية لها نقطة انصهار محددة ، أي تنتقل مادة ذات بنية بلورية من الحالة الصلبة إلى الحالة السائلة ليس بشكل تدريجي ، ولكن بشكل مفاجئ ، عند الوصول إلى درجة حرارة معينة. تشمل أمثلة المواد البلورية ملح الطعام والسكر والثلج.
الفرق في الخصائص الفيزيائيةالمواد الصلبة البلورية وغير المتبلورة بالفأس ترجع في المقام الأول إلى السمات الهيكلية لهذه المواد. ما هو الفرق بين مادة في حالة غير متبلورة وحالة بلورية ، أسهل طريقة لفهمها هي من الرسم التوضيحي التالي:
كما ترون ، في مادة غير متبلورة ، على عكس المادة البلورية ، لا يوجد ترتيب في ترتيب الجسيمات. إذا ، في مادة بلورية ، تربط إحداهما عقليًا ذرتين قريبتين من بعضهما البعض بخط مستقيم ، فيمكن للمرء أن يجد أن الجسيمات نفسها ستقع على هذا الخط في فترات محددة بدقة:
وهكذا ، في حالة المواد البلورية ، يمكن للمرء أن يتحدث عن مفهوم مثل الشبكة البلورية.
شعرية الكريستال يسمى الإطار المكاني الذي يربط بين نقاط الفضاء التي توجد فيها جزيئات تشكل بلورة.
تسمى النقاط في الفضاء حيث توجد الجسيمات التي تشكل البلورة عقد شعرية .
اعتمادًا على الجسيمات الموجودة في عقد الشبكة البلورية ، هناك: الجزيئية والذرية والأيونية و شعرية الكريستال المعدنية .
في عقدة شعرية الكريستال الجزيئي
الشبكة البلورية للجليد كمثال للشبكة الجزيئيةهناك جزيئات ترتبط فيها الذرات بروابط تساهمية قوية ، لكن الجزيئات نفسها تقترب من بعضها البعض بواسطة قوى ضعيفة بين الجزيئات. بسبب هذه التفاعلات الضعيفة بين الجزيئات ، تكون البلورات ذات الشبكة الجزيئية هشة. تختلف هذه المواد عن المواد ذات الأنواع الأخرى من الهيكل من خلال انخفاض درجات الانصهار والغليان بشكل ملحوظ ، ولا يتم إجراءها كهرباء، قد يذوب أو لا يذوب في مذيبات مختلفة. قد تقوم حلول هذه المركبات بتوصيل الكهرباء وقد لا تقوم بذلك ، اعتمادًا على فئة المركب. تشتمل المركبات ذات الشبكة البلورية الجزيئية على العديد من المواد البسيطة - غير الفلزية (H 2 ، O 2 ، Cl 2 ، الكبريت المعيني S 8 ، الفوسفور الأبيض P 4) ، بالإضافة إلى العديد من المواد المعقدة - مركبات الهيدروجينغير الفلزات والأحماض والأكاسيد غير المعدنية ، ومعظم المواد العضوية. وتجدر الإشارة إلى أنه إذا كانت المادة في حالة غازية أو سائلة ، فمن غير المناسب التحدث عن الشبكة البلورية الجزيئية: فمن الأصح استخدام المصطلح - النوع الجزيئي للهيكل.
الشبكة البلورية للماس كمثال للشبكة الذريةفي عقدة شعرية الكريستال الذرية
هناك ذرات. في هذه الحالة ، يتم "ربط" جميع العقد الخاصة بمثل هذه الشبكة البلورية ببعضها البعض عن طريق روابط تساهمية قوية في بلورة واحدة. في الواقع ، مثل هذه البلورة هي جزيء عملاق. نظرًا للسمات الهيكلية ، فإن جميع المواد ذات الشبكة البلورية الذرية صلبة ، ولها نقاط انصهار عالية ، وغير نشطة كيميائيًا ، وغير قابلة للذوبان في الماء أو المذيبات العضوية ، ولا تنقل ذوبانها تيارًا كهربائيًا. يجب أن نتذكر أن المواد ذات النوع الذري من التركيب من مواد بسيطة تشمل البورون B ، والكربون C (الماس والجرافيت) ، والسيليكون Si ، من المواد المعقدة - ثاني أكسيد السيليكون SiO 2 (الكوارتز) ، كربيد السيليكون SiC ، نيتريد البورون BN.
للمواد مع شعرية الكريستال الأيونية
في المواقع الشبكية هي أيونات مرتبطة ببعضها البعض من خلال الرابطة الأيونية.
نظرًا لأن الروابط الأيونية قوية بدرجة كافية ، فإن المواد ذات الشبكة الأيونية تتمتع بصلابة عالية نسبيًا وانكسارًا. غالبًا ما تكون قابلة للذوبان في الماء ، وحلولها ، مثل الذوبان ، توصل الكهرباء.
المواد ذات النوع الأيوني من الشبكة البلورية تشمل المعادن وأملاح الأمونيوم (NH 4 +) ، والقواعد ، وأكاسيد الفلزات. العلامة الحقيقية للتركيب الأيوني للمادة هي وجود كلتا الذرتين في تركيبتهما معدن نموذجيوغير المعدنية.
 الشبكة البلورية لكلوريد الصوديوم كمثال على الشبكة الأيونية
الشبكة البلورية لكلوريد الصوديوم كمثال على الشبكة الأيونية
لوحظ في بلورات المعادن الحرة ، على سبيل المثال ، الصوديوم ، الحديد الحديد ، المغنيسيوم المغنيسيوم ، إلخ. في حالة الشبكة البلورية المعدنية ، توجد الكاتيونات وذرات المعدن عند عقدها ، والتي تتحرك الإلكترونات بينها. في هذه الحالة ، ترتبط الإلكترونات المتحركة بشكل دوري بالكاتيونات ، وبالتالي تحييد شحنتها ، وبدلاً من ذلك "تطلق" ذرات المعدن المحايدة بعضًا من إلكتروناتها ، وتتحول بدورها إلى كاتيونات. في الواقع ، لا تنتمي الإلكترونات "الحرة" إلى الذرات الفردية ، بل تنتمي إلى البلورة بأكملها.
تؤدي هذه الميزات الهيكلية إلى حقيقة أن المعادن توصل الحرارة والتيار الكهربائي جيدًا ، وغالبًا ما يكون لها ليونة عالية (ليونة).
إن التبعثر في قيم درجات حرارة انصهار المعادن كبير جدًا. لذلك ، على سبيل المثال ، تكون درجة انصهار الزئبق تقريبًا ناقص 39 درجة مئوية (سائل في ظل الظروف العادية) ، والتنغستن - 3422 درجة مئوية. وتجدر الإشارة إلى أنه في ظل الظروف العادية ، تعتبر جميع المعادن ، باستثناء الزئبق ، مواد صلبة.
ثيمات استخدام المبرمج: مواد التركيب الجزيئي وغير الجزيئي. نوع الشبكة البلورية. اعتماد خصائص المواد على تكوينها وبنيتها.
النظرية الحركية الجزيئية
تتكون جميع الجزيئات من جزيئات صغيرة تسمى الذرات. يتم جمع جميع الذرات المكتشفة حاليًا في الجدول الدوري.
ذرةهو أصغر جسيم غير قابل للتجزئة كيميائيًا من مادة ما ويحتفظ بخصائصه الكيميائية. الذرات تتصل ببعضها البعض روابط كيميائية. لقد نظرنا سابقًا في ملف. احرص على دراسة النظرية حول موضوع: أنواع الروابط الكيميائية قبل دراسة هذا المقال!
الآن دعونا نلقي نظرة على كيف يمكن للجسيمات أن تتحد في المادة.
اعتمادًا على موقع الجسيمات بالنسبة لبعضها البعض ، يمكن أن تختلف خصائص المواد التي تتكون منها بشكل كبير. لذلك ، إذا كانت الجسيمات تقع عن بعضها البعض طريق طويل(المسافة بين الجسيمات أكبر بكثير من حجم الجسيمات نفسها) ، فهي عمليا لا تتفاعل مع بعضها البعض ، فهي تتحرك بشكل عشوائي ومستمر في الفضاء ، ثم نتعامل مع غاز .
إذا كانت الجسيمات موجودة قريبلبعضهم البعض ، ولكن فوضوية، أكثر تتفاعل مع بعضها البعض، اجعلها مكثفة حركات تذبذبيةفي موضع واحد ، ولكن يمكنك القفز إلى موضع آخر ، فهذا نموذج للهيكل السوائل .
إذا كانت الجسيمات موجودة قريبلبعضنا البعض ، ولكن أكثر منظم، و تتفاعل أكثرفيما بينهم ، ولكن يتحركون فقط داخل وضع توازن واحد ، عمليا دون الانتقال إلى وضع آخر الموقف الذي نتعامل معه صلب .

يمكن أن توجد معظم المواد الكيميائية والمخاليط المعروفة في المواد الصلبة والسائلة و الدول الغازية. أبسط مثال هو ماء. في ظل الظروف العادية ، فإنه سائل، عند 0 درجة مئوية يتجمد - ينتقل من الحالة السائلة إلى صلب، وعند 100 درجة مئوية يغلي - يدخل مرحلة الغاز- بخار الماء. في نفس الوقت ، العديد من المواد في الظروف العادية هي غازات أو سوائل أو مواد صلبة. على سبيل المثال ، الهواء ، وهو خليط من النيتروجين والأكسجين ، هو غاز في الظروف العادية. ولكن في ضغط مرتفعوانخفاض درجة الحرارة ، يتكثف النيتروجين والأكسجين ويمران إلى المرحلة السائلة. يستخدم النيتروجين السائل بنشاط في الصناعة. منعزلة في بعض الأحيان بلازما، إلى جانب بلورات سائلةكمراحل منفصلة.

يتم شرح العديد من خصائص المواد والمخاليط الفردية بواسطة الترتيب المتبادلالجسيمات في الفضاء بالنسبة لبعضها البعض!
تعتبر هذه المقالة الخصائص المواد الصلبة حسب هيكلها. الخصائص الفيزيائية الأساسية للمواد الصلبة: نقطة الانصهار ، الموصلية الكهربائية ، التوصيل الحراري ، القوة الميكانيكية ، اللدونة ، إلخ.
درجة حرارة الانصهار
هي درجة الحرارة التي تتغير عندها مادة ما من مادة صلبة إلى سائلة والعكس صحيح.
هي قدرة المادة على التشوه دون أن تنكسر.

التوصيل الكهربائي هي قدرة المادة على إجراء التيار.
التيار هو الحركة المنظمة للجسيمات المشحونة. وبالتالي ، لا يمكن إجراء التيار إلا بواسطة المواد الموجودة فيها تتحرك الجسيمات المشحونة. وفقًا للقدرة على إجراء التيار ، يتم تقسيم المواد إلى موصلات وعوازل كهربائية. الموصلات عبارة عن مواد يمكنها توصيل التيار (أي تحتوي على جزيئات مشحونة متحركة). العوازل هي المواد التي عمليا لا تجري التيار.

في المادة الصلبة ، يمكن تحديد موقع جزيئات المادة فوضوية، أو أكثر تنظيماحول. إذا كانت جزيئات المادة الصلبة موجودة في الفضاء فوضوية، المادة تسمى عديم الشكل. أمثلة على المواد غير المتبلورة - الفحم وزجاج الميكا.

إذا كانت جزيئات المادة الصلبة مرتبة في الفضاء بطريقة منظمة ، أي شكل تكرار الهياكل الهندسية ثلاثية الأبعاد ، تسمى هذه المادة كريستالوالهيكل نفسه شعرية الكريستال . معظم المواد المعروفة لنا هي بلورات. تقع الجسيمات نفسها في العقدشعرية الكريستال.
تتميز المواد البلورية ، على وجه الخصوص ، بـ نوع الرابطة الكيميائية بين الجسيمات في بلور - ذري ، جزيئي ، معدني ، أيوني ؛ على شكل هندسيأبسط خلية في الشبكة البلورية - مكعب ، سداسي ، إلخ.
يعتمد على نوع الجسيمات التي تشكل شبكة بلورية ، تميز التركيب البلوري الذري والجزيئي والأيوني والمعدني .
شعرية الكريستال الذرية

تتشكل شبكة بلورية ذرية عند وجودها ذرات. الذرات متصلة ببعضها البعض روابط كيميائية تساهمية. وفقًا لذلك ، ستكون هذه الشبكة البلورية جدًا متين، ليس من السهل تدميرها. يمكن أن تتكون الشبكة البلورية الذرية من ذرات ذات تكافؤ عالي ، أي من عدد كبيرالروابط مع الذرات المجاورة (4 أو أكثر). كقاعدة عامة ، هذه ليست فلزات: مواد بسيطة - السيليكون والبورون والكربون (تعديلات متآصلة للماس والجرافيت) ومركباتها (البوروكربون وأكسيد السيليكون (IV) ، إلخ..). نظرًا لأن الرابطة الكيميائية التساهمية في الغالب تحدث بين اللافلزات ، الإلكترونات الحرة(بالإضافة إلى الجسيمات المشحونة الأخرى) في مواد ذات شبكة بلورية ذرية في معظم الحالات لا. لذلك ، عادة ما تكون هذه المواد توصيل الكهرباء بشكل سيء للغاية ، أي هي عوازل. هذه أنماط عامة يوجد منها عدد من الاستثناءات.

التواصل بين الجسيمات في البلورات الذرية:.
في العقد من الكريستال مع بنية بلورية ذرية مرتبة ذرات.
حالة المرحلة البلورات الذرية في الظروف العادية: كقاعدة عامة ، المواد الصلبة .
مواد، والتي تشكل بلورات ذرية في الحالة الصلبة:
- مواد بسيطة التكافؤ العالي (تقع في منتصف الجدول الدوري): البورون والكربون والسيليكون ، إلخ.
- المواد المعقدة التي تتكون من هذه اللافلزات:السيليكا (أكسيد السيليكون ، رمل الكوارتز) SiO 2 ؛ كربيد السيليكون (اكسيد الالمونيوم) كربيد كربيد ؛ كربيد البورون ، نيتريد البورون ، إلخ.
الخصائص الفيزيائية للمواد ذات الشبكة البلورية الذرية:
— الخضوع ل؛
- الحران (نقطة انصهار عالية) ؛
- الموصلية الكهربائية المنخفضة ؛
- الموصلية الحرارية المنخفضة ؛
- الخمول الكيميائي (المواد الخاملة) ؛
- عدم الذوبان في المذيبات.

شعرية بلورية جزيئيةهي شعرية تكون عقدها الجزيئات. عقد الجزيئات في البلورة قوى الجذب الضعيفة بين الجزيئات (قوات فان دير فالأو روابط هيدروجينية أو جذب إلكتروستاتيكي). وفقًا لذلك ، مثل هذه الشبكة البلورية ، كقاعدة عامة ، من السهل جدا تدميرها. المواد ذات الشبكة البلورية الجزيئية - واهية وهشة. كلما زادت قوة الجذب بين الجزيئات ، زادت نقطة انصهار المادة. كقاعدة عامة ، لا تزيد نقاط انصهار المواد ذات الشبكة البلورية الجزيئية عن 200-300 كلفن. لذلك ، في ظل الظروف العادية ، توجد معظم المواد ذات الشبكة البلورية الجزيئية في الشكل الغازات أو السوائل. تتكون الشبكة البلورية الجزيئية ، كقاعدة عامة ، في صورة صلبة عن طريق الأحماض ، وأكاسيد المواد غير المعدنية ، والمركبات الثنائية الأخرى من غير المعادن ، والمواد البسيطة التي تشكل جزيئات مستقرة (الأكسجين O 2 ، النيتروجين N 2 ، الماء H 2 O ، وما إلى ذلك) ، والمواد العضوية. كقاعدة عامة ، هذه مواد ذات رابطة تساهمية قطبية (نادرًا ما تكون غير قطبية). لأن تشارك الإلكترونات في الروابط الكيميائية ، والمواد ذات الشبكة البلورية الجزيئية - العوازل ، الموصلات السيئة للحرارة.

التواصل بين الجسيمات في البلورات الجزيئية: م قوى الجذب بين الجزيئات أو الكهروستاتيكية أو بين الجزيئات.
في العقد من الكريستال مع هيكل بلوري جزيئي مرتبة الجزيئات.
حالة المرحلة البلورات الجزيئية في ظل الظروف العادية: الغازات والسوائل والمواد الصلبة.
مواد، تتشكل في الحالة الصلبة بلورات جزيئية:
- مواد بسيطة غير معدنية تشكل جزيئات صغيرة وقوية (O 2، N 2، H 2، S 8 وغيرها) ؛
- المواد المعقدة (مركبات غير الفلزية) ذات الروابط القطبية التساهمية (باستثناء أكاسيد السيليكون والبورون ومركبات السيليكون والكربون) - الماء H 2 O وأكسيد الكبريت SO 3 ، إلخ.
- الغازات النادرة أحادية الذرة (الهيليوم ، النيون ، الأرجون ، الكريبتون وإلخ.);
- معظم المواد العضوية التي لا تحتوي على روابط أيونية — الميثان CH 4 ، البنزين C 6 H 6 ، إلخ.
الخصائص الفيزيائية المواد ذات الشبكة البلورية الجزيئية:
- الانصهار ( درجة حرارة منخفضةذوبان):
- انضغاطية عالية
- البلورات الجزيئية في صورة صلبة ، وكذلك في المحاليل والذوبان ، لا توصل التيار ؛
- حالة الطور في ظل الظروف العادية - الغازات والسوائل والمواد الصلبة ؛
- تقلبات عالية
- صلابة منخفضة.
شعرية الكريستال الأيونية

إذا كانت هناك جزيئات مشحونة في عقد البلورة - الأيونات، يمكننا التحدث عنه شعرية الكريستال الأيونية . كقاعدة عامة ، تتناوب البلورات الأيونية الأيونات الموجبة(الكاتيونات) و الأيونات السالبة(الأنيونات) ، لذلك يتم الاحتفاظ بالجسيمات الموجودة في البلورة قوى الجذب الكهروستاتيكي . اعتمادًا على نوع البلورة ونوع الأيونات التي تشكل البلورة ، يمكن أن تكون هذه المواد قوي وصعب للغاية. في الحالة الصلبة ، كقاعدة عامة ، لا توجد جسيمات مشحونة متحركة في البلورات الأيونية. ولكن عندما تذوب البلورة أو تذوب ، يتم إطلاق الأيونات ويمكن أن تتحرك تحت تأثير خارجي الحقل الكهربائي. أولئك. إجراء الحلول الحالية فقط أو الذوبانبلورات أيونية. تتميز الشبكة البلورية الأيونية بأنها مميزة للمواد ذات الرابطة الكيميائية الأيونية. أمثلةمثل هذه المواد ملح كلوريد الصوديوم كربونات الكالسيوم- كربونات الكالسيوم 3 ، إلخ. تتكون الشبكة البلورية الأيونية ، كقاعدة عامة ، في الطور الصلب الأملاح والقواعد وكذلك أكاسيد الفلزات والمركبات الثنائية للمعادن واللافلزات.

التواصل بين الجسيمات في البلورات الأيونية: .
في العقد من الكريستال مع شعرية أيونية الأيونات.
حالة المرحلة البلورات الأيونية في الظروف العادية: عادة المواد الصلبة.
مواد كيميائية بشبكة بلورية أيونية:
- الأملاح (العضوية وغير العضوية) ، بما في ذلك أملاح الأمونيوم (علي سبيل المثال، كلوريد الأمونيوم NH4Cl) ؛
- أسباب.
- أكاسيد معدنية
- مركبات ثنائية تحتوي على معادن وغير فلزية.
الخصائص الفيزيائية للمواد ذات التركيب البلوري الأيوني:
- درجة انصهار عالية (مقاومة للحرارة) ؛
- محاليل وانصهار البلورات الأيونية - الموصلات الحالية ؛
- معظم المركبات قابلة للذوبان في المذيبات القطبية (الماء) ؛
- حالة الطور الصلب في معظم المركبات في الظروف العادية.

وأخيرًا ، تتميز المعادن بنوع خاص من التركيب المكاني - شعرية الكريستال المعدنية، وهو مستحق رابطة كيميائية معدنية . تحتوي ذرات المعادن على إلكترونات التكافؤ بشكل ضعيف. تحدث العمليات التالية في بلورة مكونة من معدن في وقت واحد: تتبرع بعض الذرات بالإلكترونات وتصبح أيونات موجبة الشحنة؛ هؤلاء تتحرك الإلكترونات بشكل عشوائي في البلورة; تنجذب بعض الإلكترونات إلى الأيونات. تحدث هذه العمليات بشكل متزامن وعشوائي. في هذا الطريق، تظهر الأيونات ، كما في تكوين رابطة أيونية ، و تتشكل الإلكترونات المشتركة كما في تكوين الرابطة التساهمية. تتحرك الإلكترونات الحرة بشكل عشوائي ومستمر في جميع أنحاء حجم البلورة ، مثل الغاز. لذلك ، يطلق عليهم أحيانًا غاز الإلكترون ". بسبب التواجد عدد كبيرالمعادن الجسيمات المشحونة المتنقلة توصيل الكهرباء والحرارة. درجة انصهار المعادن تختلف اختلافا كبيرا. تتميز المعادن أيضًا بريق معدني غريب ، مرونة، بمعنى آخر. القدرة على تغيير الشكل دون تدمير تحت ضغط ميكانيكي قوي ، tk. روابط كيميائيةبينما لا يتم تدميرها.

التواصل بين الجسيمات : .
في العقد من الكريستال مع صريف معدني أيونات وذرات المعادن.
حالة المرحلة المعادن في ظل الظروف العادية: عادة المواد الصلبة(استثناء - الزئبق ، السائل في ظل الظروف العادية).
مواد كيميائية مع شبكة معدنية بلورية - مواد بسيطة - معادن.
الخصائص الفيزيائية للمواد ذات الشبكة المعدنية البلورية:
- الموصلية الحرارية والكهربائية العالية ؛
- المرونة واللدونة ؛
- بريق معدني؛
- المعادن غير قابلة للذوبان بشكل عام في المذيبات ؛
معظم المعادن صلبة في ظل الظروف العادية.
مقارنة خصائص المواد مع المشابك البلورية المختلفة
يجعل نوع الشبكة البلورية (أو عدم وجود شبكة بلورية) من الممكن تقييم الخصائص الفيزيائية الأساسية للمادة. لإجراء مقارنة تقريبية للخصائص الفيزيائية النموذجية للمركبات ذات المشابك البلورية المختلفة ، فمن الملائم جدًا استخدام المواد الكيميائية مع الخصائص المميزة . بالنسبة للشبكة الجزيئية ، على سبيل المثال ، نشبع، للشبكة البلورية الذرية - الماس، للمعادن - نحاس، وللشبكة البلورية الأيونية - ملح, كلوريد الصوديومكلوريد الصوديوم.

جدول موجز عن هياكل المواد البسيطة المتكونة العناصر الكيميائيةمن المجموعات الفرعية الرئيسية للجدول الدوري (عناصر المجموعات الفرعية الثانوية هي معادن ، وبالتالي ، لديهم شبكة بلورية معدنية).

الجدول النهائي لعلاقة خواص المواد بالهيكل: