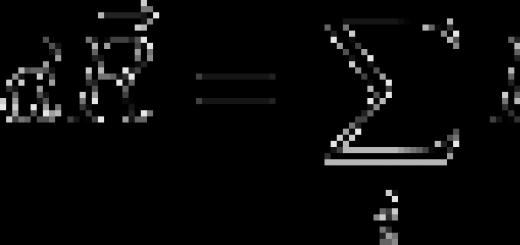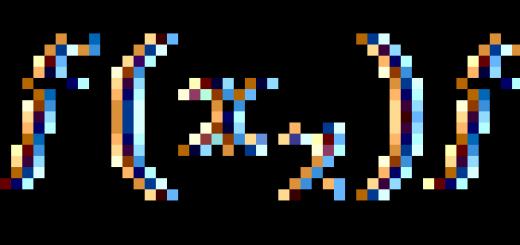مدرسة MBOU الثانوية رقم 139 من حي مدينة سمارة.
ملخص درس في الكيمياء للصف الثامن.
موضوعات: الصيغ الكيميائية. الذري والجزيئي النسبي الجماهير. جزء الشاملعنصر في الاتصال.
أهداف الدرس
التعليمية:
- لدراسة المفاهيم: الصيغة الكيميائية ، المؤشر ، المعامل ؛ صيغ الكتابة والقراءة.
- دراسة الفروق بين الكتل النسبية والذرية والجزيئية ؛
- سيدرس مفهوم الكسر الكتلي عنصر كيميائيوتعلم كيفية حسابها.
تطوير:
- تنمية القدرة لدى الطلاب على إنشاء بنى منطقية بسيطة مبنية على أساسها المعرفة الكيميائية;
- تنمية القدرة على استخدامها في المواقف غير القياسية أنشطة البحثالمعرفة من أقسام مختلفة من التخصصات المدرسية (الفيزياء والجبر) ، إذا لزم الأمر ، ابحث عن المعلومات المفقودة في المرجع و الأدب التربوي;
التعليمية:
- لتنمية التفكير الشخصي ، أي القدرة على فهم أفعال الفرد والنفس في حالة بحث إشكالية ؛
- تنمية التنظيم الذاتي وتقدير الذات لدى الطلاب في أداء المهام البحثية داخل الفصل.
معدات:جداول "الكتل الذرية والجزيئية النسبية" ، بطاقات فرديةالواجبات للطلاب ، جدول D.I. Mendeleev.
خلال الفصول
أنا. تنظيم الوقت
يقوم المعلم بإعداد الطلاب للعمل أثناء الدرس. يشرح جميع مراحل الدرس وتصرفات الطلاب في كل منها.
- أيها الرجال اليوم ، سيصبح كل واحد منكم باحثًا وسيكتسب "معرفة جديدة": اكتشف تركيبة الصيغ الكيميائية ، وقواعد كتابتها وقراءتها ؛ اشتق صيغة الكسر الكتلي لعنصر كيميائي واحسبه.
ثانيًا. دراسة موضوع جديد
1. كلام المعلم.
- كل ذرة من أي عنصر كيميائي لها كتلتها الخاصة ، وكذلك أي جسم مادي يحيط بنا ، بما في ذلك أنت وأنا. لكن على عكسنا ، فإن كتلة الذرات صغيرة جدًا. لذلك ، اتخذ العلماء الكتلة كمعيار 1/12 كتلة ذرة كربون 6 12 مع(كالأخف وزنًا) وكتلة الذرات المتبقية تمت مقارنتها بكتلة هذا المعيار ، ومن هنا جاء اسم "الكتلة الذرية النسبية" من اللغة الإنجليزية. « نسبيا » نسبيا. هذه القيمة ليس لها وحدات ويتم الإشارة إليها أر . يتم كتابة القيمة العددية للكتلة الذرية النسبية لأي عنصر الجدول الدوريدي. مندليف.
إذا تم تشكيل مادة من عدة عناصر (متشابهة أو مختلفة) ، فإننا نتحدث عن الجزيئات و "الكتلة النسبية الجزيئية". هي تكون يطورمن الكتل الذرية الكلالعناصر الكيميائية التي تشكل الجزيء تضاعفتلعدد هذه الذرات. كما أنه لا يحتوي على وحدات قياس ويتم الإشارة إليه السيد . علي سبيل المثال:
السيد (O 2) \ u003d Ar (O) 2 \ u003d 16 2 \ u003d 32 ؛
السيد (H 2 O) \ u003d Ar (H) 2 + Ar (O) \ u003d 1 2 + 16 \ u003d 18 ؛
السيد (H 2 SO 4) \ u003d Ar (H) 2 + Ar (S) + Ar (O) 4 \ u003d 1 2 + 32 + 16 4 \ u003d 98 ؛
يذكر المعلم الطلاب مرارًا وتكرارًا أن قيمة Ar موجودة في النظام الدوريدي. منديليف تحت علامة عنصر كيميائي. تضاف قيمة الكتل الذرية للعناصر الكيميائية المختلفة معًا. إذا كان هناك عدة ذرات متطابقة في الجزيء ، فمن بينها قيمة عدديةيتم ضرب الكتل الذرية في عدد تلك الذرات. (سيحدث توحيد الموضوع الجديد عند القيام بعمل مستقل في جزء البحث من الدرس)
2. جزء البحث (عمل مستقلتحت إشراف المعلم) ، إذا واجه الطلاب صعوبات ، يجب على المعلم أن يكون حذرًا للغاية ولا يعطي الطلاب إجابة صحيحة مباشرة بأي حال من الأحوال ، " معرفة جاهزة"عليهم أن يحصلوا عليها بأنفسهم. من الأفضل "دفع" الطالب إلى الحل الصحيح بأسئلة إرشادية تحفز النشاط العقلي ، والحاجة إلى ربط المعرفة الموجودة من مناطق أخرى بالمواد الجديدة. يعد هذا ضروريًا حتى لا يتم تعطيل عملية بحث الطلاب وتحقيق أفضل نتيجة عند دراسة مادة جديدة ، حيث يتم الاحتفاظ بالمعرفة المكتسبة بشكل مستقل في الذاكرة طويلة المدى بدلاً من المعلومات الجاهزة.
عينة الأسئلة:
- كيف تفكر؟
"تخيل ماذا سيحدث إذا ...؟"
— كيف ستتغير وماذا تعني؟
- فكر في أي مكان آخر قابلت فيه هذا المفهوم؟ إلخ.
يعطي المعلم الطلاب بطاقات - مهام ، ويركز انتباههم على حقيقة أن هذا أمر مستقل ابحاث، ولكن إذا لزم الأمر ، فإنك (المعلم) ستساعد بالتأكيد وتوجه عمل كل طالب في الاتجاه الصحيح.
البطاقات - المهام
موضوعات: صيغة كيميائية. الكتل النسبية والذرية والجزيئية. الكسر الكتلي للعناصر الكيميائية.
المهمة 1. الصيغة الكيميائية وتكوينها وتسجيلها ونطقها.
لكن.اكتشف التركيب النوعي والكمي للصيغ الكيميائية. حلل ما يعنيه كل منهم في الصيغة.
التركيب النوعي | |
ا 3 | الأكسجين ( س) |
ح 2 | الهيدروجين ( ح) |
ال 2 ا 3 | ألمنيوم ( Al) والأكسجين (O) |
الموجودات:
1) التركيب النوعي توضح الصيغة الكيميائية: ____________________________________ تشكل مادة.
2) التركيب الكمي تظهر الصيغة الكيميائية:
هم يشكلون مادة.
في.قم بتحليل الإدخال ، ما رأيك في الفهرس والمعامل في الصيغة الكيميائية.
2
![]() ال 2
ا 3
ال 2
ا 3
مؤشر المعامل
فهرس - هذا هو _____________ ، الذي يظهر _______________ في مادة ، وهو مكتوب ______________________ من رمز عنصر كيميائي ؛
معامل في الرياضيات او درجة هو _______________ ، والذي يظهر رقم _____________ المواد الكيميائية، هو مكتوب ______________ الصيغة الكيميائية ؛
في.استكشف قواعد قراءة الصيغ.
ترتيب نطق مكونات الصيغة:
1. معامل
2. رمز العنصر الكيميائي * ومؤشره (إن وجد).
3. الرمز التالي للعنصر الكيميائي ومؤشره.
* عند قراءة صيغة كيميائية ، يُقرأ نطق رمز العنصر الكيميائي وليس اسمه.
عمل مستقل.
(توحيد المواد الجديدة)
1.1. اكتب التركيب النوعيكل صيغة:
H 2 SO 4 _______________ FeSO 3 _____________________
H 3 PO 4 ________________ H 2 Cl 2 O 7 ____________________
1.2. اكتب التركيب الكمي لكل صيغة:
O 3 __________________ K 2 O _______________________
Cl 2 __________________ MgCO 3 ____________________
MgO ________________ NaOH _____________________
H 2 SO 4 _______________ FeSO 3 _____________________
H 3 PO 4 ________________ H 2 Cl 2 O 7 ____________________
1.3. اقرأ الصيغ. اكتب ما حصلت عليه:
لي 2 يا _________________________________________________
CAS ___________________________________________________
H 2 SiO 3 ________________________________________________________________
MgSO4 _________________________________________________
المهمة 2. اعتماد الكسر الكتلي للعناصر في المركب على بعض الكميات الفيزيائية.
قم بتحليل المعلمات وكيف يعتمد الكسر الكتلي لعنصر ما في المركب.
لكن.استكشف التركيب والكتل الذرية النسبية لعناصر جزيء حمض الهيدروكلوريك.
مُجَمَّع | نوعي | هيدروجين ح | الكلور Cl |
كمي | |||
الكتلة الذرية النسبية لـ Ar | |||
قارن الكسور الكتلية للعناصر في المركب: (H) _________ (Cl)
( , , )
ب.استكشف تركيب جزيئات الإيثان C 2 H 6 والأسيتيلين C 2 H 2.
الإيثان ج 2 ح 6 |
الأسيتيلين ج 2 ح 2 | |
عدد الذراتكربون ن (ج) | ||
عدد الذراتن الهيدروجين (ح) |
قارن بين الكسور الكتلية هيدروجينفي الإيثان والأسيتيلين:
( ح) ج 2 ح 6 _______________ (ح) ج 2 ح 2
( , , )
ما هي المعلمة وكيف تؤثر على قيمة الكسر الكتلي لعنصر ما في المركب؟
في.اكتشف تكوين جزيء ثاني أكسيد الكربون CO 2 وأول أكسيد الكربون CO.
ثاني أكسيد الكربون CO2 |
أول أكسيد الكربون CO | |
عدد ذرات الكربون n (C) | ||
الوزن الجزيئي النسبي للمركب السيد |
قارن بين كسور كتلة الكربون في ثاني أكسيد الكربون و أول أكسيد الكربون:
( ج) كو 2 _____________ (ج) كو
( , , )
ما هي المعلمة وكيف تؤثر على قيمة الكسر الكتلي لعنصر ما في المركب؟
قم بتعميم النتائج وعمل صيغة توضح اعتماد الكسر الكتلي على المعلمات التي وجدتها. لهذا:اكتب متناسبًا عكسيا مع المقام
قيمة الكسر الكتلي
للتعبير عن الكسر الكتلي كنسبة مئوية ، من الضروري ضرب الجانب الأيمن من الصيغة بنسبة 100٪
عمل مستقل.
2.1. ضع خطًا تحت المركب الذي يوجد فيه أكبر جزء من الكبريت:
أ ) Na 2 SO 3 و Na 2 S 2 O 3 ؛ ب) H 2 S و Na 2 S ؛ ج) Na 2 S 4 O 6 و Na 2 S 2 O 8.
2.2. دون إجراء حسابات ، اكتب المركبات التالية على التوالي بترتيب تنازلي الكسر الكتلي:
أ) الهيدروجين - H 2 O، H 2 O 2 _________________________
ب) الكلور - Cl 2 O ، Cl 2 O 7 ، ClO 2 ______________________
ج) الكبريت - SCl 4 ، S 2 Cl 2 ، SCl 2 ________________________
د) الكربون - CH 4 ، C 2 H 2 ، C 2 H 4 ____________________
ه) الفلور - P 2 F 4 ، PF 3 ، PF 5 _________________________
ثالثا. نتائج الدرس.
يتم تلخيص النتائج ، ويتم التحدث عن المفاهيم الكيميائية التي تمت دراستها في هذا الدرس: الكتل الذرية والجزيئية النسبية ، الصيغة الكيميائية ، الفهرس ، المعامل ، الكسر الكتلي لعنصر كيميائي في المركب.
رابعا. الواجب المنزلي.
§5. السابق. 1-5. (أي من الطلاب لم يكمل المهام المستقلة أثناء الدرس ، قم بها في المنزل)
Obernikhina Tatyana Sergeevna
مدرس كيمياء في المدرسة الثانوية التصنيفات.
مذكرة تفاهم "المدرسة الثانوية رقم 3 في كورياجما"
شيء . كيمياء.
موضوع الدرس الكسر الكتلي للعنصر.
الصف 8.
WMC ج. رودزيتيس.
نوع الدرس: تعلم مواد جديدة
هدف : لتكوين مهارة حل المشكلات لحساب النسبة وإيجاد كتلة مكون الحل.
مهام
التعليمية:
تشكيل مفهوم الكسر الكتلي لعنصر ما ؛
لتعليم إنشاء أبسط صيغة لمادة بواسطة كسور الكتلة من العناصر.
النامية:
تنمية مهارات التفكير المنطقي واهتمام الطلاب بالعلوم الكيميائية.
التعليمية:
لتثقيف الشخص بطريقة التفكير البيئية.
غرس روح الصداقة والمسؤولية في نفوس الطلاب.
مخرجات التعلم المخطط لها:
موضوعات:
تكوين المعرفة المنظمة حول نسبة عنصر في مادة ؛
تطوير القدرة على حساب الكسر الكتلي في المواد المختلفة ؛
موضوع التعريف:
تكوين الكفاءة في مجال استخدام المعرفة المكتسبة على الآخرين التخصصات الأكاديمية;
الشخصية:
تكوين الاقتناع بالحاجة إلى المعرفة الكيميائية لحياة الإنسان ؛
وسائل التعليم :
جهاز عرض الوسائط المتعددة
كمبيوتر؛
البطاقات ؛
الصفحة العلوية للكتاب المدرسي مع جدول D.I. Mendeleev ؛
دفاتر الملاحظات؛
الجدول من قبل D.I. Mendeleev ؛
نقش للدرس:
الطبيعة تحيط بنا مع الألغاز و ، و
محاولة لحلها تنتمي
لأعظم مباهج الحياة.
دبليو رامزي
مراحل الدرس
| مرحلة الدرس | نشاط المعلم | الأنشطة الطلابية |
| 1. لحظة تنظيمية. | يتحقق من استعداد الأطفال للدرس. تحياتي الموقف الايجابي للدرس. | تحقق من الاستعداد للدرس. |
| 2. تحديد الهدف والدافع. | خلق موقف محفز ومحفز من خلال نظام الأسئلة: فيما يلي المعادن المختلفة التي يمكن من خلالها الحصول على الحديد (FeO، Fe2 ا3 ، Fe3 ا4 ) (على جهاز عرض الوسائط المتعددة). سؤال إشكالي: ما هو برأيك المعدن الأكثر ربحية لاستخدامه في إنتاج الحديد. | طرح افتراضاتهم على السؤال المطروح. |
| ينظم أنشطة الطلاب لصياغة موضوع الدرس وأهدافه. ما رأيك هو الغرض من درسنا؟ | حدد الغرض من الدرس |
|
| لديك قدر معين من المعرفة ، ما المفاهيم التي تعلمتها مسبقًا والتي ستساعدك على تحقيق هدفك؟ | العنصر الكيميائي ، الصيغة الكيميائية ، الكتلة الذرية والجزيئية النسبية. |
|
| 3- تحديث المعرفة والتحكم فيها. | ماذا نقول عن هذه المعادن؟ | تتكون من ذرات الحديد والأكسجين |
| هل يمكن الاجابة على السؤال المطروح نوعا وكميا؟ | العمل بروح الفريق الواحد |
|
| الوزن الجزيئي للمواد |
||
| فحص الواجب المنزلي | يقوم الطلاب بحساب الكتلة المولية لأكاسيد الحديد على البطاقات الصادرة ، وبعد الانتهاء من المهمة ، يتبادلون البطاقات مع أحد الجيران على مكتبهم ويفحصونها مع المعلم. |
|
| 3. دراسة مادة تعليمية جديدة. | ينظم محادثة باستخدام معلومات العرض التقديمي ونص الكتاب المدرسي والمصنف. يتحكم في "اكتشاف" المعرفة الجديدة. يصحح لهم. كيف يمكنك تمثيل الصيغ المكتوبة بيانيا؟ ما هي الحصة؟ يرسم تشبيهًا لحساب نسبة مادة ما بالرياضيات. ما هي الكمية الرئيسية في الكيمياء ما هي الكتلة الذرية للحديد؟ كيف ، بناءً على معرفة الوزن الذري والجزيئي ، يمكن للمرء أن يشتق صيغة المادة؟ احسب كتلة الحديد في كل مادة وأجب عن السؤال (ارجع إلى الشريحة الأولى) مناقشة المهام المكتملة. هل تؤثر عملية التعدين بيئة? فيزكولتمينوتكا. لنتذكر العناصر الكيميائية. أنا أطلق عليك الاسم ، إذا كان يطابق النطق - رفع اليد اليمنىإذا لم يكن كذلك ، غادر. التعميم والتنظيم يقدم مواد جديدة يحدث فيها نفس العنصر الكيميائي. احسب الكسر الكتلي في كل منهما. لذا2 وهكذا3 ω (S) = لذا2 و CO (C) = ω (N) = HNO3 , HNO2 أكمل المهام في المصنف لدمج المادة. | أجب على الأسئلة المقدمة. ارسم تركيبة المواد بألوان مختلفة. جزء من الكل. يتذكر الطلاب كيف يتم حساب النسبة في الرياضيات. الكتلة الذريةعنصر استخرج مع المعلم صيغة المادة ω = (عربي ن / السيد) 100٪ احسب. 3 طلاب يعملون على السبورة اجب على السؤال طرح افتراضاتهم فيزكولتمينوتكا. أحد الطلاب في اتجاه المعلم - يسمي النطق الصحيح. قم بإجراء الحسابات يقومون بالعمل. |
| 4. تأمل وتلخيص الدرس. | ينظم التفكير وتلخيص الدرس. إذا طلبت منك والدتك أن تكتب لها رسالة نصية قصيرة حول أهم شيء في الدرس ، ماذا ستكتب؟ هل حققنا أهدافنا؟ يا رفاق ، بعد الانتهاء من الدرس ، أطلب منكم لصق الدائرة الصادرة على أحد الملصقات عند المخرج. (تم تعلم كل شيء ، ولم يتم تعلم ما يكفي ، والمراجعة الجادة مطلوبة). | يتحدثون إجاباتهم. تقييم عملهم في ملصقات عند المخرج. |
| 5. معلومات عن الواجب المنزلي. | يقدم مهمة وفقًا للإمكانيات: 1. احسب في أي من المركبات المقترحة (بيروكسيد الهيدروجين ، الماء ، حامض الكبريتيك، أكسيد الكالسيوم ، الصيغ التي دونها المعلم بيروكسيد الصوديوم) هل الجزء الكتلي من الأكسجين هو الأكبر؟ 2. أوجد الكسر الكتلي لكل عنصر في المركب(Fe3 (ص4 ) 2 * 8 ح2 س) | يقومون باختيار الواجب المنزلي وفقًا لقدراتهم وقدراتهم واهتمامهم بالموضوع المدروس. |
الأدب المستخدم:
1. الكيمياء الصف الثامن الكيمياء غير العضوية، الصف الثامن ، Rudzitis G.E. ، Feldman F.G. ، 2013.
2. فاديف ج. مهام واختبارات للتدريب الذاتي في الكيمياء: دليل للطلاب والمعلمين. - م: بينوم. معمل المعرفة 2008.
3. دفتر العمل. الصف 8.
4. المواد التعليمية. 8-9 درجات.
معرفة صيغة كيميائية، يمكنك حساب الكسر الكتلي للعناصر الكيميائية في مادة ما. عنصر في المواد يرمز له باليونانية. الحرف "أوميغا" - ω E / V ويحسب بالصيغة:
حيث k هو عدد ذرات هذا العنصر في الجزيء.
ما هو الكسر الكتلي للهيدروجين والأكسجين في الماء (H 2 O)؟
قرار:
M r (H 2 O) \ u003d 2 * A r (H) + 1 * A r (O) \ u003d 2 * 1 + 1 * 16 \ u003d 18
2) احسب الكسر الكتلي للهيدروجين في الماء:
3) احسب الكسر الكتلي للأكسجين في الماء. نظرًا لأن تكوين الماء يشتمل على ذرات عنصرين كيميائيين فقط ، فسيكون الجزء الكتلي من الأكسجين مساويًا لـ:

أرز. 1. صياغة حل المشكلة 1
احسب الكسر الكتلي للعناصر في المادة H 3 PO 4.
1) احسب النسبي الوزن الجزيئي الغراميمواد:
M r (H 3 RO 4) \ u003d 3 * A r (H) + 1 * A r (P) + 4 * A r (O) \ u003d 3 * 1 + 1 * 31 + 4 * 16 \ u003d 98
2) نحسب الكسر الكتلي للهيدروجين في المادة:
3) احسب الكسر الكتلي للفوسفور في المادة:
4) احسب الكسر الكتلي للأكسجين في المادة:
1. مجموعة من المهام والتمارين في الكيمياء: الصف الثامن: إلى الكتاب المدرسي من قبل P.A. Orzhekovsky وآخرون. "الكيمياء ، الصف الثامن" / P.A. Orzhekovsky، N.A. تيتوف ، ف. هيجل. - M: AST: Astrel، 2006.
2. Ushakova O.V. كتاب الكيمياء: الصف الثامن: إلى الكتاب المدرسي بقلم أ. Orzhekovsky وآخرون "الكيمياء. الصف 8 "/ O.V. أوشاكوفا ، بي. بيسبالوف ، ب. أورزيكوفسكي. تحت. إد. الأستاذ. ب. Orzhekovsky - M.: AST: Astrel: Profizdat، 2006. (ص 34-36)
3. الكيمياء: الصف الثامن: كتاب مدرسي. للعامة المؤسسات / P.A. Orzhekovsky ، L.M. ميشرياكوفا ، إل. بونتاك. M: AST: Astrel، 2005. (§15)
4. موسوعة للأطفال. المجلد 17. الكيمياء / الفصل. حرره V.A. فولودين ، الرائد. علمي إد. أنا لينسون. - م: أفانتا + ، 2003.
1. مجموعة واحدة من المصادر التعليمية الرقمية ().
2. النسخة الإلكترونية لمجلة "الكيمياء والحياة" ().
4. درس فيديو حول موضوع "الكسر الكتلي لعنصر كيميائي في مادة" ().
الواجب المنزلي
1. ص 78 رقم 2من الكتاب المدرسي "الكيمياء: الصف الثامن" (P.A. Orzhekovsky، L.M. Meshcheryakova، LS Pontak. M.: AST: Astrel، 2005).
2. مع. 34-36 №№ 3.5من كتاب المصنف في الكيمياء: الصف الثامن: إلى الكتاب المدرسي بقلم أ. Orzhekovsky وآخرون "الكيمياء. الصف 8 "/ O.V. أوشاكوفا ، بي. بيسبالوف ، ب. أورزيكوفسكي. تحت. إد. الأستاذ. ب. Orzhekovsky - M: AST: Astrel: Profizdat، 2006.