آي أيولكوف ، أو في. Arkhangelskaya M.V. بافلوفا
نظام التحضير لأولمبياد الكيمياء
محاضرات 5-8
الجامعة التربوية "الأول من سبتمبر"
إيغور ألكساندروفيتش تيولكوف ، أولغا فالنتينوفنا أرخانجيلسكايا ، ماريا فياتشيسلافوفنا بافلوفا
مواد مقرر "نظام التحضير للأولمبياد في الكيمياء": محاضرات 5-8. - م: الجامعة التربوية "الأول من سبتمبر" 2009. - 96 ص.
مساعدة تعليمية
محرر O.G. بلوخين
تخطيط الكمبيوتر د. كاردانوفسكي
تم التوقيع للنشر في 17.06.2009.
تنسيق 60 × 90/16. محرف "Times New Roman".
طباعة أوفست. بيتش. ل. 6.0 تداول 200 نسخة. رقم الطلب
الجامعة التربوية "الأول من سبتمبر" ، ش. كيفسكايا ، 24 ، موسكو ، 121165 http://edu.1september.ru
I ل. تيولكوف ، 2008 O.V. أرخانجيلسكايا ، 2008 بافلوفا ، 2008
الجامعة التربوية "الأول من سبتمبر" 2008
محاضرة رقم 1. الأهداف والغايات الرئيسية لحركة الأولمبياد في سياقها التعليم الحديثفي روسيا. تاريخ مادة كيميائية
1 منهم حركة الأولمبياد في روسيا. نظام الأولمبياد الكيميائي والمسابقات الإبداعية في روسيا. دور الأولمبياد الكيميائي في التربية والعلوم.
محاضرة رقم 2. طرق إعداد وإقامة الأولمبياد على مختلف المستويات. تنظيم أولمبياد الكيمياء: من pro-
1 ستوجو إلى معقد. المراحل التحضيرية والرئيسية والنهائية لتنظيم الأولمبياد. نظام ممثلينالأولمبياد ، دورهم.(تيولكوف آي ، أرخانجيلسكايا أو في)
المحاضرة رقم 3. الأساس المفاهيمي لمحتوى مهام الأولمبياد
داشا. برنامج تقريبي لمحتوى المراحل المختلفة لأوليمبياد الكيمياء: حدود جامدة أم إرشادات للتحضير؟
1 تصنيف مهام أولمبياد. مهام أولمبياد الكيمياء: من مرحلة إلى أخرى ، من السياحة.(تيولكوف آي ، أرخانجيلسكايا أو في)
اختبار رقم 1
المحاضرة رقم 4
1 تحويلات. تصنيف مشاكل مخططات التحويل. تكتيكات وإستراتيجيات حل مشكلات الأولمبياد باستخدام "السلسلة-
كامي ". (تيولكوف آي إيه ، أرخانجيلسكايا أو في ، بافلوفا إم في)
محاضرة رقم 5. طرق حل المشكلات في الكيمياء الفيزيائية (1) المهام
2 في الكيمياء الحرارية المهام باستخدام مفاهيم "الانتروبيا" و "الطاقة
جيا جيبس ". (تيولكوف آي إيه ، أرخانجيلسكايا أو في ، بافلوفا إم في)
محاضرة رقم 6. طرق حل المشكلات في الكيمياء الفيزيائية (2).
المهام المتعلقة بالتوازن الكيميائي ، المهام على الخواص الحركية (Tyulkov
2 IA ، Arkhangelskaya O.V. ، Pavlova M.V.)
اختبار رقم 2
محاضرة رقم 7. المداخل المنهجية لتنفيذ التجارب
2 المهام. تصنيف مهام الجولة التجريبية. المهارات العملية اللازمة للتنفيذ الناجح للتجربة
المهام العقلية.(تيولكوف آي إيه ، أرخانجيلسكايا أو في ، بافلوفا إم في)
محاضرة رقم 8. المبادئ المنهجية لإعداد تلاميذ المدارس للكوليمبياد. استخدام التقنيات التربوية الحديثة في إعداد الكوليمبياد بمستويات مختلفة ، وتكتيكات وإستراتيجيات التحضير والمشاركة في الأولمبياد. التنظيمية
2 عمل منهجيمعلم مرشد. مناهج منهجية لتجميع مهام الأولمبياد ، الأولمبياد كوسيلة لتحسين مؤهلات المعلمين والموجهين ، دور الاتصال عبر الإنترنت ووسائل الإعلام في تبادل الخبرات التربوية. (تيولكوف آي إيه ، أرخانجيلسكايا أو في ، بافلوفا إم في)
العمل النهائي

محاضرة # 5
طرق حل المشكلات في الكيمياء الفيزيائية (1)
مشاكل في الكيمياء الحرارية
أي تفاعل كيميائي مصحوب بامتصاص أو إطلاق الطاقة () ، تسمى هذه الطاقة عادةً "التأثير الحراري للتفاعل". في شكل مبسط ، يمكن للمرء أن يتخيل أن التغيير في الطاقة يحدث بسبب حقيقة أنه أثناء التفاعل الكيميائي ، تنكسر الروابط الكيميائية في المواد الأولية (بينما يتم امتصاص الطاقة) وتتشكل روابط كيميائية جديدة في نواتج التفاعل (بينما يتم إطلاق الطاقة في البيئة الخارجية). إذا كانت الطاقة المستهلكة في تكسير الروابط الكيميائية أكبر من الطاقة المنبعثة أثناء تكوين روابط كيميائية جديدة ، يستمر التفاعل بامتصاص الطاقة ، وفي الحالة المعاكسة ، يتم إطلاق الطاقة.
يمكن أن تتخذ الطاقة المصاحبة للتفاعلات الكيميائية أشكالًا مختلفة.
الجدول 1 |
|
أنواع الطاقة المنبعثة |
|
معادلة كيميائية |
نوع الطاقة |
هيدروكسيد الصوديوم (محلول) + حمض الهيدروكلوريك (محلول) = |
حراري |
كلوريد الصوديوم (محلول) + H2 O (لتر) |
|
Mg (صلب) + 1 / 2O2 (g) \ u003d MgO (صلب) |
حراري وخفيف |
حراري وميكانيكي (منتج- |
|
هناك انخفاض في حجم التفاعل |
|
NH3 (g) + HCl (g) = NH4 Cl (صلب) |
onnoysystem: من غازين - |
المواد التي اتضح أنها صلبة |
|
الجوهر) ، البيئة |
|
القيام بالعمل على النظام |
|
معادلة كيميائية |
نوع الطاقة |
||
الحرارية والميكانيكية (الأصل- |
|||
Zn (صلب) + 2HCl (محلول) = |
هناك زيادة في حجم النظام |
||
نحن لان الغازي |
|||
ZnCl2 (محلول) + H2 (ز) |
|||
الجوهر) ، يعمل النظام |
|||
العمل على البيئة |
|||
Zn (صلب) + Cu (محلول) = |
الكهرباء والحرارية |
||
زنك (محلول) + نحاس (صلب) |
|||
يسمى رد الفعل المصحوب بإطلاق الحرارة في البيئة طارد للحرارةتفاعل. تفاعل مصحوب بامتصاص الحرارة من بيئة، يسمى ماص للحرارةتفاعل.
الجول (J) هو الوحدة الأساسية لقياس الحرارة في النظام الدولي للوحدات (SI). في الأعمال القديمة ، تم العثور أيضًا على السعرات الحرارية التي تساوي 4.184 J كوحدة قياس ، وهي محفوظة حاليًا كوحدة خارج النظام لمقارنة نتائج الأعمال الحديثة مع البيانات التجريبية والمرجعية المتراكمة على مدى مئات السنين.
تُسمى معادلة تفاعل كيميائي ، يُشار فيها إلى تأثير الطاقة (الحراري عادةً) للتفاعل مع كمية معينة من مادة (بالإضافة إلى العوامل الأخرى التي يعتمد عليها هذا التأثير) معادلة التفاعل الكيميائي الحراري.
العلم الذي يدرس التأثيرات الحرارية للتفاعلات الكيميائية يسمى الكيمياء الحرارية. التأثير الحراري للتفاعل الكيميائي هو الطاقة المنبعثة أو الممتصة أثناء تفاعل كيميائي.
في شكل من أشكال الحرارة (أو عمل ميكانيكي، والذي يتحول أيضًا
في في النهاية إلى طاقة حرارية).
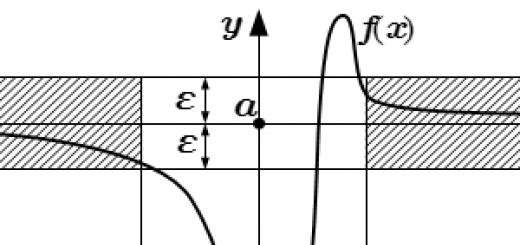
يُشار إلى التأثير الحراري للتفاعل ، المقاس عند ضغط ثابت ، بالرمز Q p ، ( حراريةالتعيين) أو H p نشوئها (المحتوى الحراري للتفاعل - الديناميكا الحراريةتعيين).
س ص \ u003d - ح ف نشوئها.

محاضرة # 5 |
|
حرارة التفاعل تساوي المحتوى الحراري لهذا التفاعل ، إذا أُخذت معكوسًا |
|
فيما يلي سنستخدم الترميز Q بدلاً من |
|
ثم س ع ، لأن فقط ردود الفعل التي تحدث في |
|
ضغط مستمر |
|
طارد للحرارة |
|
ردود الفعل مستمرة |
|
إطلاق الحرارة من |
|
أنظمة في البيئة |
|
البيئة (الشكل 1): |
|
س> 0 ، نصيب< 0. |
|
على سبيل المثال ، الحزن- |
|
استخراج الفحم: |
|
أرز. 1. تناقص المحتوى الحراري للنظام ، |
C + O2 = CO2. |
يتم إطلاق الطاقة من النظام إلى البيئة |
ماص للحرارة |
Δ حموضة< 0 |
|
ردود الفعل مستمرة |
|
امتصاص الحرارة |
|
نظام iso- البيئة |
|
البيئة (الشكل 2): |
|
س< 0, H р-ции > 0. |
|
تشمل التفاعلات الماصة للحرارة بعض تفاعلات التحلل ، على سبيل المثال:
أرز. 2. زيادة المحتوى الحراري للنظام ، يأخذ النظام الطاقة من البيئة الخارجية ، ΔH p-tion> 0
CaCO3 = CaO + CO2 ،
جميع تفاعلات تفاعل النيتروجين مع الأكسجين ، إلخ.

منهجية حل المشكلات عن طريق الكيمياء الفيزيائية (1)
العوامل المؤثرة في التأثير الحراري للتفاعل الكيميائي:
1) طبيعة المتفاعلات.
2) كمية المتفاعلات
3) الحالات الإجمالية للمواد ؛
4) التعديلات المتآصلة أو متعددة الأشكال للمواد. العاملان الأولان ، في رأينا ، واضحان.
يتم توضيح الحالات والتعديلات المتآصلة من خلال الأمثلة التالية.
1) الحصول من مواد بسيطةمركبات بصيغة H 2 س
في مختلف دول التجميع(تين. 3).
أرز. 3. مخطط الطاقة للحصول على المياه من مواد بسيطة:
∆H1 هو المحتوى الحراري لتفاعل تكوين الماء في الحالة الغازية ؛ ∆H2 هو المحتوى الحراري لتفاعل تكوين الماء السائل ؛ ∆H3 هو المحتوى الحراري لتفاعل تكوين الماء في الحالة البلورية ؛ ∆H4 هو المحتوى الحراري للتبخر (تكثيف) الماء ؛ ∆H5 هو المحتوى الحراري للذوبان (التبلور)
الماء ؛ ∆Н6 - المحتوى الحراري لتسامي الجليد

محاضرة # 5 |
|||
المعادلات الحرارية الكيميائية: |
|||
(ز) + 1 / 2O2 |
(ز) = H2 O (g) + 242 كيلو جول ؛ |
||
(ز) + 1 / 2O2 |
(ز) = H2 O (l.) + 286 kJ ؛ |
||
(ز) + 1 / 2O2 |
(ز) = H2 O (تلفزيون) + 292 كيلو جول. |
||
تُظهر البيانات المعطاة بوضوح تأثير حالة التجميع على التأثير الحراري للتفاعل:
س 1< Q 2 < Q 3.
2) احتراق الجرافيت والماس نتيجة أحدهما
و نفس المادة نشبع(الشكل 4).
أرز. 4. مخطط الطاقة لاحتراق الجرافيت والماس:
∆H1 هو المحتوى الحراري لتكوين ثاني أكسيد الكربون (جم) ، يساوي عدديًا المحتوى الحراري لاحتراق الجرافيت ؛ ∆H2 هو المحتوى الحراري لاحتراق الماس (لا يساوي المحتوى الحراري لتكوين ثاني أكسيد الكربون (جم) ، منذ الحالة القياسية للكربون ليست الماس ، ولكن الجرافيت) ؛ ∆H3 هو المحتوى الحراري
المرحلة الانتقالية الجرافيت الماس
المعادلات الحرارية الكيميائية:
C (alm.) + O2 (g.) = CO2 (g.) + 395 kJ ؛
C (غرام) + O2 (g.) = СO2 (g.) + 393 kJ.
طرق حل المشكلات في الكيمياء الفيزيائية (1)
تذكر مرة أخرى أن H p-tions = Q.
المحتوى الحراري القياسي لتكوين مادة (∆H arr) هو المحتوى الحراري لتفاعل تكوين 1 مول من مادة من مواد بسيطة في الحالة القياسية في ظل الظروف القياسية (الضغط 101325 باسكال ، درجة الحرارة 298 كلفن). جميع المواد في حالة أكثر استقرارًا في ظل الظروف القياسية. على سبيل المثال ، بالنسبة للأكسجين والهيدروجين والنيتروجين ، هذه الحالة المستقرة غازية ، وبالنسبة للكربون فهو جرافيت ، وبالنسبة للكبريت فهو تعديل معيني ، وبالنسبة للماء فهو حالة سائلة ، وبالنسبة لمعظم الأملاح فهو حالة بلورية صلبة ، إلخ.
المحتوى الحراري لتكوين مادة بسيطة في الحالة القياسية في ظل الظروف القياسية هو صفر.
إذا كانت ∆ H arr من مادة ما أقل من الصفر ، فهذا يعني أن الطاقة قد تم إطلاقها أثناء تكوين هذه المادة. لذلك ، يجب إنفاق الطاقة لتدمير هذا المركب. كلما زادت الطاقة المنبعثة أثناء تكوين مادة ما ، زادت ثباتها الديناميكي الحراري ، كقاعدة عامة.
يتم إعطاء المحتوى الحراري لتكوين العديد من المواد في كتب مرجعية خاصة.
المحتوى الحراري القياسي لاحتراق مادة ما هو المحتوى الحراري لتفاعل الاحتراق (∆H حرق ) 1 مول من مادة في الأكسجين الغازي فيص (س 2 ) = 1 بار. تتوافق القيمة الحرارية للهيدروكربون ، ما لم يُذكر خلاف ذلك ، مع أكسدة الكربون إلى ثاني أكسيد الكربون 2 (ز) ، الهيدروجين إلى H. 2 أوه (ف.). بالنسبة للمواد الأخرى ، من المعتاد الإشارة إلى المنتجات الناتجة في كل حالة. على سبيل المثال ، يمكن كتابة المعادلات الكيميائية الحرارية التالية:
CH3 OH (l.) + 1.5O2 (g.) \ u003d CO2 (g.) + 2H2 O (l.) + 726 kJ ؛
C2 H5 Cl (g.) + 3O2 (g.) = 2CO2 (g.) + HCl (g.) +
2H2 O (l.) + 685 كيلوجول ؛
FeS (صلب) + 1.75O2 (g) = 0.5Fe2 O3 (صلب) + SO2 (g) + 828 kJ ؛
CH3 NH2 (g.) + 2.25O2 (g.) = CO2 (g.) + 2.5H2 O (l.) + + 0.5N2 (g.) + 1768.5 kJ.
محاضرة # 5 |
|
نؤكد مرة أخرى أن المحتوى الحراري لاحتراق الميثانول ، كلورو إيثان ، كبريتيد الحديد (II) والميثيل أمين هي –726 ، –685 ، –828 ، –1768.5 كيلو جول ، على التوالي.
عادة ، يتعلم تلاميذ المدارس وحتى الطلاب بصعوبة كبيرة تعريفات المحتوى الحراري لتكوين المواد واحتراقها. لإزالة هذا الحاجز ، من المفيد الرجوع إلى خوارزمية إنشاء ملف
لينيا ، على سبيل المثال ، عند التحديدالمحتوى الحراري القياسي لتكوين مادة أجب على الأسئلة الرئيسية التالية.
1) المحتوى الحراري لأي رد فعل؟
(تفاعل التكوين الكيميائي.)
2) ما هي كمية المادة التي يجب أن تتكون أثناء هذا التفاعل؟
3) مما تتكون هذه المادة؟
(من مواد بسيطة.)
4) في أي حالة يجب أن تؤخذ المواد الأولية؟
(في الدول القياسية.)
5) في أي ظروف يجب أن يستمر التفاعل؟
(في ظل الظروف القياسية.)
الإجابات المتسقة على الأسئلة المطروحة تضيف تعريفًا. المحتوى الحراري القياسي لتكوين مادة (∆ H arr) هو المحتوى الحراري للتفاعل الكيميائي لتكوين 1 مول من مادة من مواد بسيطة مأخوذة في حالات قياسية وفقًا للشروط القياسية. وبالمثل ، فإن تعريفات المحتوى الحراري لتفاعلات احتراق مادة أو طور أو انتقال متآصل أو تكوين رابطة كيميائيةوإلخ.
اختر معادلة التفاعل ، والتي سيكون المحتوى الحراري منها مساويًا للمحتوى الحراري القياسي لتكوين كبريتات النحاس (II) (CuSO3):
أ) النحاس (في.) + S (في.) + 3O (في.) \ u003d CuSO3 (صلب) ؛ ب) CuO (صلب) + SO2 (g) = CuSO3 (صلب) ؛
ج) النحاس (صلب) + S (معين) + 1.5O2 (ز) = CuSO3 (صلب) ؛ د) 2Cu (صلب) + 2S (معين) + 3O2 (g) \ u003d 2CuSO3 (صلب).
- لونين فاليري فاسيليفيتش(رئيس) - أستاذ ، عميد كلية الكيمياء ، جامعة موسكو الحكومية. م. لومونوسوف ، أكاديمي في الأكاديمية الروسية للعلوم
- أرخانجيلسكايا أولغا فالنتينوفنا (نائب رئيس مجلس الإدارة) - أستاذ مشارك بكلية الكيمياء ، جامعة موسكو الحكومية. م. Lomonosov ، مرشح العلوم الكيميائية
- إريمين فاديم فلاديميروفيتش
- تيولكوف إيغور ألكساندروفيتش- أستاذ مشارك بكلية الكيمياء جامعة موسكو الحكومية. م. لومونوسوف ، مرشح العلوم التربوية
- تيرينين فلاديمير إيليتش- أستاذ بكلية الكيمياء جامعة موسكو الحكومية. م. لومونوسوف ، دكتور في العلوم الكيميائية
- جيروف الكسندر ايفانوفيتش
- ليبيديفا أولغا كونستانتينوفنا- أستاذ مشارك بكلية الكيمياء جامعة موسكو الحكومية. M.V. Lomonosov ، مرشح العلوم الكيميائية
- ريشيتوفا مارينا دميترييفنا- باحث أول بكلية الكيمياء جامعة موسكو الحكومية. م. Lomonosov ، مرشح العلوم الكيميائية
- تروشكوف إيغور فيكتوروفيتش- أستاذ مشارك بكلية الكيمياء جامعة موسكو الحكومية. م. Lomonosov ، مرشح العلوم الكيميائية
- باتشيفا آنا فلاديميروفنا- أستاذ مشارك بكلية الكيمياء جامعة موسكو الحكومية. م. Lomonosov ، مرشح العلوم الكيميائية
- غلاديلين الكسندر كيريلوفيتش- أستاذ بكلية الكيمياء جامعة موسكو الحكومية. م. لومونوسوف ، دكتور في العلوم الكيميائية
- إميليانوف فياتشيسلاف ألكسيفيتش- باحث أول ، نائب عميد كلية الكيمياء في نوفوسيبيرسك جامعة الدولة، دكتوراه في الكيمياء
- زلوتنيكوف إدوارد جريجوريفيتش- أستاذ مشارك بكلية الكيمياء بالدولة الروسية الجامعة التربويةهم. أ. هيرزن ، مرشح العلوم الكيميائية
- Kosmynin فاسيلي فاسيليفيتش- أستاذ مشارك بكلية الكيمياء جامعة ولاية بيلغورود مرشح العلوم الكيميائية
- لينسون ايليا أبراموفيتش- أستاذ مشارك بكلية الكيمياء جامعة موسكو الحكومية. م. Lomonosov ، مرشح العلوم الكيميائية
- ميدفيديف يوري نيكولايفيتش- أستاذ مشارك ، نائب عميد كلية الكيمياء ، جامعة موسكو الحكومية التربوية ، مرشح العلوم الكيميائية
- ريوتوف فلاديمير الكسيفيتش- أستاذ ، رئيس قسم التكنولوجيا الكيميائية ، كلية الكيمياء ، جامعة الشرق الأقصى الحكومية ، دكتوراه في العلوم الكيميائية
- Samorukova أولغا ليونيدوفنا- أستاذ مشارك بالجامعة الكيميائية التكنولوجية الروسية. دي. منديليف ، مرشح للعلوم الكيميائية (كما هو متفق عليه)
480 فرك. | 150 غريفنا | 7.5 دولارات أمريكية ، MOUSEOFF ، FGCOLOR ، "#FFFFCC" ، BGCOLOR ، "# 393939") ؛ " onMouseOut = "return nd ()؛"> أطروحة - 480 روبل ، الشحن 10 دقائق 24 ساعة في اليوم وسبعة أيام في الأسبوع وأيام العطل
240 فرك. | 75 غريفنا | 3.75 دولارًا أمريكيًا ، MOUSEOFF ، FGCOLOR ، "#FFFFCC" ، BGCOLOR ، "# 393939") ؛ " onMouseOut = "return nd ()؛"> الخلاصة - 240 روبل ، توصيل 1-3 ساعات ، من الساعة 10 إلى 19 (بتوقيت موسكو) ، ما عدا يوم الأحد
تيولكوف إيغور ألكساندروفيتش. دراسة مقرر الكيمياء العامة على أساس الديناميكا الحرارية الكيميائية كعامل تشكيل النظام: Dis. ... كان. بيد. العلوم: 13.00.02: موسكو ، 2001177 ص. RSL OD، 61: 02-13 / 833-6
مقدمة
الفصل الأول: مقرر الكيمياء العامة في نظام التربية الكيميائية للمرحلتين العليا والثانوية.
1.1 تحليل محتوى مقررات الكيمياء العامة التي تدرس في الجامعات و المدرسة الثانوية 8
1.2 الديناميكا الحرارية الكيميائية في سياق الكيمياء العامة 19
1.3 طرق تدريس مادة الكيمياء العامة في الجامعات 24
1.4 ندوة في نظام تدريس طلاب الكيمياء العامة. المناهج المنهجية لعقد الندوات في الكيمياء العامة في الجامعة ومبرراتها 29
1.5 دور الحاسب الآلي في العملية التعليمية بالندوة في تدريس مادة الكيمياء العامة 34
1.6 مراقبة نتائج تعلم الطلاب في الندوات وتشخيصها ... 39 الفصل الثاني. تشكيل مفهوم تدريس طلاب الكيمياء العامة في الندوات على أساس الديناميكا الحرارية الكيميائية كعامل مكون للنظام 46
2.1. 46
2.2. بناء ندوات في الكيمياء العامة على أساس الديناميكا الحرارية الكيميائية كعامل تشكيل نظام 49
الفصل 3
3.1 عقد ندوة حول الديناميكا الحرارية الكيميائية بطرق مختلفة 57
3.2 منهجية تقييم فاعلية ندوة عن الديناميكا الحرارية الكيميائية
3.3 مقارنة نتائج خيارات التدريب الثلاثة 65
3.5 دراسة منهجية إجراء الندوات في الكيمياء العامة على أساس الديناميكا الحرارية الكيميائية كعامل تشكيل النظام 69
3.6 نتائج دراسة فاعلية عقد الندوات في الكيمياء العامة بالاعتماد على الديناميكا الحرارية الكيميائية كعامل تشكيل النظام ومناقشة النتائج 73
الأدب 94
التطبيقات 108
الملحق 1. محتوى الديناميكا الحرارية الكيميائية في برامج الكيمياء العامة الملحق 2. العلاقات متعددة التخصصات المحددة في تحليل برامج الكيمياء العامة 111
الملحق 3. اختبار الديناميكا الحرارية الكيميائية 112
الملحق 4. خطط الندوة 144
الملحق 5. نتائج إنجاز مهام البحث المؤكّد 1998/1999
و 1999/2000 عام دراسي 148
الملحق 6. أمثلة لتعيينات الندوات ونتائج التعيينات الندوات من قبل طلاب كلية الجغرافيا وكلية الجيولوجيا وكلية الطب الأساسي في جامعة موسكو الحكومية 153
التذييل 7. نتائج تكليفات العمل النهائي من قبل طلاب الكليات الجغرافية والجيولوجية وكلية الطب الأساسي بجامعة موسكو الحكومية 170
مقدمة في العمل
يهدف التعليم العالي إلى تدريب المتخصصين على نطاق واسع ، القادرين على البحث الإبداعي المستمر واكتساب المعرفة الجديدة. الأهداف الرئيسية لتدريس الكيمياء العامة هي:
بناء أساس متين معرفة نظريةفي الكيمياء العامة ، ضروري للدراسة الناجحة للتخصصات الكيميائية الأخرى المنصوص عليها في المناهج الدراسية للتخصصات ذات الصلة (الفيزيائية ، التحليلية ، الغروية ، الكيمياء العضويةإلخ) ، بالإضافة إلى عدد من التخصصات الأكاديمية المتعلقة بالكيمياء (الهيدرولوجيا ، والأرصاد الجوية ، وعلم البلورات ، والبيئة ، والكيمياء الحيوية ، والفيزياء الحيوية ، وما إلى ذلك)
تكوين أساليب التفكير العلمي لدى الطلاب لتجديد المعرفة وتطبيقها في حل مشكلات البحث.
في الممارسة الحالية للتدريس ، يتم بناء مسار الندوات في الكيمياء العامة بشكل خطي. في دورة منظمة بشكل مشابه ، تشكل الموضوعات الفردية تسلسلًا مستمرًا من الموضوعات (الديناميكا الحرارية الكيميائية ، وعلم الحركة ، والتوازن في محاليل الإلكتروليتات والإلكتروليتات ، وما إلى ذلك) ، والتي يتم وضعها مرة واحدة أثناء التدريب. مع مثل هذا الهيكل للعرض التقديمي ، لا يمكن استخدام المعرفة التي لم يكتسبها الطلاب بشكل صحيح في الندوات السابقة بشكل كامل في دراسة الموضوعات اللاحقة ، مما يعني أن فعالية التدريب تنخفض. في دراسة كل موضوع لاحق ، يجب على الطلاب الاستفادة بنشاط من المعرفة المكتسبة مسبقًا. ومع ذلك ، فإن هذا لا يحدث للسبب الموصوف أعلاه ، وأيضًا بسبب قلة دافع الطلاب لدراسة مقرر الكيمياء العامة. يلعب أيضًا دور سلبي بسبب الترابط المنخفض لموضوعات الندوات. غالبًا ما يتم تحديد تسلسل الموضوعات تاريخيًا أو اختياره بشكل تعسفي من قبل الجامعة ، وغالبًا ما لا يشرح المعلمون للطلاب أهداف دراسة الكيمياء في أقسام العلوم الطبيعية ولا يظهرون آفاق دراسة الكيمياء. لم يتم الكشف عن الروابط متعددة التخصصات بين الكيمياء والمواد التي درسها الطلاب في كلياتهم أو تياراتهم. نتيجة لذلك ، تكتسب معرفة الطلاب بالكيمياء شخصية رسمية. يتجلى ذلك في حقيقة أن:
تتشكل المعرفة من خلال حفظ المواد دون فهم تطبيقها.
نيا.
لا توجد علاقة بين المعرفة المكتسبة والأفكار السابقة و
المفاهيم (لوحظ ما يسمى عزل المعرفة).
وهكذا ، فإن الرئيسي مشكلةيكمن البحث في شكليات المعرفة في الكيمياء العامة لدى طلاب تخصصات العلوم الطبيعية غير الكيميائية بالجامعات. لا يساهم البناء التقليدي لدورة الندوات في الكيمياء العامة والأساليب المستخدمة في التدريس في تكوين معرفة واعية ومنهجية للكيمياء العامة لمزيد من الدراسة للكيمياء في الجامعة.
4 يكمن حل هذه المشكلة في تطوير نهج لتعليم الكيمياء ، قائم على أساس
وهو تقوية العلاقات بين الأقسام المختلفة للدورة. هذا ممكن عند استخدام القسم الأساسي من مقرر الكيمياء العامة كعامل أساسي. تحت عامل تشكيل النظامنحن نفهم نظام النظريات والقوانين والمفاهيم التي تربط الأقسام في مقرر واحد.
الديناميكا الحرارية هي أحد الأقسام الأساسية في مقرر الكيمياء العامة في الجامعة. غالبًا ما يبدأ تدريب طلاب تخصصات العلوم الطبيعية غير الكيميائية بهذا القسم. تغيرات الطاقة هي الجوهر الداخلي للعمليات الكيميائية ، مما يسمح بفهم أعمق لنمط مسارها.
ونتيجة لهذا ذو صلةيُقترح تطوير منهجية لإجراء ندوات في الكيمياء العامة بناءً على الديناميكا الحرارية الكيميائية كعامل لتشكيل النظام.
الأهمية ترجع إلى:
الحاجة إلى القضاء على شكليات المعرفة في الكيمياء العامة بين طلاب تخصصات العلوم الطبيعية في الجامعات ؛
متأخر في المدرسة الثانويةشروط بناء مقرر الكيمياء العامة على أساس عامل العمود الفقري ؛
ضعف التطور في منهجية تدريس الكيمياء لمهمة بناء مقرر من الندوات في الكيمياء العامة على أساس عامل تشكيل النظام.
الفكرة الرئيسية للعملهو إعادة التفكير في محتوى مقرر الندوات في الكيمياء العامة وتطوير نهج منهجي جديد لتدريس الكيمياء العامة على أساس الديناميكا الحرارية الكيميائية كعامل لتشكيل النظام.
موضوع الدراسة: عملية تدريس مادة الكيمياء العامة في كليات العلوم الطبيعية بالجامعات.
موضوع الدراسة:هيكل مقرر الندوات في الكيمياء العامة على أساس الديناميكا الحرارية كعامل تشكيل النظام.
استهدافيهدف هذا البحث إلى تطوير بناء محتوى وتنظيم تدريس الكيمياء العامة لطلاب العلوم الطبيعية والتخصصات غير الكيميائية في الجامعات على أساس الديناميكا الحرارية الكيميائية ، كعامل تشكيل النظام.
في هذا العمل ، تم طرحه فرضية،أن تكوين أساس متين من المعرفة في الديناميكا الحرارية الكيميائية ، وبناء نظام من الندوات في الكيمياء العامة على أساس الديناميكا الحرارية الكيميائية كعامل لتشكيل النظام ، وتحديد العلاقة بين قسم الديناميكا الحرارية الكيميائية مع بقية أقسام هذه الدورة ومع تخصصات العلوم الطبيعية الأخرى ، ستسمح للطلاب بإدراك الكيمياء العامة كنظام متكامل موجه إلى:
* الحصول على المعرفة المنهجية والواعية للكيمياء العامة.
تكوين أسس التفكير العلمي.
الغرض والفرضية حددت ما يلي أهداف البحث:
1. إجراء دراسة تأكيديّة:
أ) تحليل الأدبيات التربوية والمنهجية والعلمية حول موضوع
التالي؛
ب) تحليل المناهج والمناهج المستخدمة بشكل مختلف
ملكات؛
ج) تحديد المستوى الأولي للمعرفة لدى الطلاب.
ثانيًا.تطوير مفهوم سليم منهجيًا لبناء دورة من الندوات
الطبقات علىالكيمياء العامة على أساس الديناميكا الحرارية الكيميائية باعتبارها العمود الفقري لهيئة التدريس
التوراة.
ثالثا.تطوير نهج منهجي لإجراء الندوات على مسار
كيمياء الملفوف:
أ) تطوير نظام ندوات في الكيمياء العامة مبني على أساس كيميائي
الديناميكا الحرارية كعامل تشكيل النظام ؛
ب) وضع منهجية لعقد ندوة عن الديناميكا الحرارية الكيميائية.
رابعا. تحقق من فعالية النهج المنهجي المقترح.
الموثوقية والصلاحيةالأحكام والاستنتاجات العلمية المقدمة:
بناء على الاستنتاجات علم النفسوالتعليم العام والخاص.
باستخدام مجموعة متنوعة من طرق البحث المناسبة للمهام.
تم استخدام طرق البحث التالية في العمل: تحليل الأدبيات النفسية والتربوية حول مشكلة البحث ، وطرق التحقق من البحث والتجربة التكوينية ، نهج النظمطرق البحث التربوي باستخدام مهام مصممة خصيصًا لتشخيص المعرفة التي يتم تكوينها والاختبار والتحليل النوعي والكمي لإجابات الطلاب والمعالجة الرياضية لنتائج البحث وتفسيرها المنهجي.
نفذت الدراسة على عدة مراحل (1996 - 2000):
دراسة مؤكدة ، جعلت من الممكن دراسة حالة المشكلة قيد الدراسة نظريًا ، وتحديد الأهداف ، والموضوع ، والمهام ، وفرضية البحث.
المرحلة النظرية لتطوير مفهوم بناء مقرر من الندوات في الكيمياء العامة على أساس الديناميكا الحرارية الكيميائية كعامل أساسي.
مرحلة تجريبية لتنظيم وإجراء تجربة تربوية لاختبار فاعلية ندوة عن الديناميكا الحرارية الكيميائية. تحليل وتفسير نتائج هذه المرحلة من الدراسة.
مرحلة تجريبية لتنظيم وإجراء تجربة تربوية لاختبار فرضية العمل المطروحة.
المرحلة النهائيةحول تحليل وتفسير نتائج التجربة التربوية ، وتعميم نتائج الدراسة بأكملها ، وتشكيل الاستنتاجات العلمية.
الحداثة العلمية:
تم إنشاء نظام جديد لتعليم الطلاب في الندوات في الكيمياء العامة ، والذي يعتمد على الديناميكا الحرارية الكيميائية كعامل تشكيل النظام.
تم إنشاء المجموعة مواد تعليميةبالنسبة الدعم المنهجيالمقرر الدراسي المقترح (خطط الندوات ، اختبار برنامج الكمبيوتر على الديناميكا الحرارية الكيميائية ، مجموعة مهام للتحكم التمهيدي والحدودي والنهائي).
الأهمية النظرية للعملهو خلق الأسس المنهجيةدورة ندوات في الكيمياء العامة مبنية على أساس الديناميكا الحرارية الكيميائية كعامل أساسي. تم إثبات ضرورة بناء دورة على أساس هذا النهج.
الأهمية العملية للعمل:النهج المنهجي المقترح لإنشاء واستخدام نظام الندوات في الكيمياء العامة يجعل من الممكن تطبيقه عند تدريس الكيمياء العامة في الجامعة.
موثوقية النتائجبسبب اختيار مناسب الأساليب الحديثةبحث القيم الإيجابية لمؤشرات فعالية المنهج المطور لتدريس الكيمياء العامة.
الاستحسان وتنفيذ النتائج.
تمت مناقشة نتائج الدراسة في:
المؤتمر والمعرض الدولي الثامن " تكنولوجيا المعلوماتفي التعليم "، موسكو ، 1998 ؛
ندوة علمية ومنهجية لعموم روسيا في جامعة موسكو الحكومية التربوية. لينين ، 1998
المؤتمر العلمي "قراءات لومونوسوف - 99" قسم "مشاكل منهجية اكمال التعليم"، القسم الفرعي" الكيمياء والبيئة "، موسكو ، 1999 ؛
دولي مؤتمر علمي وعملي"تحسين تدريس الكيمياء في المدرسة والجامعة" ، إيركوتسك ، 1999
المؤتمر الدولي "العلم والتعليم على عتبة الألفية الثالثة". مينسك ، 2000
7 قراءات هرزن الثامنة والأربعون (المؤتمر العلمي العملي لعموم روسيا بمشاركة دولية "المشاكل الفعلية للتعليم الكيميائي والتربوي والكيميائي الحديث") ، سانت بطرسبرغ ، 2001 ، اجتماع مختبر الكيمياء IOSO RAO ، 2001
اجتماع إدارة الكيمياء غير العضويةوطرق تدريس الكيمياء في جامعة موسكو الحكومية التربوية. لينين ، 2001
يتم استخدام نتائج الدراسة في ممارسة قسم الكيمياء العامة ، كلية الكيمياء ، جامعة لومونوسوف موسكو الحكومية. إم في لومونوسوف.
هيكل ونطاق الرسالة.يتكون العمل من مقدمة وثلاثة فصول واستنتاجات وقائمة مراجع وتطبيقات. محتواه محدد في 107 صفحة. يتكون النص الكامل للأطروحة من 177 صفحة. يشتمل العمل على 55 شكلًا و 17 جدولًا و 3 مخططات. تحتوي قائمة المراجع على 229 عنوانًا ، منها 23 عنوانًا لغات اجنبية. تحتوي الملاحق على محتوى قسم "الديناميكا الحرارية الكيميائية" في برامج مختلفة في الكيمياء العامة ؛ كشفت الروابط متعددة التخصصات في تحليل برامج الكيمياء العامة ؛ نص كاملاختبار الديناميكا الحرارية الكيميائية ، التي وضعها المؤلف ؛ نتائج تحقيق الطلاب لمهام قسم الضبط في معرفة الطلاب ؛ خيارات مهام الندوات ونتائج تنفيذها ؛ نتائج استكمال تكليفات العمل النهائي.
تم طرح الأحكام التالية للدفاع:
يتطلب استخدام الديناميكا الحرارية الكيميائية كعامل لتشكيل النظام إعادة هيكلة محتوى الندوات وتسلسلها في سياق الكيمياء العامة.
يساهم بناء الندوات على أساس الديناميكا الحرارية الكيميائية كعامل أساسي في تكوين أساسيات التفكير العلمي لدى الطلاب ، وكذلك المعرفة المنهجية والواعية للكيمياء العامة.
تحليل محتوى مقررات الكيمياء العامة التي تدرس في الجامعات والمدارس الثانوية
تركز معظم الكتب المدرسية الجامعية على نظام المفاهيم حول المادة. في هذه الكتب المدرسية ، أقسام "بنية الذرة" ، "الرابطة الكيميائية" ، " قانون دوريدي آي مينديليف.
وتجدر الإشارة إلى أن تسلسل عرض حتى هذه الأقسام الثلاثة للكيمياء العامة يختلف باختلاف المؤلفين. لذلك في الكتب المدرسية ، يكون ترتيب العرض كما يلي: هيكل الذرة هو قانون دوري و النظام الدوريالعناصر - الرابطة الكيميائية. في عدد من الكتيبات الأخرى ، يختلف هذا التسلسل: القانون الدوري والنظام الدوري للعناصر - بنية الذرة - الرابطة الكيميائية.
يوضح تحليل بناء الدورات التي تركز على نظام مفاهيم المادة أن عددًا كبيرًا من الدورات يشترك في البناء في التسلسل التالي: بنية الذرة - الرابطة الكيميائية - وصف الخصائص العناصر الكيميائيةومركباتهم. مثل هذا البناء ، على ما يبدو ، متحد بفكرة عبر عنها بوضوح Ya. A. Ugai: "إن فكرة العلاقة بين التركيب الكيميائي للمادة ... وخصائصها مثل الخيط الأحمر عبر دورة كاملة في الكيمياء غير العضوية. في هذا الصدد ، يتم لفت الانتباه بشكل خاص إلى نظرية التركيب الكيميائي لـ AM Butlerov في تفسيرها الحديث ، والتي تعد أساسًا نظرية كيميائية عامة ... في النهاية ، كانت أهم مهمة للكيمياء ... وما زالت هي تحديد العلاقة بين التركيب الكيميائيالمادة من جهة وخصائصها من جهة أخرى.
وتجدر الإشارة إلى أن O.M Poltorak و Yu. بدون معرفة أساسيات الديناميكا الحرارية والحركية الكيميائية ، من المستحيل استخلاص استنتاجات حول إمكانية وجود عملية كيميائية ، وعمقها وسرعتها. يؤكد GP Luchinsky أيضًا هذه الفكرة: "يتطلب المستوى الحالي لتطور الكيمياء عرضًا تقديميًا لمسار العلوم من وجهة نظر عقيدة بنية المادة والديناميكا الحرارية."
يركز النوع الثاني من الكتب المدرسية على نظام مفاهيم التفاعل الكيميائي ، وهناك عدد أقل بكثير منها من الكتب المدرسية من النوع الأول. في هذه الكتب المدرسية ، يتم إبراز دراسة أنماط التدفق. تفاعلات كيميائية، بمعنى آخر. الجوانب الديناميكية الحرارية والحركية.
في الكتب المدرسية المختلفة ، يختلف تسلسل عرض أساسيات الديناميكا الحرارية الكيميائية وعلم الحركة. في الكتب المدرسية ، وضع المؤلفون الديناميكا الحرارية الكيميائية أولاً وعلم الحركة ثانيًا. تشير الكتيبات والكتب المدرسية الأخرى [11 ، 49 ، 183 ، 184 ، 222 ، 229] إلى الترتيب: الحركية - الديناميكا الحرارية.
بالإضافة إلى ذلك ، كما هو مذكور أعلاه ، فإن موضع هذه الموضوعات في الدورة يختلف أيضًا بشكل كبير. على سبيل المثال ، في الكتيبات ، يتم تقديم الموضوعات المذكورة بعد بنية الذرة والنظام الدوري ومفهوم الترابط الكيميائي. في الكتب المدرسية ، يتم النظر في الديناميكا الحرارية والحركية في وقت لاحق ؛ أنها في الواقع تسبق الوصف الخواص الكيميائيةالعناصر والوصلات.
ترتيب عرض الموضوعات عمليا لا أحد من المؤلفين ، باستثناء نظام التشغيل. زايتسيف ، بي في نيكراسوف ، جي آي نوفيكوف وعدد من الآخرين ، غير مثبتة ، وفي الكتب المدرسية الموجودة هناك مجموعة متنوعة من تسلسل مقدمتهم.
يقترح G.I. Novikov بناء كتاب مدرسي على أساس "تسلسل خطوات المبادئ النظرية للكيمياء: قياس العناصر الكيميائية ، والكيمياء الحرارية ،
كيمياء إرغوكيمياء ( التوازن الكيميائيوأسس الديناميكا الحرارية الكيميائية) ، والكيمياء الزمنية (أسس علم الحركة) ، وبداية دراسة بنية المادة (بنية الذرة ، والجزيئات ، والسوائل ، والبلورات ، والمركبات ذات الروابط غير التكافئة).
يبني بي. مهم بشكل خاص ... عند النظر في الأسئلة النظرية ... يجب أن يضمن البناء نفسه أولاً وقبل كل شيء إمكانية نشره المنطقي.
تحتل مكانة خاصة الدورة التعليميةكيمياء حديثة دورات قصيرة"O. S. Zaitsev. الكتاب مصمم إلى حد كبير لـ دراسة مستقلةالموضوع ، "الغرض من الكتاب هو تطوير التفكير الكيميائي للطلاب بحيث لا يتمكن اختصاصي المستقبل فقط من حل المشكلات الكيميائية المختلفة بشكل مستقل ، ولكن أيضًا نقل الطرق الشائعة عمل علميللعمل في التخصص ". ويشير المؤلف إلى أن دراسة حالة المادة والتفاعلات الكيميائية تُعطى على أساس النظريات الأساسية للحديث العلوم الكيميائيةوعلاقاتهم. الأساس المنطقي للدورة المذكورة هو نظام المعرفة حول أربعة مبادئ أساسية: حول اتجاه العمليات الكيميائية (الديناميكا الحرارية الكيميائية) وسرعتها (حركية) ، نظرية بنية المادة وتواتر التغييرات في خصائص العناصر ومركباتها
اختيار مادة في الديناميكا الحرارية الكيميائية لندوات حول مسار الكيمياء العامة ، مبنية على أساس الديناميكا الحرارية الكيميائية كعامل لتشكيل النظام
اختيار مادة في الديناميكا الحرارية الكيميائية لندوات حول مسار الكيمياء العامة ، مبنية على أساس الديناميكا الحرارية الكيميائية كعامل لتشكيل النظام
كما هو موضح أعلاه (1.1) ، عند بناء مقرر في الكيمياء العامة ، فإن التسلسل الأكثر قبولًا لعرض المادة هو كما يلي: الديناميكا الحرارية الكيميائية (بدون توازن كيميائي) - "الحركية الكيميائية + التوازن الكيميائي - # الحلول ، التوازن في المحاليل - التركيب الذري - الرابطة الكيميائية - القانون الدوري لـ D. I. Mendeleev. تعتبر الديناميكا الحرارية الكيميائية جزءًا أساسيًا من مقرر الكيمياء العامة ، لذا فإن الندوة حول الديناميكا الحرارية الكيميائية هي واحدة من أولى الدورات التدريبية في الكيمياء العامة. يجب اعتبار المعرفة التي تم تكوينها في هذه الندوة أساسية. هم الأساس لمزيد من الدراسة لمسار الكيمياء العامة. لذلك ، فإن مشكلة ملحة هي اختيار محتوى الديناميكا الحرارية الكيميائية ، والتي تعد عاملاً أساسياً للدورة التجريبية للندوات في الكيمياء العامة.
تم اختيار مادة الديناميكا الحرارية الكيميائية لندوات في الكيمياء العامة وفقًا للمبادئ التالية:
امتثال المادة للمستوى العلمي الحديث ؛
إمكانية استخدام الطلاب للمادة في الأنشطة العلمية المستقبلية ؛
العلاقة بين مادة الندوة والمواد المعروضة في الكتب المدرسية والأدلة الموصى بها للطلاب ؛
استخدام المعرفة من التخصصات الأخرى ضمن النطاق المدروس حتى الآن ؛
حد المواد منهاج دراسيووقت دراسة مقرر الكيمياء العامة ؛
وجود صلة بين مادة الندوات وأقسام أخرى من مقرر الكيمياء العامة ؛
وجود روابط متعددة التخصصات مع التخصصات الأخرى.
بناءً على تحليل محتوى قسم الديناميكا الحرارية الكيميائية في البرامج في الكيمياء العامة والأدب (في 1.1 و 1.2) ، يتم تمثيل قسم الديناميكا الحرارية الكيميائية بنظام يتكون من خمسة مكونات مرتبة في التسلسل التالي (انظر المخطط الأول) ).
كما هو مذكور في 1.2 ، فإن قسم "الديناميكا الحرارية الكيميائية" له صلات مع جميع أقسام مقرر الكيمياء العامة تقريبًا ، مثل:
معدل التفاعل الكيميائي. آليات التفاعلات الكيميائية. الحفز.
حلول. التوازن في الحلول ؛
عمليات الأكسدة والاختزال
أساسيات الكيمياء الكهربائية.
رابطة كيميائية
مركبات معقدة
أنظمة مشتتة
القانون الدوري والنظام الدوري للعناصر الكيميائية. كشف تحليل البرامج في الكيمياء العامة وتخصصات العلوم الطبيعية الأخرى أن قسم "الديناميكا الحرارية الكيميائية" له العديد من الروابط متعددة التخصصات (مع علم الأحياء والجيولوجيا والطب والبيئة وغيرها من التخصصات التي درسها طلاب العلوم الطبيعية) (انظر الملحق 2 ، الجدول 12) ). وتجدر الإشارة إلى أنه في برامج الكيمياء العامة ، لم يتم الكشف عن التكامل متعدد التخصصات بشكل كامل.
في تشكيل الجهاز معرفة علميةيتم لعب دور مهم ليس فقط من خلال مادة الموضوع المختارة بشكل معقول ، ولكن أيضًا من خلال تسلسل دراستها ، والذي يتم تحديده بشكل أساسي من خلال المبادئ التعليمية الثلاثة التالية: الاتساق ، وإمكانية الوصول ، والشخصية العلمية.
عقد ندوة عن الديناميكا الحرارية الكيميائية بالطرق المختلفة
لكي يتمكن الطلاب من استخدام المعرفة بالديناميكا الحرارية الكيميائية ، من الضروري وضع معرفة كاملة وعميقة بأساسيات الديناميكا الحرارية الكيميائية في الندوات الأولى. لذلك ، تم التحقيق أولاً في فعالية عقد ندوة حول الديناميكا الحرارية الكيميائية.
في 1996/1997 السنة الأكاديميةأجريت دراسة حول فاعلية عقد ندوة عن الديناميكا الحرارية الكيميائية.
قارنا طرق إجراء ندوة حول الديناميكا الحرارية. اشتملت التجربة على حقيقة أن ثلاث مجموعات من الطلاب (13 شخصًا لكل منهم) عقدت ثلاثة أنواع من الندوات: ندوة تقليدية (يتم إجراء الندوة كما يتم تنفيذها على الدفق) ندوة كمبيوتر (عمل فردي للطلاب باستخدام كمبيوتر برنامج تدريبي) ندوة مشتركة (مزيج العمل الفرديالطلاب من خلال برنامج تعليمي قائم على الكمبيوتر ، ومناقشة أهم القضايا وشرح المفاهيم الصعبة)
تم اختبار المستوى الأولي لمعرفة الطلاب في الحلقة الدراسية الأولى (ذكر البحث). طُلب منهم إكمال المهمة التالية: أعطيت معادلة التفاعل لاحتراق الجرافيت في الأكسجين
1) ما هو رد الفعل. exo أو ماص للحرارة؟
2) احسب كتلة الجرافيت المطلوبة للحصول على 1179.3 كيلو جول من الحرارة. يتم عرض البيانات الكمية حول تنفيذ المهمة المقترحة في الشكل. 3. يتم رسم النسبة المئوية للنجاح في إكمال المهام على طول المحور ص ، أي ٪ من المهام المكتملة بشكل صحيح من الرقم الإجماليالمهام ، على طول الإحداثي السيني - رقم سؤال المهمة ، الذي يتحقق من المستوى الأولي لمعرفة الطلاب. بناءً على البيانات الواردة في الشكل. 4 ، يمكننا القول أن 15 ٪ فقط من الطلاب في جميع المجموعات يمكنهم وصف التفاعل من خلال التأثير الحراري ويمكنهم إجراء حسابات كيميائية حرارية.
يمكن الاستنتاج أن مستوى معرفة الطلاب بالديناميكا الحرارية الكيميائية قبل التدريب هو نفسه تقريبًا. وتجدر الإشارة إلى أنه بحلول الوقت الذي يبدأون فيه في دراسة الكيمياء العامة ، لا يعرف معظم الطلاب كيفية إجراء الحسابات الكيميائية الحرارية الأولية ووصف التفاعلات من حيث تأثيرات الطاقة.
في برامج ومناهج الكيمياء العامة ، تعتبر ندوة "أساسيات الديناميكا الحرارية الكيميائية" من أولى الندوات. إنه يضع المعرفة الديناميكية الحرارية ، والتي يمكن للطلاب بناءً عليها حساب قيم AH ، AS ، AG للعمليات الكيميائية وتقييم الاحتمال الأساسي للعمليات الكيميائية التي تحدث في ظل ظروف معينة.
الهدف الرئيسي من هذه الندوة هو إرساء أساس متين من المعرفة في الديناميكا الحرارية الكيميائية ، حيث إن إجراء دراسة ناجحة لدورة الكيمياء العامة أمر مستحيل دون حل القضايا الأساسية للديناميكا الحرارية الكيميائية:
ما هو التأثير الحراري للعملية؟
هل يمكن أن تستمر العملية بشكل عفوي وبأي شروط؟
ما هو عمق العملية الكيميائية؟
تم اختيار نفس المادة التعليمية للندوات ، بما في ذلك القوانين الأساسية ومفاهيم الديناميكا الحرارية الكيميائية.
عقدت الندوة في النسخة المقبولة عمومًا وفقًا للمنهجية التي يستخدمها معظم أساتذة الجامعات لشرح المفاهيم الأساسية للديناميكا الحرارية. في هذه الطريقة ، تم تخصيص معظم الوقت للشرح من قبل المعلم المواد التعليميةوتعليم الطلاب مهارات الحل مهام نموذجية. في بداية الدرس ، يتم تنفيذ العمل الأمامي ، ولكن يتم تحديث المعرفة المكتسبة من قبل الطلاب في المحاضرة السابقة حول الديناميكا الحرارية الكيميائية. ثم يقوم المعلم بتعريف الطلاب على المفاهيم: أنظمة كيميائية، التأثير الحراري للتفاعل ، العمليات مع إطلاق الحرارة وامتصاصها ، الظروف القياسية والعادية ، المحتوى الحراري للعمليات المختلفة: تكوين المواد ، تكوين الروابط الكيميائية ، انتقال الطور واحتراق المواد. يتم إيلاء اهتمام خاص لحل المشاكل المتعلقة بقانون هيس وعواقبه. علاوة على ذلك ، يتعرف الطلاب على مفهوم الانتروبيا ، القانونين الثاني والثالث للديناميكا الحرارية ، الطاقة الحرة وطاقة جيبس ، معيار الحدوث التلقائي للعمليات الكيميائية. يحل الطلاب مسائل لإيجاد قيمة الانتروبيا وطاقة جيبس الحرة واستخلاص استنتاجات حول الاحتمال الأساسي للعمليات الكيميائية العفوية.
تم استخدام برامج التدريب على الكمبيوتر التي طورها فريق قسم الكيمياء العامة بكلية الكيمياء بجامعة موسكو الحكومية لإجراء ندوة حول أساليب الكمبيوتر. إنها أداة ثابتة عالمية تجمع بين إمكانية استخدام الحوار وبنك البيانات والمعلومات النصية والحسابات والتحكم في الاختبار. البرنامج مادة ورقة بديلة مع التحكم التدريجي في معرفة الطالب. إنها مبنية في وضع الحوار ، والذي يسمح بالتغذية الراجعة الفعالة في التدريب وتصحيح أفكار الطلاب في الوقت المناسب. المعرفة الكيميائية. يعمل الطالب بشكل مستقل مع البرامج ، وبالتالي ، فهو يتحكم في عملية التعلم الخاصة به ويحدد وتيرة إتقان المواد المناسبة له.