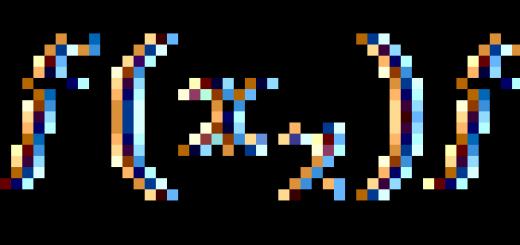1. موقع المعادن في جدول العناصر
توجد المعادن بشكل رئيسي في الجزء الأيسر والسفلي من PSCE. وتشمل هذه:
2. هيكل الذرات المعدنية
تحتوي ذرات المعدن عادةً على 1-3 إلكترونات عند مستوى الطاقة الخارجي. ذراتها لها نصف قطر كبير وتتبرع بسهولة بإلكترونات التكافؤ ، أي تظهر خصائص التصالحية.

3. الخصائص الفيزيائية للمعادن

تغير في التوصيل الكهربائي للمعدن أثناء تسخينه وتبريده
اتصال معدني - هذه هي الرابطة التي تحملها الإلكترونات الحرة بين الكاتيونات في شبكة بلورية معدنية.
4. الحصول على المعادن
1. استرجاع المعادن من الأكاسيد بالفحم أو بأول أكسيد الكربون
أنا x O y + C \ u003d CO 2 + Me أو Me x O y + CO \ u003d CO 2 + Me
2. تحميص كبريتيد متبوعًا بالاختزال
المرحلة الأولى - Me x S y + O 2 \ u003d Me x O y + SO 2
المرحلة 2 -Me x O y + C \ u003d CO 2 + Me أو Me x O y + CO \ u003d CO 2 + Me
3 ألمنيوم (الانتعاش بمعدن أكثر نشاطًا)
أنا x O y + Al \ u003d Al 2 O 3 + Me
4. الحرارة المائية -للحصول على معادن عالية النقاء
أنا x O y + H 2 = H 2 O + Me
5. استرجاع المعادن بالتيار الكهربائي (التحليل الكهربائي)
1) الفلزات القلوية والقلوية الترابية تم الحصول عليها في الصناعة عن طريق التحليل الكهربائي يذوب الملح (كلوريدات):
2كلوريد الصوديوم - تذوب ، كهربائي. حاضر. → 2 Na + Cl 2
CaCl 2 - تذوب ، كهربائي. حاضر.→ كاليفورنيا + Cl2
يذوب هيدروكسيد:
4هيدروكسيد الصوديوم - تذوب ، كهربائي. حاضر.→ 4 Na + O 2 + 2 H 2 O
2) الألومنيوم ينتج صناعيا عن طريق التحليل الكهربائي ذوبان أكسيد الألومنيوم أنا في الكريوليت Na 3 AlF6 (من البوكسيت):
2Al 2 O 3 - تذوب في الكريوليت ، كهربائي. حاضر.→ 4 آل + 3 يا 2
3) التحليل الكهربائي محاليل مائيةأملاح استعمال للحصول على معادن ذات نشاط متوسط وخامل:
2CuSO 4 + 2H 2 O - محلول كهربائي. حاضر.→ 2 نحاس + س 2 + 2 س 2 سو 4
5. العثور على المعادن في الطبيعة
الأكثر شيوعًا في قشرة الأرضالمعدن هو الألمنيوم. تم العثور على المعادن في كل من المركبات والشكل الحر.
1. نشط - في شكل أملاح (كبريتات ، نترات ، كلوريدات ، كربونات)
2. نشاط متوسط - على شكل أكاسيد ، كبريتيدات ( Fe 3 O 4 ، FeS 2)
3. نوبل - في شكل حر ( Au ، Pt ، Ag)الخصائص الكيميائية للمعادن
عام الخواص الكيميائيةيتم عرض المعادن في الجدول:

مهام التعزيز
رقم 1. إنهاء المعادلات عمليردود الفعل تسمي منتجات التفاعل
Li + H 2 O \ u003d
النحاس + H 2 O \ u003d
Al + H 2 O \ u003d
Ba + H 2 O =
ملغ + H 2 O \ u003d
كا + حمض الهيدروكلوريك =
Na + H 2 SO 4 (K) \ u003d
Al + H 2 S \ u003d
Ca + H 3 PO 4 \ u003d
حمض الهيدروكلوريك + الزنك =
H 2 SO 4 (to) + Cu \ u003d
H 2 S + Mg =
حمض الهيدروكلوريك + النحاس =
HNO 3 (K) + C u =
H 2 S + Pt =
H 3 PO 4 + Fe =
HNO 3 (ع) + نا =
رقم 2. قم بإنهاء UHR ، وقم بترتيب المعاملات باستخدام طريقة التوازن الإلكتروني ، وقم بالإشارة إلى العامل المؤكسد (العامل المختزل):
آل + O 2 \ u003d
Li + H 2 O =
Na + HNO 3 (ك) =
Mg + Pb (NO 3) 2 \ u003d
ني + حمض الهيدروكلوريك =
Ag + H 2 SO 4 (k) \ u003dرقم 3. أدخل الأحرف المفقودة بدلاً من النقاط (<, >أو =)
الشحنة الأساسية | لي ... رب | نا… ال | كاليفورنيا… ك |
عدد مستويات الطاقة | لي ... رب | نا… ال | كاليفورنيا… ك |
عدد الإلكترونات الخارجية | لي ... رب | نا… ال | كاليفورنيا… ك |
نصف قطر الذرة | لي ... رب | نا… ال | كاليفورنيا… ك |
الخصائص التصالحية | لي ... رب | نا… ال | كاليفورنيا… ك |
رقم 4. قم بإنهاء UHR ، وقم بترتيب المعاملات باستخدام طريقة التوازن الإلكتروني ، وقم بالإشارة إلى العامل المؤكسد (العامل المختزل):
K + O 2 \ u003d
ملغ + H 2 O \ u003d
Pb + HNO 3 (ع) =
Fe + CuCl 2 \ u003d
Zn + H 2 SO 4 (p) \ u003d
Zn + H 2 SO 4 (k) \ u003d
رقم 5. حل مهام الاختبار
|
1- اختر مجموعة العناصر التي تحتوي على معادن فقط: أ) آل ، أس ، ف ؛ ب) ملغ ، كاليفورنيا ، سي ؛ ب) ك ، كاليفورنيا ، الرصاص 2. حدد مجموعة لا يوجد فيها سوى مواد بسيطة - غير فلزية: أ) K 2 O ، SO 2 ، SiO 2 ؛ ب) H 2 ، Cl 2 ، أنا 2 ؛ ب) كا ، با ، حمض الهيدروكلوريك ؛ 3. وضح ما هو شائع في بنية ذرات K و Li: أ) 2 إلكترون على طبقة الإلكترون الأخيرة ؛ ب) 1 إلكترون على آخر طبقة إلكترون ؛ ج) نفس عدد الطبقات الإلكترونية. 4. خصائص معدن الكالسيوم: أ) عامل مؤكسد ب) عامل الاختزال. ج) عامل مؤكسد أو مختزل حسب الظروف. 5. الخواص المعدنية للصوديوم أضعف من تلك الموجودة في - أ) المغنيسيوم ، ب) البوتاسيوم ، ج) الليثيوم. 6 - تشمل المعادن الخاملة ما يلي: أ) الألومنيوم والنحاس والزنك ؛ ب) الزئبق والفضة والنحاس ؛ ج) الكالسيوم والبريليوم والفضة. 7. ما هي الممتلكات المادية ليسمشترك لجميع المعادن: أ) الموصلية الكهربائية ، ب) الموصلية الحرارية ، ب) صلبة حالة التجميعفي ظل ظروف طبيعية، د) البريق المعدني |
|
الجزء ب. الإجابة على مهام هذا الجزء هي مجموعة من الأحرف التي يجب تدوينها اضبط المباراة. مع الزيادة رقم سريعنصر في المجموعة الفرعية الرئيسية للمجموعة الثانية من النظام الدوري ، تتغير خصائص العناصر والمواد التي تشكلها على النحو التالي: |
1. ما هي سمات بنية ذرات المعدن التي تحدد خصائص اختزالها؟
يتم تحديد خصائص الاختزال للمعادن من خلال القدرة على التبرع بالإلكترونات من الطبقة الخارجية. كلما كان من الأسهل تبرع الذرة بالإلكترونات للطبقة الخارجية ، كان عامل الاختزال أقوى.
2. اسم العنصر الكيميائي الذي يتكون من مادة بسيطة - أكثر المعادن نشاطا. برر اختيارك.
أكثر المعادن نشاطا هو الفرانسيوم.
يتبرع الفرانسيوم بسهولة بإلكترون للطبقة الخارجية. لديها أكبر نصف قطر ذري ، وبالتالي فإن طاقة تفاعل نواة الذرة مع الخارج قذيفة الإلكترونصغير.
3. كيف أن العبارة القائلة بأن المعادن تظهر فقط خصائص مختزلة ، وبالتالي تتأكسد في نفس الوقت ، تتفق مع العملية التي يمكن أن تنعكس باستخدام المعادلة: اسم هذه العملية. ما هي أشكال وجود العنصر الكيميائي يظهر النحاس؟ لأي شكل من أشكال الوجود العناصر الكيميائيةهل البيان أعلاه صحيح؟
تظهر المعادن خصائص مختزلة في حالة الأكسدة الصفرية ، أي يمكن أن يكون المعدن نفسه عاملاً مختزلاً فقط. العملية المذكورة أعلاه هي مثال لأكسدة Cu2 + إلى Cu0. في هذا المثال ، يعمل النحاس كاتيون.
مقدمة
المعادن عبارة عن مواد بسيطة لها خصائص مميزة في ظل الظروف العادية: الموصلية الكهربائية والحرارية العالية ، والقدرة على عكس الضوء جيدًا (مما يتسبب في تألقها وشفافيتها) ، والقدرة على اتخاذ الشكل المطلوب تحت تأثير القوى الخارجية (اللدونة). هناك تعريف آخر للمعادن - وهي عناصر كيميائية تتميز بالقدرة على التبرع بالإلكترونات الخارجية (التكافؤ).
من بين جميع العناصر الكيميائية المعروفة ، يوجد حوالي 90 عنصرًا من المعادن. غالبية المركبات غير العضويةهي مركبات من المعادن.
هناك عدة أنواع من تصنيف المعادن. والأكثر وضوحًا هو تصنيف المعادن وفقًا لموقعها في النظام الدوريالعناصر الكيميائية - التصنيف الكيميائي.
في الإصدار "الطويل" من الجدول الدوري ، إذا تم رسم خط مستقيم من خلال عنصري البورون والأستاتين ، فسيتم وضع المعادن على يسار هذا الخط وعدم وجود المعادن على يمينه.
من وجهة نظر بنية الذرة ، تنقسم المعادن إلى لازمة وانتقالية. توجد المعادن غير الانتقالية في المجموعات الفرعية الرئيسية للنظام الدوري وتتميز بحقيقة أنه يوجد في ذراتها تعبئة متسلسلة للمستويات الإلكترونية s و p. تشمل المعادن الانتقالية 22 عنصرًا من المجموعات الفرعية الرئيسية أ: Li ، Na ، K ، Rb ، Cs ، Fr ، Be ، Mg ، Ca ، Sr ، Ba ، Ra ، Al ، Ga ، In ، Tl ، Ge ، Sn ، Pb ، Sb ، بي ، بو.
توجد المعادن الانتقالية في مجموعات فرعية جانبية وتتميز بملء المستويات d - أو f الإلكترونية. تتضمن عناصر d 37 فلزًا من مجموعات فرعية ثانوية ب: Cu ، Ag ، Au ، Zn ، Cd ، Hg ، Sc ، Y ، La ، Ac ، Ti ، Zr ، Hf ، Rf ، V ، Nb ، Ta ، Db ، Cr ، Mo ، W ، Sg ، Mn ، Tc ، Re ، Bh ، Fe ، Co ، Ni ، Ru ، Rh ، Pd ، Os ، Ir ، Pt ، Hs ، Mt.
يشتمل العنصر f على 14 لانثانيدات (Ce ، Pr ، Nd ، Pm ، Sm ، Eu ، Gd ، Tb ، D y ، Ho ، Er ، Tm ، Ub ، Lu) و 14 أكتينيدات (Th ، Pa ، U ، Np ، Pu ، Am ، Cm ، Bk ، Cf ، Es ، Fm ، Md ، لا ، Lr).
من بين المعادن الانتقالية ، هناك أيضًا معادن أرضية نادرة (Sc ، Y ، La و lanthanides) ، معادن بلاتينية (Ru ، Rh ، Pd ، Os ، Ir ، Pt) ، معادن عبر اليورانيوم (N p وعناصر ذات كتلة ذرية أعلى) .
بالإضافة إلى المواد الكيميائية ، يوجد أيضًا تصنيف تقني للمعادن ، على الرغم من عدم قبوله بشكل عام. إنه ليس منطقيًا مثل العنصر الكيميائي - فهو يعتمد على ميزة أو أخرى مهمة عمليًا للمعدن. يصنف الحديد والسبائك القائمة عليه على أنه معادن حديدية ، وجميع المعادن الأخرى غير حديدية. هناك ضوء (Li ، Be ، Mg ، Ti ، إلخ.) ومعادن ثقيلة (Mn ، F e ، Co ، Ni ، Cu ، Zn ، Cd ، Hg ، Sn ، Pb ، إلخ) ، بالإضافة إلى مجموعات مقاومة للحرارة (Ti ، Zr ، Hf ، V ، Nb ، Ta ، Cr ، Mo ، W ، R e) والمعادن الثمينة (Ag ، Au ، البلاتين) والمعادن المشعة (U ، Th ، N p ، Pu ، إلخ). في الكيمياء الجيولوجية ، يتم أيضًا تمييز المعادن المتناثرة (Ga ، Ge ، Hf ، Re ، إلخ) والنادرة (Zr ، Hf ، Nb ، Ta ، Mo ، W ، Re ، إلخ). كما ترى ، لا توجد حدود واضحة بين المجموعات.
مرجع التاريخ
على الرغم من حقيقة أن حياة المجتمع البشري بدون المعادن مستحيلة ، لا أحد يعرف بالضبط متى وكيف بدأ الشخص في استخدامها لأول مرة. تحكي أقدم الكتابات التي وصلت إلينا عن الورش البدائية التي كان يتم فيها صهر المعدن وتصنيع المنتجات منه. هذا يعني أن الإنسان أتقن المعادن قبل الكتابة. عند التنقيب عن المستوطنات القديمة ، يجد علماء الآثار أدوات العمل والصيد التي استخدمها الناس في تلك الأوقات البعيدة - السكاكين والفؤوس ورؤوس الأسهم والإبر وخطافات الأسماك وغير ذلك الكثير. كيف مستوطنة قديمة، كانت منتجات الأيدي البشرية أقسى وأكثر بدائية. تم العثور على أقدم المنتجات المعدنية خلال عمليات التنقيب في المستوطنات التي كانت موجودة منذ حوالي 8 آلاف عام. كانت هذه المجوهرات مصنوعة بشكل أساسي من الذهب والفضة ورؤوس سهام ورماح مصنوعة من النحاس.
الكلمة اليونانية "ميتالون" تعني في الأصل مناجم ، مناجم ، ومن هنا جاء مصطلح "معدن". في العصور القديمة ، كان يعتقد أن هناك 7 معادن فقط: الذهب والفضة والنحاس والقصدير والرصاص والحديد والزئبق. ارتبط هذا الرقم بعدد الكواكب المعروفة آنذاك - الشمس (الذهب) ، القمر (الفضة) ، الزهرة (النحاس) ، المشتري (القصدير) ، زحل (الرصاص) ، المريخ (الحديد) ، الزئبق (الزئبق) (انظر الشكل ). وفقًا للأفكار الكيميائية ، وُلدت المعادن في أحشاء الأرض تحت تأثير أشعة الكواكب وتحسنت تدريجياً ، وتحولت إلى ذهب.
أتقن الإنسان أولاً المعادن الأصلية - الذهب والفضة والزئبق. كان أول معدن تم الحصول عليه صناعياً هو النحاس ، ثم كان من الممكن إتقان إنتاج سبيكة من النحاس بواسطة العندليب - البرونز ، وبعد ذلك فقط - الحديد. في عام 1556 ، نُشر كتاب لعالم المعادن الألماني جي.أجريكولا "عن التعدين والفلزات" في ألمانيا - وهو أول دليل تفصيلي للحصول على المعادن الذي وصل إلينا. صحيح أنه في ذلك الوقت كان الرصاص والقصدير والبزموت لا يزالان يعتبران أصنافًا من نفس المعدن. في عام 1789 ، قدم الكيميائي الفرنسي لافوازييه ، في دليله للكيمياء ، قائمة بالمواد البسيطة ، والتي تضمنت جميع المعادن المعروفة آنذاك - الأنتيمون ، الفضة ، البزموت ، الكوبالت ، القصدير ، الحديد ، المنغنيز ، النيكل ، الذهب ، جيش التحرير الشعبى الصينى - الطين والرصاص والتنغستن والزنك. مع تطور طرق البحث الكيميائي ، بدأ عدد المعادن المعروفة في الزيادة بسرعة. في القرن ال 18 تم اكتشاف 14 معادن في القرن التاسع عشر. - 38 في القرن العشرين. - 25 معادن. في النصف الأول من القرن التاسع عشر تم اكتشاف أقمار صناعية من البلاتين ، وتم الحصول على المعادن الأرضية القلوية والقلوية عن طريق التحليل الكهربائي. في منتصف القرن ، تم اكتشاف السيزيوم والروبيديوم والثاليوم والإنديوم عن طريق التحليل الطيفي. تم التأكيد ببراعة على وجود المعادن التي تنبأ بها D. اكتشاف النشاط الإشعاعي في نهاية القرن التاسع عشر. أدى إلى البحث عن المعادن المشعة. أخيرًا بطريقة التحولات النووية في منتصف القرن العشرين. تم الحصول على المعادن المشعة التي لا توجد في الطبيعة ، ولا سيما عناصر عبر اليورانيوم.
الخصائص الفيزيائية والكيميائية للمعادن.
جميع المعادن صلبة (باستثناء الزئبق السائل في الظروف العادية) ، فهي تختلف عن غير المعادن نوع خاصالسندات (السندات المعدنية). ترتبط إلكترونات التكافؤ بشكل فضفاض بذرة معينة ، وداخل كل معدن يوجد ما يسمى بغاز الإلكترون. معظم المعادن لها بنية بلورية ، ويمكن اعتبار المعدن على أنه شبكة بلورية "صلبة" من الأيونات الموجبة (الكاتيونات). يمكن لهذه الإلكترونات أن تتحرك بشكل أو بآخر حول المعدن. إنها تعوض قوى التنافر بين الكاتيونات وبالتالي تربطها بجسم مضغوط.
تتمتع جميع المعادن بموصلية كهربائية عالية (أي أنها موصلات ، على عكس المواد العازلة غير المعدنية) ، وخاصة النحاس والفضة والذهب والزئبق والألمنيوم ؛ الموصلية الحرارية للمعادن عالية أيضًا. الخاصية المميزة للعديد من المعادن هي ليونة (ليونة) ، ونتيجة لذلك يمكن دحرجتها إلى صفائح رقيقة (رقائق) وسحبها في سلك (القصدير ، والألمنيوم ، وما إلى ذلك) ، ومع ذلك ، هناك أيضًا معادن هشة تمامًا ( الزنك والأنتيمون والبزموت).
في الصناعة ، لا يتم استخدام المعادن النقية في كثير من الأحيان ، ولكن خليطها يسمى السبائك. في السبيكة ، عادةً ما تكمل خصائص أحد المكونات خصائص عنصر آخر بنجاح. لذلك ، يتمتع النحاس بصلابة منخفضة وقليل الاستخدام في تصنيع أجزاء الماكينة ، في حين أن سبائك النحاس والزنك ، التي تسمى النحاس الأصفر ، صلبة بالفعل وتستخدم على نطاق واسع في الهندسة الميكانيكية. يتميز الألمنيوم بليونة جيدة وخفة كافية (كثافة منخفضة) ، لكنه ناعم جدًا. على أساسها ، يتم تحضير سبيكة من الأيورالومين (دورالومين) تحتوي على النحاس والمغنيسيوم والمنغنيز. يكتسب دورالومين ، دون أن يفقد خصائصه من الألمنيوم ، صلابة عالية وبالتالي يستخدم في تكنولوجيا الطيران. سبائك الحديد مع الكربون (وإضافات معادن أخرى) معروفة جيداً بالحديد الزهر والصلب.
تختلف المعادن اختلافًا كبيرًا في الكثافة: بالنسبة للليثيوم فهو يقارب نصف كثافة الماء (0.53 جم / سم 3) ، وبالنسبة للأوزميوم فهو أعلى بأكثر من 20 مرة (22.61 جم / سم 3). تختلف المعادن أيضًا في الصلابة. أنعم - المعادن القلوية ، يتم قطعها بسهولة بسكين ؛ أقسى معدن - كروم - يقطع الزجاج. الفرق في نقاط انصهار المعادن كبير: الزئبق سائل في ظل الظروف العادية ، ويذوب السيزيوم والغاليوم عند درجة حرارة جسم الإنسان ، وأكثر المعادن مقاومة للصهر ، التنجستن ، لها نقطة انصهار تبلغ 3380 درجة مئوية. تصنف المعادن التي تكون نقطة انصهارها أعلى من 1000 درجة مئوية على أنها معادن مقاومة للصهر ، منخفضة - على أنها قابلة للانصهار. في درجات الحرارة المرتفعة ، تكون المعادن قادرة على إصدار إلكترونات ، والتي تستخدم في الإلكترونيات والمولدات الكهروحرارية للتحويل المباشر للطاقة الحرارية إلى طاقة كهربائية. الحديد والكوبالت والنيكل والجادولينيوم ، بعد وضعها في مجال مغناطيسي ، قادرة على الحفاظ بشكل دائم على حالة من المغنطة.
تحتوي المعادن أيضًا على بعض الخصائص الكيميائية. تتخلى ذرات المعادن عن إلكترونات التكافؤ بسهولة نسبية وتنتقل إلى أيونات موجبة الشحنة. لذلك ، المعادن عوامل الاختزال. هذه ، في الواقع ، هي الخاصية الكيميائية الرئيسية والأكثر شيوعًا.
من الواضح أن المعادن كعوامل اختزال تتفاعل مع عوامل مؤكسدة مختلفة ، من بينها قد يكون هناك مواد بسيطة وأحماض وأملاح معادن أقل نشاطًا وبعض المركبات الأخرى. مركبات المعادن مع الهالوجينات تسمى هاليدات ، مع الكبريت - الكبريتيد ، مع النيتروجين - النيتريد ، مع الفوسفور - الفوسفات ، مع الكربون - الكربيدات ، مع السيليكون - مبيدات السليكون ، مع البورون - البوريدات ، مع الهيدروجين - الهيدريد ، إلخ. العديد من هذه المركبات وجدت تطبيقات مهمة في التكنولوجيا الجديدة. على سبيل المثال ، تُستخدم بوريدات المعادن في الإلكترونيات الراديوية ، وكذلك في التكنولوجيا النووية كمواد لتنظيم الإشعاع النيوتروني والحماية منه.
تحت تأثير الأحماض المؤكسدة المركزة ، يتشكل أيضًا فيلم أكسيد ثابت على بعض المعادن. هذه الظاهرة تسمى التخميل. لذلك ، في حامض الكبريتيك المركز ، يتم تخميل المعادن مثل Be و Bi و Co و F e و Mg و Nb (ولا تتفاعل معها) ، وفي حمض النيتريك المركز - المعادن Al ، Be ، Bi ، Co ، Cr و F e و Nb و Ni و Pb و Th و U.
كلما كان المعدن على اليسار في هذا الصف ، زادت خصائص الاختزال التي يتمتع بها ، أي أنه يتأكسد بسهولة ويذهب إلى المحلول في شكل كاتيون ، ولكن من الصعب استعادته من الكاتيون إلى الدولة الحرة.
يتم وضع الهيدروجين غير المعدني في سلسلة من الفولتية ، لأن هذا يسمح لك بتحديد ما إذا كان هذا المعدن سيتفاعل مع الأحماض - عوامل غير مؤكسدة في محلول مائي (بتعبير أدق ، سيتأكسد بواسطة كاتيونات الهيدروجين H + ). على سبيل المثال ، يتفاعل الزنك مع حمض الهيدروكلوريك ، لأنه في سلسلة الفولتية يكون على اليسار (قبل) الهيدروجين. على العكس من ذلك ، لا يتم نقل الفضة إلى محلول بواسطة حمض الهيدروكلوريك ، لأنها في سلسلة الفولتية على اليمين (بعد) الهيدروجين. تتصرف المعادن بالمثل في حمض الكبريتيك المخفف. تسمى المعادن الموجودة في سلسلة الفولتية بعد الهيدروجين نوبل (Ag ، Pt ، Au ، إلخ.)
دورية النظامد. مندليفتنقسم إلى ... الفترة (باستثناء الأولى) تبدأ القلوية فلزوينتهي بغاز نبيل. العناصر 2 ...
دورية النظامعناصر مندليف
الملخص >> الكيمياءثانيًا. دوريالقانون و دورية النظامالعناصر الكيميائية الافتتاحية D.I. مندليف دوريهيكل القانون دوري أنظمةأ) ... - غير معدني ، وبزموت - فلز). في دوري النظامعادي المعادنتقع في المجموعة IA (Li ...
دوريقانون D.I. مندليف (2)
السيرة الذاتية >> علم الأحياءروابط. قرر ذلك المعادنتتوافق مع الأكاسيد والقواعد الأساسية ، ... والهيدروكسيدات في بعضها المعادنجلب الارتباك. كان التصنيف ... ذرات العناصر الكيميائية في دوري النظامدي. مندليفتغيير رتابة ، لذلك ...
دورية النظاموأهميته في تطوير الكيمياء D.I. مندليف
الملخص >> الكيمياءتشير الفترات إلى عناصر s (الأرض القلوية والقلوية المعادن) ، وتشكل مجموعات فرعية Ia و IIa (أبرزت ... الأساس العلمي لتدريس الكيمياء. الخلاصة دورية النظامد. مندليفأصبحت علامة فارقة في تطوير ...
ب حولتشكل معظم العناصر الكيميائية المعروفة مواد بسيطة ، معادن.
تشمل المعادن جميع عناصر المجموعات الفرعية الثانوية (B) ، بالإضافة إلى عناصر المجموعات الفرعية الرئيسية الواقعة أسفل "البريليوم - الأستاتين" المائل (الشكل 1). بالإضافة إلى ذلك ، تشكل معادن العناصر الكيميائية مجموعات من اللانثانيدات والأكتينيدات.
أرز. 1. موقع المعادن بين عناصر المجموعات الفرعية A (مظلل باللون الأزرق)
بالمقارنة مع الذرات غير المعدنية ، تحتوي ذرات المعدن على ب حولأحجام أكبر وعدد أقل من الإلكترونات الخارجية ، عادة 1-2. وبالتالي ، فإن الإلكترونات الخارجية لذرات المعدن مرتبطة بشكل ضعيف بالنواة ؛ المعادن تتخلص منها بسهولة ، مما يظهر خصائص مختزلة في التفاعلات الكيميائية.
ضع في اعتبارك أنماط التغيير في بعض خصائص المعادن في مجموعات وفترات.
في فتراتمنمع زيادة الشحنة النووية ، يتناقص نصف القطر الذري. تجذب نوى الذرات الإلكترونات الخارجية أكثر فأكثر ، وبالتالي تزداد القدرة الكهربية للذرات ، وتنخفض الخصائص المعدنية. أرز. 2.

أرز. 2. التغيير في الخصائص المعدنية في فترات
في المجموعات الفرعية الرئيسيةمن أعلى إلى أسفل في ذرات المعدن ، يزداد عدد طبقات الإلكترون ، وبالتالي يزداد نصف قطر الذرات. ثم تنجذب الإلكترونات الخارجية إلى النواة أضعف ، لذلك هناك انخفاض في الكهربية للذرات وزيادة في الخواص المعدنية. أرز. 3.
أرز. 3. التغيير في الخصائص المعدنية في المجموعات الفرعية
هذه الانتظامات هي أيضًا سمة لعناصر المجموعات الفرعية الثانوية ، مع استثناءات نادرة.
تميل ذرات العناصر المعدنية إلى التبرع بالإلكترونات. في التفاعلات الكيميائية ، تعمل المعادن فقط كعوامل اختزال ، وتتبرع بالإلكترونات وتزيد من حالة الأكسدة.
يمكن للذرات التي تتكون منها المواد البسيطة ، غير المعدنية ، وكذلك الذرات التي يتكون منها التركيب ، أن تقبل الإلكترونات من ذرات المعادن. مواد معقدة، والتي تكون قادرة على خفض حالة الأكسدة. علي سبيل المثال:
2Na 0 + S 0 = Na +1 2 S -2
Zn 0 + 2H +1 Cl \ u003d Zn +2 Cl 2 + H 0 2
ليست كل المعادن لها نفس النشاط الكيميائي. بعض المعادن في ظل الظروف العادية عمليا لا تدخل فيها تفاعلات كيميائيةيطلق عليهم المعادن النبيلة. المعادن النبيلة تشمل: الذهب ، الفضة ، البلاتين ، الأوزميوم ، الإيريديوم ، البلاديوم ، الروثينيوم ، الروديوم.
المعادن النبيلة نادرة جدًا في الطبيعة وتوجد دائمًا تقريبًا الدولة الأم(الشكل 4). على الرغم من مقاومتها العالية للأكسدة للتآكل ، لا تزال هذه المعادن تشكل أكاسيد وغيرها مركبات كيميائية، على سبيل المثال ، كلوريد الفضة وأملاح النترات معروفة للجميع.

أرز. 4. كتلة من الذهب
تلخيص الدرس
في هذا الدرس ، قمت بفحص موضع العناصر الكيميائية للمعادن في الجدول الدوري ، وكذلك السمات الهيكلية لذرات هذه العناصر ، والتي تحدد خصائص المواد البسيطة والمعقدة. لقد تعلمت سبب وجود عناصر كيميائية للمعادن أكثر بكثير من العناصر غير المعدنية.
فهرس
- Orzhekovsky P.A. الكيمياء: الصف التاسع: كتاب مدرسي للتعليم العام. inst. / ب. Orzhekovsky ، L.M. ميشرياكوفا ، م. شالاشوفا. - م: Astrel ، 2013. (§28)
- Rudzitis G.E. الكيمياء: inorgan. كيمياء. عضو. الكيمياء: كتاب مدرسي. لـ 9 خلايا. / ج. رودزيتيس ، إف جي. فيلدمان. - م: التنوير ، JSC "كتب موسكو المدرسية" ، 2009. (§34)
- خومشينكو آي. مجموعة من المهام والتمارين في الكيمياء ل المدرسة الثانوية. - م: ريا "الموجة الجديدة": الناشر أومرينكوف ، 2008. (ص 86-87)
- موسوعة للأطفال. المجلد 17. الكيمياء / الفصل. إد. V.A. فولودين ، الرائد. علمي إد. أنا لينسون. - م: أفانتا + ، 2003.
- مجموعة واحدة من الموارد التعليمية الرقمية (تجارب فيديو حول الموضوع) ().
- النسخة الإلكترونية من مجلة "الكيمياء والحياة" ().
واجب منزلي
- من. 195-196 رقم 7 ، A1-A4 من الكتاب المدرسي بقلم P. Orzhekovsky "الكيمياء: الصف التاسع" / P.A. Orzhekovsky ، L.M. ميشرياكوفا ، م. شالاشوفا. - م: Astrel ، 2013.
- ما هي الخصائص (المؤكسدة أو المختزلة) التي يمكن أن يمتلكها Fe 3+ أيون؟ وضح إجابتك مع معادلات التفاعل.
- قارن نصف القطر الذري ، الكهربية وخصائص تقليل الصوديوم والمغنيسيوم.
موقع المعادن في النظام الدوري
إذا رسمنا قطريًا من البورون إلى الأستاتين في جدول Mendeleev ، فستكون هناك ذرات معدنية في المجموعات الفرعية الرئيسية تحت القطر ، وفي المجموعات الفرعية الثانوية تكون جميع العناصر عبارة عن معادن. العناصر الواقعة بالقرب من القطر لها خصائص مزدوجة: في بعض مركباتها تتصرف مثل المعادن ؛ في بعض - مثل اللافلزات.
هيكل ذرات المعدن
في الفترات والمجموعات الفرعية الرئيسية ، هناك انتظام في التغيير في الخصائص المعدنية.
تحتوي ذرات العديد من المعادن على إلكترونات تكافؤ 1 أو 2 أو 3 ، على سبيل المثال:
Na (+11): 1S2 2S22p6 3S1
كاليفورنيا (+20): 1S2 2S22p6 3S23p63d0 4S2
الفلزات القلوية (المجموعة 1 ، المجموعة الفرعية الرئيسية): ... nS1.
الأرض القلوية (المجموعة 2 ، المجموعة الفرعية الرئيسية): ... nS2.
تعتمد خصائص ذرات المعدن بشكل دوري على موقعها في جدول D. I. Mendeleev.
https://pandia.ru/text/78/392/images/image002_81.jpg "العرض =" 298 "الارتفاع =" 113 ">
أ - النحاس ب) المغنيسيوم. ج) تعديل ألفا من الحديد
تميل ذرات المعادن إلى التبرع بإلكتروناتها الخارجية. في قطعة معدنية أو سبيكة أو منتج معدني ، تتبرع ذرات المعدن بإلكترونات خارجية وترسلها إلى هذه القطعة أو السبيكة أو المنتج ، وتتحول إلى أيونات. تنتقل الإلكترونات "الممزقة" من أيون إلى آخر ، وتعيد الاتصال بها مؤقتًا إلى ذرات ، وتنقطع مرة أخرى ، وتحدث هذه العملية باستمرار. تحتوي المعادن على شبكة بلورية ، في العقد التي توجد بها ذرات أو أيونات (+) ؛ بينهما إلكترونات حرة (غاز الإلكترون). يمكن عرض مخطط التوصيل في المعدن على النحو التالي:
М0 ↔ لا + Мn + ،
ذرة - أيون
أين نهو عدد الإلكترونات الخارجية المشاركة في الرابطة (y نا - 1، ذ سا - 2 ē، ذ سورة - 3).
لوحظ هذا النوع من السندات في المعادن - مواد بسيطة - معادن وفي السبائك.
الرابطة المعدنية هي رابطة بين أيونات المعادن موجبة الشحنة والإلكترونات الحرة في شعرية الكريستالالمعادن.
للرابطة المعدنية بعض أوجه التشابه مع الرابطة التساهمية ، ولكن هناك أيضًا بعض الاختلاف ، نظرًا لأن الرابطة المعدنية تقوم على التنشئة الاجتماعية للإلكترونات (التشابه) ، تشارك جميع الذرات في التنشئة الاجتماعية لهذه الإلكترونات (الاختلاف). هذا هو السبب في أن البلورات ذات الرابطة المعدنية تكون بلاستيكية ، وموصلية للكهرباء ولها لمعان معدني. ومع ذلك ، في حالة البخار ، ترتبط ذرات المعدن ببعضها البعض الرابطة التساهمية، تتكون أزواج المعادن من جزيئات فردية (أحادية الذرة وثنائية الذرة).
الخصائص العامة للمعادن
قدرة الذرات على التبرع بالإلكترونات (تتأكسد) |
← زيادة |
||
التفاعل مع الأكسجين الجوي | يتأكسد بسرعة في درجات الحرارة العادية | يتأكسد ببطء عند درجة الحرارة العادية أو عند تسخينه | لا تتأكسد |
التفاعل مع الماء | عند درجة الحرارة العادية ، يتم إطلاق H2 وتكوين الهيدروكسيد | عند تسخينها ، يتم تحرير H2 | لا يتم إزاحة H2 من الماء |
التفاعل مع الأحماض | أزح H2 من الأحماض المخففة | لا تحل محل H2 من الأحماض المخففة |
|
تفاعل مع conc. ورازب. HNO3 و conc. H2SO4 عند تسخينه | لا تتفاعل مع الأحماض |
||
التواجد في الطبيعة | فقط في الاتصالات | في شكل مركبات وفي شكل حر | في الغالب مجاني |
كيف تحصل على | التحليل الكهربائي الذائب | الاختزال بالفحم أو أول أكسيد الكربون (2) أو الألمنيوم أو التحليل الكهربائي لمحاليل الملح المائي | |
قدرة الأيونات على اكتساب الإلكترونات (استرداد) | Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au |
||
زيادة → |
|||
سلسلة الكهروكيميائية لجهود المعادن. الخصائص الفيزيائية والكيميائية للمعادن
عام الخصائص الفيزيائيةالمعادن
يتم تحديد الخصائص الفيزيائية العامة للمعادن من خلال الرابطة المعدنية والشبكة البلورية المعدنية.
المرونة ، اللدونة
يتسبب العمل الميكانيكي على بلورة معدنية في إزاحة طبقات الذرات. نظرًا لأن الإلكترونات الموجودة في المعدن تتحرك في جميع أنحاء البلورة ، فلا يوجد كسر في الروابط. تقل اللدونة في السلسلة Au ، Ag ، Cu ، Sn ، Pb ، Zn ، Fe. الذهب ، على سبيل المثال ، يمكن دحرجته إلى صفائح لا يزيد سمكها عن 0.001 مم ، والتي تُستخدم لتذهيب أشياء مختلفة. رقائق الألمنيومظهر الشاي مؤخرًا نسبيًا وقبل ذلك ، كانت الشوكولاتة مزورة في ورق قصدير ، والذي كان يسمى ستانول. ومع ذلك ، لا يتمتع Mn و Bi بمرونة: فهما معادن هشة.
بريق معدني
البريق المعدني ، الذي تفقده جميع المعادن في شكل مسحوق ، ما عدا الو ملغ. ألمع المعادن زئبق(صُنعت "المرايا الفينيسية" الشهيرة منها في العصور الوسطى) ، اي جي(تصنع منه المرايا الحديثة باستخدام تفاعل "المرآة الفضية"). تتميز المعادن الحديدية وغير الحديدية (بشروط) باللون. من بين الأخير ، نفرد الأشياء الثمينة - Au ، Ag ، Pt. الذهب هو معدن الجواهريين. على أساس ذلك تم صنع بيض فابرجيه الرائع لعيد الفصح.
رنين
حلقة المعادن ، وتستخدم هذه الخاصية في صنع أجراس (تذكر جرس القيصر في الكرملين بموسكو). أكثر المعادن رنانًا هي Au و Ag و Cu. حلقات نحاسية ذات رنين سميك ورنين قرمزي. هذا التعبير المجازي ليس تكريما لتوت العليق ، ولكن تكريما لمدينة مالينا الهولندية ، حيث أجراس الكنيسة. في روسيا ، بدأ السادة الروس في رمي الأجراس حتى أفضل جودةوتبرع سكان المدن والبلدات بالمجوهرات الذهبية والفضية حتى يبدو صوت جرس المعابد أفضل. في بعض مكاتب الرهونات الروسية ، تم تحديد أصالة الخواتم الذهبية المقبولة للحصول على عمولة من خلال رنين خاتم زواج ذهبي معلق من شعر المرأة (يُسمع صوت عالٍ طويل وواضح جدًا).
في ظل الظروف العادية ، تكون جميع المعادن ، باستثناء الزئبق ، هي المواد الصلبة. أقسى المعادن هو الكروم Cr: فهو يخدش الزجاج. أنعم المعادن القلوية ، يتم تقطيعها بسكين. يتم تخزين المعادن القلوية بعناية فائقة - Na - في الكيروسين ، و Li - في الفازلين بسبب خفتها ، والكيروسين - في وعاء زجاجي ، ووعاء - في رقائق الأسبستوس ، والأسبستوس - في وعاء من الصفيح.
التوصيل الكهربائي
يتم تفسير الموصلية الكهربائية الجيدة للمعادن من خلال وجود إلكترونات حرة فيها ، والتي ، تحت تأثير فرق جهد صغير ، تكتسب حركة موجهة من القطب السالب إلى القطب الموجب. مع ارتفاع درجة الحرارة ، تزداد اهتزازات الذرات (الأيونات) ، مما يجعل من الصعب على الحركة الموجهة للإلكترونات وبالتالي يؤدي إلى انخفاض في التوصيل الكهربائي. في درجات الحرارة المنخفضة ، تقل الحركة التذبذبية بشكل كبير وتزداد الموصلية الكهربائية بشكل حاد. بالقرب من الصفر المطلق ، تظهر المعادن موصلية فائقة. Ag ، Cu ، Au ، Al ، Fe لديها أعلى موصلية كهربائية ؛ أسوأ الموصلات هي الزئبق ، الرصاص ، دبليو.
توصيل حراري
في ظل الظروف العادية ، تتغير الموصلية الحرارية للمعادن بشكل أساسي في نفس تسلسل توصيلها الكهربائي. ترجع الموصلية الحرارية إلى الحركة العالية للإلكترونات الحرة و حركة متذبذبةالذرات ، بسبب وجود توازن سريع لدرجة الحرارة في كتلة المعدن. أعلى موصلية حرارية للفضة والنحاس ، وأقلها للبزموت والزئبق.
كثافة
كثافة المعادن مختلفة. إنه أقل هو الأقل الكتلة الذريةعنصر فلز وكلما زاد نصف قطر ذرته. أخف معدن هو الليثيوم (كثافة 0.53 جم / سم 3) ، والأثقل هو الأوزميوم (كثافة 22.6 جم / سم 3). تسمى المعادن ذات الكثافة الأقل من 5 جم / سم 3 خفيفة ، ويطلق على الباقي ثقيل.
تتنوع نقاط انصهار وغليان المعادن. أكثر المعادن قابلية للانصهار هو الزئبق (الغليان = -38.9 درجة مئوية) ، والذوبان السيزيوم والغاليوم عند 29 و 29.8 درجة مئوية ، على التوالي. التنغستن هو أكثر المعادن مقاومة للحرارة (الغليان = 3390 درجة مئوية).
مفهوم تآصل المعادن على مثال القصدير
بعض المعادن لها تعديلات متآصلة.
على سبيل المثال ، يتميز القصدير بـ:
α-tin ، أو القصدير الرمادي ("طاعون القصدير" - تحول القصدير العادي إلى α-tin أثناء درجات الحرارة المنخفضةتسببت في وفاة بعثة R. Scott's ل القطب الجنوبي، التي فقدت كل الوقود ، منذ أن تم تخزينها في خزانات مختومة بالقصدير) ، مستقرة عند t<14°С, серый порошок.
β-tin ، أو القصدير الأبيض (t = 14 - 161 ° C) معدن ناعم جدًا ، ولكنه أكثر صلابة من الرصاص ، ويمكن صبه ولحامه. يتم استخدامه في السبائك ، على سبيل المثال ، لتصنيع الصفيح (الحديد المعلب).
سلسلة الكهروكيميائية لجهود المعادن وقواعدها
يمكن تمثيل ترتيب الذرات على التوالي وفقًا لتفاعلها على النحو التالي:
Li ، K ، Ca ، Na ، Mg ، Al ، Mn ، Zn ، Fe ، Ni ، Sn ، Pb ،H2 ، Сu ، Hg ، Ag ، Pt ، Au.
يوضح موضع عنصر في السلسلة الكهروكيميائية مدى سهولة تكوينه للأيونات في محلول مائي ، أي تفاعله. تعتمد تفاعلية العناصر على القدرة على قبول أو التبرع بالإلكترونات المشاركة في تكوين الرابطة.
حكم سلسلة الجهد الأول
إذا كان المعدن في هذا الصف قبل الهيدروجين ، فإنه قادر على إزاحته من المحاليل الحمضية ، إذا كان بعد الهيدروجين ، فلا.
علي سبيل المثال، Zn، Mg، Alأعطي تفاعل استبدال مع الأحماض (هم في سلسلة من الفولتية تصل إلى ح)، لكن النحاسلا (هي بعد ح).
حكم سلسلة الإجهاد الثانية
إذا كان المعدن في سلسلة من الفولتية حتى معدن الملح ، فإنه قادر على إزاحة هذا المعدن من محلول الملح.
على سبيل المثال ، CuSO4 + Fe = FeSO4 + Cu.
في مثل هذه الحالات ، يكون موضع المعدن قبل أو بعد هيدروجينقد لا يكون مهمًا ، فمن المهم أن يسبق المعدن المتفاعل المعدن المكون للملح:
Cu + 2AgNO3 = 2Ag + Cu (NO3) 2.
الخصائص الكيميائية العامة للمعادن
في التفاعلات الكيميائية ، المعادن عوامل اختزال (التبرع بالإلكترونات).
التفاعل مواد بسيطة .
1. تشكل المعادن الأملاح مع الهالوجينات - هاليدات:
Mg + Cl2 = MgCl2 ؛
Zn + Br2 = ZnBr2.
2. تشكل المعادن أكاسيد مع الأكسجين:
4Na + O2 = 2 Na2O ؛
2Cu + O2 = 2CuO.
3 - المعادن من أملاح الكبريت - الكبريتيد:
4. مع الهيدروجين ، تشكل المعادن الأكثر نشاطًا الهيدريدات ، على سبيل المثال:
Ca + H2 = CaH2.
5. مع الكربون ، تتكون العديد من المعادن من الكربيدات:
Ca + 2C = CaC2.
التفاعل مع المواد المعقدة
1. المعادن في بداية سلسلة من الفولتية (من الليثيوم إلى الصوديوم) ، في ظل الظروف العادية ، تحل محل الهيدروجين من الماء وتشكل القلويات ، على سبيل المثال:
2Na + 2H2O = 2NaOH + H2.
2. المعادن الموجودة في سلسلة من الفولتية حتى الهيدروجين تتفاعل مع الأحماض المخففة (HCl ، H2SO4 ، إلخ) ، ونتيجة لذلك تتشكل الأملاح ويتحرر الهيدروجين ، على سبيل المثال:
2Al + 6НCl = 2AlCl3 + 3H2.
3 - تتفاعل المعادن مع محاليل أملاح المعادن الأقل نشاطًا ، ونتيجة لذلك يتشكل ملح من معدن أكثر نشاطًا ، ويتم إطلاق معدن أقل نشاطًا بشكل حر ، على سبيل المثال:
CuSO4 + Fe = FeSO4 + النحاس.
المعادن في الطبيعة.
البحث عن المعادن في الطبيعة.
تحدث معظم المعادن في الطبيعة في شكل مركبات مختلفة: توجد المعادن النشطة فقط في شكل مركبات ؛ معادن منخفضة النشاط - في شكل مركبات وفي شكل حر ؛ المعادن النبيلة (Ag ، Pt ، Au ...) في شكل حر.
عادة ما توجد المعادن الأصلية بكميات صغيرة على شكل حبيبات أو شوائب في الصخور. من حين لآخر توجد قطع كبيرة جدًا من المعادن - شذرات. توجد العديد من المعادن في الطبيعة في حالة ملزمة في شكل مركبات كيميائية طبيعية - المعادن. غالبًا ما تكون هذه أكاسيد ، على سبيل المثال ، معادن الحديد: خام الحديد الأحمر Fe2O3 ، خام الحديد البني 2Fe2O3 ∙ 3H2O ، خام الحديد المغناطيسي Fe3O4.
المعادن جزء من الصخور والخامات. خاماتتسمى التكوينات الطبيعية المحتوية على المعادن والتي تكون فيها المعادن بكميات مناسبة تقنياً واقتصادياً لإنتاج المعادن في الصناعة.
وفقًا للتركيب الكيميائي للمعادن الموجودة في الركاز ، يتم تمييز الأكسيد والكبريتيد والخامات الأخرى.
عادة ، قبل الحصول على المعادن من الخام ، يتم تخصيبها مسبقًا - الصخور الفارغة ، يتم فصل الشوائب ، ونتيجة لذلك ، يتم تكوين مركز ، والذي يعمل كمواد خام لإنتاج المعادن.
طرق الحصول على المعادن.
يعد الحصول على المعادن من مركباتها مهمة علم المعادن. أي عملية تعدين هي عملية تقليل أيونات المعادن بمساعدة عوامل الاختزال المختلفة ، ونتيجة لذلك يتم الحصول على المعادن في شكل حر. اعتمادًا على طريقة تنفيذ العملية المعدنية ، يتم تمييز المعالجة المعدنية بالحرارة ، والتعدين المائي ، والتعدين الكهربائي.
تعدين المعادن- هذا هو إنتاج المعادن من مركباتها في درجات حرارة عالية باستخدام عوامل الاختزال المختلفة: الكربون ، وأول أكسيد الكربون (II) ، والهيدروجين ، والمعادن (الألومنيوم ، والمغنيسيوم) ، إلخ.
أمثلة لاستعادة المعادن
ZnO + C → Zn + CO2 ؛
أول أكسيد الكربون:
Fe2O3 + 3CO → 2Fe + 3CO2 ؛
هيدروجين:
WO3 + 3H2 → W + 3H2O ؛
CoO + H2 → Co + H2O ؛
الألمنيوم (الألمنيوم):
4Al + 3MnO2 → 2Al2O3 + 3Mn ؛
Cr2O3 + 2Al = 2Al2O3 + 2Cr ؛
المغنيسيوم:
TiCl4 + 2Mg = Ti + 2MgCl2.
المعالجة المائية- هذا هو إنتاج المعادن ، ويتكون من عمليتين: 1) يتم إذابة مركب فلز طبيعي في حمض ، مما ينتج عنه محلول ملح معدني ؛ 2) من المحلول الناتج ، يتم إزاحة هذا المعدن بمعدن أكثر نشاطًا. علي سبيل المثال:
1. 2CuS + 3O2 = 2CuO + 2SO2.
CuO + H2SO4 = CuSO4 + H2O.
2. CuSO4 + Fe = FeSO4 + Cu.
علم المعادنهو إنتاج المعادن عن طريق التحليل الكهربائي للمحاليل أو إذابة مركباتها. يتم لعب دور عامل الاختزال في عملية التحليل الكهربائي بواسطة التيار الكهربائي.
الخصائص العامة لمعادن مجموعة IA.
تشمل معادن المجموعة الفرعية الرئيسية للمجموعة الأولى (مجموعات IA) الليثيوم (Li) والصوديوم (Na) والبوتاسيوم (K) والروبيديوم (Rb) والسيزيوم (Cs) والفرانسيوم (Fr). تسمى هذه المعادن بالمعادن القلوية ، لأنها تشكل وأكاسيدها القلويات عند التفاعل مع الماء.
الفلزات القلوية هي عناصر s. تحتوي ذرات المعدن على إلكترون s واحد (ns1) على طبقة الإلكترون الخارجية.
البوتاسيوم والصوديوم - مواد بسيطة

الفلزات القلوية في الامبولات:
أ - السيزيوم ب - الروبيديوم ج - البوتاسيوم ز - الصوديوم
معلومات أساسية عن عناصر المجموعة IA
ليثيوم الليثيوم | الصوديوم الصوديوم | ك البوتاسيوم | Rb الروبيديوم | Cs السيزيوم | الفرنسية |
|
العدد الذري | ||||||
حالة الأكسدة | ||||||
المركبات الطبيعية الأساسية | Li2O Al2O3 4SiO2 (سبودومين) ؛ LiAl (PO4) F ، LiAl (PO4) OH (أمبليغونيت) | كلوريد الصوديوم (ملح الطعام) ؛ Na2SO4 10H2O (ملح جلوبر ، ميرابيليت) ؛ بوكل كلوريد الصوديوم (سيلفينيت) | بوكل (سيلفين) ، بوكل كلوريد الصوديوم (سيلفينيت) ؛ K (الفلسبار البوتاسيوم ، orthoeye) ؛ KCl MgCl2 6H2O (كارناليت) - يوجد في النباتات | كشوائب متساوية الشكل في معادن البوتاسيوم - سيلفينيت وكارناليت | 4Cs2O 4Al2O3 18 SiO2 2H2O (شبه سايت) ؛ قمر صناعي من معادن البوتاسيوم | منتج الأكتينيوم ألفا الاضمحلال |
الخصائص الفيزيائية
البوتاسيوم والصوديوم معادن فضية ناعمة (مقطعة بسكين) ؛ ρ (K) = 860 كجم / م 3 ، Tm (K) = 63.7 درجة مئوية ، ρ (Na) = 970 كجم / م 3 ، Tm (Na) = 97.8 درجة مئوية. لها موصلية حرارية وكهربائية عالية ، وتلون اللهب بألوان مميزة: K - باللون الأرجواني الباهت ، Na - باللون الأصفر.
https://pandia.ru/text/78/392/images/image005_57.jpg "alt =" (! LANG: إذابة أكسيد الكبريت (IV) في الماء" width="312" height="253 src=">Реакция серы с натрием!}
التفاعل مع المواد المعقدة:
1. 2Na + 2H2O → 2NaOH + H2.
2. 2Na + Na2O2 → 2Na2O.
3. 2Na + 2НCl → 2NaCl + Н2.
صناعة اللب والورق "href =" / text / category / tcellyulozno_bumazhnaya_promishlennostmz / "rel =" bookmark "> إنتاج الورق ، الأقمشة الاصطناعية ، الصابون ، لتنظيف أنابيب النفط ، في إنتاج الألياف الاصطناعية ، في البطاريات القلوية.
البحث عن المركبات المعدنيةI لمجموعات في الطبيعة.
ملح ― كلوريد الصوديوم- كلوريد الصوديوم، NaNO3- نترات الصوديوم (الملح الصخري التشيلي) ، Na2CO3- كربونات الصوديوم (الصودا) ، NaHCO3- بيكربونات الصوديوم (صودا الخبز) ، Na2SO4- كبريتات الصوديوم، Na2SO4 10Н2О- ملح جلوبر بوكل- كلوريد البوتاسيوم ، KNO3- نترات البوتاسيوم (نترات البوتاسيوم) ، K2SO4- كبريتات البوتاسيوم ، K2CO3- كربونات البوتاسيوم (البوتاس) - مواد أيونية بلورية ، كلها تقريبا قابلة للذوبان في الماء. تظهر أملاح الصوديوم والبوتاسيوم خصائص الأملاح المتوسطة:
2NaCl (صلب) + H2SO4 (conc.) → Na2SO4 + 2HCl ؛
KCl + AgNo3 → KNO3 + AgCl ↓ ؛
Na2CO3 + 2HCl → NaCl + CO2 + H2O ؛
K2CO3 + H2O ↔ KHCO3 + KOH ؛
CO32- + H2O ↔ HCO3- + OH - (البيئة القلوية ، درجة الحموضة< 7).
بلورات الملح
 منجم الملح
منجم الملح
Na2CO3يستخدم لإنتاج الورق والصابون والزجاج.
NaHCO3- في الطب ، والطبخ ، وإنتاج المياه المعدنية ، وطفايات الحريق ؛
K2CO3- لتلقي الصابون السائل والزجاج ؛
البوتاس - كربونات البوتاسيوم
NaNO3 ، KNO3 ، بوكل ، K2SO4- أهم أسمدة البوتاس.
https://pandia.ru/text/78/392/images/image013_35.gif "align =" left "width =" 278 "height =" 288 src = ">
يحتوي ملح البحر على 90-95٪ كلوريد الصوديوم (كلوريد الصوديوم) وما يصل إلى 5٪ من المعادن الأخرى: أملاح المغنيسيوم وأملاح الكالسيوم وأملاح البوتاسيوم وأملاح المنغنيز وأملاح الفوسفور وأملاح اليود وما إلى ذلك معًا ، أكثر من 40 عنصرًا مفيدًا في الجدول الدوري - كل هذا موجود في مياه البحر.
البحر الميت
هناك شيء غير عادي ، يكاد يكون رائعًا فيه. في الأراضي الشرقية ، حتى أصغر تدفق للرطوبة هو مصدر للحياة ، وتزهر الحدائق هناك ، وتنضج الحبوب. لكن هذا الماء يقتل كل الحياة.
لقد زار العديد من الناس هذه الشواطئ: العرب واليهود واليونانيون والرومان ؛ أطلق كل واحد منهم على هذه البحيرة الضخمة بلغته الخاصة ، لكن معنى الاسم كان هو نفسه: ميت ، ميت ، هامد.

وقفنا على شاطئ مهجور ، أثار منظره الباهت الحزن: أرض ميتة - لا عشب ولا طيور. على الجانب الآخر من البحيرة ، ارتفعت الجبال المحمرّة بشكل حاد من المياه الخضراء. منحدرات مجردة وعارية. وبدا أن نوعا من القوة مزقت غطاءها الطبيعي وانكشف عضلات الأرض.
قررنا الغطس ، لكن تبين أن الماء بارد ، وغسلنا أنفسنا فقط بماء كثيف يتدفق مثل محلول ملحي شديد الانحدار. بعد بضع دقائق ، غُطيت الوجه والأيدي بطبقة بيضاء من الملح ، وظل طعم مر لا يطاق على الشفاه ، كان من المستحيل التخلص منه لفترة طويلة. من المستحيل الغرق في هذا البحر: فالمياه الكثيفة نفسها تُبقي الإنسان على السطح.
تسبح الأسماك أحيانًا من نهر الأردن إلى البحر الميت. تموت في دقيقة. وجدنا واحدة من هذه الأسماك ملقاة على الشاطئ. كانت صلبة مثل العصا ، في قشرة ملح قوية.
يمكن أن يصبح هذا البحر مصدر ثروة للناس. بعد كل شيء ، هذا مخزن عملاق من الأملاح المعدنية.

يحتوي كل لتر من مياه البحر الميت على 275 جرام من أملاح البوتاسيوم والصوديوم والبروم والمغنيسيوم والكالسيوم. تقدر الاحتياطيات المعدنية هنا بنحو 43 مليار طن. يمكن استخراج البروم والبوتاس بتكلفة زهيدة للغاية ، ولا شيء يحد من حجم الإنتاج. تمتلك البلاد احتياطيات ضخمة من الفوسفات ، والتي يزداد الطلب عليها في السوق العالمية ، ويتم استخراج كميات ضئيلة منها.
الخصائص العامة لعناصر مجموعة IIA.
تشمل معادن المجموعة الفرعية الرئيسية للمجموعة الثانية (مجموعات IIA) البريليوم (Be) والمغنيسيوم (Mg) والكالسيوم (Ca) والسترونشيوم (Sr) والباريوم (Ba) والراديوم (Ra). تسمى هذه المعادن بالمعادن الأرضية القلوية ، نظرًا لأن Me (OH) 2 هيدروكسيدات لها خصائص قلوية ، وأكاسيد MeO الخاصة بها متشابهة في درجة انكسارها للأكاسيد معادن ثقيلةكانت تسمى سابقًا "الأراضي".
المعادن الأرضية القلوية هي عناصر s. تحتوي ذرات المعدن على إلكترونين s (ns2) على طبقة الإلكترون الخارجية.
معلومات أساسية حول عناصر مجموعة IIA
يكون البريليوم | ملغ المغنيسيوم | كاليفورنيا الكالسيوم | ريال سعودى السترونشيوم | با الباريوم | رع الراديوم |
|
العدد الذري | ||||||
هيكل الأصداف الإلكترونية الخارجية للذرات |
حيث n = 2، 3، 4، 5، 6، 7، n هو رقم الفترة |
|||||
حالة الأكسدة | ||||||
المركبات الطبيعية الأساسية | 3BeO Al2O3 6SiO2 (البريل) ؛ Be2SiO4 (فيناسيت) | 2MgO SO2 (أوليفين) ؛ MgCO3 (مغنسيت) ؛ MgCO3 CaCO3 (الدولوميت) ؛ MgCl2 KCl 6H2O (كارنال لايت) | CaCO3 (كالسيت) ، CaF2- فلوريت ، CaO Al2O3 6SiO2 (أنورثيت) ؛ CaSO4 · 2H2O (الجبس) ؛ MgCO3 CaCO3 (دولوميت) ، Сa3 (PO4) 2 فوسفوريت ، Сa5 (PO4) 3Х (Х = F ، Cl ، OH) أباتيت | SrCO3 (سترونت سيانيت) ، SrSO4 (سيليستين) | BaCO3 (الباتيرايت) BaSO4 (الباريت ، الصاري الثقيل) | كجزء من خامات اليورانيوم |
القلوية الترابية- رئتين معادن بيضاء فضية. السترونشيوم له صبغة ذهبية ، أصعب بكثير الفلزات القلوية. الباريوم يشبه في ليونة الرصاص. في الهواء عند درجة الحرارة العادية ، سطح البريليوم والمغنيسيوم مغطى بطبقة أكسيد واقية. تتفاعل معادن الأرض القلوية بشكل فعال مع الأكسجين الجوي ، لذلك يتم تخزينها تحت طبقة من الكيروسين أو في أوعية محكمة الغلق ، مثل المعادن القلوية.
الكالسيوم مادة بسيطة
الخصائص الفيزيائية
الكالسيوم الطبيعي هو خليط من النظائر المستقرة. الكالسيوم الأكثر شيوعًا هو 97٪. الكالسيوم معدن أبيض فضي. ρ = 1550 كجم / م 3 ، ذوبان = 839 درجة مئوية. ألوان اللهب البرتقالي والأحمر.
الخواص الكيميائية
التفاعل مع المواد البسيطة (اللافلزات):
1. مع الهالوجينات: Ca + Cl2 → CaCl2 (كلوريد الكالسيوم).
2. مع الكربون: Ca + 2C → CaC2 (كربيد الكالسيوم).
3. مع الهيدروجين: Ca + H2 → CaH2 (هيدريد الكالسيوم).
ملح: كربونات الكالسيوم 3كربونات الكالسيوم هي واحدة من أكثر المركبات شيوعًا على وجه الأرض: الطباشير والرخام والحجر الجيري. وأهم هذه المعادن هو الحجر الجيري. هو نفسه حجر بناء ممتاز ، بالإضافة إلى أنه مادة خام لإنتاج الأسمنت والجير المطفأ والزجاج ، إلخ.
يتم تقوية الطرق بالحصى الجيري ، وتقليل حموضة التربة بالمسحوق.
الطباشير الطبيعي هو بقايا أصداف الحيوانات القديمة. يتم استخدامه كأقلام تلوين مدرسية ، كجزء من معاجين الأسنان ، لإنتاج الورق والمطاط.
https://pandia.ru/text/78/392/images/image040_7.jpg "العرض =" 250 "الارتفاع =" 196 ">
الخصائص الفيزيائية
الحديد معدن أبيض فضي أو رمادي ، صلب ، ذو ليونة عالية ، موصلية حرارية وكهربائية ، حراري ؛ ρ = 7874 كجم / م 3 ، Tm = 1540 درجة مئوية. على عكس المعادن الأخرى ، يمكن أن يكون الحديد ممغنطًا ، وله مغنطيسية حديدية.
الخواص الكيميائية
يتفاعل الحديد مع كل من المواد البسيطة والمعقدة.
تفاعل الحديد مع الأكسجين

أ) عند تسخينها (احتراق) ، ب) عند ن. ذ. (تآكل)
الخواص الكيميائية للحديد
في ن. في. | عند تسخينها |
|
رد فعل | 3FeSO4 + 2K3 = Fe32 ↓ + 3K2SO4 (أزرق توربولين - أزرق داكن مترسب). | 1. 4FeCl3 + 3K4 = Fe43 ↓ + 12KCl (أزرق بروسي - أزرق داكن مترسب). 2. FeCl3 + 3NH4CNS ⇆ Fe (CNS) 3 + 3NH4Cl (ثيوسيانات الدم الحمراء + الأمونيا). |
الدور البيولوجي للحديد
يكشف علماء الكيمياء الحيوية عن الدور الهائل للحديد في حياة النباتات والحيوانات والبشر. كجزء من الهيموجلوبين ، يتسبب الحديد في اللون الأحمر لهذه المادة ، والذي بدوره يحدد لون الدم. يحتوي جسم الشخص البالغ على 3 غرامات من الحديد ، 75٪ منها جزء من الهيموغلوبين ، والتي بسببها تتم أهم عملية بيولوجية ، وهي التنفس. الحديد ضروري أيضًا للنباتات. يشارك في العمليات المؤكسدة للبروتوبلازم ، في تنفس النباتات وفي بناء الكلوروفيل ، على الرغم من عدم تضمينه في تكوينه نفسه. يستخدم الحديد منذ فترة طويلة في الطب لعلاج فقر الدم والإرهاق وفقدان القوة.