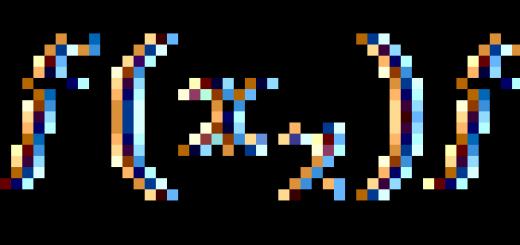الكهربية ، مثل الخصائص الأخرى للذرات العناصر الكيميائية، يتغير مع زيادة الرقم الترتيبي للعنصر بشكل دوري:
يوضح الرسم البياني أعلاه دورية التغيير في الكهربية لعناصر المجموعات الفرعية الرئيسية ، اعتمادًا على الرقم الترتيبي للعنصر.
عند الانتقال إلى أسفل المجموعة الفرعية للجدول الدوري ، تقل السلبية الكهربية للعناصر الكيميائية ، وعند الانتقال إلى اليمين على طول الفترة ، تزداد.
تعكس الكهربية اللا فلزية للعناصر: فكلما زادت قيمة السالبية الكهربية ، زاد التعبير عن الخصائص غير المعدنية في العنصر.
حالة الأكسدة
كيف تحسب حالة أكسدة عنصر في مركب؟
1) درجة أكسدة العناصر الكيميائية فيها مواد بسيطةدائما صفر.
2) هناك عناصر تظهر في مواد معقدةحالة أكسدة ثابتة:
3) هناك عناصر كيميائية تظهر حالة أكسدة ثابتة في الغالبية العظمى من المركبات. تشمل هذه العناصر:
جزء |
حالة الأكسدة في جميع المركبات تقريبًا |
استثناءات |
| الهيدروجين ح | +1 | هيدرات الفلزات القلوية والقلوية الأرضية ، على سبيل المثال: |
| الأكسجين O | -2 | هيدروجين وبيروكسيدات المعادن: فلوريد الأكسجين - |
4) يكون المجموع الجبري لحالات الأكسدة لجميع الذرات في الجزيء صفرًا دائمًا. المجموع الجبري لحالات الأكسدة لجميع الذرات في أيون يساوي شحنة الأيون.
5) أعلى حالة أكسدة (قصوى) تساوي رقم المجموعة. الاستثناءات التي لا تندرج تحت هذه القاعدة هي عناصر المجموعة الفرعية الثانوية للمجموعة الأولى ، وعناصر المجموعة الفرعية الثانوية للمجموعة الثامنة ، وكذلك الأكسجين والفلور.
العناصر الكيميائية التي لا يتطابق رقم مجموعتها مع أعلى حالة أكسدة لها (إلزامي للحفظ)
6) أدنى حالة أكسدة للمعادن هي دائمًا صفر ، ويتم حساب أدنى حالة أكسدة للغير المعادن بالصيغة:
أدنى حالة أكسدة غير معدنية = رقم المجموعة - 8
بناءً على القواعد المذكورة أعلاه ، من الممكن تحديد درجة أكسدة عنصر كيميائي في أي مادة.
إيجاد حالات أكسدة العناصر في المركبات المختلفة
مثال 1
حدد حالات الأكسدة لجميع العناصر في حامض الكبريتيك.
المحلول:
لنكتب صيغة حمض الكبريتيك:
حالة أكسدة الهيدروجين في جميع المواد المعقدة هي +1 (باستثناء هيدرات المعادن).
حالة أكسدة الأكسجين في جميع المواد المعقدة هي -2 (باستثناء بيروكسيدات وفلوريد الأكسجين 2). لنرتب حالات الأكسدة المعروفة:
دعونا نشير إلى حالة أكسدة الكبريت x:
جزيء حامض الكبريتيك ، مثل جزيء أي مادة ، محايد كهربائيًا بشكل عام ، لأنه. مجموع حالات الأكسدة لجميع الذرات في الجزيء هو صفر. من الناحية التخطيطية ، يمكن تصوير ذلك على النحو التالي:
أولئك. حصلنا على المعادلة التالية:
لنحلها:
وبالتالي ، فإن حالة أكسدة الكبريت في حامض الكبريتيك هي +6.
مثال 2
تحديد حالة الأكسدة لجميع العناصر في ثنائي كرومات الأمونيوم.
المحلول:
لنكتب صيغة ثنائي كرومات الأمونيوم:
كما في الحالة السابقة يمكننا ترتيب حالات أكسدة الهيدروجين والأكسجين:
ومع ذلك ، نرى أن حالات الأكسدة لعنصرين كيميائيين في وقت واحد ، النيتروجين والكروم ، غير معروفة. لذلك ، لا يمكننا العثور على حالات الأكسدة بنفس الطريقة كما في المثال السابق (لا تحتوي معادلة واحدة ذات متغيرين على حل فريد).
دعونا ننتبه إلى حقيقة أن المادة المشار إليها تنتمي إلى فئة الأملاح ، وبالتالي لها بنية أيونية. ثم يمكننا القول بحق أن تكوين ثنائي كرومات الأمونيوم يتضمن NH 4 + كاتيونات (يمكن رؤية شحنة هذا الكاتيون في جدول الذوبان). لذلك ، نظرًا لوجود كاتيونات NH 4 + موجبة الشحنة مفردة الشحنة في وحدة صيغة ثنائي كرومات الأمونيوم ، فإن شحنة أيون ثنائي كرومات هي -2 ، نظرًا لأن المادة ككل متعادلة كهربائيًا. أولئك. تتكون المادة من NH4 + كاتيونات و Cr 2 O 7 2- الأنيونات.
نحن نعرف حالات أكسدة الهيدروجين والأكسجين. مع العلم أن مجموع حالات الأكسدة لذرات جميع العناصر في الأيون يساوي الشحنة ، ويشير إلى حالات أكسدة النيتروجين والكروم xو ذوفقًا لذلك ، يمكننا أن نكتب:
أولئك. نحصل على معادلتين مستقلتين:
حل الذي نجد xو ذ:
وهكذا ، في ثنائي كرومات الأمونيوم ، تكون حالات أكسدة النيتروجين هي -3 ، الهيدروجين +1 ، الكروم +6 ، والأكسجين -2.
كيفية تحديد حالات أكسدة العناصر في المواد العضويةيمكن قراءتها.
التكافؤ
يُشار إلى تكافؤ الذرات بالأرقام الرومانية: I ، II ، III ، إلخ.
تعتمد احتمالات التكافؤ للذرة على الكمية:
1) الإلكترونات غير المزاوجة
2) أزواج الإلكترون غير المشتركة في مدارات مستويات التكافؤ
3) مدارات الإلكترون الفارغة لمستوى التكافؤ
احتمالات التكافؤ لذرة الهيدروجين
دعنا نصور الصيغة الرسومية الإلكترونية لذرة الهيدروجين:
قيل أن يوم احتمالات التكافؤيمكن أن تؤثر ثلاثة عوامل - وجود إلكترونات غير متزاوجة ، ووجود أزواج إلكترونية غير مشتركة على المستوى الخارجي ، ووجود مدارات (فارغة) من المستوى الخارجي. نرى إلكترونًا واحدًا غير مزدوج في مستوى الطاقة الخارجي (فقط). بناءً على ذلك ، يمكن أن يكون للهيدروجين بالضبط تكافؤ مساو لـ I ومع ذلك ، عند مستوى الطاقة الأول ، يوجد مستوى فرعي واحد فقط - س،أولئك. لا تحتوي ذرة الهيدروجين على المستوى الخارجي على أزواج إلكترونية غير مشتركة أو مدارات فارغة.
وبالتالي ، فإن التكافؤ الوحيد الذي يمكن أن تظهره ذرة الهيدروجين هو أنا.
تكافؤ احتمالات ذرة الكربون
ضع في اعتبارك الهيكل الإلكتروني لذرة الكربون. في الحالة الأرضية ، يكون التكوين الإلكتروني لمستواه الخارجي كما يلي:
أولئك. في الحالة الأرضية ، يحتوي مستوى الطاقة الخارجية لذرة كربون غير مستثارة على إلكترونين غير متزاوجين. في هذه الحالة ، يمكن أن تظهر تكافؤًا يساوي II. ومع ذلك ، فإن ذرة الكربون تنتقل بسهولة إلى حالة الإثارة عندما يتم نقل الطاقة إليها ، ويتخذ التكوين الإلكتروني للطبقة الخارجية في هذه الحالة الشكل:
على الرغم من أن قدرًا معينًا من الطاقة يتم إنفاقه على عملية إثارة ذرة الكربون ، فإن النفقات يتم تعويضها أكثر من خلال تكوين أربع روابط تساهمية. لهذا السبب ، يعتبر التكافؤ الرابع أكثر خصائص ذرة الكربون. لذلك ، على سبيل المثال ، يحتوي الكربون على التكافؤ الرابع في الجزيئات نشبعوحمض الكربونيك وجميع المواد العضوية.
بالإضافة إلى الإلكترونات غير المزاوجة وأزواج الإلكترون المنفردة ، فإن وجود () مدارات شاغرة لمستوى التكافؤ يؤثر أيضًا على احتمالات التكافؤ. يؤدي وجود مثل هذه المدارات في المستوى المملوء إلى حقيقة أن الذرة يمكن أن تعمل كمتقبل لزوج الإلكترون ، أي تشكل روابط تساهمية إضافية من خلال آلية المتبرع المتلقي. لذلك ، على سبيل المثال ، على عكس التوقعات ، في الجزيء أول أكسيد الكربونرابطة ثاني أكسيد الكربون ليست مزدوجة ولكنها ثلاثية ، وهو ما يظهر بوضوح في الرسم التوضيحي التالي:
احتمالات التكافؤ لذرة النيتروجين
نكتب الصيغة الرسومية الإلكترونية للخارج مستوى الطاقةذرة النيتروجين:
كما يتضح من الرسم التوضيحي أعلاه ، تحتوي ذرة النيتروجين في حالتها الطبيعية على 3 إلكترونات غير مقترنة ، وبالتالي فمن المنطقي أن نفترض أنها يمكن أن تظهر تكافؤًا يساوي III. في الواقع ، لوحظ تكافؤ ثلاثة في جزيئات الأمونيا (NH 3) ، وحمض النيتروز (HNO 2) ، وثلاثي كلوريد النيتروجين (NCl 3) ، إلخ.
قيل أعلاه أن تكافؤ ذرة عنصر كيميائي لا يعتمد فقط على عدد الإلكترونات غير المزدوجة ، ولكن أيضًا على وجود أزواج إلكترونية غير مشتركة. هذا يرجع إلى حقيقة أن الرابطة الكيميائية التساهمية يمكن أن تتكون ليس فقط عندما تزود ذرتان بعضهما البعض بإلكترون واحد لكل منهما ، ولكن أيضًا عندما تحتوي ذرة واحدة على زوج غير مشترك من الإلكترونات - يقوم المتبرع () بتزويدها إلى ذرة أخرى بشاغر. () مستوى التكافؤ المداري (متقبل). أولئك. بالنسبة لذرة النيتروجين ، يكون التكافؤ الرابع ممكنًا أيضًا بسبب رابطة تساهمية إضافية تكونت بواسطة آلية متلقي المانح. لذلك ، على سبيل المثال ، لوحظت أربع روابط تساهمية ، واحدة منها تتشكل بواسطة آلية متلقي المانح ، أثناء تكوين كاتيون الأمونيوم:
على الرغم من حقيقة أن إحدى الروابط التساهمية تتشكل بواسطة آلية المتبرع المتقبل ، إلا أن الكل سندات NHفي كاتيون الأمونيوم متطابقة تمامًا ولا تختلف عن بعضها البعض.
التكافؤ يساوي V ، ذرة النيتروجين غير قادرة على الظهور. ويرجع ذلك إلى حقيقة أن الانتقال إلى حالة الإثارة أمر مستحيل بالنسبة لذرة النيتروجين ، حيث يحدث الاقتران بين إلكترونين مع انتقال أحدهما إلى مدار حر ، وهو الأقرب في مستوى الطاقة. ذرة النيتروجين لا تحتوي على د-المستوى الفرعي ، والانتقال إلى المدار 3s مكلف للغاية بحيث لا يتم تغطية تكاليف الطاقة من خلال تكوين روابط جديدة. قد يتساءل الكثيرون ، ما هو إذن تكافؤ النيتروجين ، على سبيل المثال ، في جزيئات حمض النيتريك HNO 3 أو أكسيد النيتريك N 2 O 5؟ الغريب أن التكافؤ موجود أيضًا IV ، كما يتضح من الصيغ الهيكلية التالية:
يُظهر الخط المنقط في الرسم التوضيحي ما يسمى ب غير محدد π -الإتصال. لهذا السبب ، لا يمكن تسمية أي روابط نهائية بـ "واحد ونصف". تم العثور على روابط نصف ونصف مماثلة أيضًا في جزيء الأوزون O 3 ، والبنزين C 6 H 6 ، إلخ.
تكافؤ احتمالات الفوسفور
دعونا نصور صيغة الرسم الإلكتروني لمستوى الطاقة الخارجية لذرة الفوسفور:
كما نرى ، فإن بنية الطبقة الخارجية من ذرة الفوسفور في الحالة الأرضية وذرة النيتروجين هي نفسها ، وبالتالي فمن المنطقي أن نتوقع لذرة الفوسفور ، وكذلك بالنسبة لذرة النيتروجين ، التكافؤات الممكنة متساوية إلى الأول والثاني والثالث والرابع ، والتي يتم ملاحظتها في الممارسة العملية.
ومع ذلك ، على عكس النيتروجين ، تمتلك ذرة الفوسفور أيضًا د-المستوى الفرعي مع 5 مدارات شاغرة.
في هذا الصدد ، يمكن أن تنتقل إلى حالة الإثارة ، مما يؤدي إلى تبخير الإلكترونات 3 س- المدارية:
وبالتالي ، فإن التكافؤ V لذرة الفوسفور ، والذي يتعذر الوصول إليه للنيتروجين ، ممكن. لذلك ، على سبيل المثال ، تحتوي ذرة الفوسفور على تكافؤ خمسة في جزيئات مركبات مثل حمض الفوسفوريك ، هاليدات الفوسفور (V) ، أكسيد الفوسفور (V) ، إلخ.
احتمالات التكافؤ لذرة الأكسجين
صيغة الرسم الإلكتروني لمستوى الطاقة الخارجية لذرة الأكسجين لها الشكل:
نرى إلكترونين غير مزدوجين في المستوى الثاني ، وبالتالي فإن التكافؤ II ممكن للأكسجين. وتجدر الإشارة إلى أن تكافؤ ذرة الأكسجين لوحظ في جميع المركبات تقريبًا. أعلاه ، عند النظر في احتمالات التكافؤ لذرة الكربون ، ناقشنا تكوين جزيء أول أكسيد الكربون. الرابطة في جزيء ثاني أكسيد الكربون ثلاثية ، وبالتالي ، فإن الأكسجين ثلاثي التكافؤ هناك (الأكسجين متبرع بزوج الإلكترون).
يرجع ذلك إلى حقيقة أن ذرة الأكسجين ليس لها مستوى خارجي د- المستويات الفرعية ، وإضعاف الإلكترونات سو ص-المدارات مستحيلة ، وهذا هو السبب في أن قدرات التكافؤ لذرة الأكسجين محدودة مقارنة بالعناصر الأخرى من مجموعتها الفرعية ، على سبيل المثال ، الكبريت.
احتمالات التكافؤ لذرة الكبريت
مستوى الطاقة الخارجية لذرة الكبريت في الحالة غير المستثارة:
تحتوي ذرة الكبريت ، مثل ذرة الأكسجين ، على إلكترونين غير متزاوجين في حالتهما الطبيعية ، لذلك يمكننا أن نستنتج أن التكافؤ اثنين ممكن للكبريت. في الواقع ، يحتوي الكبريت على التكافؤ II ، على سبيل المثال ، في جزيء كبريتيد الهيدروجين H 2 S.
كما نرى ، فإن ذرة الكبريت في المستوى الخارجي لها دالمستوى الفرعي مع المدارات الشاغرة. لهذا السبب ، فإن ذرة الكبريت قادرة على توسيع قدرات التكافؤ ، على عكس الأكسجين ، بسبب الانتقال إلى حالات الإثارة. لذلك ، عند إلغاء إقران زوج إلكترون وحيد 3 ص- المستوى الفرعي ، تكتسب ذرة الكبريت التكوين الإلكتروني للمستوى الخارجي بالشكل التالي:
في هذه الحالة ، تحتوي ذرة الكبريت على 4 إلكترونات غير مقترنة ، والتي تخبرنا عن إمكانية إظهار ذرات الكبريت تكافؤًا يساوي IV. في الواقع ، يحتوي الكبريت على تكافؤ IV في جزيئات SO 2 و SF 4 و SOCl 2 وما إلى ذلك.
عند إلغاء اقتران زوج الإلكترون الوحيد الثاني الموجود في 3 س- المستوى الفرعي ، يكتسب مستوى الطاقة الخارجية التكوين التالي:
في مثل هذه الحالة ، يصبح مظهر التكافؤ السادس ممكنًا بالفعل. مثال على المركبات التي تحتوي على كبريت VI- التكافؤ هي SO 3 و H 2 SO 4 و SO 2 Cl 2 وما إلى ذلك.
وبالمثل ، يمكننا النظر في احتمالات التكافؤ للعناصر الكيميائية الأخرى.
ثيمات استخدام المبرمج: كهرسلبية. درجة أكسدة وتكافؤ العناصر الكيميائية.
عندما تتفاعل الذرات وتتشكل ، فإن الإلكترونات فيما بينها تكون في معظم الحالات موزعة بشكل غير متساو ، لأن خصائص الذرات تختلف. أكثر كهربية تجذب الذرة كثافة الإلكترون إليها بقوة أكبر. الذرة التي تجذب كثافة الإلكترون لنفسها تكتسب شحنة سالبة جزئية. δ — ، "الشريك" هو شحنة موجبة جزئية δ+ . إذا كان الاختلاف في الكهربية للذرات المكونة للرابطة لا يتجاوز 1.7 ، فإننا نسمي الرابطة قطبي تساهمي . إذا تجاوز الفرق في الكهربية التي تشكل رابطة كيميائية 1.7 ، فإننا نسمي هذه الرابطة أيوني .
حالة الأكسدة هي الشحنة الشرطية المساعدة لذرة عنصر في مركب ، محسوبة من افتراض أن جميع المركبات تتكون من أيونات (جميع الروابط القطبية أيونية).
ماذا تعني "الرسوم المشروطة"؟ نتفق ببساطة على أننا سنبسط الأشياء قليلاً: سنعتبر أي روابط قطبية أيونية تمامًا ، وسنعتبر أن الإلكترون يترك أو يأتي من ذرة إلى أخرى ، حتى لو لم يكن كذلك في الواقع. وشرطًا ، يترك الإلكترون ذرة أقل كهرسلبية مقابل ذرة أكثر كهرسلبية.
علي سبيل المثال، في رابطة H-Cl ، نعتقد أن الهيدروجين "أعطى" إلكترونًا بشروط ، وأصبحت شحنته +1 ، والكلور "يقبل" إلكترونًا ، وأصبحت شحنته -1. في الواقع ، لا توجد مثل هذه الرسوم الإجمالية على هذه الذرات.
بالتأكيد لديك سؤال - لماذا تخترع شيئًا غير موجود؟ هذه ليست خطة خبيثة للكيميائيين ، كل شيء بسيط: مثل هذا النموذج مناسب للغاية. الأفكار حول حالة أكسدة العناصر مفيدة في التجميع تصنيف مواد كيميائيةووصف خصائصها وصياغة المركبات والتسميات. غالبًا ما يتم استخدام حالات الأكسدة عند العمل تفاعلات الأكسدة والاختزال.
حالات الأكسدة هي أعلى, أدنىو متوسط.
أعلىحالة الأكسدة تساوي رقم المجموعة بعلامة زائد.
السفلييتم تعريفه على أنه رقم المجموعة ناقص 8.
و متوسطحالة الأكسدة هي تقريبا أي عدد صحيح في النطاق من أدنى حالة أكسدة إلى الأعلى.
علي سبيل المثاليتميز النيتروجين بما يلي: أعلى درجةالأكسدة +5 ، الأدنى 5-8 \ u003d -3 ، وحالات الأكسدة الوسيطة من -3 إلى +5. على سبيل المثال ، في الهيدرازين N 2 H 4 ، تكون حالة أكسدة النيتروجين وسيطة ، -2.
في أغلب الأحيان ، يُشار إلى حالة أكسدة الذرات في المواد المعقدة أولاً بعلامة ، ثم برقم ، على سبيل المثال +1, +2, -2 إلخ. متي نحن نتكلمحول شحنة الأيون (افترض أن الأيون موجود بالفعل في المركب) ، ثم حدد الرقم أولاً ، ثم الإشارة. علي سبيل المثال: Ca 2+، CO 3 2-.
للعثور على حالات الأكسدة ، استخدم ما يلي أنظمة :
- حالة أكسدة الذرات في مواد بسيطة يساوي صفر
- في جزيئات محايدة مجموع جبريحالات الأكسدة هي صفر ، لأن هذا المجموع للأيونات يساوي شحنة الأيون ؛
- حالة الأكسدة الفلزات القلوية (عناصر المجموعة الأولى من المجموعة الفرعية الرئيسية) في المركبات هي +1 ، حالة الأكسدة المعادن الأرضية القلوية (عناصر المجموعة الثانية من المجموعة الفرعية الرئيسية) في المركبات هي +2 ؛ حالة الأكسدة الألومنيومفي المركبات هو +3 ؛
- حالة الأكسدة هيدروجينفي المركبات التي تحتوي على معادن (- NaH ، CaH 2 ، إلخ) يساوي -1 ؛ في مركبات مع غير المعادن () +1 ;
- حالة الأكسدة الأكسجينيساوي -2 . استثناءتشكل بيروكسيدات- المركبات التي تحتوي على مجموعة -О-О- ، حيث توجد حالة أكسدة الأكسجين -1 ، وبعض المركبات الأخرى ( الأكسيدات الفائقة ، الأوزون ، فلوريد الأكسجين من 2وإلخ.)؛
- حالة الأكسدة الفلورفي جميع المواد المعقدة يساوي -1 .
ما سبق هو الحالات التي ننظر فيها إلى درجة الأكسدة مستمر . بالنسبة لجميع العناصر الكيميائية الأخرى ، حالة الأكسدة — عامل، ويعتمد على ترتيب ونوع الذرات في المركب.
أمثلة:
المهمة: تحديد حالات أكسدة العناصر في جزيء ثنائي كرومات البوتاسيوم: K 2 Cr 2 O 7.
المحلول:حالة أكسدة البوتاسيوم هي +1 ، ويشار إلى حالة أكسدة الكروم X، حالة أكسدة الأكسجين -2. مجموع كل حالات الأكسدة لجميع الذرات في الجزيء هو 0. نحصل على المعادلة: + 1 * 2 + 2 * x-2 * 7 = 0. قمنا بحلها ، نحصل على حالة أكسدة الكروم +6.
في المركبات الثنائية ، يتميز العنصر الأكثر كهرسلبية بحالة أكسدة سالبة ، بينما يتميز العنصر الأقل كهرسلبية بعنصر إيجابي.
لاحظ أن مفهوم حالة الأكسدة مشروط جدا! لا تظهر حالة الأكسدة الشحنة الحقيقية للذرة وليس لها حقيقية الحس المادي . هذا نموذج مبسط يعمل بفعالية عندما نحتاج ، على سبيل المثال ، إلى معادلة المعاملات في المعادلة تفاعل كيميائي، أو من أجل خوارزمية تصنيف المواد.
حالة الأكسدة ليست التكافؤ! لا تتطابق حالة الأكسدة والتكافؤ في كثير من الحالات. على سبيل المثال ، تكافؤ الهيدروجين في مادة بسيطة H 2 هو I ، وحالة الأكسدة ، وفقًا للقاعدة 1 ، هي 0.
هذه هي القواعد الأساسية التي ستساعدك على تحديد حالة أكسدة الذرات في المركبات في معظم الحالات.
في بعض الحالات ، قد تجد صعوبة في تحديد حالة أكسدة الذرة. دعنا نلقي نظرة على بعض هذه المواقف وكيفية حلها:
- في الأكاسيد المزدوجة (الشبيهة بالملح) ، تكون الدرجة عند الذرة ، كقاعدة عامة ، حالتان من حالات الأكسدة. على سبيل المثال ، في أكسيد الحديد Fe 3 O 4 ، يحتوي الحديد على حالتي أكسدة: +2 و +3. أي واحد للإشارة؟ كلاهما. للتبسيط ، يمكن تمثيل هذا المركب كملح: Fe (FeO 2) 2. في هذه الحالة ، تشكل بقايا الحمض ذرة بحالة أكسدة +3. أو يمكن تمثيل أكسيد مزدوج على النحو التالي: FeO * Fe 2 O 3.
- في مركبات البيروكسو ، تتغير درجة أكسدة ذرات الأكسجين المرتبطة بالروابط التساهمية غير القطبية ، كقاعدة عامة. على سبيل المثال ، في بيروكسيد الهيدروجين H 2 O 2 ، وبيروكسيدات الفلزات القلوية ، تكون حالة أكسدة الأكسجين -1 ، لأن إحدى الروابط تساهمية غير قطبية (H-O-O-H). مثال آخر هو حمض البيروكسومونوسلفوريك (حمض كارو) H 2 SO 5 (انظر الشكل) يحتوي على ذرتين من الأكسجين مع حالة أكسدة -1 ، الذرات المتبقية مع حالة أكسدة -2 ، وبالتالي فإن الإدخال التالي سيكون أكثر قابلية للفهم: H 2 SO 3 (O2). تُعرف أيضًا مركبات بيروكسو الكروم - على سبيل المثال ، الكروم (VI) بيروكسيد CrO (O 2) 2 أو CrO 5 ، وغيرها الكثير.
- مثال آخر للمركبات ذات حالات الأكسدة الغامضة هي الأكسيدات الفائقة (NaO 2) والأوزون الشبيه بالملح KO 3. في هذه الحالة ، من الأنسب التحدث عن الأيون الجزيئي O 2 بشحنة -1 و O 3 بشحنة -1. يتم وصف هيكل هذه الجسيمات من خلال بعض النماذج ، والتي باللغة الروسية منهاج دراسياجتياز الدورات الأولى للجامعات الكيميائية: MO LCAO ، طريقة تراكب مخططات التكافؤ ، إلخ.
- في مركبات العضويةمفهوم حالة الأكسدة ليس مناسبًا جدًا للاستخدام ، لأنه بين ذرات الكربون رقم ضخمروابط تساهمية غير قطبية. ومع ذلك ، إذا قمت برسم الصيغة الهيكلية للجزيء ، فيمكن أيضًا تحديد حالة الأكسدة لكل ذرة من خلال نوع وعدد الذرات التي ترتبط بها هذه الذرة بشكل مباشر. على سبيل المثال ، بالنسبة لذرات الكربون الأولية في الهيدروكربونات ، تكون حالة الأكسدة -3 ، للثانوية -2 ، للذرات من الدرجة الثالثة -1 ، للرباعية - 0.
لنتدرب على تحديد حالة أكسدة الذرات في المركبات العضوية. للقيام بذلك ، تحتاج إلى رسم الصيغة الهيكلية الكاملة للذرة ، واختيار ذرة الكربون مع بيئتها المباشرة - الذرات التي ترتبط بها ارتباطًا مباشرًا.
- لتبسيط العمليات الحسابية ، يمكنك استخدام جدول الذوبان - يشار إلى رسوم الأيونات الأكثر شيوعًا هناك. في معظم اختبارات الكيمياء الروسية (USE ، GIA ، DVI) ، يُسمح باستخدام جدول الذوبان. هذه ورقة غش جاهزة ، والتي في كثير من الحالات يمكن أن توفر الكثير من الوقت.
- عند حساب حالة أكسدة العناصر في المواد المعقدة ، نشير أولاً إلى حالات الأكسدة للعناصر التي نعرفها على وجه اليقين (العناصر ذات حالة الأكسدة الثابتة) ، وحالة أكسدة العناصر ذات الحالة درجة متغيرةيتم الإشارة إلى الأكسدة بـ x. مجموع الشحنات لجميع الجسيمات يساوي صفرًا في الجزيء أو يساوي شحنة أيون في أيون. من السهل تكوين معادلة وحلها من هذه البيانات.
مادة من Uncyclopedia
حالة الأكسدة هي الشحنة المشروطة للذرة في المركب ، محسوبة على افتراض أنها تتكون فقط من أيونات. عند تعريف هذا المفهوم ، يُفترض بشكل مشروط أن إلكترونات الربط (التكافؤ) تمر إلى ذرات كهرسلبية أكثر (انظر الكهربية) ، وبالتالي تتكون المركبات ، كما كانت ، من أيونات موجبة وسالبة الشحنة. يمكن أن تحتوي حالة الأكسدة على قيم صفرية وسالبة وإيجابية ، والتي يتم وضعها عادةً فوق رمز العنصر في الأعلى.
يتم تعيين القيمة الصفرية لحالة الأكسدة لذرات العناصر في الحالة الحرة ، على سبيل المثال: Cu ، H 2 ، N 2 ، P 4 ، S 6. معنى سلبيحالات الأكسدة هي تلك الذرات التي تتجه نحوها سحابة الإلكترون الملزمة (زوج الإلكترون). بالنسبة للفلور في جميع مركباته ، فهو -1. الذرات التي تمنح إلكترونات التكافؤ لذرات أخرى لديها حالة أكسدة موجبة. على سبيل المثال ، بالنسبة للمعادن الأرضية القلوية والقلوية ، تكون على التوالي +1 و +2. في الأيونات البسيطة مثل Cl - ، S 2− ، K + ، Cu 2+ ، Al 3+ ، تساوي شحنة الأيون. في معظم المركبات ، تكون حالة أكسدة ذرات الهيدروجين +1 ، ولكن في هيدرات المعادن (مركباتها مع الهيدروجين) - NaH و CaH 2 وغيرهما - تكون -1. بالنسبة للأكسجين ، تكون حالة الأكسدة -2 ، ولكن ، على سبيل المثال ، بالاقتران مع الفلور 2 ستكون +2 ، وفي مركبات البيروكسيد (BaO 2 ، إلخ) -1. في بعض الحالات ، يمكن أيضًا التعبير عن هذه القيمة كرقم كسري: بالنسبة للحديد في أكسيد الحديد (II ، III) Fe 3 O 4 فهي تساوي +8/3.
المجموع الجبري لحالات أكسدة الذرات في المركب هو صفر ، وفي أيون معقد يكون شحنة الأيون. باستخدام هذه القاعدة ، نحسب ، على سبيل المثال ، حالة أكسدة الفوسفور في حمض الفوسفوريك H 3 PO 4. بدلالة x وضرب حالة الأكسدة للهيدروجين (+1) والأكسجين (−2) بعدد ذراتهم في المركب ، نحصل على المعادلة: (+1) 3 + x + (- 2) 4 = 0 ، من أين س = + 5. وبالمثل ، نحسب حالة أكسدة الكروم في أيون Cr 2 O 7 2−: 2x + (- 2) 7 = −2 ؛ س = + 6. في المركبات MnO ، Mn 2 O 3 ، MnO 2 ، Mn 3 O 4 ، K 2 MnO 4 ، KMnO 4 ، ستكون حالة أكسدة المنغنيز +2 ، +3 ، +4 ، +8/3 ، +6 ، + 7 ، على التوالي.
أعلى حالة أكسدة هي أعلى قيمة موجبة. بالنسبة لمعظم العناصر ، فهو يساوي رقم المجموعة في النظام الدوري وهو مهم الخاصية الكميةعنصر في مركباته. أدنى قيمةتسمى حالة أكسدة العنصر التي تحدث في مركباته عادةً بأقل حالة أكسدة ؛ كل الآخرين متوسط. لذلك ، بالنسبة للكبريت ، أعلى حالة أكسدة هي +6 ، وأدناها -2 ، والوسيطة هي +4.
التغيير في حالات أكسدة العناصر حسب المجموعات النظام الدورييعكس تواتر تغييرهم الخواص الكيميائيةمع زيادة الرقم التسلسلي.
يستخدم مفهوم حالة أكسدة العناصر في تصنيف المواد ووصف خصائصها وصياغة المركبات وأسمائها الدولية. لكنها تستخدم على نطاق واسع بشكل خاص في دراسة تفاعلات الأكسدة والاختزال. غالبًا ما يستخدم مفهوم "حالة الأكسدة" في الكيمياء غير العضويةبدلاً من مفهوم "التكافؤ" (cf.
درس الفيديو 2: درجة أكسدة العناصر الكيميائية
درس الفيديو 3: التكافؤ. تعريف التكافؤ
محاضرة: كهرسلبية. حالة الأكسدة وتكافؤ العناصر الكيميائية
كهرسلبية
كهرسلبية- هذه هي قدرة الذرات على جذب إلكترونات الذرات الأخرى إلى نفسها للتواصل معها.
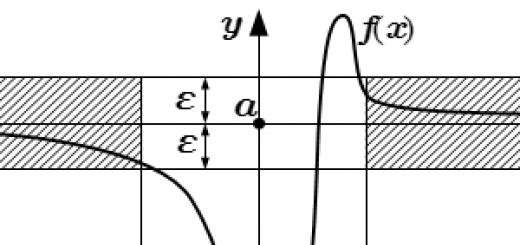
من السهل الحكم على كهرسلبية عنصر كيميائي من الجدول. تذكر ، في أحد دروسنا قيل إنه يزداد عند الانتقال من اليسار إلى اليمين عبر فترات في الجدول الدوري والانتقال من أسفل إلى أعلى في مجموعات.

على سبيل المثال ، بالنظر إلى مهمة تحديد أي عنصر من السلسلة المقترحة هو الأكثر كهرسلبية: C (كربون) ، N (نيتروجين) ، O (أكسجين) ، S (كبريت)؟ ننظر إلى الجدول ونجد أن هذا هو O ، لأنه على اليمين وفوق الباقي.
ما هي العوامل التي تؤثر على الكهربية؟ هذه:
- نصف قطر الذرة ، كلما كان أصغر ، زادت الكهربية.
- إن ملء غلاف التكافؤ بالإلكترونات ، فكلما زاد عددهم ، زادت القدرة الكهربية.
من بين جميع العناصر الكيميائية ، يعتبر الفلور هو الأكثر كهرسلبية ، لأنه يحتوي على نصف قطر ذري صغير و 7 إلكترونات في غلاف التكافؤ.
تشمل العناصر ذات القدرة الكهربية المنخفضة الفلزات الأرضية القلوية والقلوية. لديهم أنصاف أقطار كبيرة وعدد قليل جدًا من الإلكترونات في الغلاف الخارجي.
لا يمكن أن تكون قيم الكهربية للذرة ثابتة ، لأن يعتمد على العديد من العوامل ، بما في ذلك تلك المذكورة أعلاه ، وكذلك درجة الأكسدة ، والتي يمكن أن تختلف بالنسبة لنفس العنصر. لذلك ، من المعتاد التحدث عن نسبية قيم الكهربية. يمكنك استخدام المقاييس التالية:


ستحتاج إلى قيم كهرسلبية عند كتابة الصيغ للمركبات الثنائية المكونة من عنصرين. على سبيل المثال ، صيغة أكسيد النحاس هي Cu 2 O - يجب أن يكون العنصر الأول هو العنصر الذي تكون سلبيته الكهربية أقل.
في لحظة تكوين الرابطة الكيميائية ، إذا كان الاختلاف في الكهربية بين العناصر أكبر من 2.0 ، يتم تكوين رابطة تساهمية قطبية ، إذا كانت أقل ، رابطة أيونية.
حالة الأكسدة
حالة الأكسدة (كو)- هذه هي الشحنة المشروطة أو الحقيقية للذرة في المركب: شرطي - إذا كانت الرابطة قطبية تساهمية ، حقيقية - إذا كانت الرابطة أيونية.
تكتسب الذرة شحنة موجبة عندما تتبرع بالإلكترونات ، وشحنة سالبة عندما تستقبل الإلكترونات.
حالات الأكسدة مكتوبة فوق الرموز الموقعة «+»/«-» . هناك أيضًا شركات وسيطة. الحد الأقصى لثاني أكسيد الكربون للعنصر موجب ويساوي رقم المجموعة ، والحد الأدنى السلبي للمعادن هو صفر ، بالنسبة لغير المعادن = (رقم المجموعة - 8). العناصر ذات الحد الأقصى من ثاني أكسيد الكربون تقبل الإلكترونات فقط ، وبحد أدنى ، فإنها تتخلى عنها فقط. يمكن للعناصر التي تحتوي على COs وسيطة التبرع بالإلكترونات وقبولها.
ضع في اعتبارك بعض القواعد التي يجب اتباعها لتحديد CO:
يساوي أول أكسيد الكربون لجميع المواد البسيطة صفرًا.
مجموع كل ذرات ثاني أكسيد الكربون في الجزيء يساوي أيضًا صفرًا ، لأن أي جزيء متعادل كهربائيًا.
في المركبات ذات التساهمية الرابطة غير القطبيةثاني أكسيد الكربون هو صفر (O 2 0) ، ومع الرابطة الأيونية فإنه يساوي شحنات الأيونات (Na + Cl - CO صوديوم +1 ، كلور -1). تعتبر عناصر ثاني أكسيد الكربون للمركبات ذات الرابطة القطبية التساهمية كما هو الحال مع الرابطة الأيونية (H: Cl \ u003d H + Cl - ، ومن ثم H +1 Cl -1).
العناصر الموجودة في المركب التي لها أعلى كهرسلبية لها حالات أكسدة سالبة إذا كانت أقلها موجبة. بناءً على ذلك ، يمكننا أن نستنتج أن المعادن لها حالة أكسدة "+" فقط.
حالات الأكسدة المستمرة:
الهيدروجين +1. الاستثناء: هيدرات المعادن النشطة NaH ، CaH 2 ، وما إلى ذلك ، حيث تكون حالة أكسدة الهيدروجين –1.
الأكسجين -2. الاستثناء: F 2 -1 O +2 والبيروكسيدات التي تحتوي على مجموعة – О ، والتي تكون فيها حالة أكسدة الأكسجين –1.
معادن قلوية +1.
جميع معادن المجموعة الثانية +2. استثناء: Hg +1، +2.
المنيوم +3.
متى يتم تشكيلها الرابطة الأيونية، هناك انتقال معين للإلكترون ، من ذرة أقل كهرسلبية إلى ذرة ذات كهرسلبية أكبر. أيضًا ، في هذه العملية ، تفقد الذرات دائمًا حيادها الكهربائي وتتحول بعد ذلك إلى أيونات. تتشكل الشحنات الصحيحة بنفس الطريقة. عندما يتم تكوين رابطة قطبية تساهمية ، ينتقل الإلكترون جزئيًا فقط ، لذلك تنشأ الشحنات الجزئية.
التكافؤالتكافؤهي قدرة الذرات على تكوين n - العدد روابط كيميائيةمع ذرات العناصر الأخرى.
والتكافؤ هو قدرة الذرة على إبقاء الذرات الأخرى بالقرب منها. كما تعلم من دورة مدرسيةالكيمياء ، الذرات المختلفة ترتبط ببعضها البعض بواسطة إلكترونات مستوى الطاقة الخارجي. يسعى الإلكترون غير المزاوج إلى الحصول على زوج من ذرة أخرى. تسمى إلكترونات المستوى الخارجي إلكترونات التكافؤ. هذا يعني أنه يمكن تعريف التكافؤ أيضًا على أنه عدد أزواج الإلكترونات التي تربط الذرات ببعضها البعض. انظر إلى الصيغة الهيكلية للماء: H - O - N. كل اندفاعة هي زوج إلكترون ، مما يعني أنها تظهر التكافؤ ، أي يحتوي الأكسجين هنا على شرطتين ، مما يعني أنه ثنائي التكافؤ ، وتأتي شرطة واحدة من جزيئات الهيدروجين ، مما يعني أن الهيدروجين أحادي التكافؤ. عند الكتابة ، تتم الإشارة إلى التكافؤ بالأرقام الرومانية: O (II) ، H (I). يمكن أيضًا وضعه فوق عنصر.
التكافؤ إما ثابت أو متغير. على سبيل المثال ، في الفلزات القلوية ، يكون ثابتًا ويساوي I. لكن الكلور في المركبات المختلفة يظهر التكافؤ الأول والثالث والخامس والسابع.
كيف تحدد تكافؤ عنصر؟
دعنا ننتقل مرة أخرى إلى الجدول الدوري. تمتلك معادن المجموعات الفرعية الرئيسية تكافؤًا ثابتًا ، لذا فإن معادن المجموعة الأولى لها تكافؤ I ، والثاني من II. وبالنسبة لمعادن المجموعات الفرعية الثانوية ، يكون التكافؤ متغيرًا. كما أنه متغير لغير المعادن. أعلى تكافؤ للذرة يساوي رقم المجموعة ، وأدناها = رقم المجموعة - 8. صياغة مألوفة. هل هذا يعني أن التكافؤ يتزامن مع حالة الأكسدة. تذكر أن التكافؤ قد يتزامن مع درجة الأكسدة ، لكن هذه المؤشرات ليست متطابقة مع بعضها البعض. لا يمكن أن تحتوي التكافؤ على علامة = / - ولا يمكن أيضًا أن تكون صفرًا.
الطريقة الثانية لتحديد التكافؤ صيغة كيميائيةإذا كان التكافؤ الثابت لأحد العناصر معروفًا. على سبيل المثال ، خذ صيغة أكسيد النحاس: CuO. تكافؤ الأكسجين II. نرى أن هناك ذرة نحاس واحدة لكل ذرة أكسجين في هذه الصيغة ، مما يعني أن تكافؤ النحاس هو II. لنأخذ الآن صيغة أكثر تعقيدًا: Fe 2 O 3. تكافؤ ذرة الأكسجين هو II. توجد ثلاث ذرات من هذا القبيل هنا ، نضرب 2 * 3 \ u003d 6. وجدنا أن هناك 6 تكافؤ لذرتين من الحديد. لنكتشف تكافؤ ذرة حديد واحدة: 6: 2 = 3. لذا فإن تكافؤ الحديد هو III.
بالإضافة إلى ذلك ، عندما يكون من الضروري تقييم "الحد الأقصى من التكافؤ" ، يجب أن ينطلق المرء دائمًا من التكوين الإلكتروني الموجود في حالة "الإثارة".
| | |
الشحنة الرسمية للذرة في المركبات هي كمية مساعدة ، وعادة ما تستخدم في وصف خصائص العناصر في الكيمياء. هذه الشحنة الكهربائية الشرطية هي درجة الأكسدة. تتغير قيمته نتيجة للعديد من العمليات الكيميائية. على الرغم من أن الشحنة رسمية ، إلا أنها تميز خصائص وسلوك الذرات في تفاعلات الأكسدة والاختزال (ORDs).
الأكسدة والاختزال
في الماضي ، استخدم الكيميائيون مصطلح "الأكسدة" لوصف تفاعل الأكسجين مع العناصر الأخرى. يأتي اسم التفاعلات من الاسم اللاتيني للأكسجين - الأكسجين. في وقت لاحق اتضح أن العناصر الأخرى تتأكسد أيضًا. في هذه الحالة ، يتم استعادتها - يتم توصيل الإلكترونات. كل ذرة أثناء تكوين الجزيء تغير هيكل التكافؤ قذيفة الإلكترون. في هذه الحالة ، تظهر شحنة رسمية ، وتعتمد قيمتها على عدد الإلكترونات المعطاة أو المستلمة بشروط. لوصف هذه القيمة ، تم استخدام المصطلح الكيميائي الإنجليزي "رقم الأكسدة" سابقًا ، والذي يعني "رقم الأكسدة" في الترجمة. يعتمد استخدامه على افتراض أن الإلكترونات الرابطة في الجزيئات أو الأيونات تنتمي إلى الذرة ذات القدرة الكهربية الأعلى (EO). يتم التعبير عن القدرة على الاحتفاظ بالإلكترونات الخاصة بهم وجذبها من الذرات الأخرى بشكل جيد في اللافلزات القوية (الهالوجينات والأكسجين). المعادن القوية (الصوديوم والبوتاسيوم والليثيوم والكالسيوم وعناصر أخرى قلوية وقلوية أرضية) لها خصائص معاكسة.
تحديد درجة الأكسدة
حالة الأكسدة هي الشحنة التي ستكتسبها الذرة إذا تم تحويل الإلكترونات المشاركة في تكوين الرابطة تمامًا إلى عنصر كهرسلبي أكثر. هناك مواد لا تفعل ذلك التركيب الجزيئي(هاليدات الفلزات القلوية ومركبات أخرى). في هذه الحالات ، تتزامن حالة الأكسدة مع شحنة الأيون. تُظهر الشحنة الشرطية أو الحقيقية العملية التي حدثت قبل أن تكتسب الذرات حالتها الحالية. حالة الأكسدة الموجبة هي العدد الإجمالي للإلكترونات التي تمت إزالتها من الذرات. القيمة السالبة لحالة الأكسدة تساوي عدد الإلكترونات المكتسبة. من خلال تغيير حالة الأكسدة لعنصر كيميائي ، يحكم المرء على ما يحدث لذراته أثناء التفاعل (والعكس صحيح). يحدد لون المادة التغييرات التي حدثت في حالة الأكسدة. مركبات الكروم والحديد وعدد من العناصر الأخرى التي تظهر فيها تكافؤات مختلفة ملونة بشكل مختلف.
قيم حالة الأكسدة السلبية والصفر والإيجابية

تتكون المواد البسيطة من عناصر كيميائية بنفس قيمة EO. في هذه الحالة ، تنتمي الإلكترونات الرابطة إلى جميع الجسيمات الهيكلية بالتساوي. لذلك ، في المواد البسيطة ، لا تعتبر حالة الأكسدة (H 0 2 ، O 0 2 ، C 0) من سمات العناصر. عندما تقبل الذرات الإلكترونات أو تتحرك السحابة العامة في اتجاهها ، فمن المعتاد كتابة الشحنات بعلامة ناقص. على سبيل المثال ، F -1 ، O -2 ، C -4. من خلال التبرع بالإلكترونات ، تكتسب الذرات شحنة موجبة حقيقية أو رسمية. في أكسيد 2 ، تتبرع ذرة الأكسجين بإلكترون واحد لكل ذرتين من الفلور وتكون في حالة أكسدة O +2. من المعتقد أنه في جزيء أو أيون متعدد الذرات ، تتلقى الذرات الكهربية كل الإلكترونات الملزمة.
الكبريت هو عنصر يظهر التكافؤات المختلفة وحالات الأكسدة.
غالبًا ما تظهر العناصر الكيميائية للمجموعات الفرعية الرئيسية تكافؤًا أقل يساوي VIII. على سبيل المثال ، تكافؤ الكبريت في كبريتيد الهيدروجين وكبريتيدات المعدن هو II. يتميز العنصر بالتكافؤات المتوسطة والعالية في الحالة المثارة ، عندما تتخلى الذرة عن واحد أو اثنين أو أربعة أو كل الإلكترونات الستة وتعرض التكافؤ الأول والثاني والرابع والسادس على التوالي. نفس القيم ، فقط بعلامة ناقص أو علامة زائد ، لها حالات أكسدة الكبريت:
- في كبريتيد الفلور يعطي إلكترونًا واحدًا: -1 ؛
- أدنى قيمة في كبريتيد الهيدروجين: -2 ؛
- في الحالة المتوسطة لثاني أكسيد: +4 ؛
- في ثلاثي أكسيد ، حامض الكبريتيك والكبريتات: +6.
في أعلى حالة أكسدة ، لا يقبل الكبريت إلا الإلكترونات ؛ وفي أدنى حالة له ، فإنه يُظهر خصائص اختزال قوية. يمكن أن تعمل ذرات S +4 كعوامل مختزلة أو مؤكسدة في المركبات ، حسب الظروف.

نقل الإلكترونات في التفاعلات الكيميائية
عندما تتشكل البلورة ملح الطعاميتبرع الصوديوم بالإلكترونات إلى الكلور الأكثر كهرسلبية. تتطابق حالات أكسدة العناصر مع شحنات الأيونات: Na +1 Cl -1. بالنسبة للجزيئات التي تم إنشاؤها عن طريق التنشئة الاجتماعية وإزاحة أزواج الإلكترون إلى ذرة أكثر كهرسلبية ، فإن مفهوم الشحنة الرسمية فقط هو القابل للتطبيق. ولكن يمكن افتراض أن جميع المركبات تتكون من أيونات. ثم تكتسب الذرات ، عن طريق جذب الإلكترونات ، شحنة سالبة مشروطة ، ومن خلال التخلي عنها ، تكتسب شحنة موجبة. في ردود الفعل ، وضح عدد الإلكترونات التي يتم تهجيرها. على سبيل المثال ، في جزيء ثاني أكسيد الكربون C +4 O - 2 2 ، يعرض الفهرس المشار إليه في الزاوية اليمنى العليا من الرمز الكيميائي للكربون عدد الإلكترونات التي تمت إزالتها من الذرة. الأكسجين في هذه المادة له حالة أكسدة -2. الفهرس المقابل عندما علامة كيميائية O هو عدد الإلكترونات المضافة في الذرة.

كيفية حساب حالات الأكسدة
قد يستغرق حساب عدد الإلكترونات التي تم التبرع بها وإضافتها بواسطة الذرات وقتًا طويلاً. القواعد التالية تجعل هذه المهمة أسهل:
- في المواد البسيطة ، حالات الأكسدة هي صفر.
- مجموع أكسدة جميع الذرات أو الأيونات في مادة محايدة هو صفر.
- في أيون معقد ، يجب أن يتوافق مجموع حالات الأكسدة لجميع العناصر مع شحنة الجسيم بأكمله.
- تكتسب الذرة الأكثر كهرسلبية حالة أكسدة سالبة ، والتي تكتب بعلامة ناقص.
- تتلقى العناصر الكهربية الأقل حالات أكسدة موجبة ، وتتم كتابتها بعلامة زائد.
- يُظهر الأكسجين عمومًا حالة أكسدة تبلغ -2.
- بالنسبة للهيدروجين ، القيمة المميزة هي: +1 ، يحدث في هيدرات المعادن: H-1.
- الفلور هو أكثر العناصر كهربيًا ، ودائمًا ما تكون حالة الأكسدة فيه -4.
- بالنسبة لمعظم المعادن ، فإن أرقام الأكسدة والتكافؤ هي نفسها.

حالة الأكسدة والتكافؤ
تتشكل معظم المركبات نتيجة لعمليات الأكسدة والاختزال. يؤدي انتقال أو إزاحة الإلكترونات من عنصر إلى آخر إلى تغيير في حالة الأكسدة والتكافؤ. غالبًا ما تتطابق هذه القيم. كمرادف لمصطلح "حالة الأكسدة" ، يمكن استخدام عبارة "التكافؤ الكهروكيميائي". ولكن هناك استثناءات ، على سبيل المثال ، في أيون الأمونيوم ، يكون النيتروجين رباعي التكافؤ. في نفس الوقت ، تكون ذرة هذا العنصر في حالة الأكسدة -3. في المواد العضوية ، يكون الكربون دائمًا رباعي التكافؤ ، لكن حالات أكسدة ذرة الكربون في الميثان CH 4 ، والكحول الفورمي CH 3 OH وحمض HCOOH لها قيم مختلفة: -4 و -2 و +2.
تفاعلات الأكسدة والاختزال

تشمل عمليات الأكسدة والاختزال العديد من العمليات الأكثر أهمية في الصناعة ، والتكنولوجيا ، والطبيعة الحية وغير الحية: الاحتراق ، والتآكل ، والتخمير ، والتنفس داخل الخلايا ، والتمثيل الضوئي ، وظواهر أخرى.
عند تجميع معادلات OVR ، يتم تحديد المعاملات باستخدام طريقة التوازن الإلكتروني ، والتي يتم فيها تشغيل الفئات التالية:
- الأكسدة؛
- عامل الاختزال يتبرع بالإلكترونات ويتأكسد ؛
- العامل المؤكسد يقبل الإلكترونات ويتم تقليله ؛
- يجب أن يكون عدد الإلكترونات المعطاة مساويًا لعدد الإلكترونات المتصلة.
يؤدي اكتساب الذرة للإلكترونات إلى انخفاض حالة الأكسدة (الاختزال). يصاحب فقدان ذرة إلكترون واحد أو أكثر زيادة في عدد أكسدة العنصر نتيجة للتفاعلات. بالنسبة للإجمالي الذي يتدفق بين أيونات الإلكتروليتات القوية في محاليل مائية، في كثير من الأحيان لا يستخدمون الميزان الإلكتروني ، ولكن طريقة نصف ردود الفعل.