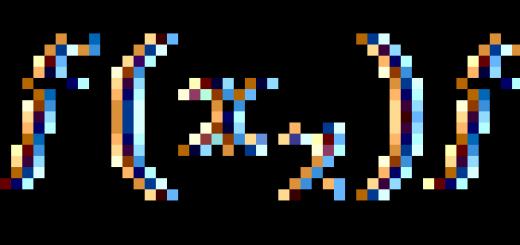Vorlesung: Substanzen molekularer und nichtmolekularer Struktur. Art des Kristallgitters. Die Abhängigkeit der Eigenschaften von Stoffen von ihrer Zusammensetzung und Struktur
Molekulare und nichtmolekulare Substanzen
Nach Struktur Chemikalien werden in zwei Gruppen unterteilt: diejenigen, die aus Molekülen bestehen, werden genannt molekular, und enthält Atome und Ionen - nicht molekular.
Molekulare Substanzen haben niedrige Schmelz-/Siedepunkte. Sie können in drei Aggregatzuständen vorliegen: flüssig, fest, gasförmig. Diese Gruppe umfasst die meisten einfache Substanzen Nichtmetalle sowie deren Verbindungen untereinander. Die Bindungen zwischen Atomen molekularer Substanzen sind kovalent.
Nichtmolekulare Substanzen haben hohe Schmelz-/Siedepunkte. Sie befinden sich im festen Zustand. Dies sind, Sie haben es erraten, einfache Substanzen - Metalle, ihre Verbindungen mit Nichtmetallen, Nichtmetalle umfassen Bor, Kohlenstoff - Diamant, Phosphor (schwarz und rot), Silizium. Nichtmolekulare Substanzen bilden ionische, atomare, molekulare Kristalle, deren Teilchenanordnung eine klare Abfolge hat und ein Gitter bildet.
Arten von Kristallgittern
Abhängig von der Art der Teilchen, die sich auf den Gitterplätzen befinden, gibt es vier Arten von Kristallgittern:

1) Ionischdas Kristallgitter ist charakteristisch für Verbindungen mit ionischer chemischer Bindung. An den Gitterplätzen befinden sich Kationen und Anionen. Beispiele für Substanzen mit einem solchen Kristallgitter sind Salze, Oxide und Hydroxide typischer Metalle. Dies sind harte, aber spröde Substanzen. Sie haben eine Zähigkeit. Sie lösen sich in Wasser auf und sind elektrisch leitfähig.

2) Nuklear Das Gitter hat Atome an seinen Knoten. Die Partikel bilden kovalente unpolare und polare Bindungen. Von den einfachen Substanzen gehört diese Art von Kristallgitter zu Kohlenstoff im Zustand von Graphit und Diamant, Bor, Silizium und Germanium. Aus komplexe Substanzen Atomgitter besitzen beispielsweise Siliziumoxid (Quarz, Bergkristall). Dies sind sehr harte feuerfeste Substanzen, die in der Natur nicht weit verbreitet sind. Nicht in Wasser auflösen.

3) Molekular Das Kristallgitter wird von Molekülen gebildet, die durch schwache intermolekulare Anziehungskräfte zusammengehalten werden. Substanzen dieses Gittertyps zeichnen sich daher durch geringe Härte, Zerbrechlichkeit und niedrige Schmelztemperaturen aus. Zum Beispiel ist es Wasser in einem eisigen Zustand. Am solidesten organische Verbindungen haben diese Art von Gitter. Der Bindungstyp in der Verbindung ist kovalent.
Molekulare und nichtmolekulare Struktur von Substanzen. Die Struktur der Materie

BEIM chemische Wechselwirkungen nicht einzelne Atome oder Moleküle treten ein, sondern Substanzen. Stoffe werden nach der Art der Bindung unterschieden molekular und nichtmolekulare Struktur. Aus Molekülen aufgebaute Substanzen werden genannt molekulare Substanzen. Die Bindungen zwischen Molekülen in solchen Substanzen sind sehr schwach, viel schwächer als zwischen Atomen innerhalb eines Moleküls, und sie brechen bereits bei relativ niedrigen Temperaturen - die Substanz wird flüssig und dann gasförmig (Jodsublimation). Die Schmelz- und Siedepunkte von Stoffen, die aus Molekülen bestehen, steigen mit zunehmender Höhe an Molekulargewicht. Zu molekulare Substanzen umfassen Substanzen mit atomarer Struktur (C, Si, Li, Na, K, Cu, Fe, W), darunter Metalle und Nichtmetalle. Zu Substanzen nichtmolekulare Struktur umfassen ionische Verbindungen. Die meisten Verbindungen von Metallen mit Nichtmetallen haben diese Struktur: alle Salze (NaCl, K 2 SO 4), einige Hydride (LiH) und Oxide (CaO, MgO, FeO), Basen (NaOH, KOH). Ionische (nicht molekulare) Substanzen haben hohe Schmelz- und Siedepunkte.

Feststoffe: amorph und kristallin
Feststoffe werden unterteilt in kristallin und amorph.
Amorphe Substanzen haben keinen klaren Schmelzpunkt - beim Erhitzen werden sie allmählich weicher und werden flüssig. Im amorphen Zustand befinden sich beispielsweise Plastilin und verschiedene Harze.
Kristalline Substanzen charakterisiert richtigen Standort jene Teilchen, aus denen sie bestehen: Atome, Moleküle und Ionen - an genau definierten Punkten im Raum. Wenn diese Punkte durch gerade Linien verbunden werden, entsteht ein räumlicher Rahmen, der als Kristallgitter bezeichnet wird. Die Punkte, an denen sich Kristallteilchen befinden, werden Gitterknoten genannt. Abhängig von der Art der Teilchen, die sich an den Knoten des Kristallgitters befinden, und der Art der Verbindung zwischen ihnen werden vier Arten von Kristallgittern unterschieden: ionische, atomare, molekulare und metallische.
Kristallgitter werden als ionisch bezeichnet, an deren Stellen sich Ionen befinden. Sie werden von Substanzen mit einer Ionenbindung gebildet, die sowohl mit einfachen Ionen Na +, Cl - als auch mit komplexen SO 4 2-, OH - assoziiert sein kann. Folglich haben Salze, einige Oxide und Hydroxide von Metallen Ionenkristallgitter. Beispielsweise ist ein Natriumchloridkristall aus abwechselnd positiven Na + - und negativen Cl – -Ionen aufgebaut, die ein würfelförmiges Gitter bilden. Die Bindungen zwischen Ionen in einem solchen Kristall sind sehr stabil. Substanzen mit einem Ionengitter zeichnen sich daher durch eine relativ hohe Härte und Festigkeit aus, sie sind feuerfest und nicht flüchtig.
Kristallgitter - a) und amorphes Gitter - b).
 Kristallgitter - a) und amorphes Gitter - b).
Kristallgitter - a) und amorphes Gitter - b). Atomare Kristallgitter
nuklear sogenannte Kristallgitter, in deren Knoten sich einzelne Atome befinden. In solchen Gittern sind Atome miteinander verbunden sehr starke kovalente Bindungen. Ein Beispiel für Substanzen mit einem solchen Kristallgitter ist Diamant, eine der allotropen Modifikationen des Kohlenstoffs. Die meisten Substanzen mit einem atomaren Kristallgitter haben sehr hohe Schmelzpunkte (zum Beispiel in Diamant sind es über 3500 ° C), sie sind fest und hart, praktisch unlöslich.


Molekulare Kristallgitter
Molekular sogenannte Kristallgitter, an deren Knoten sich Moleküle befinden. Chemische Bindungen in diesen Molekülen können sowohl polar (HCl, H 2 O) als auch unpolar (N 2 , O 2) sein. Trotz der Tatsache, dass Atome innerhalb von Molekülen durch sehr starke kovalente Bindungen gebunden sind, Zwischen den Molekülen selbst wirken schwache intermolekulare Anziehungskräfte. Daher haben Substanzen mit molekularen Kristallgittern eine geringe Härte, niedrige Schmelzpunkte und sind flüchtig. Die meisten festen organischen Verbindungen haben molekulare Kristallgitter (Naphthalin, Glucose, Zucker).
 Molekulares Kristallgitter ( Kohlendioxid)
Molekulares Kristallgitter ( Kohlendioxid)
Metallische Kristallgitter
Substanzen mit metallische Bindung haben metallische Kristallgitter. An den Knoten solcher Gitter befinden sich Atome und Ionen(entweder Atome oder Ionen, in die sich Metallatome leicht verwandeln und ihre Außenelektronen „zur allgemeinen Verwendung“ abgeben). Eine solche innere Struktur von Metallen bestimmt ihre charakteristischen physikalischen Eigenschaften: Verformbarkeit, Plastizität, elektrische und thermische Leitfähigkeit und einen charakteristischen metallischen Glanz.

Spickzettel


Unter der chemischen Struktur (Struktur) versteht man die räumliche Anordnung der Atome, aus denen das Molekül besteht, und die Arten der chemischen Bindungen zwischen ihnen. Der Schöpfer der Theorie der Struktur organischer Verbindungen A.M. Butlerow (1828–1886). Kurz gesagt, die Hauptbestimmungen von Butlerovs Theorie können wie folgt formuliert werden:
1) Chemische Eigenschaften organische Verbindungen werden weniger durch ihre Zusammensetzung als durch ihre Struktur bestimmt;
2) verschiedene Atome und Atomgruppen in einem organischen Molekül beeinflussen sich gegenseitig;
3) Die chemische Struktur eines Moleküls kann durch nur eine Formel dargestellt werden, die alle chemischen Eigenschaften einer bestimmten Substanz ausdrückt.
1.4. Isomere. Arten von Isomerie
Isomerie- das Phänomen der Existenz mehrerer Substanzen mit derselben elementaren Zusammensetzung und demselben Molekulargewicht.
Isomere– Moleküle die gleiche Zusammensetzung, aber unterschiedlicher Struktur und dementsprechend mit unterschiedlichen Eigenschaften.
Ein Beispiel für die Abhängigkeit der Eigenschaften von Stoffen von ihrer chemischen Struktur ist in Tabelle angegeben. 2.
Tabelle 2
Abhängigkeit der Eigenschaften von der chemischen Struktur
Diese beiden Substanzisomere haben auch stark unterschiedliche biologische Wirkungen auf Organismen.
Der Begriff „Struktur“ umfasst drei Aspekte:
(SONDERN) Chemisch Struktur– Art und Reihenfolge der Atomwechsel in einem Molekül;
(B) Elektronische Struktur– Art der chemischen Bindungen zwischen Atomen (–; =; );
(BEIM) Räumliche Struktur- die Art der gegenseitigen Anordnung von Atomen relativ zueinander im Raum.
Dementsprechend gibt es drei Gruppen von Isomeriequellen.
Ein Unterschied chemische Struktur:
Isomerie des C-Skeletts
(a) (b) 


n-Butan

 Isobutan Cyclopentan Methyl-c-butan
Isobutan Cyclopentan Methyl-c-butan
Unterschiedliche Positionen funktioneller Gruppen


OH [Propanol-1] OH [Propanol-2]
Verschiedene funktionelle Gruppen (Metamerie)
Isomere 



Säure]Aminoessigsäure]
Siehe auch ein Beispiel aus Tabelle. 2.
B) Der Unterschied in der elektronischen Struktur:
Verschiedene Arten und Positionen von Mehrfachbindungen
(Isomere 

[Butadien-1,3] [Butin-1] [Butin-2]
Gewöhnliche Strukturformeln spiegeln nur diese beiden (A und B) Aspekte der Struktur von Molekülen wider.
C) RÄUMLICHE ISOMERIE (oder Stereoisomerie):
Solche Isomere haben die gleiche Bindungsordnung zwischen Atomen, unterscheiden sich jedoch in der räumlichen Anordnung ihrer konstituierenden Atome oder Atomgruppen. Spezielle Techniken werden verwendet, um die räumliche Struktur zu zeigen.
Diese beinhalten:
(5) Cis-trans-Isomerie- unterschiedliche Anordnung der Atome relativ zur Doppelbindung (a) oder zur Ringebene (b):
Beispiel (a) – Stereoisomere von Buten-2:


[cis-Buten-2] [trans-Buten-2]
Beispiel (b) – Stereoisomere:

cis-Form trans-Form
(6) Optische (Spiegel-)Isomerie
Dieses Phänomen ist auf das Vorhandensein von asymmetrischen Kohlenstoffatomen in den Molekülen zurückzuführen; in den Abschnitten „Hydroxysäuren“ und „Kohlenhydrate“ besprochen.
(7) Konformationsisomerie
Die meisten Stoffe zeichnen sich dadurch aus, dass sie je nach Bedingungen einen von drei Aggregatzuständen annehmen können: fest, flüssig oder gasförmig.
Beispielsweise ist Wasser bei Normaldruck im Temperaturbereich von 0-100 o C eine Flüssigkeit, bei Temperaturen über 100 o C kann es nur noch gasförmig vorliegen und bei Temperaturen unter 0 o C ist es ein Feststoff.
Bei Stoffen im festen Zustand wird zwischen amorph und kristallin unterschieden.
Charakteristische Eigenschaften amorphe Substanzen ist das Fehlen eines klaren Schmelzpunkts: Ihre Fließfähigkeit nimmt mit zunehmender Temperatur allmählich zu. Zu den amorphen Substanzen gehören Verbindungen wie Wachs, Paraffin, die meisten Kunststoffe, Glas usw.
Dennoch haben kristalline Substanzen einen bestimmten Schmelzpunkt, d.h. Ein Stoff mit kristalliner Struktur geht nicht allmählich, sondern abrupt von einem festen in einen flüssigen Zustand über, wenn eine bestimmte Temperatur erreicht wird. Beispiele für kristalline Substanzen sind Kochsalz, Zucker, Eis.
Unterschied in physikalische Eigenschaften amorphe und kristalline Feststoffe ist in erster Linie auf die strukturellen Merkmale solcher Substanzen zurückzuführen. Was der Unterschied zwischen einer Substanz in einem amorphen und einem kristallinen Zustand ist, lässt sich am einfachsten anhand der folgenden Abbildung verstehen:
Wie Sie sehen können, gibt es in einer amorphen Substanz im Gegensatz zu einer kristallinen keine Ordnung in der Anordnung der Teilchen. Wenn man in einer kristallinen Substanz zwei nahe beieinander liegende Atome gedanklich mit einer geraden Linie verbindet, dann kann man feststellen, dass auf dieser Linie in genau definierten Abständen dieselben Teilchen liegen:
So kann man bei kristallinen Stoffen von einem solchen Begriff als Kristallgitter sprechen.
Kristallgitter wird als räumlicher Rahmen bezeichnet, der die Punkte des Raums verbindet, in denen sich Teilchen befinden, die einen Kristall bilden.
Die Punkte im Raum, an denen sich die Teilchen befinden, die den Kristall bilden, werden genannt Gitterknoten .
Je nachdem, welche Teilchen sich in den Knoten des Kristallgitters befinden, gibt es: molekular, atomar, ionisch und Kristallgitter aus Metall .
in Knoten Molekulares Kristallgitter
Das Kristallgitter von Eis als Beispiel eines MolekülgittersEs gibt Moleküle, in denen die Atome durch starke kovalente Bindungen gebunden sind, aber die Moleküle selbst durch schwache intermolekulare Kräfte nahe beieinander gehalten werden. Aufgrund solch schwacher intermolekularer Wechselwirkungen sind Kristalle mit einem Molekülgitter zerbrechlich. Solche Stoffe unterscheiden sich von Stoffen mit anderen Strukturtypen durch deutlich niedrigere Schmelz- und Siedepunkte, leiten nicht elektrischer Strom, können sich in verschiedenen Lösungsmitteln auflösen oder nicht. Lösungen solcher Verbindungen können je nach Klasse der Verbindung elektrisch leiten oder nicht. Verbindungen mit einem molekularen Kristallgitter umfassen viele einfache Substanzen - Nichtmetalle (gehärtetes H 2, O 2, Cl 2, rhombischer Schwefel S 8, weißer Phosphor P 4) sowie viele komplexe Substanzen - Wasserstoffverbindungen Nichtmetalle, Säuren, Nichtmetalloxide, die meisten organische Materie. Es sollte beachtet werden, dass es unangebracht ist, über das molekulare Kristallgitter zu sprechen, wenn sich die Substanz in einem gasförmigen oder flüssigen Zustand befindet: Es ist richtiger, den Begriff - den molekularen Strukturtyp - zu verwenden.
Das Kristallgitter von Diamant als Beispiel eines Atomgittersin Knoten Atomkristallgitter
es gibt Atome. Dabei werden alle Knoten eines solchen Kristallgitters durch starke kovalente Bindungen zu einem Einkristall miteinander "vernetzt". Tatsächlich ist ein solcher Kristall ein riesiges Molekül. Alle Substanzen mit einem atomaren Kristallgitter sind aufgrund ihrer Strukturmerkmale fest, haben einen hohen Schmelzpunkt, sind chemisch inaktiv, weder in Wasser noch in organischen Lösungsmitteln löslich und ihre Schmelzen leiten keinen elektrischen Strom. Es sei daran erinnert, dass Substanzen mit einer atomaren Struktur aus einfachen Substanzen Bor B, Kohlenstoff C (Diamant und Graphit), Silizium Si aus komplexen Substanzen umfassen - Siliziumdioxid SiO 2 (Quarz), Siliziumkarbid SiC, Bornitrid BN.
Für Substanzen mit ionisches Kristallgitter
an den Gitterplätzen befinden sich Ionen, die miteinander durch verbunden sind ionische Bindungen.
Da Ionenbindungen stark genug sind, haben Substanzen mit einem Ionengitter eine relativ hohe Härte und Feuerfestigkeit. Meistens sind sie wasserlöslich und ihre Lösungen leiten wie Schmelzen Strom.
Substanzen mit einem Kristallgitter vom ionischen Typ umfassen Metall- und Ammoniumsalze (NH 4 +), Basen, Metalloxide. Ein wahres Zeichen für die Ionenstruktur einer Substanz ist das Vorhandensein beider Atome in ihrer Zusammensetzung typisches Metall und Nichtmetall.
 Das Kristallgitter von Natriumchlorid als Beispiel für ein Ionengitter
Das Kristallgitter von Natriumchlorid als Beispiel für ein Ionengitter
beobachtet in Kristallen freier Metalle, zum Beispiel Natrium Na, Eisen Fe, Magnesium Mg usw. Bei einem Metallkristallgitter befinden sich an seinen Knoten Kationen und Metallatome, zwischen denen sich Elektronen bewegen. In diesem Fall lagern sich bewegende Elektronen periodisch an Kationen an und neutralisieren so ihre Ladung, und einzelne neutrale Metallatome „geben“ stattdessen einen Teil ihrer Elektronen ab und verwandeln sich wiederum in Kationen. Tatsächlich gehören „freie“ Elektronen nicht zu einzelnen Atomen, sondern zum gesamten Kristall.
Solche Strukturmerkmale führen dazu, dass Metalle Wärme und elektrischen Strom gut leiten, oft eine hohe Duktilität (Duktilität) aufweisen.
Die Streuung bei den Werten der Schmelztemperaturen von Metallen ist sehr groß. So beträgt beispielsweise der Schmelzpunkt von Quecksilber ungefähr minus 39 ° C (unter normalen Bedingungen flüssig) und Wolfram - 3422 ° C. Es sollte beachtet werden, dass unter normalen Bedingungen alle Metalle außer Quecksilber Feststoffe sind.
Themen Kodifikator VERWENDEN: Substanzen molekularer und nichtmolekularer Struktur. Art des Kristallgitters. Die Abhängigkeit der Eigenschaften von Stoffen von ihrer Zusammensetzung und Struktur.
Molekularkinetische Theorie
Alle Moleküle bestehen aus winzigen Teilchen, die Atome genannt werden. Alle derzeit entdeckten Atome sind im Periodensystem gesammelt.
Atom ist das kleinste, chemisch unteilbare Teilchen eines Stoffes, das seine chemischen Eigenschaften behält. Atome verbinden sich miteinander chemische Bindungen. Wir haben zuvor überlegt, a. Studieren Sie unbedingt die Theorie zum Thema: Arten chemischer Bindungen, bevor Sie diesen Artikel studieren!
Schauen wir uns nun an, wie sich Teilchen in Materie verbinden können.
Je nach Lage der Partikel zueinander können die Eigenschaften der von ihnen gebildeten Substanzen stark variieren. Also, wenn die Teilchen voneinander entfernt sind weit(der Abstand zwischen den Partikeln ist viel größer als die Größe der Partikel selbst), sie interagieren praktisch nicht miteinander, sie bewegen sich zufällig und kontinuierlich im Raum, dann haben wir es zu tun Gas .
Wenn die Partikel lokalisiert sind schließen miteinander, aber chaotisch, mehr miteinander interagieren, intensiv machen oszillierende Bewegungen an einer Position, kann aber an eine andere Position springen, dann ist dies ein Modell der Struktur Flüssigkeiten .
Wenn die Partikel lokalisiert sind schließen miteinander, aber mehr ordentlich, und mehr interagieren untereinander, sondern bewegen sich nur innerhalb einer Gleichgewichtslage, praktisch ohne sich in eine andere zu bewegen Position, mit der wir es zu tun haben fest .

Die meisten bekannten Chemikalien und Mischungen können in fester, flüssiger und gasförmige Zustände. Das einfachste Beispiel ist Wasser. Unter normalen Bedingungen ist es flüssig, bei 0 o C gefriert es - es geht vom flüssigen Zustand in über fest, und bei 100 ° C kocht es - geht hinein Gasphase- Wasserdampf. Gleichzeitig sind viele Stoffe unter Normalbedingungen Gase, Flüssigkeiten oder Feststoffe. Beispielsweise ist Luft, ein Gemisch aus Stickstoff und Sauerstoff, unter normalen Bedingungen ein Gas. Aber bei hoher Druck und niedriger Temperatur kondensieren Stickstoff und Sauerstoff und gehen in die flüssige Phase über. Flüssiger Stickstoff wird in der Industrie aktiv eingesetzt. Manchmal isoliert Plasma, und auch Flüssigkristalle, als getrennte Phasen.

Viele Eigenschaften einzelner Stoffe und Gemische werden erklärt gegenseitige Übereinkunft Teilchen im Raum relativ zueinander!
Dieser Artikel berücksichtigt Eigenschaften Feststoffe , abhängig von ihrer Struktur. Grundlegende physikalische Eigenschaften von Feststoffen: Schmelzpunkt, elektrische Leitfähigkeit, Wärmeleitfähigkeit, mechanische Festigkeit, Plastizität usw.
Schmelztemperatur
ist die Temperatur, bei der ein Stoff von fest zu flüssig und umgekehrt übergeht.
ist die Fähigkeit eines Stoffes, sich zu verformen, ohne zu brechen.

Elektrische Leitfähigkeit ist die Fähigkeit eines Stoffes, Strom zu leiten.
Strom ist die geordnete Bewegung geladener Teilchen. Strom kann also nur von Stoffen geleitet werden, in denen er vorhanden ist bewegte geladene Teilchen. Je nach Stromleitfähigkeit werden Stoffe in Leiter und Dielektrika eingeteilt. Leiter sind Substanzen, die Strom leiten können (d. h. bewegliche geladene Teilchen enthalten). Dielektrika sind Stoffe, die Strom praktisch nicht leiten.

In einem Festkörper können sich die Teilchen eines Stoffes befinden chaotisch, oder geordneterÜber. Wenn sich die Teilchen eines Festkörpers im Raum befinden chaotisch, heißt die Substanz amorph. Beispiele für amorphe Substanzen - Kohle, Glimmerglas.

Sind die Teilchen eines Festkörpers geordnet im Raum angeordnet, d.h. sich wiederholende dreidimensionale geometrische Strukturen bilden, wird eine solche Substanz genannt Kristall, und die Struktur selbst Kristallgitter . Die meisten uns bekannten Substanzen sind Kristalle. Die Partikel selbst befinden sich in Knoten Kristallgitter.
Kristalline Substanzen zeichnen sich insbesondere dadurch aus Art der chemischen Bindung zwischen Partikeln in einem Kristall - atomar, molekular, metallisch, ionisch; An Geometrische Figur die einfachste Zelle des Kristallgitters - kubisch, sechseckig usw.
Abhängig von Art von Partikeln, die ein Kristallgitter bilden , unterscheiden atomare, molekulare, ionische und metallische Kristallstruktur .
Atomares Kristallgitter

Ein atomares Kristallgitter wird gebildet, wenn es vorhanden ist Atome. Atome sind miteinander verbunden kovalente chemische Bindungen. Dementsprechend wird ein solches Kristallgitter sehr sein dauerhaft, es ist nicht leicht, es zu zerstören. Ein atomares Kristallgitter kann von Atomen mit hoher Wertigkeit gebildet werden, d.h. mit eine große Anzahl Bindungen mit benachbarten Atomen (4 oder mehr). Dies sind in der Regel Nichtmetalle: einfache Stoffe - Silizium, Bor, Kohlenstoff (allotrope Modifikationen von Diamant, Graphit) und deren Verbindungen (Borkohlenstoff, Silizium(IV)oxid usw..). Da zwischen Nichtmetallen eine überwiegend kovalente chemische Bindung auftritt, freie Elektronen(sowie andere geladene Teilchen) in Substanzen mit einem atomaren Kristallgitter in den meisten Fällen nein. Daher sind diese Substanzen in der Regel leiten Strom sehr schlecht, d.h. sind Dielektrika. Dies sind allgemeine Muster, von denen es eine Reihe von Ausnahmen gibt.

Kommunikation zwischen Teilchen in atomaren Kristallen: .
An den Knoten des Kristalls mit Atomkristallstruktur angeordnet Atome.
Phasenzustand Atomkristalle unter Normalbedingungen: in der Regel Feststoffe .
Substanzen, die im Festkörper atomare Kristalle bilden:
- Einfache Substanzen hohe Wertigkeit (befindet sich in der Mitte des Periodensystems): Bor, Kohlenstoff, Silizium usw.
- Komplexe Substanzen, die von diesen Nichtmetallen gebildet werden: Kieselsäure (Siliziumoxid, Quarzsand) SiO 2 ; Siliziumkarbid (Korund) SiC; Borcarbid, Bornitrid usw.
Physikalische Eigenschaften von Stoffen mit Atomkristallgitter:
— Stärke;
- Feuerfestigkeit (hoher Schmelzpunkt);
- geringe elektrische Leitfähigkeit;
- geringe Wärmeleitfähigkeit;
— chemische Trägheit (inaktive Substanzen);
- Unlöslichkeit in Lösungsmitteln.

Molekulares Kristallgitter ist ein Gitter, dessen Knoten sind Moleküle. halten die Moleküle im Kristall schwache zwischenmolekulare Anziehungskräfte (Van-der-Waals-Kräfte, Wasserstoffbrückenbindungen oder elektrostatische Anziehung). Dementsprechend ist ein solches Kristallgitter in der Regel ziemlich leicht zu zerstören. Substanzen mit einem molekularen Kristallgitter - dünn, zerbrechlich. Je größer die Anziehungskraft zwischen Molekülen ist, desto höher ist der Schmelzpunkt der Substanz. In der Regel liegen die Schmelzpunkte von Substanzen mit molekularem Kristallgitter nicht höher als 200-300 K. Daher liegen unter normalen Bedingungen die meisten Substanzen mit einem molekularen Kristallgitter in der Form vor Gase oder Flüssigkeiten. Das Molekülkristallgitter wird in der Regel in fester Form von Säuren, Oxiden von Nichtmetallen, anderen binären Verbindungen von Nichtmetallen, einfachen Substanzen, die stabile Moleküle bilden (Sauerstoff O 2, Stickstoff N 2, Wasser H 2 O , usw.), organische Substanzen. In der Regel handelt es sich dabei um Substanzen mit einer kovalenten polaren (selten unpolaren) Bindung. weil Elektronen sind an chemischen Bindungen beteiligt, Substanzen mit einem molekularen Kristallgitter - Dielektrika, schlechte Wärmeleiter.

Kommunikation zwischen Teilchen in Molekülkristallen: m intermolekulare, elektrostatische oder intermolekulare Anziehungskräfte.
An den Knoten des Kristalls mit molekularer Kristallstruktur angeordnet Moleküle.
Phasenzustand Molekülkristalle unter Normalbedingungen: Gase, Flüssigkeiten und Feststoffe.
Substanzen, die sich im festen Zustand bilden molekulare Kristalle:
- Einfache nichtmetallische Substanzen, die kleine, starke Moleküle bilden (O 2 , N 2 , H 2 , S 8 und andere);
- Komplexe Substanzen (Verbindungen von Nichtmetallen) mit kovalenten polaren Bindungen (mit Ausnahme von Oxiden von Silizium und Bor, Verbindungen von Silizium und Kohlenstoff) - Wasser H 2 O, Schwefeloxid SO 3 usw.
- Einatomige Edelgase (Helium, Neon, Argon, Krypton usw.);
- Die meisten organischen Substanzen, die keine ionischen Bindungen haben — Methan CH 4, Benzol C 6 H 6 usw.
Physikalische Eigenschaften Substanzen mit molekularem Kristallgitter:
- Schmelzbarkeit ( niedrige Temperatur schmelzen):
— hohe Kompressibilität;
- Molekülkristalle in fester Form sowie in Lösungen und Schmelzen leiten keinen Strom;
- Phasenzustand unter Normalbedingungen - Gase, Flüssigkeiten, Feststoffe;
— hohe Volatilität;
- geringe Härte.
Ionenkristallgitter

Wenn es geladene Teilchen an den Knoten des Kristalls gibt - Ionen, darüber können wir reden ionisches Kristallgitter . In der Regel wechseln sich Ionenkristalle ab positive Ionen(Kationen) und negative Ionen(Anionen), sodass die Partikel im Kristall zurückgehalten werden elektrostatische Anziehungskräfte . Abhängig von der Art des Kristalls und der Art der Ionen, die den Kristall bilden, können solche Substanzen sein ziemlich stark und zäh. Im festen Zustand gibt es in Ionenkristallen in der Regel keine beweglichen geladenen Teilchen. Aber wenn der Kristall aufgelöst oder geschmolzen wird, werden die Ionen freigesetzt und können sich unter der Einwirkung eines Äußeren bewegen elektrisches Feld. Jene. Strom nur Lösungen oder Schmelzen leiten ionische Kristalle. Das Ionenkristallgitter ist charakteristisch für Substanzen mit ionische chemische Bindung. Beispiele solche Substanzen Salz NaCl Kalziumkarbonat- CaCO 3 usw. Das Ionenkristallgitter wird in der Regel in der festen Phase gebildet Salze, Basen sowie Metalloxide und binäre Verbindungen von Metallen und Nichtmetallen.

Kommunikation zwischen Teilchen in Ionenkristallen: .
An den Knoten des Kristalls mit einem Ionengitter Ionen.
Phasenzustand Ionenkristalle unter normalen Bedingungen: normalerweise Feststoffe.
Chemikalien mit einem Ionenkristallgitter:
- Salze (organisch und anorganisch), einschließlich Ammoniumsalze (Zum Beispiel, Ammoniumchlorid NH4Cl);
- Gründen;
- Metalloxide;
- Binäre Verbindungen, die Metalle und Nichtmetalle enthalten.
Physikalische Eigenschaften von Substanzen mit ionischer Kristallstruktur:
- hoher Schmelzpunkt (feuerfest);
- Lösungen und Schmelzen von Ionenkristallen - Stromleiter;
- die meisten Verbindungen sind in polaren Lösungsmitteln (Wasser) löslich;
- Festphasenzustand in den meisten Verbindungen unter normalen Bedingungen.

Und schließlich zeichnen sich Metalle durch eine besondere Art der räumlichen Struktur aus - Kristallgitter aus Metall, was fällig ist metallische chemische Bindung . Metallatome halten Valenzelektronen eher schwach. In einem aus einem Metall gebildeten Kristall laufen die folgenden Prozesse gleichzeitig ab: Einige Atome geben Elektronen ab und werden zu positiv geladenen Ionen; diese Elektronen bewegen sich zufällig im Kristall; Einige der Elektronen werden von den Ionen angezogen. Diese Prozesse treten gleichzeitig und zufällig auf. Auf diese Weise, Ionen erscheinen , wie bei der Bildung einer ionischen Bindung, und gemeinsame Elektronen entstehen wie bei der Bildung einer kovalenten Bindung. Freie Elektronen bewegen sich wie ein Gas zufällig und kontinuierlich durch das Volumen des Kristalls. Daher werden sie manchmal genannt Elektronengas ". Aufgrund der Präsenz eine große Anzahl bewegliche geladene Teilchen Metalle Strom leiten, Wärme. Der Schmelzpunkt von Metallen ist sehr unterschiedlich. Metalle werden ebenfalls charakterisiert eigenartiger metallischer Glanz, Formbarkeit, d.h. die Fähigkeit, die Form ohne Zerstörung unter starker mechanischer Beanspruchung zu ändern, tk. chemische Bindungen während sie nicht zerstört werden.

Kommunikation zwischen Teilchen : .
An den Knoten des Kristalls mit Metallgitter Metallionen und Atome.
Phasenzustand Metalle unter normalen Bedingungen: normalerweise Feststoffe(Ausnahme - Quecksilber, unter normalen Bedingungen flüssig).
Chemikalien mit einem Metallkristallgitter - einfache Substanzen - Metalle.
Physikalische Eigenschaften von Stoffen mit Metallkristallgitter:
– hohe thermische und elektrische Leitfähigkeit;
- Verformbarkeit und Plastizität;
- metallischer Schimmer;
— Metalle sind im Allgemeinen in Lösungsmitteln unlöslich;
Die meisten Metalle sind unter normalen Bedingungen Festkörper.
Vergleich der Eigenschaften von Stoffen mit unterschiedlichen Kristallgittern
Die Art des Kristallgitters (oder das Fehlen eines Kristallgitters) ermöglicht es, die grundlegenden physikalischen Eigenschaften eines Stoffes zu beurteilen. Für einen ungefähren Vergleich der typischen physikalischen Eigenschaften von Verbindungen mit unterschiedlichen Kristallgittern ist es sehr bequem, Chemikalien mit einzusetzen charakteristische Eigenschaften . Für ein Molekülgitter gilt beispielsweise Kohlendioxid, für das atomare Kristallgitter - Diamant, für Metall - Kupfer, und für das Ionenkristallgitter - Salz, Natriumchlorid NaCl.

Übersichtstabelle zu den Strukturen gebildeter einfacher Substanzen chemische Elemente aus den Hauptnebengruppen des Periodensystems (die Elemente der sekundären Nebengruppen sind Metalle, haben also ein metallisches Kristallgitter).

Die letzte Tabelle der Beziehung der Eigenschaften von Stoffen mit der Struktur: