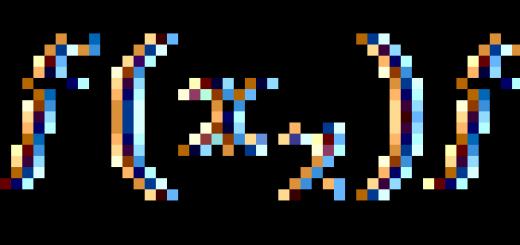Diese Lektion ist der Verallgemeinerung und Systematisierung des Wissens über die Arten chemischer Bindungen gewidmet. Während des Unterrichts Schemata zur Bildung einer chemischen Bindung in verschiedene Substanzen. Die Lektion hilft, die Fähigkeit zu festigen, die Art der chemischen Bindung in einer Substanz anhand ihrer zu bestimmen chemische Formel.
Thema: Chemische Bindung. Elektrolytische Dissoziation
Lektion: Schemata zur Bildung von Stoffen mit unterschiedlichen Bindungsarten
Reis. 1. Schema der Bindungsbildung in einem Fluormolekül
Das Fluormolekül besteht aus zwei Atomen desselben nichtmetallischen chemischen Elements mit derselben Elektronegativität, daher wird in dieser Substanz eine kovalente Beziehung realisiert. unpolare Bindung. Lassen Sie uns das Schema der Bindungsbildung in einem Fluormolekül darstellen. Reis. ein.
Um jedes Fluoratom zeichnen wir mit Punkten sieben Valenzelektronen, dh externe Elektronen. Vor einem stationären Zustand benötigt jedes Atom ein weiteres Elektron. Somit wird ein gemeinsames Elektronenpaar gebildet. Wenn wir es durch einen Strich ersetzen, zeigen wir die grafische Formel des Fluormoleküls F-F.
Ausgabe:Zwischen den Molekülen eines chemischen Elements – Nichtmetall – wird eine kovalente unpolare Bindung gebildet. Bei dieser Art der chemischen Bindung werden gemeinsame Elektronenpaare gebildet, die zu gleichen Teilen zu beiden Atomen gehören, d. h. es findet zu keinem der Atome des chemischen Elements eine Verschiebung der Elektronendichte statt

Reis. 2. Schema der Bindungsbildung in einem Wassermolekül
Das Wassermolekül besteht aus Wasserstoff- und Sauerstoffatomen - zwei nichtmetallischen Elementen mit verschiedene Werte relative Elektronegativität, daher in dieser Substanz - eine kovalente polare Bindung.
Da Sauerstoff ein elektronegativeres Element als Wasserstoff ist, verschieben sich gemeinsame Elektronenpaare in Richtung Sauerstoff. An den Wasserstoffatomen entsteht eine Teilladung, am Sauerstoffatom eine negative Teilladung. Indem wir beide gemeinsamen Elektronenpaare durch Striche oder vielmehr Pfeile ersetzen, die die Verschiebung der Elektronendichte anzeigen, schreiben wir die grafische Formel für Wasser Abb. 2.
Ausgabe:Eine kovalente polare Bindung tritt zwischen Atomen verschiedener Nichtmetallelemente auf, dh mit unterschiedlichen Werten der relativen Elektronegativität. Bei dieser Art der Bindung werden gemeinsame Elektronenpaare gebildet, die zu einem elektronegativeren Element verschoben werden..
1. Nr. 5,6,7 (S. 145) Rudzitis G.E. Anorganisch u organische Chemie. Klasse 8: Lehrbuch für Bildungsinstitutionen: ein Grundniveau von/ G. E. Rudzitis, F. G. Feldmann. M.: Aufklärung. 2011 176 S.: mit Abb.
2. Geben Sie das Teilchen mit dem größten und kleinsten Radius an: Ar-Atom, Ionen: K +, Ca 2+, Cl - Begründen Sie Ihre Antwort.
3. Nennen Sie drei Kationen und zwei Anionen, die die gleiche Elektronenhülle wie das F - -Ion haben.
Teil I
1. Metallatome, die externe Elektronen abgeben, werden zu positiven Ionen:
wobei n die Anzahl der Elektronen in der äußeren Schicht des Atoms ist, die der Gruppennummer des chemischen Elements entspricht.
2. Atome von Nichtmetallen, die Elektronen aufnehmen, die vor der Vervollständigung der äußeren Elektronenschicht fehlen, werden in negative Ionen umgewandelt:
3. Es entsteht eine Bindung zwischen entgegengesetzt geladenen Ionen, die man nennt ionisch.
4. Füllen Sie die Tabelle „Ionenbindung“ aus.

Teil II
1. Vervollständigen Sie die Schemata zur Bildung positiv geladener Ionen. Aus den Buchstaben, die den richtigen Antworten entsprechen, bilden Sie den Namen eines der ältesten natürlichen Farbstoffe: Indigo.
2. Spielen Sie Tic-Tac-Toe. Zeigen Sie den Gewinnweg, den die Formeln von Substanzen mit einer ionisch-chemischen Bindung bilden.

3. Sind die folgenden Aussagen wahr?
3) nur B ist wahr
4. Unterstreichen Sie die Paare chemischer Elemente, zwischen denen ein Ion steht chemische Bindung.
1) Kalium und Sauerstoff
3) Aluminium und Fluor
Zeichnen Sie Diagramme für die Bildung einer chemischen Bindung zwischen den ausgewählten Elementen.

5. Erstellen Sie eine Zeichnung im Comic-Stil über die Bildung einer ionischen chemischen Bindung.
6. Zeichnen Sie die Bildung von zwei auf Chemische Komponenten mit ionischer Bindung nach Konvention:
Auswählen chemische Elemente„A“ und „B“ aus der folgenden Liste:
Calcium, Chlor, Kalium, Sauerstoff, Stickstoff, Aluminium, Magnesium, Kohlenstoff, Brom.
Geeignet für diese Regelung sind Calcium und Chlor, Magnesium und Chlor, Calcium und Brom, Magnesium und Brom.

7. Schreiben Sie eine kurze literarische Arbeit (Essay, Kurzgeschichte oder Gedicht) über eine der ionischen Bindungssubstanzen, die eine Person im Alltag oder bei der Arbeit verwendet. Verwenden Sie das Internet, um die Aufgabe abzuschließen.
Natriumchlorid ist eine Substanz mit einer Ionenbindung, ohne die es kein Leben gibt, obwohl es bei viel davon auch nicht gut ist. Es gibt sogar einen Volksmärchen, die besagt, dass die Prinzessin ihren Vater, den König, so sehr liebte wie Salz, weshalb sie aus dem Königreich vertrieben wurde. Aber als der König einmal Essen ohne Salz probierte und feststellte, dass es unmöglich war, wurde ihm klar, dass seine Tochter ihn sehr liebte. Das bedeutet, dass Salz Leben ist, aber sein Konsum sollte in sein
messen. Denn zu viel Salz schadet der Gesundheit. Überschüssiges Salz im Körper führt zu Nierenerkrankungen, verändert die Hautfarbe, hält überschüssige Flüssigkeit im Körper zurück, was zu Ödemen und Stress für das Herz führt. Daher müssen Sie Ihren Salzkonsum kontrollieren. 0,9% Natriumchloridlösung ist eine Kochsalzlösung, die verwendet wird, um Medikamente in den Körper zu infundieren. Daher ist es sehr schwierig, die Frage zu beantworten: Ist Salz nützlich oder schädlich? Wir brauchen sie in Maßen.
Antwort auf Frage 5.
Das Element mit der Ordnungszahl 35 ist Brom (Br). Die Kernladung seines Atoms beträgt 35. Ein Bromatom enthält 35 Protonen, 35 Elektronen und 45 Neutronen.
§7. Änderungen in der Zusammensetzung der Kerne von Atomen chemischer Elemente. Isotope
Antwort auf Frage 1.
Die Isotope 40 19 K und 40 18 Ar weisen unterschiedliche Eigenschaften auf, da sie unterschiedliche Kernladungen und unterschiedliche Elektronenzahlen haben.
Antwort auf Frage 2.
Die relative Atommasse von Argon liegt nahe bei 40, weil Es gibt 18 Protonen und 22 Neutronen im Kern seines Atoms und 19 Protonen und 20 Neutronen im Kern des Kaliumatoms, so dass seine relative Atommasse nahe bei 39 liegt. Da die Anzahl der Protonen im Kern des Kaliumatoms größer ist, steht er in der Tabelle hinter Argon.
Antwort auf Frage 3.
Isotope sind Sorten von Atomen desselben Elements, die die gleiche Anzahl von Protonen und Elektronen und eine unterschiedliche Anzahl von Neutronen haben.
Antwort auf Frage 4.
Isotope von Chlor haben ähnliche Eigenschaften, weil Eigenschaften werden durch die Ladung des Kerns bestimmt und nicht durch seine relative Masse, selbst wenn die relativ ist Atommasse Chlorisotopen um 1 oder 2 Einheiten ändert sich die Masse geringfügig, im Gegensatz zu Wasserstoffisotopen, bei denen sich die Masse des Kerns durch die Hinzufügung von ein oder zwei Neutronen um das 2- oder 3-fache ändert.
Antwort auf Frage 5.
Deuterium (schweres Wasser) - eine Verbindung, bei der 1 Sauerstoffatom an zwei Atome des Wasserstoffisotops 2 1 D gebunden ist, Formel D2 O. Vergleich der Eigenschaften von D2 O und H2 O
Antwort auf Frage 6.
Das Element mit dem größten relativen Wert wird zuerst platziert.
Atommasse in Dämpfen:
Te-I (Tellur-Jod) 128 Te und 127 I.
Th-Pa (Thorium-Protactinium) 232 90 Th und 231 91 Pa . U-Np (Uran-Neptunium) 238 92 U und 237 93 Np .
§ 8 . Die Struktur der Elektronenhüllen von Atomen
Antwort auf Frage 1.
a) Al+13 |
b)P |
c) Ach |
|||||||
13 Al 2e– , 8e– , 3e– |
15 Ð 2e– , 8e– , 5e– |
8 О 2e– , 6e– |
|||||||
a) - Diagramm der Struktur des Aluminiumatoms; b) - Diagramm der Struktur des Phosphoratoms; c) - Diagramm der Struktur des Sauerstoffatoms.
Antwort auf Frage 2.
a) Vergleichen Sie die Struktur von Stickstoff- und Phosphoratomen.
7 N 2e– , 5e– |
15 Ð 2e– , 8e– , 5e– |
|||||
Struktur Elektronenhülle diese Atome sind ähnlich, beide auf der letzten Energielevel 5 Elektronen enthalten. Stickstoff hat jedoch nur 2 Energieniveaus, während Phosphor 3 hat.
b) Vergleichen wir die Struktur von Phosphor- und Schwefelatomen.
15 Ð 2e– , 8e– , 5e– |
16S 2e– , 8e– , 6e– |
||||||
Die Atome von Phosphor und Schwefel haben jeweils 3 Energieniveaus, und jedes letzte Niveau ist unvollständig, aber Phosphor hat 5 Elektronen auf dem letzten Energieniveau und Schwefel hat 6.
Antwort auf Frage 3.
Das Siliziumatom enthält im Kern 14 Protonen und 14 Neutronen. Die Anzahl der Elektronen um den Kern herum ist wie die Anzahl der Protonen gleich der Ordnungszahl des Elements. Die Anzahl der Energieniveaus wird durch die Periodenzahl bestimmt und ist gleich 3. Die Anzahl der externen Elektronen wird durch die Gruppenzahl bestimmt und ist gleich 4.
Antwort auf Frage 4.
Die Anzahl der in einer Periode enthaltenen Elemente ist gleich der maximal möglichen Anzahl von Elektronen im äußeren Energieniveau, und diese Anzahl wird durch die Formel 2n2 bestimmt, wobei n die Nummer der Periode ist.
Daher enthält die erste Periode nur 2 Elemente (2 12 ) und die zweite Periode enthält 8 Elemente (2 22 ).
Antwort auf Frage 5.
IN Astronomie - Die Rotationsdauer der Erde um ihre Achse beträgt 24 Stunden.
IN Geographie - Wechsel der Jahreszeiten mit einem Zeitraum von 1 Jahr.
IN Physik - Periodische Schwingungen des Pendels.
IN Biologie - Jede Hefezelle unter optimalen Bedingungen alle 20 min. ist geteilt.
Antwort auf Frage 6.
Elektronen und die Struktur des Atoms wurden zu Beginn des 20. Jahrhunderts entdeckt, wenig später entstand dieses Gedicht, das in vielerlei Hinsicht die nukleare oder planetarische Theorie der Struktur des Atoms widerspiegelt, und der Autor gibt das auch zu Möglichkeit, dass Elektronen auch komplexe Teilchen sind, deren Struktur wir einfach noch nicht studiert haben.
Antwort auf Frage 7.
Die im Lehrbuch 2 angegebenen Vierzeiler sprechen von V. Bryusovs enormem poetischem Talent und seinem flexiblen Geist, da er alle Errungenschaften der zeitgenössischen Wissenschaft sowie anscheinend Aufklärung und Bildung auf diesem Gebiet so leicht verstehen und akzeptieren konnte.
§ neun . Änderung der Anzahl der Elektronen auf dem externen Energieniveau von Atomen chemischer Elemente
Antwort auf Frage 1.
a) Vergleichen Sie die Struktur und Eigenschaften von Kohlenstoff- und Siliziumatomen

6 Ñ 2e– , 4e– |
14 Si 2e– , 8e– , 4e– |
||||
In Bezug auf die Struktur der Elektronenhülle sind diese Elemente ähnlich: Beide haben 4 Elektronen auf dem letzten Energieniveau, aber Kohlenstoff hat 2 Energieniveaus und Silizium hat 3. die Anzahl der Elektronen in der äußeren Ebene gleich ist, dann sind die Eigenschaften dieser Elemente ähnlich, aber der Radius des Siliziumatoms ist größer, daher weist es im Vergleich zu Kohlenstoff mehr metallische Eigenschaften auf.
b) Vergleichen Sie Struktur und Eigenschaften von Silizium- und Phosphoratomen:
14 Si 2e– , 8e– , 4e– |
15 Ð 2e– , 8e– , 5e– |
|||||
Silizium- und Phosphoratome haben 3 Energieniveaus, jedes mit einem unvollständigen letzten Niveau, aber Silizium hat 4 Elektronen auf dem letzten Energieniveau und Phosphor hat 5, so dass der Radius des Phosphoratoms kleiner ist und es in größerem Ausmaß zeigt nichtmetallische Eigenschaften als Silizium.
Antwort auf Frage 2.
a) Betrachten Sie die Bildung einer ionischen Bindung zwischen Aluminium und Sauerstoff.
1. Aluminium - ein Element der Hauptuntergruppe der Gruppe III, Metall. Es ist für sein Atom einfacher, 3 Außenelektronen abzugeben, als die fehlenden aufzunehmen.
Al0 – 3e– → Al+ 3
2. Sauerstoff - ein Element der Hauptuntergruppe der Gruppe VI, Nichtmetall. Es ist einfacher für sein Atom, 2 Elektronen aufzunehmen, die nicht ausreichen, um die äußere Ebene zu vervollständigen, als 6 Elektronen von der äußeren Ebene abzugeben.
O0 + 2e– → О− 2
3. Finden Sie zuerst das kleinste gemeinsame Vielfache zwischen den Ladungen der gebildeten Ionen, es ist gleich 6(3 2). Für Al-Atome ergibt sich 6
Elektronen müssen 2 (6: 3) genommen werden, damit Sauerstoffatome 6 Elektronen aufnehmen können, müssen sie 3 (6: 2) genommen werden.
4. Schematisch lässt sich die Bildung einer ionischen Bindung zwischen Aluminium- und Sauerstoffatomen wie folgt schreiben:
2Al0 + 3O0 → Al2 +3 O3 –2 → Al2 O3
6e–
b) Betrachten Sie das Schema für die Bildung einer ionischen Bindung zwischen Lithium- und Phosphoratomen.
1. Lithium - ein Element der Gruppe I der Hauptuntergruppe, ein Metall. Es ist einfacher für sein Atom, 1 äußeres Elektron abzugeben, als die fehlenden 7 aufzunehmen:
Li0 – 1e– → Li+ 1
2. Phosphor - ein Element der Hauptuntergruppe der Gruppe V, Nichtmetall. Es ist einfacher für sein Atom, 3 Elektronen aufzunehmen, die nicht ausreichen, um die äußere Ebene zu vervollständigen, als 5 Elektronen abzugeben:
Ð0 + 3e– → Ð− 3
3. Lassen Sie uns das kleinste gemeinsame Vielfache zwischen den Ladungen der gebildeten Ionen finden, es ist gleich 3(3 1). Für Lithiumatome zu geben
3 Elektronen, sie müssen 3 (3: 1) genommen werden, damit Phosphoratome 5 Elektronen aufnehmen können, müssen Sie nur 1 Atom (3: 3) nehmen.
4. Schematisch lässt sich die Bildung einer ionischen Bindung zwischen Lithium- und Phosphoratomen wie folgt schreiben:
3Li0 – + P0 → Li3 +1 P–3 → Li3 P
c) Betrachten Sie das Schema der Bildung einer ionischen Bindung zwischen Magnesium- und Fluoratomen.
1. Magnesium - ein Element der Gruppe II der Hauptuntergruppe, ein Metall. Es ist einfacher für sein Atom, 2 Außenelektronen abzugeben, als die fehlenden aufzunehmen.
Mg0 – 2e– → Mg+ 2
2. Fluor - ein Element der Hauptuntergruppe der Gruppe VII, Nichtmetall. Es ist einfacher für sein Atom, 1 Elektron aufzunehmen, was nicht ausreicht, um die äußere Ebene zu vervollständigen, als 7 Elektronen abzugeben:
![]()
F0 + 1e– → F− 1
3. Finde das kleinste gemeinsame Vielfache zwischen den Ladungen der gebildeten Ionen, es ist gleich 2(2 1). Damit Magnesiumatome 2 Elektronen abgeben, wird nur ein Atom benötigt, damit Fluoratome 2 Elektronen aufnehmen können, müssen sie 2 (2: 1) genommen werden.
4. Schematisch lässt sich die Bildung einer ionischen Bindung zwischen Lithium- und Phosphoratomen wie folgt schreiben:
Mg0 +– 2F0 → Mg+2 F2 –1 → MgF2
Antwort auf Frage 3.
Die typischsten Metalle befinden sich im Periodensystem
in am Anfang der Perioden und am Ende der Gruppen, also am meisten typisches Metall ist Francium (Fr). Typische Nichtmetalle befinden sich
in am Ende der Unterrichtsstunden und am Anfang der Gruppen. Somit ist das typischste Nichtmetall Fluor (F). (Helium wird nicht angezeigt jede chemische Eigenschaft).
Antwort auf Frage 4.
Edelgase wurden ebenso wie Metalle als Edelgase bezeichnet, da sie in der Natur ausschließlich in freier Form vorkommen und nur sehr schwer chemische Verbindungen eingehen.
Antwort auf Frage 5.
Der Ausdruck „Die Straßen der nächtlichen Stadt wurden mit Neon geflutet“ ist chemisch falsch, weil. Neon ist ein inertes, seltenes Gas, es enthält sehr wenig in der Luft. Allerdings Neonfüllung Neonlampen und Leuchtstofflampen, die häufig verwendet werden, um nachts Schilder, Plakate und Anzeigen zu beleuchten.
§ 10 . Wechselwirkung von Atomen nichtmetallischer Elemente untereinander
Antwort auf Frage 1.
Das elektronische Schema für die Bildung eines zweiatomigen Halogenmoleküls sieht folgendermaßen aus:
a + a → aa
Und die Strukturformel
Antwort auf Frage 2.
a) Schema der chemischen Bindungsbildung für AlCl3:
Aluminium ist ein Element der Gruppe III. Es ist einfacher für sein Atom, 3 Außenelektronen abzugeben, als die fehlenden 5 aufzunehmen.
Al° - 3e → Al+3
Chlor ist ein Element der Gruppe VII. Es ist einfacher für sein Atom, 1 Elektron aufzunehmen, was nicht ausreicht, um die äußere Ebene zu vervollständigen, als 7 Elektronen abzugeben.
Ál° + 1 e → Ál–1
Finden wir das kleinste gemeinsame Vielfache zwischen den Ladungen der gebildeten Ionen, es ist gleich 3(3:1). Damit Aluminiumatome 3 Elektronen abgeben, muss nur 1 Atom (3: 3) genommen werden, damit Chloratome 3 Elektronen aufnehmen können, müssen sie 3 (3: 1) genommen werden
Al° + 3Сl° → Al+3 Cl–1 → AlСl3
3 e-
Die Bindung zwischen Metall- und Nichtmetallatomen ist ionisch. b) Schema der chemischen Bindungsbildung für Cl2:
Chlor ist ein Element der Hauptuntergruppe der Gruppe VII. Seine Atome haben 7 Elektronen in ihrer äußeren Ebene. Die Zahl der ungepaarten Elektronen ist
→ClCl |
|||||||||
Die Bindung zwischen Atomen desselben Elements ist kovalent.
Antwort auf Frage 3.
Schwefel ist ein Element der Hauptuntergruppe der Gruppe VI. Seine Atome haben 6 Elektronen auf der äußeren Ebene. Die Zahl der ungepaarten Elektronen ist (8–6)2. In S2-Molekülen sind die Atome durch zwei gemeinsame Elektronenpaare verbunden, also ist die Bindung doppelt.
Das Schema für die Bildung des S2-Moleküls sieht folgendermaßen aus:
Antwort auf Frage 4.
Das S2-Molekül hat eine Doppelbindung, das Cl-Molekül hat eine Einfachbindung und das N2-Molekül hat eine Dreifachbindung. Daher ist das stärkste Molekül N2, das weniger haltbare S2 und das noch schwächere Cl2.
Die Bindungslänge ist im N2-Molekül am kleinsten, im S2-Molekül länger und im Cl2-Molekül noch länger.
§ elf . Kovalente polare chemische Bindung
Antwort auf Frage 1.
Da die EO-Werte von Wasserstoff und Phosphor gleich sind, wird die chemische Bindung im PH3-Molekül kovalent unpolar sein.
Antwort auf Frage 2.
1. a) im S2-Molekül ist die Bindung kovalent unpolar, weil es wird von Atomen desselben Elements gebildet. Das Verbindungsbildungsschema sieht wie folgt aus:
Schwefel ist ein Element der Hauptuntergruppe der Gruppe VI. Seine Atome haben 6 Elektronen in der äußeren Schale. Es wird ungepaarte Elektronen geben: 8 - 6 = 2.
Bezeichne die äußeren Elektronen S
b) im K2 O-Molekül ist die Bindung ionisch, weil es besteht aus Atomen von Metall und nichtmetallischen Elementen.
Kalium ist ein Element der Gruppe I der Hauptnebengruppe, ein Metall. Es ist einfacher für sein Atom, 1 Elektron abzugeben, als die fehlenden 7 zu akzeptieren:

K0 – 1e– → K + 1
Sauerstoff ist ein Element der Hauptuntergruppe der Gruppe VI, ein Nichtmetall. Es ist einfacher für sein Atom, 2 Elektronen aufzunehmen, die nicht ausreichen, um das Niveau zu vollenden, als 6 Elektronen abzugeben:
O0 + 2e– → O− 2
Finden wir das kleinste gemeinsame Vielfache zwischen den Ladungen der gebildeten Ionen, es ist gleich 2(2 1). Damit Kaliumatome 2 Elektronen abgeben, müssen sie 2 aufnehmen, damit Sauerstoffatome 2 Elektronen aufnehmen können, wird nur 1 Atom benötigt:
2K2e 0 – + O0 → K2 +1 O–2 → K2 O
c) im H2 S-Molekül ist die Bindung kovalent polar, weil es wird von Atomen von Elementen mit unterschiedlichem EO gebildet. Das Verbindungsbildungsschema sieht wie folgt aus:
Schwefel ist ein Element der Hauptuntergruppe der Gruppe VI. Seine Atome haben 6 Elektronen in der äußeren Schale. Es wird ungepaarte Elektronen geben: 8–6=2.
Wasserstoff ist ein Element der Hauptuntergruppe der Gruppe I. Seine Atome enthalten 1 Elektron pro Außenschale. 1 Elektron ist ungepaart (für ein Wasserstoffatom ist ein Zwei-Elektronen-Niveau vollständig). Bezeichnen wir die äußeren Elektronen:
H + S + H → H |
|||
Gemeinsame Elektronenpaare sind in Richtung des Schwefelatoms vorgespannt, da es elektronegativer ist
H δ+ → S 2 δ− ← H δ+
1. a) im N2-Molekül ist die Bindung kovalent unpolar, weil es wird von Atomen desselben Elements gebildet. Das Verbindungsbildungsschema ist wie folgt:
Stickstoff ist ein Element der Hauptuntergruppe der Gruppe V. Seine Atome haben 5 Elektronen in ihrer äußeren Hülle. Ungepaarte Elektronen: 8 - 5 = 3.
Bezeichnen wir die äußeren Elektronen: N
→ N N |
|||||||
N ≡ N
b) im Li3 N-Molekül ist die Bindung ionisch, weil es besteht aus Atomen von Metall und nichtmetallischen Elementen.
Lithium ist ein Element der Hauptuntergruppe der Gruppe I, ein Metall. Es ist einfacher für sein Atom, 1 Elektron abzugeben, als die fehlenden 7 zu akzeptieren:
Li0 – 1e– → Li+ 1
Stickstoff ist ein Element der Hauptuntergruppe der Gruppe V, ein Nichtmetall. Es ist einfacher für sein Atom, 3 Elektronen aufzunehmen, die nicht ausreichen, um die äußere Ebene zu vervollständigen, als fünf Elektronen von der äußeren Ebene abzugeben:
N0 + 3e– → N− 3
Lassen Sie uns das kleinste gemeinsame Vielfache zwischen den Ladungen der gebildeten Ionen finden, es ist gleich 3(3 1). Damit Lithiumatome 3 Elektronen abgeben können, werden 3 Atome benötigt, damit Stickstoffatome 3 Elektronen aufnehmen können, wird nur ein Atom benötigt:
3Li0 + N0 → Li3 +1 N–3 → Li3 N
3e–
c) im NCl3-Molekül ist die Bindung kovalent polar, weil es wird von Atomen nichtmetallischer Elemente mit unterschiedlichen EC-Werten gebildet. Das Verbindungsbildungsschema ist wie folgt:
Stickstoff ist ein Element der Hauptuntergruppe der Gruppe V. Seine Atome haben 5 Elektronen in der äußeren Schale. Es wird ungepaarte Elektronen geben: 8–5=3.
Chlor ist ein Element der Hauptuntergruppe der Gruppe VII. Seine Atome enthalten 7 Elektronen in der äußeren Schale. Bleibt ungepaart
Hilfe ist unterwegs, warten Sie.
a) Betrachten Sie die Bildung einer ionischen Bindung zwischen Natrium und
Sauerstoff.
1. Natrium - ein Element der Hauptuntergruppe der Gruppe I, ein Metall. Es ist für sein Atom einfacher, das I-Außenelektron abzugeben, als die fehlende 7 zu akzeptieren:
1. Sauerstoff ist ein Element der Hauptuntergruppe der Gruppe VI, Nichtmetall.
Es ist einfacher für sein Atom, 2 Elektronen aufzunehmen, die nicht ausreichen, um die äußere Ebene zu vervollständigen, als 6 Elektronen von der äußeren Ebene abzugeben. 
1. Zuerst finden wir das kleinste gemeinsame Vielfache zwischen den Ladungen der gebildeten Ionen, es ist gleich 2(2∙1). Damit Na-Atome 2 Elektronen abgeben können, müssen sie 2 genommen werden (2: 1), damit Sauerstoffatome 2 Elektronen aufnehmen können, müssen sie 1 genommen werden.
2. Schematisch lässt sich die Bildung einer ionischen Bindung zwischen Natrium- und Sauerstoffatomen wie folgt schreiben:
b) Betrachten Sie das Schema für die Bildung einer ionischen Bindung zwischen Lithium- und Phosphoratomen.
I. Lithium - ein Element der Gruppe I der Hauptuntergruppe, ein Metall. Es ist einfacher für sein Atom, 1 äußeres Elektron abzugeben, als die fehlenden 7 aufzunehmen: 
2. Chlor - ein Element der Hauptuntergruppe der Gruppe VII, Nichtmetall. Seine
Es ist einfacher für ein Atom, 1 Elektron aufzunehmen, als 7 Elektronen abzugeben: 
2. Kleinstes gemeinsames Vielfaches von 1, d.h. Damit 1 Atom Lithium abgegeben und ein Chloratom 1 Elektron aufnehmen kann, müssen Sie sie einzeln aufnehmen.
3. Schematisch lässt sich die Bildung einer ionischen Bindung zwischen Lithium- und Chloratomen wie folgt schreiben: 
c) Betrachten Sie das Schema für die Bildung einer ionischen Bindung zwischen Atomen
Magnesium und Fluor.
1. Magnesium ist ein Element der Gruppe II der Hauptnebengruppe, ein Metall. Seine
Es ist für ein Atom einfacher, 2 Außenelektronen abzugeben, als die fehlenden 6 aufzunehmen: 
2. Fluor - ein Element der Hauptuntergruppe der Gruppe VII, Nichtmetall. Seine
Es ist einfacher für ein Atom, 1 Elektron aufzunehmen, was nicht ausreicht, um die äußere Ebene zu vervollständigen, als 7 Elektronen abzugeben: 
2. Finde das kleinste gemeinsame Vielfache zwischen den Ladungen der gebildeten Ionen, es ist gleich 2(2∙1). Damit Magnesiumatome 2 Elektronen abgeben, wird nur ein Atom benötigt, damit Fluoratome 2 Elektronen aufnehmen können, müssen sie 2 (2: 1) genommen werden.
3. Schematisch lässt sich die Bildung einer ionischen Bindung zwischen Lithium- und Phosphoratomen wie folgt schreiben: 
TEIL 1
1. Metallatome, die externe Elektronen abgeben, werden zu positiven Ionen:
wobei n die Anzahl der Elektronen in der äußeren Schicht des Atoms ist, die der Gruppennummer des chemischen Elements entspricht.
2. Atome von Nichtmetallen, die Elektronen aufnehmen, die vor der Fertigstellung der äußeren elektronischen Schicht fehlen, werden zu negativen Ionen:

3. Zwischen entgegengesetzt geladenen Ionen entsteht eine Bindung, die als Ionenbindung bezeichnet wird.
4. Füllen Sie die Tabelle „Ionenbindung“ aus.

TEIL 2
1. Vervollständigen Sie die Schemata zur Bildung positiv geladener Ionen. Aus den Buchstaben, die den richtigen Antworten entsprechen, machen Sie einen Namen alte natürliche Farbstoffe Indigo.

2. Spielen Sie Tic-Tac-Toe. Zeigen Sie den Gewinnweg, den die Formeln von Substanzen mit einer ionisch-chemischen Bindung bilden.

3. Sind die folgenden Aussagen wahr?
3) nur B ist wahr
4. Unterstreichen Sie die Paare chemischer Elemente, zwischen denen eine ionische chemische Bindung besteht.
1) Kalium und Sauerstoff
2) Wasserstoff und Phosphor
3) Aluminium und Fluor
4) Wasserstoff und Stickstoff
Zeichnen Sie Diagramme für die Bildung einer chemischen Bindung zwischen den ausgewählten Elementen.

5. Erstellen Sie eine Zeichnung im Comic-Stil über die Bildung einer ionischen chemischen Bindung.
6. Erstellen Sie ein Diagramm der Bildung zweier chemischer Verbindungen mit einer Ionenbindung gemäß der bedingten Notation:
![]()
Wählen Sie die chemischen Elemente „A“ und „B“ aus der folgenden Liste: Calcium, Chlor, Kalium, Sauerstoff, Stickstoff, Aluminium, Magnesium, Kohlenstoff, Brom.
Geeignet für diese Regelung sind Calcium und Chlor, Magnesium und Chlor, Calcium und Brom, Magnesium und Brom.

7. Schreiben Sie eine kurze literarische Arbeit (Essay, Kurzgeschichte oder Gedicht) über eine der ionischen Bindungssubstanzen, die eine Person im Alltag oder bei der Arbeit verwendet. Verwenden Sie das Internet, um die Aufgabe abzuschließen.
Natriumchlorid ist eine Substanz mit einer Ionenbindung, ohne die es kein Leben gibt, obwohl es bei viel davon auch nicht gut ist. Es gibt sogar ein solches Volksmärchen, das besagt, dass die Prinzessin ihren Vater, den König, genauso liebte wie Salz, weshalb sie aus dem Königreich vertrieben wurde. Aber als der König einmal Essen ohne Salz probierte und feststellte, dass es unmöglich war, wurde ihm klar, dass seine Tochter ihn sehr liebte. Salz ist also Leben, aber sein Konsum sollte in Maßen sein. Denn zu viel Salz schadet der Gesundheit. Überschüssiges Salz im Körper führt zu Nierenerkrankungen, verändert die Hautfarbe, hält überschüssige Flüssigkeit im Körper zurück, was zu Ödemen und Stress für das Herz führt. Daher müssen Sie Ihren Salzkonsum kontrollieren. 0,9% Natriumchloridlösung ist eine Kochsalzlösung, die verwendet wird, um Medikamente in den Körper zu infundieren. Daher ist es sehr schwierig, die Frage zu beantworten: Ist Salz nützlich oder schädlich? Wir brauchen sie in Maßen.