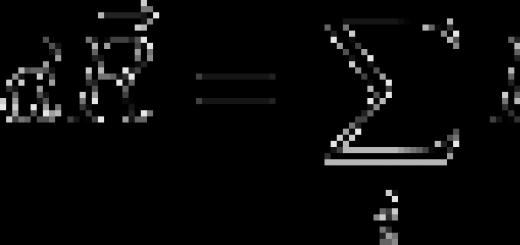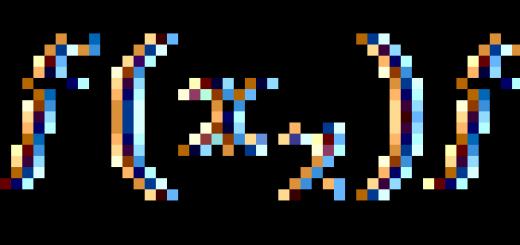كهرباءفي السوائل بسبب حركة الأيونات الموجبة والسالبة. على عكس التيار في الموصلات حيث تتحرك الإلكترونات. وبالتالي ، إذا لم يكن هناك أيونات في السائل ، فهو عازل ، على سبيل المثال ، الماء المقطر. نظرًا لأن حاملات الشحنة عبارة عن أيونات ، أي جزيئات وذرات مادة ما ، فعند مرور تيار كهربائي عبر مثل هذا السائل ، سيؤدي ذلك حتماً إلى حدوث تغيير الخواص الكيميائيةمواد.
من أين تأتي الأيونات الموجبة والسالبة في السائل؟ دعنا نقول على الفور أن حاملات الشحنة ليست قادرة على التكون في جميع السوائل. وتسمى تلك التي تظهر فيها بالكهرباء. وتشمل هذه محاليل أملاح الأحماض والقلويات. عند إذابة الملح في الماء ، على سبيل المثال ، تناول ملح الطعام كلوريد الصوديوم، يتحلل تحت تأثير مذيب ، أي الماء إلى أيون موجب نايسمى الكاتيون والأيون السالب Clيسمى الأنيون. تسمى عملية تكوين الأيونات بالتفكك الإلكتروليتي.
دعونا نجري تجربة ، لذلك نحتاج إلى لمبة زجاجية ، قطبين معدنيين ، مقياس التيار الكهربائي ومصدر تيار مباشر. نملأ القارورة بمحلول الملح الشائع في الماء. ثم نضع قطبين مستطيلين في هذا المحلول. نقوم بتوصيل الأقطاب الكهربائية بمصدر تيار مباشر من خلال مقياس التيار الكهربائي.
الشكل 1 - قارورة بمحلول ملح
عندما يتم تشغيل التيار بين الألواح ، سيظهر مجال كهربائي تحته تبدأ أيونات الملح في التحرك. سوف تندفع الأيونات الموجبة إلى القطب السالب والأيونات السالبة إلى القطب الموجب. في نفس الوقت سوف يقومون بحركة فوضوية. ولكن في نفس الوقت ، تحت تأثير المجال ، سيتم أيضًا إضافة عنصر مرتب إليه.
على عكس الموصلات التي تتحرك فيها الإلكترونات فقط ، أي نوع واحد من الشحنات ، يتحرك نوعان من الشحنات في الإلكتروليتات. هذه هي الأيونات الموجبة والسالبة. يتحركون تجاه بعضهم البعض.
عندما يصل أيون الصوديوم الموجب إلى القطب السالب ، فإنه يكتسب الإلكترون المفقود ويصبح ذرة صوديوم. ستحدث عملية مماثلة مع أيون الكلور. فقط عند الوصول إلى القطب الموجب ، سيتخلى أيون الكلور عن الإلكترون ويتحول إلى ذرة كلور. وبالتالي ، يتم الحفاظ على التيار في الدائرة الخارجية بسبب حركة الإلكترونات. وفي الإلكتروليت ، يبدو أن الأيونات تحمل الإلكترونات من قطب إلى آخر.
تعتمد المقاومة الكهربائية للإلكتروليتات على كمية الأيونات المتكونة. في الشوارد القوية ، يكون مستوى التفكك مرتفعًا جدًا عند الذوبان. الضعفاء منخفضون. أيضًا ، تتأثر المقاومة الكهربائية للإلكتروليت بدرجة الحرارة. مع زيادتها ، تنخفض لزوجة السائل وتبدأ الأيونات الثقيلة والخرقاء في التحرك بشكل أسرع. تبعا لذلك ، تقل المقاومة.
إذا تم استبدال محلول الملح بمحلول كبريتات النحاس. بعد ذلك ، عندما يمر تيار من خلاله ، عندما يصل الكاتيون النحاسي إلى القطب السالب ويستقبل الإلكترونات المفقودة هناك ، فسيتم استعادته إلى ذرة نحاسية. وإذا أزلت القطب الكهربائي بعد ذلك ، يمكنك العثور على رواسب نحاسية عليه. هذه العملية تسمى التحليل الكهربائي.
السوائل ، مثل المواد الصلبة ، يمكن أن تكون موصلات وأشباه موصلات وعوازل كهربائية. في هذا الدرس ، سوف نركز على الموصلات السائلة. وليس عن السوائل ذات الموصلية الإلكترونية (المعادن المنصهرة) ، ولكن عن الموصلات السائلة من النوع الثاني (محاليل وذوبان الأملاح والأحماض والقواعد). نوع موصلية هذه الموصلات أيوني.
تعريف. موصلات من النوع الثاني هي تلك الموصلات التي تحدث فيها العمليات الكيميائية عندما يتدفق التيار.
من أجل فهم أفضل لعملية التوصيل الحالي في السوائل ، يمكن للمرء أن يتخيل ذلك التجربة القادمة: تم وضع قطبين كهربائيين متصلين بمصدر تيار في حمام مائي ، ويمكن استخدام المصباح كمؤشر للتيار في الدائرة. إذا أغلقت مثل هذه الدائرة ، فلن يحترق المصباح ، مما يعني عدم وجود تيار ، مما يعني وجود انقطاع في الدائرة ، والماء نفسه لا يقوم بتوصيل التيار. ولكن إذا وضعت كمية معينة من الملح في الحمام وكررتها ، فسيتم تشغيل الضوء. هذا يعني أن ناقلات الشحن المجاني ، في هذه الحالة الأيونات ، بدأت في التحرك في الحمام بين القطب السالب والأنود (الشكل 1).

أرز. 1. مخطط الخبرة
موصلية الشوارد
من أين تأتي الرسوم المجانية في الحالة الثانية؟ كما ذكر في أحد الدروس السابقة ، فإن بعض المواد العازلة قطبية. الماء له نفس الجزيئات القطبية (الشكل 2).

أرز. 2. قطبية جزيء الماء
عندما يضاف الملح إلى الماء ، يتم توجيه جزيئات الماء بطريقة تجعل أقطابها السالبة قريبة من الصوديوم ، موجبة - بالقرب من الكلور. نتيجة للتفاعلات بين الشحنات ، تكسر جزيئات الماء جزيئات الملح إلى أزواج من الأيونات المعاكسة. أيون الصوديوم له شحنة موجبة ، وأيون الكلور له شحنة سالبة (الشكل 3). هذه الأيونات هي التي ستتحرك بين الأقطاب الكهربائية تحت تأثير الحقل الكهربائي.

أرز. 3. مخطط تكوين الأيونات الحرة
عندما تقترب أيونات الصوديوم من القطب السالب ، فإنها تتلقى إلكتروناتها المفقودة ، بينما تتخلى أيونات الكلوريد عن إلكتروناتها عندما تصل إلى القطب الموجب.
التحليل الكهربائي
نظرًا لأن تدفق التيار في السوائل يرتبط بنقل المادة ، مع مثل هذا التيار ، تتم عملية التحليل الكهربائي.
تعريف.التحليل الكهربائي هو عملية مرتبطة بتفاعلات الأكسدة والاختزال حيث يتم إطلاق مادة عند الأقطاب الكهربائية.
المواد التي ، نتيجة لهذا الانقسام ، توفر الموصلية الأيونيةتسمى بالكهرباء. تم اقتراح هذا الاسم من قبل الفيزيائي الإنجليزي مايكل فاراداي (الشكل 4).
يجعل التحليل الكهربائي من الممكن الحصول على المواد في صورة نقية بدرجة كافية من المحاليل ، لذلك يتم استخدامه للحصول على مواد نادرة ، مثل الصوديوم والكالسيوم ... في شكله النقي. وهذا ما يعرف باسم علم المعادن بالتحليل الكهربائي.
قوانين فاراداي
في أول عمل على التحليل الكهربائي في عام 1833 ، قدم فاراداي قانونين للتحليل الكهربائي. في الأول ، كان الأمر يتعلق بكتلة المادة المنبعثة على الأقطاب الكهربائية:
ينص قانون فاراداي الأول على أن هذه الكتلة تتناسب مع الشحنة التي تمر عبر الإلكتروليت:
هنا يتم لعب دور معامل التناسب بالكمية - المكافئ الكهروكيميائي. هذه قيمة جدولية فريدة لكل إلكتروليت وهي لها الشخصيات الرئيسيه. أبعاد المكافئ الكهروكيميائي:
![]()
المعنى المادي للمكافئ الكهروكيميائي هو الكتلة المنبعثة على القطب عندما تمر كمية الكهرباء في 1 ج عبر الإلكتروليت.
إذا كنت تتذكر الصيغ من موضوع التيار المباشر:
ثم يمكننا تمثيل قانون فاراداي الأول بالشكل:
يتعلق قانون فاراداي الثاني مباشرة بقياس المكافئ الكهروكيميائي من خلال ثوابت أخرى لإلكتروليت معين:
هنا: هي الكتلة المولية للكهارل. - شحنة أولية - التكافؤ بالكهرباء. هو رقم أفوجادرو.
تسمى القيمة بالمكافئ الكيميائي للإلكتروليت. أي ، لمعرفة المكافئ الكهروكيميائي ، يكفي معرفة المكافئ الكيميائي ، والمكونات المتبقية من الصيغة هي ثوابت العالم.
بناءً على قانون فاراداي الثاني ، يمكن تمثيل القانون الأول على النحو التالي:
![]()
اقترح فاراداي مصطلحات هذه الأيونات على أساس القطب الذي تتحرك إليه. تسمى الأيونات الموجبة الكاتيونات لأنها تتحرك نحو الكاثود سالب الشحنة ، وتسمى الشحنات السالبة الأنيونات لأنها تتحرك نحو القطب الموجب.
يسمى الإجراء السابق للماء لكسر الجزيء إلى أيونيين التفكك الالكتروليتي.
بالإضافة إلى المحاليل ، يمكن أن تكون المواد المنصهرة أيضًا موصلات من النوع الثاني. في هذه الحالة ، يتم تحقيق وجود الأيونات الحرة من خلال حقيقة أن الحركات الجزيئية النشطة للغاية والاهتزازات تبدأ عند درجة حرارة عالية ، ونتيجة لذلك تتفكك الجزيئات إلى أيونات.
التطبيق العملي للتحليل الكهربائي
أولا الاستخدام العمليحدث التحليل الكهربائي في عام 1838 من قبل العالم الروسي جاكوبي. بمساعدة التحليل الكهربائي ، حصل على انطباع بأرقام لـ كاتدرائية القديس اسحق. يسمى تطبيق التحليل الكهربائي هذا بالطلاء الكهربائي. مجال آخر للتطبيق هو الطلاء الكهربائي - تغطية معدن بآخر (طلاء الكروم ، طلاء النيكل ، التذهيب ، إلخ ، الشكل 5)
- Fatyf.narod.ru ().
- كيميك ().
- Ens.tpu.ru ().
واجب منزلي
- ما هي الشوارد؟
- ما هما الأساسيان أنواع مختلفةالسوائل التي يمكن أن يتدفق فيها التيار الكهربائي؟
- ما هي الآليات الممكنة لتشكيل ناقلات الشحن المجاني؟
- * لماذا تتناسب الكتلة المنبعثة على القطب مع الشحنة؟
السوائل ، مثل المواد الصلبة ، يمكن أن تكون موصلات وأشباه موصلات وعوازل كهربائية. في هذا الدرس ، سوف نركز على الموصلات السائلة. وليس عن السوائل ذات الموصلية الإلكترونية (المعادن المنصهرة) ، ولكن عن الموصلات السائلة من النوع الثاني (محاليل وذوبان الأملاح والأحماض والقواعد). نوع موصلية هذه الموصلات أيوني.
تعريف. موصلات من النوع الثاني هي تلك الموصلات التي تحدث فيها العمليات الكيميائية عندما يتدفق التيار.
من أجل فهم أفضل لعملية التوصيل الحالي في السوائل ، يمكن تقديم التجربة التالية: تم وضع قطبين كهربائيين متصلين بمصدر تيار في حوض ماء ، ويمكن استخدام المصباح كمؤشر للتيار في الدائرة. إذا أغلقت مثل هذه الدائرة ، فلن يحترق المصباح ، مما يعني عدم وجود تيار ، مما يعني أن هناك انقطاعًا في الدائرة ، والماء نفسه لا يوصل التيار. ولكن إذا وضعت كمية معينة من الملح في الحمام وكررتها ، فسيتم تشغيل الضوء. هذا يعني أن ناقلات الشحن المجاني ، في هذه الحالة الأيونات ، بدأت في التحرك في الحمام بين القطب السالب والأنود (الشكل 1).

أرز. 1. مخطط الخبرة
موصلية الشوارد
من أين تأتي الرسوم المجانية في الحالة الثانية؟ كما ذكر في أحد الدروس السابقة ، فإن بعض المواد العازلة قطبية. الماء له نفس الجزيئات القطبية (الشكل 2).

أرز. 2. قطبية جزيء الماء
عندما يضاف الملح إلى الماء ، يتم توجيه جزيئات الماء بطريقة تجعل أقطابها السالبة قريبة من الصوديوم ، موجبة - بالقرب من الكلور. نتيجة للتفاعلات بين الشحنات ، تكسر جزيئات الماء جزيئات الملح إلى أزواج من الأيونات المعاكسة. أيون الصوديوم له شحنة موجبة ، وأيون الكلور له شحنة سالبة (الشكل 3). هذه الأيونات هي التي ستتحرك بين الأقطاب الكهربائية تحت تأثير مجال كهربائي.

أرز. 3. مخطط تكوين الأيونات الحرة
عندما تقترب أيونات الصوديوم من القطب السالب ، فإنها تتلقى إلكتروناتها المفقودة ، بينما تتخلى أيونات الكلوريد عن إلكتروناتها عندما تصل إلى القطب الموجب.
التحليل الكهربائي
نظرًا لأن تدفق التيار في السوائل يرتبط بنقل المادة ، مع مثل هذا التيار ، تتم عملية التحليل الكهربائي.
تعريف.التحليل الكهربائي هو عملية مرتبطة بتفاعلات الأكسدة والاختزال حيث يتم إطلاق مادة عند الأقطاب الكهربائية.
المواد التي ، نتيجة لهذا الانقسام ، توفر الموصلية الأيونية تسمى الإلكتروليتات. تم اقتراح هذا الاسم من قبل الفيزيائي الإنجليزي مايكل فاراداي (الشكل 4).
يجعل التحليل الكهربائي من الممكن الحصول على المواد في صورة نقية بدرجة كافية من المحاليل ، لذلك يتم استخدامه للحصول على مواد نادرة ، مثل الصوديوم والكالسيوم ... في شكله النقي. وهذا ما يعرف باسم علم المعادن بالتحليل الكهربائي.
قوانين فاراداي
في أول عمل على التحليل الكهربائي في عام 1833 ، قدم فاراداي قانونين للتحليل الكهربائي. في الأول ، كان الأمر يتعلق بكتلة المادة المنبعثة على الأقطاب الكهربائية:
ينص قانون فاراداي الأول على أن هذه الكتلة تتناسب مع الشحنة التي تمر عبر الإلكتروليت:
هنا يتم لعب دور معامل التناسب بالكمية - المكافئ الكهروكيميائي. هذه قيمة جدولية فريدة لكل إلكتروليت وهي السمة الرئيسية لها. أبعاد المكافئ الكهروكيميائي:
![]()
المعنى المادي للمكافئ الكهروكيميائي هو الكتلة المنبعثة على القطب عندما تمر كمية الكهرباء في 1 ج عبر الإلكتروليت.
إذا كنت تتذكر الصيغ من موضوع التيار المباشر:
ثم يمكننا تمثيل قانون فاراداي الأول بالشكل:
يتعلق قانون فاراداي الثاني مباشرة بقياس المكافئ الكهروكيميائي من خلال ثوابت أخرى لإلكتروليت معين:
هنا: هي الكتلة المولية للكهارل. - شحنة أولية - التكافؤ بالكهرباء. هو رقم أفوجادرو.
تسمى القيمة بالمكافئ الكيميائي للإلكتروليت. أي ، لمعرفة المكافئ الكهروكيميائي ، يكفي معرفة المكافئ الكيميائي ، والمكونات المتبقية من الصيغة هي ثوابت العالم.
بناءً على قانون فاراداي الثاني ، يمكن تمثيل القانون الأول على النحو التالي:
![]()
اقترح فاراداي مصطلحات هذه الأيونات على أساس القطب الذي تتحرك إليه. تسمى الأيونات الموجبة الكاتيونات لأنها تتحرك نحو الكاثود سالب الشحنة ، وتسمى الشحنات السالبة الأنيونات لأنها تتحرك نحو القطب الموجب.
يسمى الإجراء الموضح أعلاه لكسر جزيء ما إلى أيونيين بالتفكك الإلكتروليتي.
بالإضافة إلى المحاليل ، يمكن أن تكون المواد المنصهرة أيضًا موصلات من النوع الثاني. في هذه الحالة ، يتم تحقيق وجود الأيونات الحرة من خلال حقيقة أن الحركات الجزيئية النشطة للغاية والاهتزازات تبدأ عند درجة حرارة عالية ، ونتيجة لذلك تتفكك الجزيئات إلى أيونات.
التطبيق العملي للتحليل الكهربائي
أول تطبيق عملي للتحليل الكهربائي حدث في عام 1838 من قبل العالم الروسي جاكوبي. بمساعدة التحليل الكهربائي ، تلقى انطباعًا عن الأشكال لكاتدرائية القديس إسحاق. يسمى تطبيق التحليل الكهربائي هذا بالطلاء الكهربائي. مجال آخر للتطبيق هو الطلاء الكهربائي - تغطية معدن بآخر (طلاء الكروم ، طلاء النيكل ، التذهيب ، إلخ ، الشكل 5)
- Fatyf.narod.ru ().
- كيميك ().
- Ens.tpu.ru ().
واجب منزلي
- ما هي الشوارد؟
- ما هما نوعا السوائل المختلفان جوهريًا اللذين يمكن أن يتدفق فيهما تيار كهربائي؟
- ما هي الآليات الممكنة لتشكيل ناقلات الشحن المجاني؟
- * لماذا تتناسب الكتلة المنبعثة على القطب مع الشحنة؟
الماء كمذيب عالمي .. محاليل مائية .. تفكك إلكتروليت .. إلكتروليت .. شوارد ضعيفة وقوية .. ناقلات الشحنات الكهربائيةفي السوائل .. الأيونات الموجبة والسالبة .. التحليل الكهربائي .. يذوب .. طبيعة التيار الكهربائي في الذوبان ..
أحد شروط حدوث تيار كهربائي هو وجود شحنات حرة قادرة على التحرك تحت تأثير مجال كهربائي. تحدثنا عن طبيعة التيار الكهربائي في المعادن و.
سنحاول في هذا الدرس معرفة ذلك ما الجسيمات التي تحمل شحنة كهربائية في السوائل وتذوب.
الماء كمذيب عالمي
كما نعلم ، لا يحتوي الماء المقطر على ناقلات شحنة وبالتالي لا يوصل تيارًا كهربائيًا ، أي أنه عازل. ومع ذلك ، فإن وجود أي شوائب بالفعل يجعل الماء موصلًا جيدًا إلى حد ما.
يتمتع الماء بقدرة هائلة على إذابة كل شيء تقريبًا في حد ذاته. العناصر الكيميائية. عندما يذوب في الماء مواد مختلفة(الأحماض ، القلويات ، القواعد ، الأملاح ، إلخ) ، يصبح المحلول موصلًا بسبب تكسير جزيئات المادة إلى أيونات. تسمى هذه الظاهرة بالتفكك الإلكتروليتي ، والمحلول نفسه عبارة عن إلكتروليت قادر على توصيل تيار كهربائي. جميع أحواض المياه على الأرض هي ، بدرجة أكبر أو أقل ، شوارد طبيعية.
محيط العالم هو محلول الأيونات لجميع عناصر الجدول الدوري تقريبًا.
عصير المعدة ، الدم ، اللمف ، جميع السوائل في جسم الإنسان هي شوارد. تتكون جميع الحيوانات والنباتات أيضًا بشكل أساسي من الإلكتروليتات.
وفقًا لدرجة التفكك ، توجد شوارد ضعيفة وقوية. الماء هو إلكتروليت ضعيف ، ومعظمه أحماض غير عضويةيشير إلى إلكتروليتات قوية. تسمى الإلكتروليتات أيضًا موصلات من النوع الثاني.
ناقلات الشحنات الكهربائية في سائل
 عندما تذوب في الماء (أو سائل آخر) من مواد مختلفة ، فإنها تتحلل إلى أيونات.
عندما تذوب في الماء (أو سائل آخر) من مواد مختلفة ، فإنها تتحلل إلى أيونات.
على سبيل المثال ، عادي ملحينفصل كلوريد الصوديوم (كلوريد الصوديوم) في الماء إلى أيونات صوديوم موجبة (Na +) وأيونات كلوريد سالبة (Cl-). إذا كان القطبان الموجودان في الإلكتروليت الناتج عند إمكانات مختلفة ، فإن الأيونات السالبة تنجرف نحو القطب الموجب بينما تنجرف الأيونات الموجبة نحو القطب السالب.
وبالتالي ، فإن التيار الكهربائي في السائل يتكون من تدفقات من الأيونات الموجبة والسالبة الموجهة تجاه بعضها البعض.
في حين أن الماء النقي تمامًا هو عازل ، فإن الماء الذي يحتوي على شوائب صغيرة (طبيعية أو يتم إدخالها من الخارج) من مادة متأينة هو موصل للتيار الكهربائي.
التحليل الكهربائي

لأن الأيونات الموجبة والسالبة للمذاب تنجرف في اتجاه المجال الكهربائي جوانب مختلفة، تنقسم المادة تدريجياً إلى قسمين.
يسمى هذا الفصل للمادة إلى عناصرها المكونة بالتحليل الكهربائي.
تُستخدم الإلكتروليتات في الكيمياء الكهربائية ، وفي مصادر التيار الكيميائي (الخلايا والبطاريات الجلفانية) ، وفي عمليات إنتاج الطلاء بالكهرباء وغيرها من التقنيات القائمة على حركة الشحنات الكهربائية في السوائل تحت تأثير المجال الكهربائي.
يذوب
يمكن تفكك مادة ما دون مشاركة الماء. يكفي لإذابة البلورات التركيب الكيميائيالمواد وتذوب. ذوبان المادة ، مثل الإلكتروليتات المائية ، هي موصلات من النوع الثاني ، وبالتالي يمكن تسميتها بالكهرباء. للتيار الكهربي في الذوبان نفس طبيعة التيار في الإلكتروليتات المائية - وهي تدفقات عكسية للأيونات الموجبة والسالبة.

باستخدام المواد المنصهرة ، في علم المعادن ، يتم الحصول على الألومنيوم كهربائياً من الألومينا. يمر تيار كهربائي عبر أكسيد الألومنيوم وأثناء التحليل الكهربائي ، يتراكم الألمنيوم النقي في أحد الأقطاب الكهربائية (الكاثود). هذه عملية كثيفة الاستهلاك للطاقة ، والتي ، من حيث استهلاك الطاقة ، تشبه تحلل الماء إلى هيدروجين وأكسجين باستخدام التيار الكهربائي.
في محل الألمنيوم للتحليل الكهربائي
« فيزياء - الصف العاشر "
ما هي ناقلات التيار الكهربائي في الفراغ؟
ما هي طبيعة حركتهم؟
السوائل ، مثل أجسام صلبةيمكن أن تكون عوازل وموصلات وأشباه الموصلات. تشمل المواد العازلة للكهرباء الماء المقطر والموصلات - المحاليل وذوبان الإلكتروليتات: الأحماض والقلويات والأملاح. أشباه الموصلات السائلة هي السيلينيوم المنصهر ، الكبريتيد المنصهر ، إلخ.
التفكك الالكتروليتي.
عندما يتم إذابة الإلكتروليتات ، تحت تأثير المجال الكهربائي لجزيئات الماء القطبية ، تتحلل جزيئات الإلكتروليت إلى أيونات.
يسمى تفكك الجزيئات إلى أيونات تحت تأثير المجال الكهربائي لجزيئات الماء القطبية التفكك الالكتروليتي.
درجة التفكك- نسبة الجزيئات في المادة المذابة التي تحللت إلى أيونات.
درجة التفكك تعتمد على درجة الحرارة وتركيز المحلول و الخواص الكهربائيةمذيب.
مع زيادة درجة الحرارة ، تزداد درجة التفكك ، وبالتالي يزداد تركيز الأيونات الموجبة والسالبة الشحنة.
يمكن للأيونات ذات العلامات المختلفة ، عند الاجتماع ، أن تتحد مرة أخرى في جزيئات محايدة.
في ظل ظروف ثابتة ، يتم إنشاء توازن ديناميكي في المحلول ، حيث يكون عدد الجزيئات التي تتحلل إلى أيونات في الثانية مساويًا لعدد أزواج الأيونات التي تتحد في جزيئات محايدة في نفس الوقت.
التوصيل الأيوني.
حاملات الشحنة في المحاليل المائية أو المواد المنصهرة بالكهرباء عبارة عن أيونات موجبة وسالبة الشحنة.
إذا تم تضمين وعاء به محلول إلكتروليت دائرة كهربائية، ثم تبدأ الأيونات السالبة في التحرك نحو القطب الموجب - الأنود ، والإيجابي - نحو القطب السالب - الكاثود. نتيجة لذلك ، سوف يتدفق تيار كهربائي عبر الدائرة.
التوصيل محاليل مائيةأو ذوبان المنحلات بالكهرباء ، التي تتم بواسطة الأيونات ، يسمى الموصلية الأيونية.
التحليل الكهربائي.مع التوصيل الأيوني ، يرتبط مرور التيار بنقل المادة. على الأقطاب الكهربائية ، يتم إطلاق المواد التي تتكون منها الإلكتروليتات. في القطب الموجب ، تتبرع الأيونات السالبة الشحنة بإلكتروناتها الزائدة (يسمى هذا في الكيمياء تفاعل مؤكسد) ، وعند الكاثود ، تحصل الأيونات الموجبة على الإلكترونات المفقودة (تفاعل اختزال).
يمكن أن تحتوي السوائل أيضًا على موصلية إلكترونية. هذه الموصلية تمتلكها ، على سبيل المثال ، المعادن السائلة.
تسمى عملية إطلاق مادة في القطب ، مرتبطة بتفاعلات الأكسدة والاختزال التحليل الكهربائي.
ما الذي يحدد كتلة المادة التي يتم إطلاقها في وقت معين؟ من الواضح أن الكتلة m للمادة المحررة تساوي ناتج الكتلة m 0i لأيون واحد بعدد N i من الأيونات التي وصلت إلى القطب خلال الوقت Δt:
م = م 0 ط ن أنا. (16.3)
الكتلة الأيونية m 0i هي:
حيث M هي الكتلة المولية (أو الذرية) للمادة ، و N A هي ثابت أفوجادرو ، أي عدد الأيونات في مول واحد.
عدد الأيونات التي تصل إلى القطب هو
حيث Δq = IΔt هي الشحنة التي تمر عبر المنحل بالكهرباء خلال الوقت Δt ؛ q 0i هي شحنة الأيون ، والتي يتم تحديدها من خلال التكافؤ n للذرة: q 0i \ u003d ne (e هي الشحنة الأولية). أثناء تفكك الجزيئات ، على سبيل المثال KBr ، تتكون من ذرات أحادية التكافؤ (n = 1) ، تظهر أيونات K + و Br. يؤدي تفكك جزيئات كبريتات النحاس إلى ظهور أيونات Cu 2+ و SO2-4 مشحونة بشكل مضاعف (ن = 2). استبدال التعبيرات (16.4) و (16.5) في الصيغة (16.3) مع الأخذ في الاعتبار أن Δq = IΔt ، a q 0i = ne ، نحصل عليها
قانون فاراداي.
دعونا نشير بواسطة k إلى معامل التناسب بين الكتلة m للمادة والشحنة Δq = IΔt المار عبر المنحل بالكهرباء:
حيث F \ u003d eN A \ u003d 9.65 10 4 C / mol - ثابت فاراداي.
يعتمد المعامل k على طبيعة المادة (قيم M و n). حسب الصيغة (16.6) لدينا
م = kIΔt. (16.8)
قانون فاراداي للتحليل الكهربائي:
كتلة المادة المنبعثة على القطب خلال الوقت Δt. أثناء مرور التيار الكهربائي ، يتناسب مع قوة التيار والوقت.
تم الحصول على هذا البيان نظريًا لأول مرة بشكل تجريبي بواسطة فاراداي.
تسمى القيمة k في الصيغة (16.8) المكافئ الكهروكيميائيمادة معينة ومعبر عنها في كيلوغرام لكل قلادة(كجم / ج).
من الصيغة (16.8) يمكن ملاحظة أن المعامل k يساوي عدديًا كتلة المادة المنبعثة على الأقطاب الكهربائية أثناء نقل شحنة مقدارها 1 C بواسطة الأيونات.

المكافئ الكهروكيميائي له بسيط المعنى المادي. منذ M / N A \ u003d m 0i و en \ u003d q 0i ، ثم وفقًا للصيغة (16.7) k \ u003d rn 0i / q 0i ، أي k هي نسبة كتلة الأيونات إلى شحنتها.
من خلال قياس قيم m و q ، يمكن للمرء تحديد المعادلات الكهروكيميائية للمواد المختلفة.
يمكنك التحقق من صحة قانون فاراداي من خلال الخبرة. دعونا نقوم بتجميع التثبيت الموضح في الشكل (16.25). تمتلئ جميع الحمامات الإلكتروليتية الثلاثة بمحلول الإلكتروليت نفسه ، لكن التيارات التي تمر عبرها مختلفة. دعنا نشير إلى قوة التيارات من خلال I1 ، I2 ، I3. ثم أنا 1 = أنا 2 + أنا 3. من خلال قياس الكتل م 1 ، م 2 ، م 3 من المواد المنبعثة على الأقطاب الكهربائية في الحمامات المختلفة ، يمكن التأكد من أنها متناسبة مع التيارات المقابلة I 1 ، I 2 ، I 3.
تحديد شحنة الإلكترون.
يمكن استخدام الصيغة (16.6) لكتلة المادة المنبعثة على القطب لتحديد شحنة الإلكترون. من هذه الصيغة ، يترتب على ذلك أن معامل شحنة الإلكترون يساوي:
بمعرفة كتلة m من المادة المحررة أثناء مرور الشحنة IΔt ، والكتلة المولية M ، وتكافؤ n من الذرات وثابت Avogadro N A ، يمكن للمرء أن يجد قيمة معامل شحنة الإلكترون. اتضح أنها تساوي e = 1.6 10 -19 C.
وبهذه الطريقة تم الحصول على قيمة الشحنة الكهربائية الأولية لأول مرة في عام 1874.
تطبيق التحليل الكهربائي.يستخدم التحليل الكهربائي على نطاق واسع في الهندسة لأغراض مختلفة. قم بتغطية سطح أحد المعادن بطبقة رقيقة من معدن آخر ( طلاء النيكل والكروم والطلاء بالذهبإلخ.). هذا الطلاء المتين يحمي السطح من التآكل. إذا تم ضمان التقشير الجيد للطلاء الإلكتروليتي من السطح الذي ترسب عليه المعدن (يتم تحقيق ذلك ، على سبيل المثال ، عن طريق تطبيق الجرافيت على السطح) ، فيمكن الحصول على نسخة من سطح الإغاثة.
عملية الحصول على طلاءات قابلة للنزع - النوع الكهربائي- تم تطويره بواسطة العالم الروسي ب. س. جاكوبي (1801-1874) ، الذي طبق هذه الطريقة في عام 1836 لعمل أشكال مجوفة لكاتدرائية القديس إسحاق في سانت بطرسبرغ.
في السابق ، في صناعة الطباعة ، تم الحصول على نسخ من سطح إغاثة (قوالب نمطية) من المصفوفات (بصمة لمجموعة على مادة بلاستيكية) ، والتي من أجلها وضعت طبقة سميكة من الحديد أو مادة أخرى على المصفوفات. هذا جعل من الممكن إعادة إنتاج المجموعة بالعدد المطلوب من النسخ.
يزيل التحليل الكهربائي الشوائب من المعادن. وهكذا ، يصب النحاس الخام الذي يتم الحصول عليه من الركاز في شكل صفائح سميكة ، توضع بعد ذلك في الحمام على شكل أنودات. أثناء التحليل الكهربائي ، يذوب أنود النحاس ، وتسقط الشوائب التي تحتوي على معادن ثمينة ونادرة إلى القاع ، ويستقر النحاس النقي على القطب السالب.
يتم الحصول على الألمنيوم من البوكسيت المنصهر عن طريق التحليل الكهربائي. كانت هذه الطريقة في الحصول على الألمنيوم هي التي جعلته رخيصًا ، وإلى جانب الحديد ، الأكثر شيوعًا في التكنولوجيا والحياة اليومية.
بمساعدة التحليل الكهربائي ، يتم الحصول على لوحات الدوائر الإلكترونية ، والتي تعمل كأساس لجميع المنتجات الإلكترونية. يتم لصق طبقة رقيقة على العازل لوحة من النحاس، حيث يتم تطبيق نمط معقد من الأسلاك المتصلة بطلاء خاص. ثم يتم وضع اللوحة في إلكتروليت ، حيث يتم حفر مناطق الطبقة النحاسية غير المغطاة بالطلاء. بعد ذلك ، يتم غسل الطلاء ، وتظهر تفاصيل الدائرة الصغيرة على السبورة.