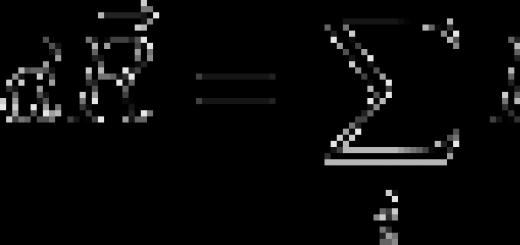Усім знайоме визначення електричного струму. Воно представляється як спрямований рух заряджених частинок. Подібний рух у різних середовищах має важливі відмінності. Як основний приклад цього явища можна представити перебіг та розповсюдження електричного струму в рідинах. Такі явища характеризуються різними властивостями та серйозно відрізняються від упорядкованого руху заряджених частинок, що відбувається у звичайних умовах не під впливом різних рідин.
Малюнок 1. Електричний струму рідинах. Автор24 - інтернет-біржа студентських робіт
Формування електричного струму у рідинах
Незважаючи на те, що процес провідності електричного струму здійснюється за допомогою металевих приладів (провідників), струм у рідинах залежить від руху заряджених іонів, які придбали або втратили з певної причини подібні атоми і молекули. Показником такого руху є зміна властивостей певної речовини, де проходять іони. Таким чином, потрібно спиратися на основне визначення електричного струму, щоб сформувати специфічне поняття формування струму різних рідин. Визначено, що розкладання негативно заряджених іонів сприяє руху в область джерела струму з позитивними значеннями. Позитивно заряджені іони у таких процесах рухатимуться у протилежному напрямку – до негативного джерела струму.
Рідкі провідники поділяються на три основні типи:
- напівпровідники;
- діелектрики;
- провідники.
Визначення 1
Електролітична дисоціація – процес розкладання молекул певного розчинуна негативні та позитивні заряджені іони.
Можна встановити, що електрострум у рідинах може виникати після зміни складу та хімічної властивості використовуваних рідин. Це геть-чисто суперечить теорії поширення електричного струму іншими способами при використанні звичайного металевого провідника.
Досліди Фарадея та електроліз
Перебіг електричного струму в рідинах – це продукт переміщення заряджених іонів. Проблеми, пов'язані з виникненням і розповсюдженням електроструму в рідинах, стали причиною вивчення знаменитого вченого Майкла Фарадея. Він за допомогою численних практичних дослідженьзміг знайти докази, що маса речовини, що виділяється у процесі електролізу, залежить від кількості часу та електрики. При цьому має значення час, протягом якого проводилися експерименти.
Також вчений зміг з'ясувати, що в процесі електролізу при виділенні певної кількості речовини потрібна однакова кількість електричних зарядів. Цю кількість вдалося точно встановити та зафіксувати в постійній величині, яка одержала назву числа Фарадея.
У рідинах електричний струм має інші умови розповсюдження. Він взаємодіє із молекулами води. Вони значною мірою ускладнюють всі пересування іонів, що не спостерігалося в дослідах з використанням звичайного металевого провідника. З цього випливає, що утворення струму при електролітичні реакціїбуде не настільки великим. Однак зі збільшенням температури розчину провідність поступово збільшується. Це означає, що напруга електричного струму зростає. Також у процесі електролізу було помічено, що ймовірність розпаду певної молекули на негативні чи позитивні заряди іонів збільшується через великої кількостімолекул речовини, що використовується, або розчинника. При насиченні розчину іонами понад певну норму, відбувається зворотний процес. Провідність розчину знову починає знижуватися.
В даний час процес електролізу знайшов своє застосування в багатьох галузях та сферах науки та на виробництві. Промислові підприємства його використовують при отриманні чи обробці металу. Електрохімічні реакції беруть участь у:
- електролізі солей;
- гальваніку;
- полірування поверхонь;
- інших окисно-відновних процесах.
Електричний струм у вакуумі та рідинах
Поширення електричного струму в рідинах та інших середовищах є досить складним процесом, який має власні характеристики, особливості та властивості. Справа в тому, що в подібних середовищах відсутні заряди в тілах, тому їх прийнято називати діелектриками. Головною метою досліджень стало те, щоб створити такі умови, за яких атоми та молекули могли б розпочати свій рух і процес утворення електричного струму розпочався. Для цього прийнято використовувати спеціальні механізми чи пристрої. Основним елементом таких модульних пристроїв стали провідники як металевих пластин.
Для визначення основних параметрів струму необхідно скористатися відомими теоріями та формулами. Найпоширенішим є закон Ома. Він виступає у ролі універсальної амперної характеристики, де здійснюється принцип залежності струму від напруги. Нагадаємо, що напруга вимірюється в одиниці Ампер.
Для проведення дослідів з водою та сіллю необхідно підготувати посудину із солоною водою. Це дасть практичне та візуальне уявлення про процеси, що відбуваються при утворенні електричного струму в рідинах. Також установка повинна містити електроди прямокутної форми та джерела живлення. Для повномасштабної підготовки до експериментів необхідно мати амперну установку. Вона допоможе провести енергію від мережі живлення до електродів.
У ролі провідників виступатимуть металеві пластини. Їх опускають у рідину, а потім підключається напруга. Відразу починається переміщення частинок. Воно відбувається у хаотичному режимі. У разі виникнення магнітного поляміж провідниками весь процес руху частинок упорядковуються.
Іони починають змінюватися зарядами та об'єднуватися. Отже, катоди стають анодами, а аноди – катодами. У цьому процесі необхідно враховувати ще кілька важливих факторів:
- рівень дисоціації;
- температура;
- електричний опір;
- використання змінного чи постійного струму.
Наприкінці експерименту відбувається утворення шару солі на пластинах.
Походження електричного струму (рух електричних зарядів) через розчин істотно відрізняється від руху електричних зарядів металевим провідником.
Відмінність, насамперед у цьому, що зарядоносіями в розчинах не електрони, а іони, тобто. самі атоми або молекули, що втратили або захопили один або кілька електронів.
Звичайно, цей рух, так чи інакше, супроводжується зміною властивостей самої речовини.
Розглянемо електричний ланцюг, елементом якого є посудина з розчином кухонної соліта з вставленими в нього електродами будь-якої форми із пластини. При підключенні до джерела живлення в ланцюзі з'являється струм, що є в розчині рух важких заряджених частинок - іонів. Поява іонів означає можливість хімічного розкладання розчину на два основних елементи - Na і Cl. Натрій, що втратив електрон, є позитивно зарядженим іоном, що рухається до електрода, який підключений до негативного полюса джерела живлення, електричного ланцюга. Хлор, "узурпірував" електрон, є негативним іон.
Негативні іони хлору рухаються до електрода, підключеного до позитивного полюса джерела живлення ел. ланцюги.
Утворення позитивних та негативних іонів відбувається внаслідок мимовільного розпаду молекули кухонної солі у водному розчині (електролітична дисоціація). Рух іонів обумовлений напругою, поданою на електроди, опущені розчин. Досягнувши електродів, іони забирають або віддають електрони, утворюючи відповідно молекули Cl та Na. Подібні явища спостерігаються у розчинах багатьох інших речовин. Молекули цих речовин, подібно до молекул кухонної солі, складаються з протилежно заряджених іонів, на які вони і розпадаються в розчинах. Кількість молекул, що розпалися, точніше, кількість іонів, характеризує електричний опір розчину.
Ще раз підкреслимо, що походження електричного струму по ланцюгу, елементом якого є розчин, викликає переміщення речовини цього елемента електричного ланцюга, і, отже, зміна його хімічних властивостей, у той час як при проходженні електричного струму по металевому провіднику жодних змін у провіднику не відбувається.
Від чого залежить кількість речовини, що виділяється при електролізі на електродах? Вперше на це запитання відповів Фарадей. Фарадей показав експериментально, що маса речовини, що виділяється, пов'язана з силою струму і часом його протікання t співвідношенням (закон Фарадея):
Маса речовини, що виділяється при електролізі речовини прямо пропорційна кількості що пройшла через електроліт електрики і не залежить від інших причин, крім роду речовини.
Зазначену закономірність можна перевірити на наступних дослідів. Наллємо в кілька ванн той самий електроліт, але різної концентрації. Опустимо у ванни електроди, що мають різну площу, і розташуємо їх у ванних кімнатах на різних відстанях. З'єднаємо всі ванни послідовно і пропустимо через них струм. Тоді через кожну ванну, очевидно, пройде однакова кількість електрики. Зваживши катоди до і після досвіду, ми виявимо, що у всіх катодах виділилося однакову кількість речовини. З'єднавши всі ванни паралельно і пропустивши через них струм, можна переконатися, що кількість речовини, що виділилася на катодах, прямо пропорційно кількості електрики, що пройшла через кожну з них. Нарешті, з'єднавши послідовно ванни з різними електролітами, легко встановити, що кількість речовини, що виділилася, залежить від роду цієї речовини.
Величина, що характеризує залежність кількості речовини, що виділяється при електролізі від його роду, називається електрохімічним еквівалентом і позначається буквою до.
Маса речовини, що виділяється при електролізі, являє собою загальну масу всіх іонів, що розрядилися на електроді. Піддаючи електролізу різні солі, можна на досвіді встановити кількість електрики, що має пройти через електроліт, щоб виділився один кілограм – еквівалент даної речовини. Такі досліди вперше проробив Фарадей. Він виявив, що з виділення одного кілограм - еквівалента будь-якої речовини при електролізі потрібно однакові кількості електрики, рівні 9,65·107 к.
Кількість електрики, необхідне виділення при електролізі кілограм - еквівалента речовини, називається числом Фарадея і позначається літерою F:
F = 9,65 · 107 к.
В електроліті іон виявляється оточеним молекулами розчинника (води), що мають значні дипольні моменти. Взаємодіючи з іоном, дипольні молекули повертаються до нього своїми кінцями, що мають заряд, знак якого протилежний заряду іона, тому упорядкове рух іона в електричному полі не може, і рухливість іонів значно поступається рухливості електронів провідності в металі. Так як і концентрація іонів зазвичай не велика в порівнянні з концентрацією електронів у металі, то електрична провідність у електролітів завжди істотно менша за електричну провідність металів.
Внаслідок сильного нагрівання струмом електролітах досяжні лише незначні щільності струму, тобто. невеликі напруженості електричного поля. При підвищенні температури електроліту впорядкована орієнтація диполів розчинника погіршується під впливом безладного руху молекул, що посилився, тому дипольна оболонка частково руйнується, рухливість іонів і провідність розчину збільшується. Залежність питомої електричної провідності від концентрації за постійної температурі складна. Якщо розчинення можливе у будь-яких пропорціях, то за деякої концентрації електрична провідність має максимум. Причина цього така: ймовірність розпаду молекул на іони пропорційна числу молекул розчинника та числу молекул розчинної речовинив одиниці обсягу. Але можливий і зворотний процес: (рекомбінація іонів у молекули), можливість якого пропорційна квадрату числа пар іонів. Нарешті, електрична провідність пропорційна числу пар іонів в одиниці обсягу. Тому при малих концентраціях дисоціація повна, але загальна кількість іонів мала. При дуже великих концентраціях дисоціація слабка та кількість іонів також невелика. Якщо розчинність речовини обмежена, зазвичай максимуму електричної провідності немає. При заморожуванні в'язкість водного розчину різко зростає, рухливість іонів різко зменшується, і питома електрична провідність падає у тисячу разів. При затвердінні ж рідких металів рухливість електронів і питома електрична провідність майже не змінюється.
Електроліз широко застосовується у різних електрохімічних виробництвах. Найважливіші з них: електролітичне отримання металів з водних розчинів їх солей та їх розплавлених солей; електроліз хлористих солей; електролітичне окиснення та відновлення; одержання водню електролізом; гальваностегія; гальванопластика; електрополірування. Методом рафінування одержують чистий метал, очищений від домішок. Гальваностегія – покриття металевих предметів іншим шаром металу. Гальванопластика - отримання металевих копій з рельєфних зображень будь-яких поверхонь. Електрополірування – вирівнювання металевих поверхонь.
Практично кожній людині відоме визначення електричного струму як вся справа в тому, що походження і рух його в різних середовищах досить сильно відрізняється один від одного. Зокрема, електричний струм у рідинах має дещо інші властивості, ніж Мова йдепро ті ж металеві провідники.
Основна відмінність полягає в тому, що струм у рідинах - це рух заряджених іонів, тобто атомів або навіть молекул, які з будь-якої причини втратили або придбали електрони. При цьому одним із показників цього руху є зміна властивостей тієї речовини, за якою дані іони проходять. Спираючись на визначення електричного струму, ми можемо припустити, що при розкладанні негативно заряджені іони будуть рухатися у бік позитивного, а позитивні, навпаки, до негативного.
Процес розкладання молекул розчину на позитивні та негативні заряджені іони отримав у науці назву електролітичної дисоціації. Таким чином, електричний струм у рідинах виникає внаслідок того, що, на відміну від того ж металевого провідника, змінюється склад і Хімічні властивостіцих рідин, результатом чого є процес переміщення заряджених іонів.
Електричний струм у рідинах, його походження, кількісні та якісні характеристики були однією з головних проблем, вивчення якої тривалий час займався знаменитий фізик М. Фарадей. Зокрема, за допомогою численних експериментів йому вдалося довести, що маса речовини, що виділяється при електролізі, безпосередньо залежить від кількості електрики і часу, протягом якого цей електроліз здійснювався. Від жодних інших причин, за винятком роду речовини, ця маса не залежить.
Крім того, вивчаючи струм у рідинах, Фарадей експериментально з'ясував, що для виділення одного кілограма будь-якої речовини при електролізі необхідна одна і та ж кількість Ця кількість, що дорівнює 9,65.10 7 к., отримала назву числа Фарадея.
На відміну від металевих провідників, електричний струм у рідинах виявляється оточеним, які значно ускладнюють пересування іонів речовини. У зв'язку з цим, у будь-якому електроліті можливе утворення струму лише невеликої напруги. У той самий час, якщо температура розчину підвищується, його провідність збільшується, а поля зростає.
Електроліз має ще одну цікаву властивість. Справа в тому, що ймовірність розпаду тієї чи іншої молекули на позитивні та негативні заряджені іони тим вища, чим більша кількістьмолекул власне речовини та розчинника. У той же час, у певний момент настає перенасичення розчину іонами, після чого провідність розчину починає знижуватися. Таким чином, найбільш сильна проходитиме в розчині, де концентрація іонів вкрай невелика, проте напруженість електричного струму в таких розчинах буде вкрай низькою.
Процес електролізу знайшов широке застосуванняу різних промислових виробництвах, пов'язаних із проведенням електрохімічних реакцій. До найбільш важливих з них можна віднести отримання металу за допомогою електролітів, електроліз солей, що містять хлор та його похідні, окислювально-відновлювальні реакції, отримання такої необхідної речовини, як водень, полірування поверхонь, гальваніка. Наприклад, багатьох підприємствах машино- і приладобудування дуже поширений метод рафінування, який є отримання металу без будь-яких непотрібних домішок.
Щодо своїх електричних властивостейрідини відрізняються великою різноманітністю. Розплавлені метали, як і метали у твердому стані, мають високу електропровідність, пов'язану з великою концентрацією вільних електронів.
Багато рідин, наприклад чиста вода, спирт, гас, є хорошими діелектриками, оскільки їх молекули електронейтральні і відсутні вільні носії заряду.
Електроліти. Особливий клас рідин складають так звані електроліти, до яких належать водні розчини неорганічних кислот, солей і основ, розплави іонних кристалів і т. д. Для електролітів характерна наявність високих концентрацій іонів, що зумовлюють можливість проходження електричного струму. Ці іони виникають при плавленні і при розчиненні, коли під впливом електричних полів молекул розчинника відбувається розкладання молекул речовини, що розчиняється, на окремі позитивно і негативно заряджені іони. Такий процес називається електролітичною дисоціацією.
Електролітична дисоціація.Ступінь дисоціації цієї речовини, тобто частка молекул розчиненої речовини, що розпалися на іони, залежить від температури, концентрації розчину і діелектричної проникності розчинника. Зі збільшенням температури ступінь дисоціації зростає. Іони протилежних знаків можуть рекомбінувати, поєднуючись знову в нейтральні молекули. За незмінних зовнішніх умов у розчині встановлюється динамічна рівновага, при якому процеси рекомбінації та дисоціації компенсують один одного.
Якісно залежність ступеня дисоціації, а від концентрації розчиненої речовини можна встановити за допомогою наступних простих міркувань. Якщо в одиниці обсягу міститься молекул розчиненої речовини, то їх дисоційовані, а інші не дисоційовані. Число елементарних актів дисоціації в одиниці об'єму розчину пропорційно числу нерозщеплених молекул і тому дорівнює де А - коефіцієнт, що залежить від природи електроліту та температури. Число актів рекомбінації пропорційно числу зіткнень різноїменних іонів, тобто пропорційно числу як тих, так і інших іонів. Тому воно дорівнює де - коефіцієнт, постійний для даної речовини при певній температурі.
У стані динамічної рівноваги
![]()
Відношення не залежить від концентрації Видно, що менше концентрація розчину, тим ближче до одиниці: у дуже розбавлених розчинах практично всі молекули розчиненої речовини дисоційовані.
Чим вище діелектрична проникність розчинника, тим більше послаблюються іонні зв'язкиу молекулах розчиненої речовини і, отже, тим більший ступінь дисоціації. Так, соляна кислотадає електроліт з високою електропровідністю при розчиненні у воді, в той час як її розчин в етиловому ефірі дуже погано проводить електричний струм.
Незвичайні електроліти.Трапляються і дуже незвичайні електроліти. Наприклад, електролітом є скло, що є сильно переохолодженою рідиною, що володіє величезною в'язкістю. При нагріванні скло розм'якшується та його в'язкість сильно зменшується. Іони натрію, що присутні в склі, набувають помітної рухливості, і стає можливим проходження електричного струму, хоча при звичайних температурах скло є хорошим ізолятором.

Рис. 106. Демонстрація електропровідності скла під час нагрівання
Наочною демонстрацією цього може бути досвід, схема якого показано на рис. 106. Скляна паличка включена в освітлювальну мережу через реостат Поки паличка холодна, струм у ланцюгу мізерний через високий опір скла. Якщо паличку нагріти газовим пальником до температури 300-400 °С, її опір впаде до кількох десятків омів і нитка лампочки Л розжариться. Тепер можна укоротити лампочку ключем К. При цьому опір ланцюга зменшиться і сила струму зросте. У таких умовах паличка ефективно нагріватиметься електричним струмом і розпалюватиметься до яскравого світіння, навіть якщо прибрати пальник.
Іонна провідність.Проходження електричного струму в електроліті описується законом Ома
Електричний струм в електроліті виникає при скільки завгодно малому прикладеному напрузі.
Носіями заряду в електроліті є позитивно та негативно заряджені іони. Механізм електропровідності електролітів багато в чому подібний до описаного вище механізму електропровідності газів. Основні відмінності пов'язані з тим, що в газах опір руху носіїв заряду обумовлено головним чином зіткненнями з нейтральними атомами. У електролітах рухливість іонів обумовлена внутрішнім тертям - в'язкістю - при їх русі в розчиннику.
При підвищенні температури провідність електролітів, на противагу металам, збільшується. Це з тим, що із зростанням температури зростає ступінь дисоціації і зменшується в'язкість.
На відміну від електронної провідності, характерної для металів і напівпровідників, де проходження електричного струму не супроводжується будь-якою зміною хімічного складуречовини, іонна провідність пов'язана з перенесенням речовини
та виділенням на електродах речовин, що входять до складу електролітів. Такий процес називається електролізом.
Електроліз.При виділенні речовини на електроді зменшується концентрація відповідних іонів в області електроліту, що примикає до електрода. Тим самим тут порушується динамічна рівновага між дисоціацією та рекомбінацією: саме тут відбувається розкладання речовини внаслідок електролізу.
Електроліз вперше спостерігався при розкладанні води струмом від вольтова стовпа. Через кілька років знаменитий хімік Г. Деві відкрив натрій, виділивши його шляхом електролізу з їдкого натру. Кількісні закони електролізу були експериментально встановлені М. Фарадеєм в них легко обґрунтувати виходячи з механізму явища електролізу.
Закони Фарадея.Кожен іон має електричний заряд, кратний елементарному заряду е. Іншими словами, заряд іона дорівнює , де - ціле число, що дорівнює валентності відповідного хімічного елемента або сполуки. Нехай під час проходження струму на електроді виділилося іонів. Їхній заряд по абсолютної величиниПозитивні іони досягають катода і їх заряд нейтралізується електронами, що припливають до катода по дротах від джерела струму. Негативні іони підходять до анода і така сама кількість електронів йде по дротах до джерела струму. При цьому по замкнутому електричному ланцюзі проходить заряд
Позначимо через масу речовини, що виділився одному з електродів, а через масу іона (атома чи молекули). Очевидно, що, отже, помноживши чисельник і знаменник цього дробу на постійну авогадро.
де - атомна або молярна маса, постійна Фарадея, що визначається виразом
З (4) видно, що стала Фарадея має сенс «одного моля електрики», тобто це сумарний електричний заряд одного моля елементарних зарядів:
Формула (3) містить обидва закони Фарадея. Вона говорить про те, що маса речовини, що виділилася при електролізі, пропорційна минулому по ланцюгу заряду (перший закон Фарадея):
Коефіцієнт називається електрохімічним еквівалентом даної речовини і виражається в
кілограмів на кулон Він має сенс зворотної величини питомого заряду іона.
Електрохімічний еквівалент до пропорційний хімічному еквіваленту речовини (другий закон Фарадея).
Закони Фарадея та елементарний заряд.Оскільки в часи Фарадея уявлення про атомарну природу електрики ще не існувало, експериментальне відкриття законів електролізу було не тривіальним. Навпаки, саме закони Фарадея послужили сутнісно першим експериментальним доказом справедливості цих уявлень.
Вимірювання на досвіді постійної Фарадеядозволило вперше отримати числову оцінку значення елементарного заряду задовго до прямих вимірювань елементарного електричного заряду в дослідах Міллікена з масляними краплями. Чудово, що ідея атомарної структури електрики отримала недвозначне експериментальне підтвердження в дослідах електролізу, виконаних у 30-ті роки XIX століття, коли навіть ідея атомарної будови речовини ще не поділялася всіма вченими. У знаменитій промові, вимовленій у Королівському суспільстві та присвяченій пам'яті Фарадея, Гельмгольц таким чином коментував цю обставину:
«Якщо ми визнаємо існування атомів хімічних елементів, то ми не можемо уникнути і подальшого висновку, що електрика, як позитивна, так і негативна, розділена на певні елементарні кількості, які поводяться як атоми електрики».
Хімічні джерела струму.Якщо будь-який метал, наприклад цинк, занурити у воду, то кілька позитивних іонів цинку під впливом полярних молекул води почне переходити з поверхневого шару. кристалічних ґратметалу у воду. Через війну цинк зарядиться негативно, а вода позитивно. На межі металу та води утворюється тонкий шар, званий подвійним електричним шаром; у ньому існує сильне електричне поле, напруга якого спрямована від води до металу. Це поле перешкоджає подальшому переходу іонів цинку у воду, і в результаті виникає динамічна рівновага, при якому середня кількість іонів, що приходять з металу у воду, дорівнює кількості іонів, що повертаються з води в метал.
Динамічна рівновага встановиться і в тому випадку, якщо метал занурити в водний розчинсолі того ж металу, наприклад, цинк в розчин цинкового купоросу . У розчині сіль дисоціює на іони іони цинку, що утворилися при цьому, нічим не відрізняються від іонів цинку, що надійшли в розчин з електрода. Підвищення концентрації іонів цинку в електроліті полегшує перехід цих іонів у метал з розчину та ускладнює
перехід із металу в розчин. Тому в розчині цинкового купоросу занурений цинковий електрод хоч і заряджається негативно, але слабше, ніж у чистій воді.
При зануренні металу розчин метал не завжди заряджається негативно. Наприклад, якщо мідний електрод занурити в розчин мідного купоросу, то іони почнуть з розчину осаджуватися на електроді, заряджаючи його позитивно. Напруженість поля у подвійному електричному шарі в даному випадку спрямована від міді до розчину.
Таким чином, при зануренні металу у воду або водний розчин, що містить іони того ж металу, на межі металу з розчином між ними виникає різниця потенціалів. Знак і величина цієї різниці потенціалів залежить від типу металу (мідь, цинк тощо) від концентрації іонів у розчині і майже не залежить від температури та тиску.
Два електроди з різних металів, занурені в електроліт, утворюють гальванічний елемент. Наприклад, в елементі Вольта цинковий та мідний електроди занурені у водний розчин сірчаної кислоти. Спочатку розчин не містить ні іонів цинку, ні іонів міді. Однак надалі ці іони надходять у розчин з електродів і встановлюється динамічна рівновага. Поки електроди не з'єднані один з одним дротом, потенціал електроліту однаковий у всіх точках, а потенціали електродів відрізняються від потенціалу електроліту завдяки подвійним шарам, що утворюються, на їх межі з електролітом. При цьому електродний потенціал цинку дорівнює -0,763 В, а міді електродвигуна сила елемента Вольта, що складається з цих стрибків потенціалів, буде дорівнює
Струм у ланцюгу з гальванічним елементом.Якщо електроди гальванічного елемента з'єднати дротом, то електрони з цього дроту переходитимуть з негативного електрода (цинк) на позитивний (мідь), що порушує динамічну рівновагу між електродами та електролітом, в який вони занурені. Іони цинку почнуть переходити з електрода в розчин, щоб підтримувати подвійний електричний шар у колишньому стані з незмінним стрибком потенціалу між електродом і електролітом. Аналогічно у мідного електрода іони міді почнуть переходити з розчину і брати в облогу на електроді. При цьому у негативного електрода утворюється нестача іонів, а у позитивного - надлишок таких іонів. Загальне числоіонів у розчині не зміниться.
В результаті описаних процесів у замкненому ланцюгу буде підтримуватися електричний струм, який у сполучному дроті створюється рухом електронів, а в електроліті іонами. При проходженні електричного струму відбувається поступове розчинення цинкового електрода та осадження міді на позитивному (мідному)
електрод. Концентрація іонів збільшується у цинкового електрода та зменшується у мідного.
Потенціал у ланцюзі з гальванічним елементом.Описана картина проходження електричного струму в неоднорідному замкнутому ланцюгу, що містить хімічний елементвідповідає розподілу потенціалу вздовж ланцюга, схематично показаному на рис. 107. У зовнішньому ланцюгу, тобто в сполучному електроди дроті потенціал плавно знижується від значення на позитивному (мідному) електроді А до значення на негативному (цинковому) електроді відповідно до закону Ома для однорідного провідника. У внутрішньому ланцюгу, тобто в електроліті між електродами, потенціал плавно знижується від значення поблизу цинкового електрода до значення поблизу мідного електрода. Якщо зовнішнього ланцюга струм йде від мідного електрода до цинкового, то всередині електроліту - від цинкового до мідного. Скачки потенціалів у подвійних електричних шарах створюються внаслідок дії сторонніх (у разі хімічних) сил. Рух електричних зарядів у подвійних шарах завдяки стороннім силам відбувається проти спрямування дії електричних сил.

Рис. 107. Розподіл потенціалу вздовж ланцюга, що містить хімічний елемент
Похилим ділянкам зміни потенціалу на рис. 107 відповідають електричні опори зовнішнього та внутрішнього ділянок замкнутого ланцюга. Сумарне падіння потенціалу вздовж цих ділянок дорівнює сумі стрибків потенціалу в подвійних шарах, тобто електрорушійної сили елемента.
Проходження електричного струму в гальванічному елементі ускладнюється побічними продуктами, що виділяються на електродах, та появою перепаду концентрації в електроліті. Про ці явища говорять як про електролітичну поляризацію. Наприклад, в елементах Вольти при замиканні ланцюга позитивні іони рухаються до мідного електрода і осідають на ньому. В результаті через деякий час мідний електрод заміняється водневим. Оскільки електродний потенціал водню на 0,337 нижче електродного потенціалу міді, то ЕРС елемента зменшується приблизно на таку ж величину. Крім того, що виділяється на мідному електроді водень збільшує внутрішній опір елемента.
Для зменшення шкідливого впливуводню використовуються деполяризатори – різні окислювачі. Наприклад, у найбільш уживаному елементі Лекланше («сухі» батареї)
позитивним електродом служить графітовий стрижень, оточений спресованою масою перекису марганцю та графіту.
Акумулятори.Практично важливим різновидом гальванічних елементів є акумулятори, для яких після розрядки можливий зворотний процес заряджання з перетворенням електричної енергії на хімічну. Речовини, що витрачаються при отриманні електричного струму, відновлюються всередині акумулятора електролізом.
Видно, що при зарядці акумулятора підвищується концентрація сірчаної кислоти, що веде до збільшення густини електроліту.
Таким чином, у процесі зарядки створюється різка асиметрія електродів: один стає свинцевим, інший – з перекису свинцю. Заряджений акумулятор є гальванічний елемент, здатний служити джерелом струму.
При підключенні до акумулятора споживачів електричної енергії через ланцюг потече електричний струм, напрямок якого протилежний зарядному струму. Хімічні реакціїйдуть у зворотному напрямку та акумулятор повертається у вихідний стан. Обидва електроди будуть покриті шаром солі, а концентрація сірчаної кислоти повернеться до первісного значення.
У зарядженого акумулятора ЕРС становить приблизно 2,2 В. При розрядці вона знижується до 1,85 В. Подальшу розрядку робити не рекомендується, оскільки процес утворення сірчанокислого свинцю стає необоротним і акумулятор псується.
Максимальний заряд, який може віддати акумулятор при розрядженні, називається його ємністю. Ємність акумулятора зазвичай
вимірюється в ампер-годиннику. Вона тим більша, чим більша поверхняпластин.
Застосування електролізу.Електроліз використовується у металургії. Найбільш поширене електролітичне отримання алюмінію та чистої міді. За допомогою електролізу можна створювати тонкі шари одних речовин на поверхні інших з метою одержання декоративних та захисних покриттів (нікелювання, хромування). Процес отримання покриттів, що відшаровуються (гальванопластика) був розроблений російським ученим Б. С. Якобі, що застосував його для виготовлення порожніх скульптур, що прикрашають Ісаакіївський соборв Санкт-Петербурзі.
Чим відрізняється фізичний механізм електропровідності в металах та електролітах?
Поясніть, чому рівень дисоціації цієї речовини залежить від діелектричної проникності розчинника.
Поясніть, чому у сильно розведених розчинах електроліту практично всі молекули розчиненої речовини дисоційовані.
Поясніть, у чому механізм електропровідності електролітів подібний до механізму електропровідності газів. Чому за незмінних зовнішніх умов електричний струм пропорційний доданій напрузі?
Яку роль при виведенні закону електролізу (3) відіграє закон збереження електричного заряду?
Поясніть зв'язок електрохімічного еквівалента речовини із питомим зарядом його іонів.
Як можна на досвіді визначити відношення електрохімічних еквівалентів різних речовинякщо є кілька електролітичних ванн, але немає приладів для вимірювання сили струму?
Як явище електролізу можна використовуватиме створення лічильника витрати електроенергії в мережі постійного струму?
Чому закони Фарадея можна розглядати як експериментальний доказ уявлень про атомарну природу електрики?
Які процеси відбуваються при зануренні металевих електродів у воду та електроліт, що містить іони цих металів?
Опишіть процеси, що відбуваються в електроліті поблизу електродів гальванічного елемента під час проходження струму.
Чому всередині гальванічного елемента позитивні іони рухаються від негативного (цинкового) електрода до позитивного (мідного) електрода? Як у ланцюгу виникає розподіл потенціалу, що змушує іони рухатися саме так?
Чому ступінь зарядженості кислотного акумулятора можна перевіряти за допомогою ареометра, тобто приладу для вимірювання густини рідини?
Чим відрізняються процеси в акумуляторах від процесів у «сухих» батарейках?
Яка частина електричної енергії, витраченої в процесі заряджання акумулятора може бути використана при його розрядці, якщо в процесі зарядки акумулятора на його клемах підтримувалося напруга
Електронний струм у рідинах
У металевому провіднику електричний струм утворюється спрямованим рухом вільних електронів і що при цьому жодних змін речовини, з якого провідник зроблений, не відбувається.
Такі провідники, у яких проходження електронного струму не супроводжується хімічними змінами їх речовини, називаються провідниками першого роду. До них відносяться всі метали, вугілля та ряд інших речовин.
Але є в природі і такі провідники електричного струму, в яких під час проходження струму відбуваються хімічні явища. Ці провідники називаються провідниками другого роду. До них відносяться переважно різні суміші у воді кислот, солей і лугів.
Якщо в скляну посудину налити води і додати до неї кілька крапель сірчаної кислоти (або будь-якої іншої кислоти або лугу), а потім взяти дві залізні пластинки і приєднати до них провідники, опустивши ці пластинки в посудину, а до інших кінців провідників підключити джерело струму. через вимикач і амперметр, то відбудеться виділення газу з розчину, при цьому воно триватиме безперервно, поки замкнений ланцюг т.к. підкислена вода справді є провідником. З іншого боку, платівки почнуть покриватися бульбашками газу. Потім ці бульбашки відриватимуться від пластинок і виходитимуть назовні.
При проходженні по розчину електричного струму відбуваються хімічні зміни, у яких виділяється газ.
Провідники другого роду називаються електролітами , а явище, що у електроліті під час проходження нього електронного струму, - .
Залізні платівки, опущені в електроліт, називаються електродами; одна з них, пов'язана з позитивним полюсом джерела струму, називається анодом, а інша, пов'язана з негативним полюсом, - катодом.
Чим все-таки визначається проходження електронного струму в рідкому провіднику? Виявляється, у таких сумішах (електролітах) молекули кислоти (луги, солі) під дією розчинника (у цьому випадку води) розпадаються на дві складові, при цьому одна частинка молекули має позитивний електронний заряд, іншу негативний.
Частинки молекули, які мають електронним зарядом, називаються іонами . При розчиненні у питній воді кислоти, солі чи луги у розчині утворюється величезна кількістьяк позитивних, і негативно заряджених іонів.
Тепер має стати зрозумілим, чому через розчин пройшов електричний струм, адже між електродами, з'єднаними з джерелом струму, створена різниця потенціалів, інакше кажучи, один з них виявився зарядженим позитивно, а інший негативно. Під дією цієї різниці потенціалів позитивні іони почали перемішатися у напрямку негативного електрода - катода, а негативні іони - до анода.
Таким чином, хаотичний рух іонів став упорядкованим зустрічним рухом негативно заряджених іонів в один бік і позитивних в інший. Цей процес перенесення зарядів і становить перебіг електронного струму через електроліт і відбувається доти, поки є різниця потенціалів на електродах. Зі зникненням різниці потенціалів припиняється струм через електроліт, порушується впорядкований рух іонів, і знову настає хаотичний рух.
Як приклад розглянемо явище електролізу при пропусканні електронного струму через розчин мідного купоросу CuSO4 з опущеними до нього мідними електродами.

Явище електролізу при проходженні струму через розчин мідного купоросу: С - посудина з електролітом, Б - джерело струму, В - вимикач
Тут також буде зустрічний рух іонів до електродів. Позитивним іоном буде іон міді (Сі), а негативним – іон кислотного залишку (SO4). Іони міді при зіткненні з катодом будуть розряджатися (приєднуючи до себе відсутні електрони), тобто перетворюватися на нейтральні молекули чистої міді, і у вигляді найтоншого (молекулярного) шару відкладатися на катоді.
Негативні іони, досягнувши анода, також розряджаються (віддають зайві електрони). Але при цьому вони вступають у хімічну реакцію з міддю анода, в результаті чого до кислотного залишку SO4 приєднується молекула міді Сu і утворюється молекула мідного купоросу СuS О4, що повертається назад електроліту.
Так як цей хімічний процес протікає довгий час, то на катоді відкладається мідь, що виділяється з електроліту. У цьому електроліт замість які пішли на катод молекул міді отримує нові молекули міді з допомогою розчинення другого електрода - анода.
Той самий процес відбувається, якщо замість мідних взяті цинкові електроди, а електроліт служить розчин цинкового купоросу Zn SO4. Цинк також переноситиметься з анода на катод.
Таким чином, різниця між електричним струмом в металах і рідких провідникаху тому, що у металах переносниками зарядів є лише вільні електрони, т. е. негативні заряди, тоді як і електролітах електрика переноситься різноіменно зарядженими частинками речовини - іонами, які у зворотних напрямах. Тому кажуть, що електроліти мають іонну провідність.

Явище електролізубуло відкрито в 1837 р. Б. С. Якобі, який створював численні експерименти з вивчення та вдосконалення хімічних джерел струму. Якобі встановив, що один із електродів, поміщених у розчин мідного купоросу, при проходженні через нього електронного струму покривається міддю.
Це явище, назване гальванопластикою, знаходить на Наразідуже величезне практичне застосування. Однією з прикладів тому може бути покриття залізних предметів вузьким шаром інших металів, т. е. нікелювання, золочення, сріблення тощо.
Гази (зокрема і повітря) у звичайних умовах не проводять електричний струм. Наприклад, голі дроти повітряних ліній, будучи підвішені паралельно один одному, виявляються ізольованими один від одного шаром повітря.
Однак під впливом високої температури, великої різниці потенціалів та інших причин гази, подібно рідким провідникам, іонізуються, тобто в них з'являються у великій кількості частинки молекул газу, які, будучи переносниками електрики, сприяють проходженню через газ електричного струму.
Але водночас іонізація газу відрізняється від іонізації рідкого провідника. Якщо води відбувається розпад молекули на дві заряджені частини, то газах під впливом іонізації від кожної молекули завжди відокремлюються електрони і залишається іон як позитивно зарядженої частини молекули.
Варто тільки закінчити іонізацію газу, як він закінчить проводити, тоді як рідина завжди залишається провідником електронного струму. Отже, провідність газу - явище тимчасове, залежить від дії зовнішніх причин.

Але є й інший вид розряду, що називається дуговим розрядомабо просто електронною дугою. Явище електронної дуги було відкрито на початку 19 століття першим російським електротехніком В. В. Петровим.
В. В. Петров, проробляючи численні експерименти, виявив, що між двома деревними вугіллям, з'єднаними з джерелом струму, утворюється безперервний електронний розряд через повітря, що супроводжується яскравим світлом. У своїх працях В. В. Петров писав, що при цьому «чорний спокій досить яскраво висвітлений можливо». Так вперше було отримано електронне світло, практично застосував який ще один російський учений-електротехнік Павло Миколайович Яблочков.
«Свічка Яблочкова», робота якої заснована на використанні електронної дуги, зробила на той час реальний переворот в електротехніці.

Дуговий розряд застосовується як джерело світла і в наші дні, наприклад у прожекторах та проекційних апаратах. Висока температура дугового розряду дозволяє використовувати його для влаштування дугової печі. В даний час дугові печі, що живляться струмом дуже великої сили, використовуються у ряді областей промисловості: для виплавки сталі, чавуну, феросплавів, бронзи і т.д. А в 1882 році Н. Н. Бенардосом дуговий розряд вперше був застосований для різання та зварювання металу.
У газосвітніх трубках, лампах денного світла, стабілізаторах напруги, щоб одержати електричних і іонних пучків використовується так званий тліючий газовий розряд.
Іскровий розряд застосовується для вимірювання величезних різниць потенціалів за допомогою кульового розрядника, електродами якого служать дві залізні кулі з полірованою поверхнею. Кулі розсувають, і на них подається різниця потенціалів, що вимірюється. Потім кулі зближують до того часу, поки з-поміж них не перескочить іскра. Знаючи діаметр куль, відстань з-поміж них, тиск, температуру і вологість повітря, знаходять різницю потенціалів між кулями за спеціальним таблицям. Цим методом можна визначати з точністю до кількох відсотків різниці потенціалів порядку десятків тисяч вольт.
Це поки що все. Ну а якщо Ви хочете дізнатися більше, то рекомендую звернути увагу на диск Михайла Ванюшина:
«Про електрику для початківців у відео форматі на DVD-диску»