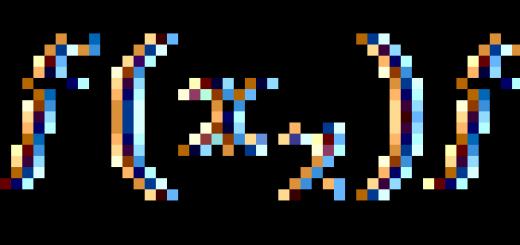Не зайве почати з визначення поняття алканів. Це насичені або граничні Також можна сказати, що це вуглеці, в яких з'єднання атомів C здійснюється за допомогою простих зв'язків. Загальна формула має вигляд: CnH₂n+2.
Відомо, що співвідношення кількості атомів H та C у їх молекулах максимально, якщо порівнювати з іншими класами. Зважаючи на те, що всі валентності зайняті або C, або H, хімічні властивості алканів виражені недостатньо яскраво, тому їх другою назвою виступає словосполучення граничні або насичені вуглеводні.
Також існує більш давнє найменування, яке найкраще відображає їхню відносну хімінертність - парафіни, що в перекладі означає «позбавлені спорідненості».
Отже, тема нашої сьогоднішньої розмови: "Алкани: гомологічний ряд, номенклатура, будова, ізомерія". Також будуть представлені дані щодо їх фізичних властивостей.
Алкани: будова, номенклатура
Вони атоми C перебувають у такому стані, як sp3-гибридизация. У зв'язку з цим молекулу алканів можна продемонструвати як набор тетраедричних структур C, які пов'язані не тільки між собою, але і з H.
Між атомами C і H присутні міцні, малополярні s-зв'язку. Атоми ж навколо простих зв'язків завжди обертаються, через що молекули алканів набувають різноманітних форм, причому довжина зв'язку, кут між ними. постійні величини. Форми, які трансформуються одна в одну через обертання молекули, що відбувається навколо σ-зв'язків, прийнято називати її конформаціями.

У процесі відриву атома H від молекули, що розглядається, формуються 1-валентні частинки, звані вуглеводневими радикалами. Вони виникають у результаті сполук як і неорганічних. Якщо відібрати 2 атоми водню від молекули граничного вуглеводню, то вийдуть 2-валентні радикали.
Таким чином, номенклатура алканів може бути:
- радіальної (старий варіант);
- замісною (міжнародна, систематична). Вона запропонована ІЮПАК.
Особливості радіальної номенклатури
У першому випадку номенклатура алканів характеризується таким:
- Розгляд вуглеводнів як похідних метану, що має заміщений 1 чи кілька атомів H радикалами.
- Висока міра зручності у випадку з не дуже складними з'єднаннями.
Особливості замісної номенклатури
Замісна номенклатура алканів має такі особливості:
- Основа для назви - 1 вуглецевий ланцюг, решта молекулярних фрагментів розглядаються як заступники.
- За наявності кількох ідентичних радикалів перед найменуванням вказується число (суворо прописом), а радикальні номери поділяються комами.
Хімія: номенклатура алканів
Для зручності інформація представлена як таблиці.
Назва речовини | Основа назви (корінь) | Молекулярна формула | Назва вуглецевого заступника | Формула вуглецевого заступника |
Вищевказана номенклатура алканів включає назви, що склалися історично (перші 4 члени низки граничних вуглеводнів).
Найменування нерозгорнутих алканів з 5 і більше атомами C утворені від грецьких числівників, які відображають це число атомів C. Так, суфікс -ан говорить про те, що речовина з низки насичених сполук.

При складанні назв розгорнутих алканів у ролі основного ланцюга вибирається той, який містить максимальну кількість атомів C. Він нумерується так, щоб заступники були з найменшим номером. У разі двох і більше ланцюгів однакової довжини головною стає та, що містить найбільша кількістьзаступників.
Ізомерія алканів
Як вуглеводень-родоначальник їх ряду виступає метан CH₄. З кожним наступним представником метанового ряду спостерігається відмінність від попереднього на метиленову групу - CH₂. Ця закономірність простежується у всьому ряді алканів.
Німецький вчений Шиль висунув пропозицію назвати цей ряд гомологічним. У перекладі з грецької означає «подібний».
Таким чином, гомологічний ряд - набір споріднених органічних сполук, що мають однотипну структуру з близькими хім властивостями. Гомологи – члени даного ряду. Гомологічна різниця - метиленова група, на яку відрізняються 2 сусідні гомологи.
Як уже згадувалося раніше, склад будь-якого насиченого вуглеводню може бути виражений за допомогою загальної формули CnH₂n + 2. Так, наступним за метаном членом гомологічного рядує етан - C₂H₆. Щоб вивести структуру з метанової, необхідно замінити 1 атом H на CH₃ (рисунок нижче).

Структура кожного наступного гомолога може бути виведена з попереднього так само. У результаті етану утворюється пропан - C₃H₈.
Що таке ізомери?
Це речовини, які мають ідентичний якісний та кількісний молекулярний склад (ідентичну молекулярну формулу), проте різне хімічна будова, а також які мають різні хімвластивості.
Вищерозглянуті вуглеводні відрізняються таким параметром, як температура кипіння: -0,5° - бутан, -10° - изобутан. Цей вид ізомерії називається як ізомерія вуглецевого скелета, вона належить до структурного типу.
Число структурних ізомерів зростає швидкими темпами зі збільшенням кількості вуглецевих атомів. Таким чином, C₁₀H₂₂ буде відповідати 75 ізомерам (не включаючи просторові), а для C₁₅H₃₂ вже відомі 4347 ізомерів, для C₂₀H₄₂ - 366319.
Отже, стало зрозуміло, що таке алкани, гомологічний ряд, ізомерія, номенклатура. Тепер варто перейти до правил складання назв щодо ІЮПАК.

Номенклатура ІЮПАК: правила освіти назв
По-перше, необхідно знайти у вуглеводневій структурі вуглецевий ланцюг, який найбільш довгий і містить максимальну кількість заступників. Потім потрібно пронумерувати атоми C ланцюга, починаючи з кінця, якого ближче всього розташований заступник.
По-друге, основа - назва нерозгалуженого насиченого вуглеводню, якому за кількістю атомів C відповідає найголовніший ланцюг.
По-третє, перед основою необхідно вказати номери локантів біля яких розташовані заступники. За ними записуються через дефіс назви заступників.
По-четверте, у разі наявності ідентичних заступників при різних атомах C локанти об'єднуються, при цьому перед назвою з'являється приставка, що множить: ді - для двох ідентичних заступників, три - для трьох, тетра - чотирьох, пента - для п'яти і т. д. Цифри повинні бути відокремлені один від одного комою, а від слів – дефісом.
Якщо один і той же атом C міститься відразу два заступники, локант також записується двічі.
Відповідно до цих правил і формується міжнародна номенклатура алканів.

Проекції Ньюмена
Цей американський учений запропонував для графічної демонстрації конформацій спеціальні проекційні формули – проекції Ньюмена. Вони відповідають формам А та Б і представлені на малюнку нижче.

У першому випадку це А-затулена конформація, а в другому - Б-загальмована. У позиції А атоми розташовуються на мінімальній відстані один від одного. Даній формі відповідає саме велике значенняенергії, через те, що відштовхування між ними найбільше. Це енергетично невигідний стан, унаслідок чого молекула прагне покинути його і перейти до більш стійкого положення Б. Тут атоми H максимально віддалені один від одного. Так, енергетична різниця цих положень - 12 кДж/моль, завдяки чому вільне обертання навколо осі в молекулі етану, що сполучає мітильні групи, виходить нерівномірним. Після потрапляння в енергетично вигідне становище молекула там затримується, тобто «гальмується». Саме тому воно і називається загальмованим. Результат – 10 тис. молекул етану перебувають у загальмованій формі конформації за умови кімнатної температури. Тільки одна має іншу форму – заслоненную.
Одержання граничних вуглеводнів
Зі статті вже стало відомо, що це алкани (будова, номенклатура їх докладно описані раніше). Не зайве буде розглянути способи їх отримання. Вони виділяються з таких природних джерел, як нафту, природне, кам'яне вугілля. Застосовуються також синтетичні методи. Наприклад, H₂ 2H₂:
- Процес гідрування CnH₂n (алкени)→ CnH₂n+2 (алкани)← CnH₂n-2 (алкіни).
- З суміші монооксиду C і H - синтез-газу: nCO+(2n+1)H₂→ CnH₂n+2+nH₂O.
- З карбонових кислот(їх солей): електроліз на аноді, на катоді:
- електроліз Кольбе: 2RCOONa+2H₂O→R-R+2CO₂+H₂+2NaOH;
- реакція Дюма (сплав із лугом): CH₃COONa+NaOH (t)→CH₄+Na₂CO₃.
- Крекінг нафти: CnH₂n+2 (450-700°)→ CmH₂m+2+ Cn-mH₂(n-m).
- Газифікація палива (твердого): C+2H₂→CH₄.
- Синтез складних алканів (галогеновиробних), які мають меншу кількість атомів C: 2CH₃Cl (хлорметан) +2Na →CH₃- CH₃ (етан) +2NaCl.
- Розкладання водою метанідів (карбідів металів): Al₄C₃+12H₂O→4Al(OH₃)↓+3CH₄.
Фізичні властивості граничних вуглеводнів
Для зручності дані згруповані у таблицю.
Формула | Алкан | Температура плавлення у °С | Температура кипіння у °С | Щільність, г/мл |
0,415 при t = -165 ° С |
||||
0,561 при t=-100°C |
||||
0,583 при t = -45°C |
||||
0,579 при t=0°C |
||||
2-Метилпропан | 0,557 при t = -25°C |
|||
2,2-Діметіл-пропан | ||||
2-Метилбутан | ||||
2-Метілпентан | ||||
2,2,3,3-Тетра-метилбутан | ||||
2,2,4-Триметил-пентан | ||||
н-C₁₀H₂₂ | ||||
н-C₁₁H₂₄ | н-Ундекан | |||
н-C₁₂H₂₆ | н-Додекан | |||
н-C₁₃H₂₈ | н-Трідекан | |||
н-C₁₄H₃₀ | н-Тетрадекан | |||
н-C₁₅H₃₂ | н-Пентадекан | |||
н-C₁₆H₃₄ | н-Гексадекан | |||
н-C₂₀H₄₂ | н-Ейкозан | |||
н-C₃₀H₆₂ | н-Тріаконтан | 1 мм рт. ст | ||
н-C₄₀H₈₂ | н-Тетраконтан | 3 мм рт. ст. | ||
н-C₅₀H₁₀₂ | н-Пентаконтан | 15 мм рт. ст. | ||
н-C₆₀H₁₂₂ | н-Гексаконтан | |||
н-C₇₀H₁₄₂ | н-Гептаконтан | |||
н-C₁₀₀H₂₀₂ |
Висновок
У статті було розглянуто таке поняття, як алкани (будівля, номенклатура, ізомерія, гомологічний ряд та ін.). Трохи розказано про особливості радіальної та замісної номенклатур. Описано способи одержання алканів.
Крім того, у статті докладно перераховано всю номенклатуру алканів (тест може допомогти засвоїти отриману інформацію).
Фізичні властивості алканів
У звичайних умовах перші чотири члени гомологічного ряду алканів (З 1 - З 4) - гази. Нормальні алкани від пентану до гептадекану (З 5 - З 17) - рідини, починаючи з З 18 і вище - тверді речовини. Принаймні збільшення кількості атомів вуглецю в ланцюзі, тобто. зі зростанням відносної молекулярної маси, зростають температури кипіння та плавлення алканів
При однаковій кількості атомів вуглецю в молекулі алкани з розгалуженою будовою мають більше низькі температурикипіння ніж нормальні алкани.
Алкани майже нерозчинні у питній воді, т.к. їх молекули малополярні і взаємодіють із молекулами води. Рідкі алкани легко поєднуються один з одним. Вони добре розчиняються в неполярних органічних розчинниках, таких як бензол, тетрахлорметан і т.п.
Будова
Молекула найпростішого алкану – метану – має форму правильного тетраедра, у центрі якого знаходиться атом вуглецю, а у вершинах – атоми водню. Кути між осями зв'язків С-Нстановлять 109 ° 28 "(рис. 29).
У молекулах інших граничних вуглеводнів кути між зв'язками (як С-Н, так і С-С) мають таке саме значення. Для опису форми молекул використовується поняття гібридизації атомних орбіталей(Див. частина I, §6).
В алканах всі атоми вуглецю перебувають у стані sp 3 -гібридизації (рис. 30).
Таким чином, атоми вуглецю у вуглецевому ланцюзі не знаходяться на одній прямій. Відстань між сусідніми атомами вуглецю (між ядрами атомів) суворо фіксована – це довжина хімічного зв'язку(0,154 нм). Відстань З 1 - З 3, З 2 - З 4 і т.д. (через один атом) теж незмінні, т.к. постійний кут між зв'язками - валентний кут.

Відстань між більш віддаленими атомами вуглецю можуть змінюватися (у деяких межах) внаслідок обертання навколо s-зв'язків. Таке обертання не порушує перекриття орбіталей, що утворюють s-зв'язок, оскільки цей зв'язок має осьову симетрію.


Різні просторові форми однієї молекули, що утворюються при обертанні груп атомів навколо s-зв'язків, називають конформаціями(Рис. 31).
Конформації розрізняють по енергії, але ця різниця невелика (12-15 кДж/моль). Більш стійкі такі конформації алканів, у яких атоми розташовані можливо далі друг від друга (відштовхування електронних оболонок). Перехід від однієї конформації в іншу здійснюється за рахунок енергії теплового руху. Для конформації зображення використовують спеціальні просторові формули (формули Ньюмена).
Чи не плутати!
Слід розрізняти поняття конформація та конфігурація.
Різні конформації можуть перетворюватися одна на одну без розриву хімічних зв'язків. Для перетворення молекули з однією конфігурацією на молекулу з іншою конфігурацією потрібен розрив хімічних зв'язків.
З чотирьох видів ізомеріїдля алканів характерні два: ізомерія вуглецевого скелета та оптична ізомерія (див. частина
Хімічні зв'язки в алканах, їх розрив та утворення визначають хімічні властивості алканів. Зв'язки С-С та С-Н ковалентні, прості (s-зв'язки), практично неполярні, досить міцні, тому:
1) алкани вступають найчастіше у такі реакції, що йдуть з гемолітичним розривом зв'язків;
2) у порівнянні з органічними сполукамиінших класів алкани мають низьку реакційну здатність (їх за це називають парафінами- «Позбавлені властивості»). Так, алкани стійкі до дії водних розчинівкислот, лугів та окислювачів (наприклад, перманганату калію) навіть при кип'ятінні.
Алкани вступають у реакції приєднання до них інших молекул, т.к. алкани немає у своїх молекулах кратних зв'язків.
Алкани розкладаються при сильному нагріванні в присутності каталізаторів у вигляді платини або нікелю, при цьому від алканів відщеплюється водень.
Алкани можуть вступати у реакції ізомеризації. Характерною реакцією для них є реакція заміщення,протікає за радикальним механізмом.
Реакції радикального заміщення
Як приклад розглянемо взаємодія алканів із галогенами.Фтор реагує дуже енергійно (як правило, з вибухом) - при цьому рвуться всі С-Н та С-З зв'язку, і в результаті утворюються сполуки CF 4 та HF. Практичного значення реакція немає. Йод із алканами не взаємодіє. Реакції з хлором чи бромом йдуть або за освітленні, або за сильному нагріванні; при цьому відбувається утворення від моно- до полігалогензаміщених алканів, наприклад:
СН 3 -СН 3 +Сl 2 ® hv СН 3 -СН 2 -Сl+НСl
Утворення галогенопохідних метану протікає по ланцюговому вільнорадикальномумеханізму. Під дією світла молекули хлору розпадаються на неорганічні радикали:
Неорганічний радикал Сl. відриває від молекули метану атом водню з одним електроном, утворюючи НС1 та вільний радикал СН 3
![]()
Вільний радикал взаємодіє з молекулою хлору Сl 2 утворюючи галогенопроизводное і радикал хлору.
![]()
Реакція окислення починається з відриву атома водню молекулою кисню (яка є бірадикал) і далі йде як розгалужена ланцюгова реакція. Кількість радикалів під час реакції збільшується. Процес супроводжується
виділенням великої кількостітеплоти, що рвуться вже не тільки С-Н, але і С-З зв'язку, так що в результаті утворюється оксид вуглецю (IV) і вода. Реакція може протікати як горіння або призводить до вибуху.
2С n Н2 n+2 +(3n+1)О 2 ®2nСO 2 +(2n+2)Н 2 O
При звичайній температурі реакція окиснення не йде; її можна ініціювати або запалюванням, або дією електричного розряду.
При сильному нагріванні (понад 1000 ° С) алкани повністю розкладаються на вуглець і водень. Ця реакція називається піролізом.
СН 4 ® 1200° С+2Н 2
При м'якому окисненні алканів, зокрема метану, киснем повітря у присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота.

Якщо метан пропускати через нагріту зону дуже швидко, а потім одразу охолоджувати водою, то в результаті утворюється ацетилен.
Ця реакція – основа промислового синтезу, який називається крекінгом(Неповним розкладанням) метану.
Крекінг гомологів метану проводять за нижчої температури (близько 600°С). Наприклад, крекінгу пропану включає наступні стадії:

Отже, крекінг алканів призводить до утворення суміші алканів та алкенів меншої молекулярної маси.
Нагрівання алканів до 300-350 ° С (крекінг ще не йде) у присутності каталізатора (Pt або Ni) призводить до дегідрування- відщепленню водню.

При дії розведеної азотної кислоти на алкани при 140°З невеликому тиску протікає радикальна реакція:
СН 3 -СН 3 + HNO 3 ®CH 3 -CH 2 -NO 2 + Н 2 О Ізомеризація
За певних умов алкани нормальної будови можуть перетворюватися на алкани з розгалуженим ланцюгом.
Отримання алканів
Розглянемо одержання алканів на прикладі одержання метану. Метан широко поширений у природі. Він є головною складовою багатьох горючих газів, як природних (90-98%), так і штучних, що виділяються при сухій перегонці дерева, торфу, кам'яного вугілля, а також при крекінгу нафти. Природні гази, особливо попутні гази нафтових родовищ, крім метану містять етан, пропан, бутан та пентан.
Метан виділяється з дна боліт і з кам'яновугільних пластів у копальнях, де він утворюється при повільному розкладанні рослинних залишків без доступу повітря. Тому метан часто називають болотним газом або рудничним газом.
У лабораторії метан отримують при нагріванні суміші ацетату натрію з гідроксидом натрію:
CH 3 COONa+NaOH® 200 ° Na 2 CO 3 +CH 4
або при взаємодії карбіду алюмінію з водою: Аl 4 Сl 3 +12H 2 O®4Аl(ОН) 3 +3CH 4
У разі метан виходить дуже чистим.
Метан може бути отриманий з простих речовинпри нагріванні у присутності каталізатора:
З+2Н 2 ® Ni СН 4 8 також синтезом на основі водяного газу
CO+3H 2 ® Ni CH 4 +H 2 O
Цей метод має промислове значення. Однак зазвичай використовують метан природних газів або газів, що утворюються при коксуванні кам'яного вугілля і при переробці нафти.
Гомологи метану, як і метан, лабораторних умовотримують прожарювання солей відповідних органічних кислот з лугами. Інший метод - реакція Вюрца, тобто. нагрівання моногалогенопохідних з металевим натрієм, наприклад:
З 2 Н 5 Br+2Na+BrC 2 H 6 ® З 2 Н 5 -З 2 Н 5 +2NaBr
У техніці для отримання технічного бензину (суміш вуглеводнів, що містять 6-10 атомів вуглецю) застосовують синтез
з оксиду вуглецю (II) та водню у присутності каталізатора (сполуки кобальту) та при підвищеному тиску. Процес
можна виразити рівнянням
nСО+(2n+1)Н 2 ® 200° C n H 2n+2 +nН 2 O
I Отже, основним джерелом алканів є природний газ і нафта. Однак деякі граничні вуглеводнісинтезують із інших сполук.
Застосування алканів
Більшість алканів використовується як паливо. Крекінг та
Дегідрування їх призводить до ненасичених вуглеводнів, на
основі яких отримують безліч інших органічних речовин.
Метан – основна частина природних газів (60-99%). До складу
природних газів входять пропан та бутан. Рідкі вуглеводні
застосовуються як паливо в двигунах внутрішнього згоряння, а автомашинах, літаках та ін. Очищена суміш рідких
та твердих алканів утворює вазелін. Вищі алкани є
вихідними речовинами при отриманні синтетичних миючих засобів. Алкани, отримані шляхом ізомеризації, використовуються у виробництві високоякісних бензинів та каучуку. Нижче наведено схему застосування метану

Циклоалкани
Будова
Циклоалкани - насичені вуглеводні, у молекулах яких є замкнуте кільце з вуглецевих атомів.
Циклоалкани (циклопарафіни) утворюють гомологічний ряд із загальною формулою С n Н 2 n , в якому першим членом є
циклопропан З 3 Н 6 т.к. для утворення кільця потрібна наявність не менше трьох атомів вуглецю.
Циклоалкани мають кілька назв: циклопарафіни, нафтени, циклани, поліметилени. Приклади деяких з'єднань:

Формула З n Н 2 n характерна для циклопарафінів, і така сама формула описує гомологічний ряд алкенів (ненасичених вуглеводнів, що мають одну кратну зв'язок). З цього можна дійти невтішного висновку, що кожному циклоалкану ізомерено відповідний алкен - це приклад «міжкласової» ізомерії.
Циклоалкани за розміром циклу діляться ряд груп, у тому числі розглянемо дві: малі (З 3 , З 4) і стандартні (З 5 -З 7) цикли.
Назви циклоалканів будуються шляхом додавання приставки цикло до назви алкану з відповідним числом атомів вуглецю. Нумерацію у циклі проводять так, щоб заступники отримали найменші номери.
Структурні формули циклоалканів зазвичай записуються у скороченому вигляді, використовуючи геометричну форму циклу та опускаючи символи атомів вуглецю та водню. Наприклад:

Структурна ізомерія циклоалканів обумовлена розміром циклу (циклобутан та метилциклопропан - ізомери) та положенням заступників у циклі (наприклад, 1,1- та 1,2-диметилбутан), а також їх будовою.
Просторова ізомеріятакож й у циклоалканов, т.к. вона пов'язана з різним розташуванням замісників щодо площини циклу. При розміщенні замісників по одну сторону від площини циклу виходять цис-ізомери, різні сторони- транс-ізомери.
Найпростішими органічними сполуками є вуглеводні, що складаються з вуглецю та водню. Залежно від характеру хімічних зв'язків у вуглеводнях та співвідношення між вуглецем і воднем вони поділяються на граничні та ненасичені (алкени, алкіни та ін.)
ГраничнимиВуглеводнями (алканами, вуглеводнями метанового ряду) називаються сполуки вуглецю з воднем, в молекулах яких кожен атом вуглецю витрачає на з'єднання з будь-яким іншим сусіднім атомом не більше однієї валентності, причому всі не витрачені на з'єднання з вуглецем валентності насичені воднем. Усі атоми вуглецю в алканах перебувають у sp 3 - стані. Граничні вуглеводні утворюють гомологічний ряд, що характеризується загальною формулою З n Н 2n+2. Родоначальником цього є метан.
Ізомерія. Номенклатура.
Алкани з n=1,2,3 можуть існувати лише як одного ізомеру
Починаючи з n=4, утворюється явище структурної ізомерії.

Число структурних ізомерів алканів швидко зростає зі збільшенням числа вуглецевих атомів, наприклад, пентан має 3 ізомери, гептан - 9 і т.д.
Число ізомерів алканів збільшується за рахунок можливих стереоізомерів. Починаючи з C 7 Н 16 можливе існування хіральних молекул, які утворюють два енантіомери.
Номенклатура алканів.
Домінантною номенклатурою є номенклатура IUPAC. У той же час у ній є елементи тривіальних назв. Так, перші чотири члени гомологічного ряду алканів мають тривіальні назви.
СН 4 – метан
З 2 Н 6 - етан
З 3 Н 8 - пропан
З 4 Н 10 – бутан.
Назви решти гомологів утворені від грецьких латинських числівників. Так, для наступних членів ряду нормальної (нерозгалуженої) будівлі використовуються назви:
З 5 Н 12 - пентан, З 6 Н 14 - гексан, З 7 Н 18 - гептан,
З 14 Н 30 – тетрадекан, З 15 Н 32 – пентадекан і т.д.
Основні правила IUPAC для розгалужених алканів
а) вибирають найбільш довгий нерозгалужений ланцюг, назва якого становить основу (корінь). До цієї основи додають суфікс "ан"
б) нумерують цей ланцюг за принципом найменших локантів,
в) заступник вказують у вигляді префіксів в алфавітному порядку із зазначенням місця знаходження. Якщо при родоначальній структурі перебувають кілька однакових заступників, їх кількість вказують грецькими числівниками.
Залежно від числа інших вуглецевих атомів, з якими безпосередньо пов'язаний вуглецевий атом, розрізняють: первинні, вторинні, третинні і четвертинні вуглецеві атоми.


Як заступники в розгалужених алканах фігурують алкільні групи або алкільні радикали, які розглядаються як результат відщеплення від молекули алкану одного водневого атома.
Назва алкільних груп утворюють від назви відповідних алканів шляхом заміни останніх суфіксу "ан" на суфікс "мул".
СН 3 - метил
СН 3 СН 2 – етил
СН 3 СН 2 СН 2 - пропив

Для назви розгалужених алкільних груп використовують також нумерацію ланцюга:

Починаючи з етану, алкани здатні утворювати конформери, яким відповідає загальмована конформація. Можливість переходу однієї загальмованої конформації в іншу через заслонений визначається бар'єром обертання. Визначення структури, складу конформерів та бар'єрів обертання є завданнями конформаційного аналізу.
2. Хімічні властивості алканів (метану, етану): горіння, заміщення, розкладання, дегідрування.
Всі зв'язки в алкана малополярні, тому для них характерні радикальні реакції. Відсутність пі-зв'язків унеможливлює реакції приєднання.
Для алканів характерні реакції заміщення, відщеплення, горіння.
1. Реакції заміщення
А) із галогенами(з хлором Cl 2 -на світлі, Br 2 – при нагріванні) реакція підпорядковується правилу Марковника (Правила Марковникова) - насамперед галоген замінює водень у найменш гідрованого атома вуглецю. Реакція проходить поетапно - за один етап заміщається трохи більше одного атома водню.
Найважче реагує йод, і притому реакція не йде до кінця, так як, наприклад, при взаємодії метану з йодом утворюється йодистий водень, що реагує з йодистим метилом з утворенням метану і йоду (зворотна реакція):
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан)
CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан)
Б) Нітрування (Реакція Коновалова)
Алкани реагують з 10% розчином азотної кислоти або оксидом азоту N 2 O 4 в газовій фазі при температурі 140° та невеликому тиску з утворенням нітропохідних. Реакція також підпорядковується правилу Марковникова. Один з атомів водню замінюється на залишок NO 2 (нітрогрупа) та виділяється вода

Реакції відщеплення
А) дегідрування-відщеплення водню. Умови реакції каталізатор -платина та температура.
CH 3 - CH 3 → CH 2 = CH 2 + Н 2
Б) крекінґпроцес термічного розкладання вуглеводнів, основу якого лежать реакції розщеплення вуглецевої ланцюга великих молекул із заснуванням сполук із коротшим ланцюгом. При температурі 450–700 o С алкани розпадаються за рахунок розриву зв'язків С–С (міцніші зв'язки С–Н за такої температури зберігаються) та утворюються алкани та алкени з меншою кількістю вуглецевих атомів
C 6 H 14 C 2 H 6 + C 4 H 8
В) повне термічне розкладання
СН 4 C + 2H 2
Реакції окиснення
а) реакція горінняПри підпалюванні (t = 600 o З) алкани вступають у реакцію з киснем, у своїй відбувається їх окислення до вуглекислого газута води.
З n Н 2n+2 + O 2 ––>CO 2 + H 2 O + Q
СН 4 + 2O 2 ––>CO 2 + 2H 2 O + Q
Б) Каталітичне окиснення- при відносно невисокій температурі та із застосуванням каталізаторів супроводжується розривом тільки частини зв'язків С–Приблизно в середині молекули та С–Н та використовується для отримання цінних продуктів: карбонових кислот, кетонів, альдегідів, спиртів.
Наприклад, при неповному окисленні бутану (розрив зв'язку З 2 -З 3) отримують оцтову кислоту
4. Реакції ізомеризації характерні не для всіх алканів. Звертається увага на можливість перетворення одних ізомерів на інші, наявність каталізаторів.
4 Н 10 C 4 H 10
5.. Алкани з основним ланцюгом в 6 і більше атомів вуглецю також вступають у реакцію дегідроциклізації, але завжди утворюють 6-членний цикл (циклогексан та його похідні). В умовах реакції цей цикл піддається подальшому дегідрування і перетворюється на енергетично стійкіший бензольний цикл ароматичного вуглеводню (арена).

Ациклічні вуглеводні називаються алканами. Усього налічується 390 алканів. Найдовшу структуру має нонаконтатриктан (C 390 H 782). До атомів вуглецю можуть приєднуватися галогени, утворюючи галогеналкани.
Будова та номенклатура
За визначенням алкани - граничні чи насичені вуглеводні, мають лінійну чи розгалужену структуру. Також називають парафінами. Молекули алканів містять лише одинарні ковалентні зв'язки між атомами вуглецю. Загальна формула
Щоб назвати речовину, необхідно дотримуватись правил. За міжнародною номенклатурою назви формуються за допомогою суфікса -ан. Назви перших чотирьох алканів склалися історично. Починаючи з п'ятого представника, назви складаються з приставки, що означає кількість атомів вуглецю, і суфікса -ан. Наприклад, окта (вісім) утворює октан.
Для розгалужених ланцюгів назви складаються:
- із цифр, що вказують номери атомів вуглецю, біля яких стоять радикали;
- із назви радикалів;
- із назви головного ланцюга.
Приклад: 4-метилпропан - у четвертого атома вуглецю в ланцюзі пропану є радикал (метил).

Рис. 1. Структурні формули із назвами алканів.
Кожен десятий алкан дає назву наступним дев'яти алканам. Після декана йдуть ундекан, додекан і далі, після ейкозану – генейкозан, докозан, трикозан тощо.
Гомологічний ряд
Перший представник – метан, тому алкани також називають гомологічним рядом метану. У таблиці алканів наведені перші 20 представників.
|
Назва |
Формула |
Назва |
Формула |
|
Тридекан |
|||
|
Тетрадекан |
|||
|
Пентадекан |
|||
|
Гексадекан |
|||
|
Гептадекан |
|||
|
Октадекан |
|||
|
Нанадекан |
|||
Починаючи з бутану, усі алкани мають структурні ізомери. До назви додається приставка ізо-: ізобутан, ізопентан, ізогексан.

Рис. 2. Приклади ізомерів.
Фізичні властивості
Агрегатний стан речовин змінюється у списку гомологів зверху донизу. Чим більше міститься атомів вуглецю і, що більше молекулярна маса сполук, то вище температура кипіння і твердіше речовина.
Інші речовини, що містять більше 15 атомів вуглецю, знаходяться у твердому стані.

Газоподібні алкани горять блакитним або безбарвним полум'ям.
Отримання
Алкани, як та інші класи вуглеводнів, одержують із нафти, газу, кам'яного вугілля. Для цього використовують лабораторні та промислові методи:
- газифікація твердого палива:
C + 2H 2 → CH 4;
- гідрування оксиду вуглецю (II):
CO + 3H 2 → CH 4 + H 2 O;
- гідроліз карбіду алюмінію:
Al 4 C 3 + 12H 2 O → 4Al(OH) 3 + 3CH 4 ;
- реакція карбіду алюмінію із сильними кислотами:
Al 4 C 3 + H 2 Cl → CH 4 + AlCl 3;
- відновлення галогеналканів (реакція заміщення):
2CH 3 Cl + 2Na → CH 3 -CH 3 + 2NaCl;
- гідрування галогеналканів:
CH 3 Cl + H 2 → CH 4 + HCl;
- сплавлення солей оцтової кислоти з лугами (реакція Дюма):
CH 3 COONa + NaOH → Na 2 CO 3 + CH 4 .
Алкани можна отримати гідруванням алкенів та алкінів у присутності каталізатора – платини, нікелю, паладію.
Хімічні властивості
Алкани вступають у реакції з неорганічними речовинами:
- горіння:
CH 4 + 2O 2 → CO 2 + 2H 2 O;
- галогенування:
CH 4 + Cl 2 → CH 3 Cl + HCl;
- нітрування (реакція Коновалова):
CH 4 + HNO 3 → CH 3 NO 2 + H 2 O;
- приєднання:
Алканами в хімії називають граничні вуглеводні, у яких вуглецевий ланцюг незамкнутий і складається з вуглецю, пов'язаних один з одним за допомогою одинарних зв'язків. Також характерною особливістюАлканів є те, що вони зовсім не містять подвійних чи потрійних зв'язків. Іноді алкани називають парафінами, річ у тому, що парафіни власне і є сумішшю граничних вуглеців, тобто алканів.
Формула алканів
Формулу алкану можна записати як:
При цьому n більше або 1.
Алканам властива ізомерія вуглецевого скелета. При цьому з'єднання можуть приймати різні геометричні форми, як це показано на малюнку нижче.

Ізомерія вуглецевого скелета алканів
Зі збільшенням зростання вуглецевого ланцюга збільшується і кількість ізомерів. Так, наприклад, у бутану є два ізомери.

Отримання алканів
Алкан зазвичай отримують різними синтетичними методами. Скажімо, один із способів одержання алкану передбачає реакцію «гідрування», коли алкани видобуваються з ненасичених вуглеводів під впливом каталізатора та при температурі.
Фізичні властивості алканів
Алкани від інших речовин відрізняються повною відсутністю кольору, також вони не розчиняються у воді. Температура плавлення алканів підвищується зі збільшенням їхньої молекулярної маси і довжини вуглеводневого ланцюга. Тобто чим більш розгалуженим є алкан, тим більша температура горіння і плавлення. Газоподібні алкани взагалі горять блідо-блакитним або безбарвним полум'ям, при цьому виділяючи багато тепла.
Хімічні властивості алканів
Алкани в хімічному плані малоактивні речовини, внаслідок міцності міцних сигма зв'язків С-С та С-Н. При цьому зв'язку С-Снеполярні, а С-Н малополярні. Оскільки все це малополяризируемые види зв'язків, які відносяться до сигма виду, то розриватися вони будуть за механізмом гомолітичному, внаслідок чого утворюються радикали. І як наслідки хімічні властивості алканів є переважно реакції радикального заміщення.
Такий вигляд має формула радикального заміщення алканів (галогенування алканів).
Крім цього також можна виділити такі хімічні реакціїяк нітрування алканів (реакція Коновалова).
Ця реакція протікає при температурі 140 С, причому найкраще саме з третинним атомом вуглецю.
Крекінг алканів – ця реакція протікає при дії високих температур та каталізаторів. Тоді створюються умови, коли вищі алкани можуть рвати зв'язки утворюючи алкани нижчого порядку.