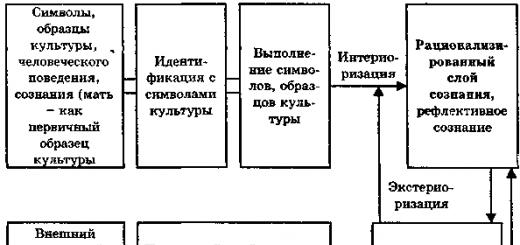
Einführung
Interatomare Wechselwirkung
Eigenschaften von Wasserstoffbrückenbindungen
elektromagnetische Strahlung
Laserstrahlung
Fazit
Wasserstoffenergie
EINLEITUNG
Wasserstoffverbindung-Form der Assoziation zwischen einem elektronegativen Atom und einem Wasserstoffatom H kovalent an ein anderes elektronegatives Atom gebunden. N, O oder F können als elektronegative Atome wirken, Wasserstoffbrückenbindungen können intermolekular oder intramolekular sein.
Häufig wird die Wasserstoffbindung als elektrostatische Wechselwirkung angesehen, die durch die geringe Größe des Wasserstoffs verstärkt wird, was die Nähe der wechselwirkenden Dipole ermöglicht. Dann sprechen sie davon als eine Art Donor-Akzeptor-Bindung, eine Nicht-Valenz-Wechselwirkung zwischen einem Wasserstoffatom H, kovalent an ein Atom gebunden EIN Gruppen AH Moleküle RA-H und ein elektronegatives Atom B ein anderes Molekül (oder eine funktionelle Gruppe desselben Moleküls) BR". Das Ergebnis solcher Wechselwirkungen sind Komplexe RA-HBR" unterschiedlicher Stabilität, bei der das Wasserstoffatom als "Brücke" zwischen den Fragmenten fungiert RA und BR".
Die Merkmale der Wasserstoffbrückenbindung, nach denen sie als eigenständige Spezies unterschieden werden, sind ihre nicht sehr hohe Stärke, ihre Prävalenz und Bedeutung, insbesondere in organischen Verbindungen, sowie einige Nebenwirkungen, die mit kleinen Größen und dem Fehlen zusätzlicher verbunden sind Elektronen aus Wasserstoff.
Derzeit wird im Rahmen der Theorie der Molekülorbitale die Wasserstoffbrücke als Sonderfall der kovalenten Bindung mit Delokalisierung der Elektronendichte entlang der Atomkette und der Bildung von Drei-Zentren-Vier-Elektronen-Bindungen betrachtet (z. B. - H -).
Intermolekulare und intramolekulare Wasserstoffbrückenbindung
Wasserstoffverbindung- das ist die Wechselwirkung zwischen zwei elektronegativen Atomen eines oder verschiedener Moleküle durch ein Wasserstoffatom: A−H ... B (eine Linie zeigt eine kovalente Bindung an, drei Punkte zeigen eine Wasserstoffbindung an).
Eine Wasserstoffbrücke entsteht durch die elektrostatische Anziehung eines Wasserstoffatoms (das eine positive Ladung δ+ trägt) zu einem Atom eines elektronegativen Elements mit einer negativen Ladung δ−. In den meisten Fällen ist es schwächer als kovalent, aber viel stärker als die übliche Anziehung von Molekülen in festen und flüssigen Stoffen. Im Gegensatz zu intermolekularen Wechselwirkungen hat eine Wasserstoffbrücke die Eigenschaften der Direktionalität und Sättigung, weshalb sie oft als eine der Varianten einer kovalenten chemischen Bindung angesehen wird. Sie kann mit der Molekülorbitalmethode als Drei-Zentren-Zwei-Elektronen-Bindung beschrieben werden.
Eines der Anzeichen für eine Wasserstoffbindung kann der Abstand zwischen dem Wasserstoffatom und einem anderen Atom sein, das es bildet. Er muss kleiner sein als die Summe der Radien dieser Atome. Häufiger sind asymmetrische Wasserstoffbrückenbindungen, bei denen der Abstand H ... B mehr als AB. In seltenen Fällen (Fluorwasserstoff, einige Carbonsäuren) ist die Wasserstoffbrücke jedoch symmetrisch. Winkel zwischen Atomen im Fragment А−Н ... B liegt normalerweise nahe bei 180º. Die stärksten Wasserstoffbrückenbindungen werden unter Beteiligung von Fluoratomen gebildet. In einem symmetrischen Ion beträgt die Wasserstoffbrückenbindungsenergie 155 kJ/mol und ist vergleichbar mit der kovalenten Bindungsenergie. Die Wasserstoffbindungsenergie zwischen Wassermolekülen ist bereits deutlich niedriger (25 kJ/mol).
HAUPTTEIL
Interatomare Wechselwirkung
Art der Bindung zwischen Atomen, zwischen Valenz und Nicht-Valenz interatomarer Wechselwirkung. V.s. kann in Gegenwart eines H-Atoms zwischen zwei e-negativ gebildet werden. Atome - F, N oder O, und mit einem dieser beiden Atome ist das Wasserstoffatom durch eine kovalente Bindung verbunden.
Die Natur von V. mit. besteht darin, dass die Elektronendichte an der O-H (N-H usw.) Bindungslinie zu mehr e-negativ verschoben ist. zum O-Atom (N usw.). In diesem Fall ist das Wasserstoffproton "blank", was zur Konvergenz von e-negativ beiträgt. Atome benachbarter Moleküle. Aufgrund des Abstandes O. . .O und N. . .O in V. mit. OH. . .0 und N - H. . .O erweisen sich als ungefähr gleich der Summe der Van-der-Waals-Atomradien, also el-negativ. Atome in Kristallen nähern sich einander an, als wäre kein Wasserstoffatom zwischen ihnen.
Energie V. s. 1-1,5 Größenordnungen kleiner als die chemische Energie. Bindungen und ist 2-3 Größenordnungen höher als die Energie der Nicht-Valenz-Van-der-Waals-Wechselwirkung. Naib. starke V. mit. untereinander HF-Moleküle bilden, die sich zu den Polymerstrukturen H 2 F 2, H 3 F 3, H 4 F 4, H 6 F 5 und H 6 F 6 verbinden können (letzteres ist besonders stabil, da es ring- geformt und dadurch stabilisiert durch zusätzliche V. s.). Sehr stark B.c. (mit einer Energie von je ~30 kJ/mol) stabilisieren die Ameisensäure-Dimere dazu – sie sind sogar im Dampfzustand stabil. In flüssigem und festem Wasser ist die Energie von V. s. beträgt ~20 kJ/mol. Ungefähr die gleiche Energie wird durch V. s charakterisiert. NH. . .O und O-H. . .O im Pl. biologisch wichtige Moleküle - Proteine, Nukleinsäuren, Kohlenhydrate usw.

V. Anwesenheit mit. aufgrund der Originalität der Struktur und der physischen. Eigenschaften von Wasser und wässrigen Lösungen. Kristallin Die Eisstruktur, die unter normalen Bedingungen existiert, ist ein durchbrochenes Gitter B.s., in dem es eine große Anzahl von Hohlräumen gibt. Wenn Eis schmilzt, werden diese Hohlräume teilweise mit Wassermolekülen gefüllt, und daher ist die Dichte von Wasser höher als die Dichte von Eis.
V.s. kann nicht nur intermolekular (wie in den oben diskutierten Beispielen), sondern auch intramolekular sein. Intramolekulare V. mit. sind einer der wichtigsten Faktoren, die die kugelförmige Struktur von Proteinmolekülen stabilisieren, die die Funktion von Proteinen in lebenden Zellen bestimmen; Sie beeinflussen auch weitgehend die Eigenschaften von Holz und Papier, die aus Zellulosefasern bestehen, und sind für die einzigartige Struktur von Nuklein-K-T-Molekülen verantwortlich.
EIGENSCHAFTEN:
Die Energie einer Wasserstoffbindung ist viel geringer als die Energie einer gewöhnlichen kovalenten Bindung (übersteigt 40 kJ/mol nicht). Diese Energie reicht jedoch aus, um die Assoziation von Molekülen zu bewirken, dh ihre Assoziation zu Dimeren oder Polymeren. Es ist die Assoziation von Molekülen, die die ungewöhnlich hohen Schmelz- und Siedepunkte von Substanzen wie Fluorwasserstoff, Wasser und Ammoniak verursacht.
Obwohl diese Art von Bindung schwächer als ionische und kovalente Bindungen ist, spielt sie dennoch eine sehr wichtige Rolle bei intra- und intermolekularen Wechselwirkungen. Wasserstoffbrückenbindungen bestimmen weitgehend die physikalischen Eigenschaften von Wasser und vielen organischen Flüssigkeiten (Alkohole, Carbonsäuren, Amide von Carbonsäuren, Ester).
Die Stärke der Wasserstoffbrückenbindung (Komplexbildungsenthalpie) hängt von der Polarität des Komplexes ab und reicht von ~ 6 kJ/mol für Komplexe von Halogenwasserstoffmolekülen mit Edelgasen bis 160 kJ/mol für Ionen-Molekül-Komplexe (AHB) ±; also für den Komplex (H2OHOH2) + gebildet H2O und H3O+- 132 kJ/mol in der Gasphase.
Nach modernen Konzepten führt das Vorhandensein von Wasserstoffbrückenbindungen zwischen Wassermolekülen zur Bildung sogenannter Wassercluster oder -komplexe. Das einfachste Beispiel für einen solchen Cluster ist ein Wasserdimer:
Die Wasserstoffbindungsenergie in einem Wasserdimer beträgt 0,2 eV (≈ 5 kcal/mol), was nur eine Größenordnung größer ist als die charakteristische Energie der thermischen Bewegung bei einer Temperatur von 300 K. Gleichzeitig ist die Energie der kovalente O-H-Bindung ist 200-mal größer als die thermische Energie. Daher sind Wasserstoffbrückenbindungen relativ schwach und instabil: Es wird angenommen, dass sie aufgrund thermischer Schwankungen leicht entstehen und wieder verschwinden können. Dies führt insbesondere dazu, dass Wasser nicht als „einfache“, sondern als „gebundene Flüssigkeit“ betrachtet werden sollte: Wasser wird als Netzwerk von Molekülen dargestellt, die durch Wasserstoffbrückenbindungen verbunden sind.
INTERATOMISCHE INTERAKTION- die Wechselwirkung von Atomen, die sich in derselben oder in unterschiedlicher Energie befinden. und Ladezustände. M. c. gekennzeichnet durch potentielle Energie (Wechselwirkungspotential) F, abhängig von der relativen Position der wechselwirkenden Atome, insbesondere vom Abstand r zwischen ihren Kernen. Beim Definieren Gleichgewichtsabstand r0 und nicht zu große Kinetik. Energien freier Atome als Ergebnis von M. c. mehr oder weniger stabil chem. Bindung zwischen Atomen, deren Stärke von der Art der Atome abhängt; sein Maß kann die Lebensdauer des Moleküls sowie die Energie der Chemikalie sein. Verbindungen.
Naib, ein einfacher Fall von M. v. ist ein elastischer Stoß von Atomen idealer Gase, der in diesem Artikel nicht betrachtet wird (siehe Atomic Collisions). ist mehrdeutig im Hinblick auf die Vielfalt der Bedingungen, in denen sich Atome befinden können. Ihr internes Energie kann sich nur aufgrund von ext. Einflüsse, To-Roggen sind in der Lage, Äußeres für einige Zeit wahrzunehmen und zu speichern. Elektronenhüllen von Atomen; mehrere Die Bandbreite der Gaswindungen und Querschnitte anderer, komplexerer Prozesse nimmt Größenordnungen ein, die Symmetrie und Abstände sind anders, ebenso wie die Orientierung der Elektronendichten ihrer Schalen. Alle diese Eigenschaften von Atomen bestimmen M. in direkt.
M. c. in der Hauptsache verbunden mit El-Statik. und el-magn. Kräfte, die zwischen Atomen wirken. Quantitative Quantentheorie M. v. forderte zudem die Berücksichtigung des Pauli-Prinzips. T. o., M. v. wird durch die gegenseitige Anordnung und Bewegung wechselwirkender Atome und ihrer Fragmente (im Raum verteilte Elektronen oder Elektronenhüllen und die Kerne selbst) bestimmt.
Unterscheiden Sie chemisch (oder Valenz) und physikalisch (nichtwertig) M. des Jahrhunderts. Die ersteren umfassen kovalente (oder homopolare, Austausch- oder Donor-Akzeptor-), ionische (oder heteropolare) und metallische Mineralien. Bis zum zweiten - van der Waals M. Jahrhundert, einschließlich E-Statik. Multipol-Wechselwirkungen, Polarisation (induktiv und dispersiv), relativistisch magnetisch. und nacheilende e-magn. M. c. Laut energisch und Räume, Merkmale, die zwischen der Wertigkeit und der Nichtwertigkeit M. Jahrhundert liegen, wird M. Jahrhundert genannt. Wasserstoffverbindung. Chem. Bindungen sind mehr als eine Größenordnung stärker als physikalische (jeweils Einheiten - Zehner von eV und Zehntel - Einheiten von eV). M. c. angeregte Atome können zur Bildung kurzlebiger angeregter Moleküle (Excimermoleküle) führen. Dies ist ein Beispiel für eine starke (~5 eV), aber nicht starke bzw. nicht lange Bindung. Diese Art von M. in. manchmal resonant.
Normalerweise ein bestimmtes M. in. umfasst verschiedene Grade von Arten von M. in. und bezieht sich auf den Beitrag jedes M. in. Installation nicht immer möglich; Dies kann auf enge Abhängigkeiten für sie zurückzuführen sein v aus r, zum Beispiel für mehrere Art M. in. über lange Distanzen v ~r-6. Einige der körperlichen M. c. eher charakteristisch für intermolekulare Wechselwirkungen.
Chemische M. Kovalentes M. c. hat einen gerichteten, lokalisierten und gesättigten Charakter. Bei der Bildung von chem. kovalente Bindung Sozialisation und Konzentration eines Elektronenpaares auf Molekülorbital, die Leerzeichen hat. Fixierung in Bezug auf Bindungsatome. In dem gebildeten gemeinsamen Orbital könnten die sozialisierten Elektronen zunächst beiden Atomen (Bildung von H 2, N 2, O 2 usw.) oder, wenn eine Donor-Akzeptor-Bindung entsteht, nur einem der Atome - dem Donor - gehören , während das freie Orbital zum zweiten Atom gehört - dem Akzeptor. Ganze Atomgruppen können als Donor oder Akzeptor dienen. Moleküle mit einer kovalenten Bindung sind normalerweise polar, das heißt, sie haben eine nachgeschaltete elektrische Bindung. Dipolmoment.
Als Ergebnis der Verarbeitung Art von Experimenten und direkter Quantenmechanik. Berechnungen stellte sich heraus, dass das Potential von kovalentem M. in. darstellen kann als
wobei die Anpassungsparameter die Koordinaten des potentiellen Minimums sind V0 und r 0 werden durch bestimmte wechselwirkende Atome bestimmt. Der erste Term in (1) ist mit Anziehung verbunden, der zweite mit Abstoßung [V. W. Heitler und F. London (1927).
Ionische M.v. verursacht durch die Verschiebung der Valenzelektronen von einem Atom (Anion) zu einem anderen (Kation), zwischen denen e-Statik auftritt. Attraktion. Beispiele für ionische Bindungen - M. c. in Alkalimetallhalogeniden. Diese Bindungen sind nicht lokalisiert und nicht sättigbar. Potenzial von ionischem M. in. bestimmt von f-loy
wo n = 6-9, t = ein; die anderen Anpassungsparameter hängen von den wechselwirkenden Atomen ab. Da rein ionisches oder kovalentes M. c. nicht existiert, wird zur Beurteilung des ionischen Anteils in der ionisch-kovalenten Bindung der Parameter Elektronegativität der Atome der Elemente eingeführt, der durch die Halbsumme aus Ionisationspotential und Elektronenaffinität bestimmt wird. Die Differenz zwischen den elektronegativ wechselwirkenden Atomen ist ungefähr gleich dem Anteil der ionischen Komponente in M. c.
Metall M. c. ist durch Nicht-Lokalisation, Nicht-Sättigung und Nicht-Direktionalität von Bindungen gekennzeichnet und wird durch die Wechselwirkung des sozialisierten Elektronengases mit dem Ionenkern des Kristalls bestimmt. Strukturen. Naib, ausgedrückt von M. in. dieser Art in Kristallen von Metallen und Legierungen. Metallisches Potential. M. c. wird durch den Ausdruck definiert
wo a, b1, b2, b3- Anpassungsparameter, die einen bestimmten M charakterisieren. c.
Physikalisch (van der Waals) M. c. vollständig beschreiben die Wechselwirkung von Atomen von Edelgasen, einige organische. Verbindungen und tragen darüber hinaus zu Wechselwirkungen anderer Art bei. Elektrisch die Wechselwirkung von Multipolen führt zu den sogenannten. Orientierung zu m an der durch die f-loy beschriebenen Interaktion
wo d1, d2- Dipolmomente wechselwirkender Teilchen. M. c. ist nicht auf die Wechselwirkung von nur Dipolen beschränkt.
Allerdings hat M. c. unter Beteiligung von Quadrupolen und Multipolen höherer Ordnung sind klein und können meist vernachlässigt werden (sie sind charakteristisch für intermolekulare Wechselwirkungen). Beispiele für die Wechselwirkung von Multipolen - M. c. mit angeregten Atomen und Molekülen.
Polarisierung M.v. tritt während der Polarisation auf. Verschiebung von Elektronenhüllen wechselwirkender Atome; wie M. in. kann als abgeschwächte Form einer rein ionischen Bindung angesehen werden. Polarisator M. c. unterteilt in Induktion und Dispersion. Induktion Wechselwirkungsenergie von Atomen im Wesentlichen. Zustand entspricht immer Anziehung, und in angeregten elektronischen Zuständen sind sowohl Anziehung als auch Abstoßung möglich; sie wird durch die Debye-Falkenhagen-Formel bestimmt
Dispersionsenergie entsteht rein quantenmechanisch. Schwankungen der Elektronendichte, nicht mit einem klassischen. analog [Wong (Wong), 1927]. F. London (1930) gab eine allgemeine Theorie der Dispersionskräfte, die die Anziehung zwischen Edelgasatomen und die Abstoßung auf kurze Distanzen erklärte. F-la für Dispersion M. Jahrhundert. erhält man aus der Lösung der Schrödinger-Gleichung nach der Methode der Störungstheorie:
wo V1, V2- charakteristisch. Anregungsfrequenzen wechselwirkender Atome. Für sphärisch symmetrische Polarisationssysteme. Energie wird durch Statik bestimmt. Polarisierbarkeiten Atome und Dispersion - dynamisch. Polarisierbarkeit oder Oszillatorkräfte von Quantenübergängen.
Relativistische magnetische und retardierte elektromagnetische Wellen. bei großen Atomabständen berücksichtigt werden. Beiträge dieser Art M. zu. mit zunehmender Masse der Atome und während ihrer Anregung (d. h. mit zunehmender Größe und innerer Energie) zunehmen. Direkte Berechnung zeigt, dass M. in. magn. Typen machen sich in Entfernungen bemerkbar ~ (10-100) r B ( r B ist der Bohr-Radius) auch für Heliumatome. Der Mechanismus der Manifestation von e-magn. die Verzögerung wird durch die Fehlanpassung der gegenseitigen Orientierung der Dipole während der Ausbreitung der Wechselwirkung erklärt.
Die Berücksichtigung von Spin-Wechselwirkungen, die eine Hyperfeinaufspaltung von Spektrallinien verursachen, erweist sich auch bei großen Entfernungen (für Wasserstoffatome bei r > 10r B).
Die Wasserstoffbrückenbindung kann sowohl intramolekular als auch intermolekular sein. Der Energiebereich von H-Brücken umfasst den gesamten energetischen Bereich. Bereich M. in. und wird in Bereiche mit starken, mittleren und schwachen H-Brücken unterteilt. Sie spielen eine wichtige Rolle in der Bio. Verbindungen und MH. biochem. Prozesse. Die Besonderheit der H-Bindung beruht auf der Tatsache, dass das H + -Ion aufgrund des kleinen Radius (eine Größenordnung kleiner als die Radien anderer Ionen) in kleine Bereiche zwischen Atomen gelangen kann. Beispielsweise wird die Bindung zwischen Wassermolekülen durch Protonen bestimmt, die gleichzeitig durch eine kovalente intramolekulare Bindung an den „eigenen“ Sauerstoff und durch eine ionische intermolekulare Bindung an den Sauerstoff anderer Moleküle gebunden sind (Abb. 1).

Im Tisch. 1 zeigt die Bindungsenergien und Gleichgewichtsabstände zwischen den Atomen A und B, H und A beim Zerfall. Arten von M. in.
Excimer M. in. Atome von Inertgasen (und einigen anderen Elementen, z. B. Hg) in einem angeregten Zustand weisen ähnliche Eigenschaften wie Alkalimetallatome auf. Insbesondere bilden sie Excimermoleküle mit Lebensdauern von 4·10 –9 s (für ArF) bis 4·10 –6 s (für Ar 2).
Ionen, einschließlich Halogenatome, haben Bindungsenergien, die denen der entsprechenden Moleküle nahe kommen. Im Tisch. Tabelle 2 zeigt die Gleichgewichtsabstände rn zwischen Atomen und die Dissoziationsenergien D bestimmte Excimermoleküle und ihre entsprechenden Moleküle von Alkalimetallhalogeniden.
| Tab. 2. | ||
| Moleküle | D, eV | |
| Kr*F | 2,27 | 5,54 |
| RbF | 2,27 | 5,80 |
| Xe*F | 2,49 | 5,30 |
| CsF | 2,35 | 5,66 |
| Xe*Cl | 2,94 | 4,53 |
| CsCl | 2,91 | 4,87 |
| Xe*Br | 2,96 | 4,30 |
| CsBr | 3,07 | 4,71 |
| Xe*I | 3,31 | 4,08 |
| CsI | 3,35 | 4,39 |
| T a b l. 3. | ||
| System | V 0 , meV | |
| H-Er | 0,46 | 3,6 |
| H-Ne | 2,82 | 3,18 |
| HAr | 4,80 | 3,56 |
| H-Kr | 6,08 | 3,70 |
| H-Xe | 6,81 | 3,95 |
| Nein nein | 0,93 | 2,965 |
| Ne-Ne | 3,62 | 3,102 |
| Ar-Ar | 12,10 | 3,76 |
| Kr-Kr | 17,00 | 4,03 |
| Xe Xe | 24,20 | 4,36 |
Im Excimer-Ar 2 F-Molekül sind die Atome gleichzeitig durch ionische (Fluor und angeregtes Argon) und kovalente (Argonatome) Arten von Chil gebunden. Verbindungen.
Zu Excimer M. Jahrhundert. sollte auch dem resonanten M zugeschrieben werden. c. zwischen identischen Atomen, von denen eines angeregt ist und daher eine deformierte Elektronenhülle hat. Vielzahl von M. in. aufgrund der Merkmale von Verformungen der Dichten der Elektronenhüllen der wechselwirkenden Atome. Eine große Anzahl bestehender Darstellungen der Potentiale von M. (nur für elastische M. v. gibt es mehrere Dutzend davon) erfüllt die Praxis nur teilweise, da keine der vorgeschlagenen fl universell ist. Verschieden V(R) haben einen Geltungsbereich entweder nach Art der Atome oder nach den Abständen zwischen ihnen, oder sie sind an eine bestimmte gebunden. Art des primären Experiments. Information. Parameterwerte v berechnet nach der Anpassmethode, die die beste Übereinstimmung mit der gewählten Matte bietet. Modell des Phänomens.
Einer der naiven, universellen stellte sich als das f-la der Modifikationen heraus. Dunham-Potenzial:
wo v 0 - Tiefe des Potentialtopfes; r 0 - Gleichgewichtswert G dem Minimum entsprechen v ; b0, bp- Parameter anpassen. Es besteht eine relativ große Stabilität der Zahlenwerte V0 und r 0 beim Bewegen zu Diff. Ideen v. Schwierigkeiten bei der Analytik Annäherungen v isyo erzwingt häufiger eine Beschränkung auf numerische tabellarische oder grafische Darstellungen. Leistung v = v(r), wo r ich- interatomarer Abstand und andere Koordinaten der gegenseitigen Anordnung wechselwirkender Atome. Auf Abb. 2 zeigt das dimensionslose Potential von M. c. identische Edelgasatome. In solchen Koordinaten wird das Gesetz der entsprechenden Zustände perfekt eingehalten. Im Tisch. Es werden 3 Werte angegeben V0 und r 0 auch für diff. Atompaare. Bei realen Atom- und Molekülbildungen gilt das Prinzip der Paaradditivität, bei der das Potential M. in. gleich der Summe der Paarpotentiale aller Teilnehmer im M. Jahrhundert ist, ist nicht streng erfüllt, da die Ladungen nicht als Punktladungen betrachtet werden können, ihre Dichte eine kontinuierliche raumzeitliche Verteilung hat, die durch das Äußere gestört wird. und besitzen Felder. Dieses Prinzip ist nur für Modifikatoren näherungsweise erfüllt. Paarpotentiale. In diesem Fall werden Paarpotentiale nicht von isolierten Paaren wechselwirkender Objekte genommen, sondern deren Potentiale unter Bedingungen, die den untersuchten möglichst nahe kommen. Die paarweise additive Potentialnäherung wird häufig für Schätzberechnungen verwendet. Also, auf der Grundlage von analytischen Ausdrücke für das Potenzial von M. c. erhielt [J. K. Maxwell (J. C. Maxwell), L. Boltzmann (L. Boltzmann)] explizite Ausdrücke für die Koeffizienten. Diffusion, Wärmeleitfähigkeit, Viskosität (siehe Art. Gas ) , und später - Koeffizient. virale Expansionen. Quantenmechanik. Berechnungen realer (naib, einfacher) Systeme werden mit Adiabat durchgeführt. Näherung, die die Bewegung von Kernen berücksichtigt (langsamer als die Bewegung von Elektronen). Allerdings für M. Jahrhundert. Atome, die sich schnell relativ zueinander bewegen, ist diese Näherung nicht anwendbar. Adiabat die Annäherung gilt, wenn die Interaktionszeit a/v(a- Systemgröße, v- die Geschwindigkeit bezieht sich auf die Verschiebung von Atomen) ist viel länger als die Übergangszeit zwischen den Termen des wechselwirkenden Systems (der Massey-Parameter). Auf große Distanzen auf kleine v M berechnen. c. angeregte, ionisierte und andere Systeme verwenden manchmal asymptotische. Ansatz zur Lösung der Schrödinger-Gleichung.
Reis. 2. Dimensionsloses Wechselwirkungspotential symmetrischer Atompaare von Edelgasen. Abweichungen vom Gesetz der entsprechenden Zustände für verschiedene Atome passen in unterschiedliche Breiten der Diagrammlinie.

Lange Zeit glaubte man, dass das Potenzial von M. c. hängt nur vom Abstand zwischen den wechselwirkenden Teilchen ab, d.h. die Abmessungen der Teilchen selbst und ihre gegenseitige Orientierung wurden vernachlässigt, die Atome wurden als kugelsymmetrisch angesehen. Derzeit werden anisotrope Potentiale von M. Century in Betracht gezogen, die für intermolekulare Wechselwirkungen relevanter sind, aber auch für M. Century eine wichtige Rolle spielen. gyularisov. Atome. Auf Abb. Abbildung 3 zeigt die Temperaturabhängigkeit des zweiten Virialkoeffizienten, der die Natur von M. Century steuert. für polarisiertes und unpolarisiertes 3 He.
Eine der Erscheinungsformen der Anisotropie von M. ist die Bildung von Molekülen und Kristallen.

Reis. 3. Temperaturabhängigkeit des zweiten Virialkoeffizienten BEIM(cm 3 /mol) für polarisiertes und unpolarisiertes 3 He.
Beim Eintritt in komplexere Systeme kann die Symmetrie einzelner Struktureinheiten erhalten bleiben oder sich je nach Symmetrie ihrer Position in den von ihnen gebildeten Molekülen und Kristallen verändern. Diese Probleme werden gemäß dem Curie-Prinzip und dem Prinzip der minimalen Energie der Neubildung gelöst. Potenzial v in den einfachsten Systemen (Atome und Ionen von Wasserstoff und Helium) kann aus der Lösung der Schrödinger-Gleichung bestimmt werden. In den allermeisten Fällen v findet man durch Lösen der sog. inverse Probleme in Bezug auf experimentell gefundene Größen, die direkt davon abhängen v. Naib, die genauen Werte der Potentiale werden experimentell ermittelt. Streuung von Daten Molekular- und Atomstrahlen; Der Wert von F wird auch unter Verwendung empirisch erhaltener Virialkoeffizienten von Spectroconic gefunden. Daten einiger Modellrechnungen.
ELEKTROMAGNETISCHE EMISSIONEN
Elektromagnetische Strahlung(elektromagnetische Wellen) - eine Störung (Zustandsänderung) des elektromagnetischen Feldes, das sich im Raum ausbreitet (dh elektrische und magnetische Felder, die miteinander interagieren).
Unter elektromagnetischen Feldern im Allgemeinen, die durch elektrische Ladungen und ihre Bewegung erzeugt werden, ist es üblich, der Strahlung den Teil elektromagnetischer Wechselfelder zuzuschreiben, der sich am weitesten von seinen Quellen entfernt ausbreiten kann - sich bewegende Ladungen, die mit der Entfernung am langsamsten verblassen.
Elektromagnetische Strahlung wird unterteilt in
Funkwellen (beginnend mit extra lang),
· Infrarotstrahlung,
sichtbares Licht,
· UV-Strahlung,
Röntgenstrahlen und harte (Gamma-)Strahlung (siehe unten, siehe auch Abbildung).
Elektromagnetische Strahlung kann sich in fast allen Umgebungen ausbreiten. In einem Vakuum (einem Raum frei von Materie und Körpern, die elektromagnetische Wellen absorbieren oder emittieren) breitet sich elektromagnetische Strahlung ohne Dämpfung über beliebig große Entfernungen aus, aber in einigen Fällen breitet sie sich in einem mit Materie gefüllten Raum ziemlich gut aus (obwohl sie ihr Verhalten etwas ändert). .
LASERSTRAHLUNG
Laserstrahlung - elektromagnetische Strahlung, die bei Zwang entsteht. Anregung von Quantensystemen. Laser erzeugen elektromagnetische Strahlung im ultravioletten, sichtbaren und infraroten Bereich mit einer Wellenlänge von 0,2–1000 Mikrometer. L.i. verwendet beim Schweißen, Schneiden, Löten, Bohren von Löchern und anderen Prozessen zur Verarbeitung von Metallen, Kunststoffen usw. Baumaterialien. Beim Betrieb von Lasersystemen ist der menschliche Körper den gefährlichen Einwirkungen von Wärme, Licht und Mechanik ausgesetzt. und elektrisch Faktoren. Der Grad der Schädigung hängt in diesem Fall von den Parametern von L.I. ab: Energie, Leistung und Energiedichte der Strahlung, Dauer und Frequenz der Impulse, Wellenlänge usw. Bestrahlung mit hoher Intensität führt zu Hautschäden, ext. Gewebe und Organe. Die schädigende Wirkung von L.i. stellt eine ernsthafte Gefahr für die Augen dar.
Zum Schutz vor L.i. Es ist notwendig, einen Komplex aus technischen, sanitären und hygienischen Aspekten anzuwenden. und organisatorisch Maße. Insbesondere sollten Expositionsgrenzwerte nicht überschritten werden. Laseranlagen müssen Schutzvorrichtungen haben. Die Oberflächen des Raumes und der Ausstattung müssen matt und lackiert sein. in dunklen Tönen, ausgenommen die Reflexion von Laserstrahlen. Betreiber von Laseranlagen müssen persönliche Schutzausrüstung tragen (Kittel aus Baumwoll- oder Kattunstoff in hellgrün oder blau, Handschuhe, Laserschutzbrille in blaugrün oder orange, je nach Wellenlänge der Laserstrahlung).
FAZIT
Seit vielen Jahrtausenden leistet die im fließenden Wasser enthaltene Energie dem Menschen treue Dienste. Seine Reserven auf der Erde sind kolossal. Kein Wunder, dass einige Wissenschaftler glauben, dass es richtiger wäre, unseren Planeten nicht Erde, sondern Wasser zu nennen – immerhin sind etwa drei Viertel der Erdoberfläche mit Wasser bedeckt. Der Weltozean dient als riesiger Energiespeicher und absorbiert den größten Teil der Energie, die von der Sonne kommt. Hier treten Wellen auf, Ebbe und Flut treten auf, mächtige Meeresströmungen entstehen. Mächtige Flüsse entstehen, die riesige Wassermassen in die Meere und Ozeane tragen. Es ist klar, dass die Menschheit auf der Suche nach Energie an solchen gigantischen Reserven nicht vorbeikommen konnte.
Wasserstoffenergie
Wasserstoffenergie auf unserem Planeten könnte viele Probleme im Bereich der Umweltbelastung und des Ersatzes von Kohlenwasserstoffen lösen, da Wasser auf unserem Planeten zu 3/4 aus Wasser besteht. Um mechanische Energie zu erhalten, könnten wir verwenden Wasserstoffmotoren ( derselbe Verbrennungsmotor, aber statt Benzin oder Diesel nur Wasser). Ein weiterer Bereich der Wasserstoffenergie ist Brennstoffzelle, ein wenig an eine galvanische Zelle erinnernd, nur die Substanz (Wasser) wird von außen zugeführt. Bisher benötigt die Herstellung von Wasserstoff mehr Energie, als mit ihm gewonnen werden kann, sodass er nicht als Energiequelle angesehen werden kann. Es ist nur ein Mittel zur Speicherung und Abgabe von Energie.
Verzeichnis der verwendeten Literatur
Wasserstoff ist das einfachste chemische Element im Universum. Sein Atom besteht nur aus einem Proton im Kern und einem Elektron. Trotz seiner physikalischen und chemischen Einfachheit ist Wasserstoff das Hauptelement des Universums, dank ihm brennen und leuchten die Sterne, unser Planet ist mit Wasser bedeckt, und die komplexesten organischen Verbindungen haben das erstaunlichste Phänomen im Universum hervorgebracht -.
In Kontakt mit
Eigenschaften des Stoffes
In der Natur ist Wasserstoff überall in der Zusammensetzung anderer Elemente des Periodensystems zu finden. Das auffälligste Beispiel für eine solche Verbindung ist eine Substanz wie z.
Wasserstoff hat drei Isotope:
- Protium H (das allererste Element des Periodensystems, Wasserstoff, der uns allen bekannt ist);
- Deuterium (der sogenannte schwere Wasserstoff, der im Kern nicht nur ein Proton, sondern auch ein Neutron enthält);
- Tritium ist ein radioaktives Wasserstoffisotop, dessen Kern aus einem Proton und zwei Neutronen besteht.
Wasserstoffbrückenbindungen sind charakteristisch und in den meisten organischen Verbindungen vorhanden. In Verbindung mit Chlor bildet Wasserstoff Perchlorsäure, mit Sauerstoff - Wasser, mit Stickstoff - Ammoniak. Diese Ende des 19. Jahrhunderts entdeckten Phänomene wurden von den russischen Chemikern M. Ilyinsky und N. Beketov entdeckt.
Wissenschaftler haben herausgefunden, dass eine Gruppe von Atomen, die Wasserstoff enthalten, am häufigsten stabile Assoziationen mit einem negativ geladenen Atom bildet, das Teil eines bestimmten Moleküls sein kann (möglicherweise sogar in demselben). Diese zusätzliche "Kopplung" wird als Wasserstoffbrücke bezeichnet.
Die Natur des Phänomens
Lassen Sie uns die Definition einer Wasserstoffbrücke (h.c.) geben. Dies ist die Wechselwirkung zwischen negativ geladenen Teilchen von Molekülen, die durch das Wasserstoffatom realisiert wird.
Wenn ein Balken eine kovalente Bindung und drei Punkte eine Wasserstoffbrücke bezeichnen, dann können wir symbolisch die v.s. zwischen den Molekülen A und B auf diese Weise: .
Die Natur dieses interatomaren Phänomens ist recht einfach zu verstehen. Das H-Atom trägt positive Ladungen δ+, trifft es auf seinem Weg auf ein negativ geladenes mit der Ladung δ−, so tritt es mit diesem in elektrostatischen Kontakt.
Wichtig! Meistens vs. viel schwächer als kovalente. Sie sind jedoch viel stärker als die normale molekulare Anziehungskraft von Partikeln, die Feststoffen und Flüssigkeiten innewohnt.
Kovalenz
Trotz der Tatsache, dass v.s. innerhalb zweier Teilchen eines Paares völlig unterschiedlicher Moleküle auftreten kann, ist die Wasserstoffchemikalie keine molekulare Bindung. Die Eigenschaft der Richtung und Sättigung ist eine der Qualitäten eines W.S., was es einem kovalenten sehr ähnlich macht. Beachten Sie, dass in vielen Theorien v.s. gilt als eine Art und dies beeinflusst die Ergebnisse in keiner Weise, daher kann diese Meinung als richtig angesehen werden. Darüber hinaus ist die Natur der v.s. sehr nahe kovalent.
Dies kann leicht mit traditionellen chemischen Methoden demonstriert werden, die Orbitale innerhalb von Molekülen berechnen. In dieser Berechnung handelt es sich um eine Drei-Zentren-Zwei-Elektronen-Bindung. Dies beweist einmal mehr, dass die Zuordnung von VS zur kovalenten Sorte nichts Antiwissenschaftliches enthält.

Bildungsprozess
Was ist der Weg der Bildung. Wasserstoffbrückenbindungen werden zwischen elektronegativen Atomen gebildet, von denen eines ein freies Elektronenpaar hat.
Das überzeugendste Zeichen von v.s. ist der Abstand zwischen dem H-Atom und dem zweiten Atom. Die Sache ist, dass der Abstand zwischen Atomen kleiner ist als die Summe von zwei Atomradien. Trotz der oft auftretenden Asymmetrie (wenn in , ist der Abstand größer als der Abstand ), ist die Summe der Atomradien immer noch größer als der Abstand zwischen ihnen.
Ja, Asymmetrie in vs. üblich, es gibt aber auch symmetrische Bauformen wie HF. Der Winkel zwischen dem ersten und dem zweiten Atom im System beträgt fast 180 Grad. In Erinnerung an HF-Fluorwasserstoffe ist zu beachten, dass die Verbindung mit Fluor eine der stärksten ist. HF ist ein Ion vom symmetrischen Typ ![]() . Darin beträgt die Energie von Wasserstoffverbindungen etwa 150 Kilojoule pro Mol. Die kovalente Bindung von Fluorwasserstoff ist ungefähr gleich. In Wasser H 2 O vs. viel weniger - etwa 20 Kilojoule pro Mol.
. Darin beträgt die Energie von Wasserstoffverbindungen etwa 150 Kilojoule pro Mol. Die kovalente Bindung von Fluorwasserstoff ist ungefähr gleich. In Wasser H 2 O vs. viel weniger - etwa 20 Kilojoule pro Mol.
Die Verbindung von Teilchen durch Wasserstoff findet sich in einer Vielzahl unterschiedlicher Verbindungen. Eine chemische Bindung tritt häufig zwischen Fluor, Stickstoff und auf, da letztere die elektronegativsten Elemente sind. Selten zwischen Chlor, Schwefel und anderen Nichtmetallen zu finden.
Wichtig! Stickstoff und Sauerstoff sind die Grundlage des Lebens, diese Elemente kommen in besonders hoher Konzentration in Kohlenhydraten, Proteinen und Nukleinsäuren vor. Gäbe es keinen starken Kontakt zwischen diesen Stoffen durch das H-Atom, wäre Leben auf der Erde unmöglich.
Eine intermolekulare Wasserstoffbrücke ist eine Form der Bildung einer starken Struktur, die ein Molekül über ein H-Atom mit einem anderen verbindet. Ein Paradebeispiel ist Ameisensäure. Es ist ein Molekül, das aus zwei oder mehr einfachen Molekülen (Dimer) besteht.

Intramolekulares HB ist ein Typ, bei dem das H-Atom ein Bindeglied innerhalb eines Moleküls ist.
Gleiches gilt für den gasförmigen Fluorwasserstoff. Es enthält solche polymeren Strukturen, die aus vier einfachen HF-Molekülen bestehen können, die durch Wasserstoff miteinander verbunden sind.
Es braucht nicht nach Beispielen für eine intermolekulare Struktur von Wasserstoff gesucht zu werden: Die Löslichkeit von Glucose, Fructose, Saccharose in einer wässrigen Lösung wird genau mit Hilfe von Wasserstoff und seinen verbindenden Eigenschaften erklärt. Die molekularen Strukturen lebender Organismen (zum Beispiel das Molekül) enthalten Millionen von komplexen Strukturen, die durch Wasserstoff gebunden sind.
Verbindungsfunktion
Wie wichtig ist die soziale Rolle dieser Verbindungen. Betrachten Sie mehrere Substanzen, die aufgrund von Wasserstoffbrückenbindungen existieren. Wir werden diese Moleküle mit Wasser vergleichen. Um in unseren Überlegungen ehrlich zu sein, werden wir nur Nichtmetalle zum Vergleich auswählen. Diese Stoffe werden Wasserstoffchalkogene genannt.
Zum Beispiel Tellur. Die Wasserstoffverbindung H 2 Te siedet bei -2 Grad. Was Selen betrifft, so siedet H 2 Se bei einer Temperatur von -42 Grad und Schwefelwasserstoffchalkogen H 2 S siedet bei -60 Grad. Es ist erstaunlich, dass Wasser bei +100 Grad kocht.
Beachtung! Wenn es keine Wasserversorgung gäbe und Sauerstoff nicht solche „hartnäckigen“ Eigenschaften hätte, gäbe es im gegenwärtigen Klima auf der Erde kein Wasser in flüssigem Zustand. Dieser hohe Siedepunkt ist eine direkte Folge der Wasserstoffbindung.
Die „Anhaftung“ von Sauerstoffatomen an Wasserstoff ist im folgenden Bild dargestellt.

Aber die erstaunlichen Eigenschaften des Wassers enden hier nicht. Sie sollten sich auch an das Schmelzen erinnern. Und wieder die Wasserstoffbrücke - deswegen beginnt die Dichte beim Schmelzen zuzunehmen. Beim Schmelzen von Eis wird jede zehnte Wasserstoffverbindung zerstört, wodurch sich Wassermoleküle nähern.
Arten und Eigenschaften von Wasserstoffbrückenbindungen.
Wasserstoffverbindung. Selbstvorbereitung auf das Einheitliche Staatsexamen und TsT in Chemie
Fazit
Wasserstoffbrückenbindungen beeinflussen den Säuregehalt von Substanzen. Beispielsweise ist Flusssäure HF ziemlich schwach. Gleichzeitig sind andere Halogenwasserstoffsäuren ziemlich stark. Der Grund dafür ist, dass H mit zwei F-Atomen gleichzeitig verbunden ist, und dies gibt ihnen keine Möglichkeit, sich zu lösen. Aus diesem Grund ist HF die einzige Säure, die das Säuresalz NaHF 2 bildet.
2. Bestimmung der Wasserstoffbrückenbindung
Die Bindung, die sich zwischen den Wasserstoffatomen eines Moleküls und einem Atom eines stark elektronegativen Elements (O, N, F) eines anderen Moleküls bildet, wird als Wasserstoffbrücke bezeichnet.
Es stellt sich die Frage: Warum genau geht Wasserstoff eine so spezifische chemische Bindung ein?
Das liegt daran, dass der Atomradius von Wasserstoff sehr klein ist. Wenn ein einzelnes Elektron verdrängt oder vollständig abgegeben wird, erhält Wasserstoff außerdem eine relativ hohe positive Ladung, wodurch der Wasserstoff eines Moleküls mit Atomen elektronegativer Elemente interagiert, die eine teilweise negative Ladung haben, die Teil anderer Moleküle ist (HF, H 2 O, NH 3) .
Schauen wir uns einige Beispiele an. Üblicherweise stellen wir die Zusammensetzung von Wasser mit der Summenformel H 2 O dar. Dies ist jedoch nicht ganz korrekt. Richtiger wäre es, die Zusammensetzung von Wasser mit der Formel (H 2 O) n zu bezeichnen, wobei n \u003d 2.3.4 usw. Dies liegt daran, dass einzelne Wassermoleküle durch Wasserstoffbrückenbindungen miteinander verbunden sind.
Wasserstoffbrückenbindungen werden üblicherweise durch Punkte gekennzeichnet. Sie ist viel schwächer als eine ionische oder kovalente Bindung, aber stärker als die übliche intermolekulare Wechselwirkung.
Das Vorhandensein von Wasserstoffbrückenbindungen erklärt die Zunahme des Wasservolumens mit abnehmender Temperatur. Dies liegt daran, dass mit sinkender Temperatur die Moleküle stärker werden und damit die Dichte ihrer „Packung“ abnimmt.
Beim Studium der Organischen Chemie stellte sich auch die Frage: Warum sind die Siedepunkte von Alkoholen viel höher als die der entsprechenden Kohlenwasserstoffe? Dies erklärt sich dadurch, dass auch zwischen Alkoholmolekülen Wasserstoffbrückenbindungen gebildet werden.
Eine Erhöhung des Siedepunktes von Alkoholen erfolgt auch durch die Vergrößerung ihrer Moleküle. Die Wasserstoffbrückenbindung ist auch für viele andere organische Verbindungen (Phenole, Carbonsäuren etc.) charakteristisch. Aus den Vorlesungen der Organischen Chemie und der allgemeinen Biologie ist bekannt, dass das Vorhandensein einer Wasserstoffbrücke die Sekundärstruktur von Proteinen, die Struktur der DNA-Doppelhelix, also das Phänomen der Komplementarität, erklärt.
3. Arten von Wasserstoffbrückenbindungen
Es gibt zwei Arten von Wasserstoffbrückenbindungen: intramolekulare und intermolekulare Wasserstoffbrückenbindungen. Verbindet eine Wasserstoffbrücke Teile eines Moleküls, spricht man von einer intramolekularen Wasserstoffbrücke. Dies gilt insbesondere für viele organische Verbindungen. Wenn zwischen dem Wasserstoffatom eines Moleküls und dem Nichtmetallatom eines anderen Moleküls eine Wasserstoffbrücke gebildet wird (intermolekulare Wasserstoffbrücke), dann bilden die Moleküle ziemlich starke Paare, Ketten, Ringe. Ameisensäure liegt also sowohl im flüssigen als auch im gasförmigen Zustand in Form von Dimeren vor:
und gasförmiger Fluorwasserstoff enthalten polymere Moleküle, darunter bis zu vier HF-Partikel. Starke Bindungen zwischen Molekülen finden sich in Wasser, flüssigem Ammoniak, Alkoholen. Die für die Bildung von Wasserstoffbrückenbindungen notwendigen Sauerstoff- und Stickstoffatome enthalten alle Kohlenhydrate, Proteine, Nukleinsäuren. Es ist zum Beispiel bekannt, dass Glucose, Fructose und Saccharose vollkommen wasserlöslich sind. Eine wichtige Rolle spielen dabei in Lösung gebildete Wasserstoffbrücken zwischen Wassermolekülen und zahlreichen OH-Gruppen von Kohlenhydraten.
4. Wasserstoffbindungsenergie
Es gibt mehrere Ansätze zur Charakterisierung von Wasserstoffbrückenbindungen. Das Hauptkriterium ist die Energie der Wasserstoffbrückenbindung (R–X–H…B–Y), die sowohl von der Natur der X- und B-Atome als auch von der allgemeinen Struktur der RXH- und BY-Moleküle abhängt. Meistens beträgt sie 10–30 kJ/mol, kann aber in einigen Fällen 60–80 kJ/mol und noch mehr erreichen. Entsprechend den Energieeigenschaften werden starke und schwache Wasserstoffbrückenbindungen unterschieden. Die Bildung starker Wasserstoffbrückenbindungen beträgt 15–20 kJ/mol und mehr. Dazu gehören O–H…O-Bindungen in Wasser, Alkoholen, Carbonsäuren, O–H…N-, N–H…O- und N–H…N-Bindungen in Verbindungen mit Hydroxyl-, Amid- und Amingruppen, beispielsweise in Proteinen. Schwache Wasserstoffbrücken haben eine Bildungsenergie von weniger als 15 kJ/mol. Die untere Grenze der Wasserstoffbindungsenergie beträgt 4–6 kJ/mol, z. B. C–H…O-Bindungen in Ketonen, Ethern und wässrigen Lösungen organischer Verbindungen.
Die stärksten Wasserstoffbrückenbindungen entstehen, wenn ein kleiner Wasserstoff (harte Säure) gleichzeitig an zwei kleine, stark elektronegative Atome (harte Basen) gebunden wird. Die Orbitalanpassung sorgt für eine bessere Säure-Base-Wechselwirkung und führt zu stärkeren Wasserstoffbrückenbindungen. Das heißt, die Bildung starker und schwacher Wasserstoffbrückenbindungen kann vom Standpunkt des Konzepts harter und weicher Säuren und Basen (Prinzip von Pearson, das Prinzip von HICA) erklärt werden.
Die Energie der H-Bindung steigt mit einer Zunahme der positiven Ladung am Wasserstoffatom der X-H-Bindung und mit einer Zunahme des Protonenakzeptors des B-Atoms (seiner Basizität). Obwohl die Bildung einer Wasserstoffbindung vom Standpunkt einer Säure-Base-Wechselwirkung betrachtet wird, ist die Energie der Bildung von H-Komplexen jedoch nicht streng mit sowohl der Aciditätsskala als auch der Basizitätsskala korreliert.
Ein ähnliches Bild zeigt sich bei Mercaptanen und Alkoholen. Mercaptane sind stärkere Säuren als Alkohole, aber Alkohole bilden stärkere Assoziate. Der Grund für solche offensichtlichen Anomalien ist durchaus verständlich, da die Acidität durch den pKa-Wert gemäß den Ergebnissen des vollständigen Schemas der Säure-Base-Wechselwirkung (vor der Bildung solvatisierter Ionen) und der Bildung eines molekularen Komplexes bestimmt wird mit einer H-Brücke ist nur die erste Stufe dieses Prozesses, bei der die X-Bindung nicht gespalten wird. In inerten Lösungsmitteln hört die Säure-Base-Wechselwirkung normalerweise auf der Stufe des H-Komplexes auf.
Hinsichtlich der Basizität organischer Verbindungen und ihrer Fähigkeit, an H-Brückenbildungen teilzunehmen, gibt es auch hier große Unterschiede. Bei gleicher Fähigkeit zur Bildung von Wasserstoffbrücken ist der Basizitätsgrad von Aminen also 5 Größenordnungen höher als der von Pyridinen und 13 Größenordnungen höher als der von substituierten Carbonylverbindungen.
Auf der Grundlage experimenteller Daten wurde eine lineare Korrelation zwischen dem Grad des Ladungstransfers und der Energie intermolekularer H-Brücken festgestellt, was ein wichtiges Argument für die Donor-Akzeptor-Natur der letzteren ist. Sterische Faktoren können einen signifikanten Einfluss auf die Bildung einer Wasserstoffbindung haben. Beispielsweise neigen ortho-substituierte Phenole weniger zur Selbstassoziation als die entsprechenden meta- und para-Isomere, beim 2,6-Di-tert.-butylphenol fehlt die Assoziation vollständig. Mit steigender Temperatur nimmt die Zahl der Molekülkomplexe in der Mischung ab, und sie kommen in der Gasphase viel seltener vor.
Zu Beginn des Kurses wurde festgestellt, dass die Wasserstoffbrücke eine Zwischenstellung zwischen der echten (valenzen) chemischen Bindung und der schwachen intermolekularen Wechselwirkung einnimmt. Wo ist näher? Die Antwort ist zweideutig, da die Schwankungsbreite der Energien von H-Brücken ziemlich groß ist. Wenn wir über starke Wasserstoffbrückenbindungen sprechen, die einen erheblichen Einfluss auf die Eigenschaften von Substanzen haben können, dann sind sie echten chemischen Bindungen näher. Und das wird nicht nur durch die ziemlich hohe Energie der H-Brücke bestimmt, sondern auch dadurch, dass sie räumlich lokalisiert ist, die Wasserstoffbrücke hat ihre eigenen „persönlichen“ Partner. Auch die Wirkungsrichtung der Wasserstoffbrückenbindung ist festgelegt, wenn auch nicht so starr wie bei echten chemischen Bindungen.





Wasserstoffbrückenbindung von intermolekular. Wenn die Bildung von H-Brücken spektral nachgewiesen wird, aber keine Anzeichen einer Assoziation vorliegen, ist dies ein korrekter Hinweis auf die intramolekulare Natur der Wasserstoffbrücke. Außerdem verschwindet die intermolekulare H-Brücke (und ihre spektrale Manifestation) bei einer niedrigen Konzentration einer Substanz in einem neutralen Lösungsmittel, während die intramolekulare H-Brücke unter diesen Bedingungen bestehen bleibt. Wasserstoff...
Ein Molekül und Wasserstoffatome eines anderen, Typ H-X (X ist F, O, N, Cl, Br, I) aufgrund der elektrostatischen Anziehungskräfte.
Die Bindung zwischen Wasserstoff und einem dieser Atome zeichnet sich durch ausreichende Polarität aus, da die bindende Elektronenwolke zum elektronegativeren Atom hin verschoben ist. Wasserstoff befindet sich in diesem Fall am positiven Ende des Dipols. Zwei oder mehr solcher Dipole interagieren miteinander, sodass der Kern des Wasserstoffatoms eines Moleküls (das positive Ende des Dipols) von dem einsamen Elektronenpaar des zweiten Moleküls angezogen wird. Diese Verbindung manifestiert sich in Gasen, Flüssigkeiten und Feststoffen.
Sie ist relativ langlebig. Das Vorhandensein einer Wasserstoffbindung bewirkt eine Erhöhung der Stabilität der Moleküle einer Substanz sowie eine Erhöhung ihrer Siede- und Schmelzpunkte. Die Bildung von Wasserstoffbrückenbindungen spielt sowohl in chemischen als auch in biologischen Systemen eine wichtige Rolle.
Die Wasserstoffbrückenbindung kann intra- und intermolekular sein (Abb. 14), Carbonsäuremoleküle in unpolaren Lösungsmitteln dimerisieren aufgrund von zwei intermolekularen Wasserstoffbrückenbindungen.
| a | b |
Reis. 14. Bildung einer Wasserstoffbrücke: a- intramolekular; b- intermolekular.
Das Vorhandensein von Stoffen in verschiedenen Aggregatzuständen deutet darauf hin, dass zwischen Teilchen (Atome, Ionen, Moleküle) eine Wechselwirkung aufgrund von Van-der-Waals-Anziehungskräften besteht. Das wichtigste und kennzeichnendste Merkmal dieser Kräfte ist ihre Universalität, da sie ausnahmslos zwischen allen Atomen und Molekülen wirken.
Wasserstoffbrückenbindungen beeinflussen die physikalischen (Siedepunkt und Schmelzpunkt, Flüchtigkeit, Viskosität, spektrale Eigenschaften) und chemischen (Säure-Base) Eigenschaften von Verbindungen.
Intermolekulare Wasserstoffbrückenbindungen verursachen die Assoziation von Molekülen, was zu einer Erhöhung der Siede- und Schmelzpunkte der Substanz führt. Beispielsweise siedet der assoziationsfähige Ethylalkohol C 2 H 5 OH bei +78,3 ° C und der keine Wasserstoffbrückenbindungen bildende Dimethylether CH 3 OCH 3 erst bei 24 ° C (die Summenformel beider Substanzen lautet C 2 H 6 O).
Die Bildung von H-Brücken mit Lösungsmittelmolekülen verbessert die Löslichkeit. So lösen sich Methyl- und Ethylalkohole (CH 3 OH, C 2 H 5 OH), die H-Brücken mit Wassermolekülen bilden, unbegrenzt darin auf.
Intramolekulare Wasserstoffbrückenbindung wird bei günstiger räumlicher Anordnung im Molekül aus den entsprechenden Atomgruppen gebildet und beeinflusst gezielt die Eigenschaften. Beispielsweise erhöht die H-Bindung in Salicylsäuremolekülen ihren Säuregehalt.
Wasserstoffbrückenbindungen und ihr Einfluss auf die Eigenschaften von Materie
Es wird derzeit auch angenommen, dass die chemische Wasserstoffbindung schwach und stark sein kann.
Sie unterscheiden sich in Energie und Bindungslänge (Abstand zwischen Atomen):
1. Wasserstoffbrückenbindungen sind schwach. Energie - 10-30 kJ / mol, Bindungslänge - 30. Alle oben aufgeführten Substanzen sind Beispiele für eine normale oder schwache Wasserstoffbindung.
2. Wasserstoffbrückenbindungen sind stark. Energie - 400 kJ / mol, Länge - 23-24.
Wasserstoffbrückenbindungen kommen in vielen chemischen Verbindungen vor. Sie entstehen in der Regel seltener zwischen den Atomen Fluor, Stickstoff und Sauerstoff (den elektronegativsten Elementen) - unter Beteiligung von Atomen von Chlor, Schwefel und anderen Nichtmetallen. Starke Wasserstoffbrückenbindungen werden in flüssigen Stoffen wie Wasser, Fluorwasserstoff, sauerstoffhaltigen anorganischen Säuren, Carbonsäuren, Phenolen, Alkoholen, Ammoniak, Aminen gebildet. Während der Kristallisation bleiben Wasserstoffbrückenbindungen in diesen Substanzen normalerweise erhalten. Daher haben ihre Kristallstrukturen die Form von Ketten (Methanol), flachen zweidimensionalen Schichten (Borsäure), dreidimensionalen räumlichen Gittern (Eis).
Verbindet eine Wasserstoffbrücke Teile eines Moleküls, spricht man von einer intramolekularen Wasserstoffbrücke. Dies ist besonders charakteristisch für viele organische Verbindungen (Abb. 42). Wenn zwischen dem Wasserstoffatom eines Moleküls und dem Nichtmetallatom eines anderen Moleküls eine Wasserstoffbrücke gebildet wird (intermolekulare Wasserstoffbrücke), dann bilden die Moleküle ziemlich starke Paare, Ketten, Ringe. Ameisensäure liegt also sowohl im flüssigen als auch im gasförmigen Zustand in Form von Dimeren vor:
und gasförmiger Fluorwasserstoff enthalten polymere Moleküle, darunter bis zu vier HF-Partikel. Starke Bindungen zwischen Molekülen finden sich in Wasser, flüssigem Ammoniak, Alkoholen. Die für die Bildung von Wasserstoffbrückenbindungen notwendigen Sauerstoff- und Stickstoffatome enthalten alle Kohlenhydrate, Proteine, Nukleinsäuren. Es ist zum Beispiel bekannt, dass Glucose, Fructose und Saccharose vollkommen wasserlöslich sind. Eine wichtige Rolle spielen dabei in Lösung gebildete Wasserstoffbrücken zwischen Wassermolekülen und zahlreichen OH-Gruppen von Kohlenhydraten.
15) Metallverbindung.
- Metalle vereinen Eigenschaften, die in der Natur üblich sind und sich von den Eigenschaften anderer Stoffe unterscheiden. Solche Eigenschaften sind relativ hohe Schmelzpunkte, die Fähigkeit, Licht zu reflektieren, und eine hohe thermische und elektrische Leitfähigkeit. Diese Eigenschaften sind auf das Vorhandensein einer speziellen Art von Bindung in Metallen zurückzuführen - metallische Bindung. Metallverbindung- Kommunikation zwischen positiven Ionen in Metallkristallen, die aufgrund der Anziehung von Elektronen erfolgt, die sich frei durch den Kristall bewegen. Entsprechend der Stellung im Periodensystem haben Metallatome eine geringe Zahl an Valenzelektronen. Diese Elektronen sind eher schwach an ihre Kerne gebunden und können sich leicht von ihnen lösen. Dadurch entstehen im Kristallgitter des Metalls positiv geladene Ionen und freie Elektronen. Daher gibt es im Kristallgitter von Metallen eine größere Bewegungsfreiheit der Elektronen: Einige der Atome verlieren ihre Elektronen, und die entstehenden Ionen können diese Elektronen aus dem "Elektronengas" aufnehmen. Infolgedessen besteht das Metall aus einer Reihe positiver Ionen, die an bestimmten Positionen des Kristallgitters lokalisiert sind, und einer großen Anzahl von Elektronen, die sich relativ frei im Bereich positiver Zentren bewegen. Dies ist ein wichtiger Unterschied zwischen metallischen Bindungen und kovalenten Bindungen, die eine strikte räumliche Orientierung haben. Eine metallische Bindung unterscheidet sich von einer kovalenten Bindung auch in der Stärke: Ihre Energie ist 3- bis 4-mal geringer als die Energie einer kovalenten Bindung. Bindungsenergie – die Energie, die erforderlich ist, um eine chemische Bindung in allen Molekülen aufzubrechen, die ein Mol einer Substanz ausmachen. Die Energien kovalenter und ionischer Bindungen sind üblicherweise hoch und liegen in der Größenordnung von 100–800 kJ/mol.