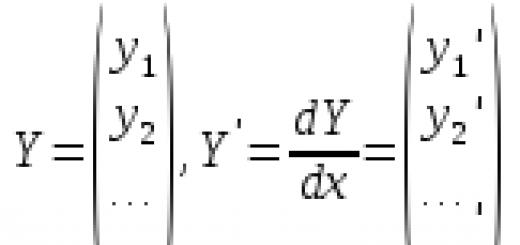Введение
Межатомные взаимодействие
Свойства водородных связей
Электромагнитные излучения
Лазерное излучение
Заключение
Водородная энергетика
ВВЕДЕНИЕ
Водородная связь -форма ассоциации между электроотрицательным атомом и атомом водорода H , связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H , ковалентно связанным с атомом A группы A-H молекулы RA-H иэлектроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR" . Результатом таких взаимодействий являются комплексы RA-H BR" различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR" .
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность , её распространенность и важность, особенно в органических соединениях , а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случайковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H -).
Межмолекулярная и внутримолекулярная водородная связь
Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками - водородная связь).
Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи. Она может быть описана с помощью метода молекулярных орбиталей как трехцентровая двухэлектронная связь.
Одним из признаков водородной связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых расстояние Н ... В больше, чем А−В. Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной. Угол между атомами во фрагменте А−Н ... В обычно близок к 180 o . Наиболее сильные водородные связи образуются с участием атомов фтора. В симметричном ионе − энергия водородная связи равна 155 кДж/моль и сопоставима с энергией ковалентной связи. Энергия водородная связи между молекулами воды уже заметно меньше (25 кДж/моль).
ОСНОВНАЯ ЧАСТЬ
Межатомное взаимодействие
Тип связи между атомами, промежуточный между валентным и невалентным межатомным взаимодействием. В. с. может образоваться при наличии атома H между двумя эл--отрицат. атомами - F, N или О, причём с одним из этих двух атомов атом водорода связан ковалентной связью.
Природа В. с. состоит в том, что электронная плотность на линии связи О-H (N-H и т. д.) смещается к более эл--отрицат. атому О (N и т. д.). При этом протон водорода "оголяется", что способствует сближению эл--отрицат. атомов соседних молекул. В результате расстояния О. . .О и N. . .О в В. с. О-H. . .0 и N - H. . .О оказываются примерно равными сумме ван-дер-ваальсовых атомных радиусов, т. е. эл--отрицат. атомы в кристаллах сближаются так, как будто бы атома водорода между ними нет.
Энергия В. с. на 1-1,5 порядка меньше энергии хим. связи и на 2-3 порядка больше энергии невалентного ван-дер-ваальсова взаимодействия. Наиб. сильную В. с. образуют между собой молекулы HF, к-рые способны соединяться в полимерные структуры H 2 F 2 , H 3 F 3 , H 4 F 4 , H 6 F 5 и H 6 F 6 (последняя особенно устойчива, поскольку является кольцеобразной и, следовательно, стабилизирована дополнительной В. с.). Весьма сильные B.с. (с энергией ~30 кДж/моль каждая) стабилизируют димер муравьиной к-ты устойчивый даже в парообразном состоянии. В жидкой и твёрдой воде энергия В. с. составляет ~20 кДж/моль. Примерно такой же энергией характеризуются В. с. N-H. . .О и О-H. . .О во мн. биологически важных молекулах - белках, нуклеиновых к-тах, углеводах и пр.

Наличием В. с. обусловлено своеобразие структуры и физ. свойств воды и водных растворов. Кристаллич. структура льда, существующая при обычных условиях, представляет собой ажурную сетку B.с., в к-рой имеется большое кол-во пустот. При плавлениильда эти пустоты частично заполняются молекулами воды, и потому плотность воды выше плотности льда.
В. с. могут быть не только межмолекулярными (как в рассмотренных выше примерах), но и внутримолекулярными. Внутримолекулярные В. с. являются одним из осн. факторов, стабилизирующих глобулярную структуру молекул белков, к-рая определяет функционирование белков в живых клетках; они же в значительной степени влияют на свойства древесины и бумаги, построенных из волокон целлюлозы, и отвечают за уникальную структуру молекул нуклеиновых K-T.
СВОЙСТВА:
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димерыили полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB) ± ; так, для комплекса (H 2 O H OH 2) + образованного H 2 O и H 3 O + - 132 кДж/моль в газовой фазе.
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить димер воды:
Энергия водородной связи в димере воды составляет 0,2 эВ (≈ 5 ккал/моль), что всего на порядок больше, чем характерная энергия теплового движения при температуре 300 К. В то же время энергия ковалентной O-H связи в 200 раз больше тепловой энергии. Таким образом, водородные связи относительно слабы и неустойчивы: предполагается, что они могут легко возникать и исчезать в результате тепловых флуктуаций. Это, в частности, приводит к тому, что вода должна рассматриваться не как «простая», а как «связанная жидкость»: вода представляется как сеть молекул , соединённых водородными связями.
МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ - взаимодействие атомов, находящихся в одинаковых либо в различных энергетич. и зарядовых состояниях. M. в. характеризуется потенциальной энергией (потенциалом взаимодействия) F, зависящей от взаимного расположения взаимодействующих атомов, в особенности от расстояния r между их ядрами. При определ. равновесном расстоянии r 0 и не слишком больших кинетич. энергиях свободных атомов в результате M. в. может возникнуть более или менее стабильная хим. связь между атомами,прочность к-рой зависит от вида атомов; её мерой могут служить время жизни молекулы, а также энергия хим. связи.
Наиб, простой случай M. в.- упругое столкновение атомов идеальных газов, к-рое в данной статье рассматриваться не будет (см.Столкновения атомные).В др. случаях M. в. неоднозначно ввиду многообразия условий, в к-рых могут оказаться атомы. Их внутр. энергия может измениться на десятки эВ только за счёт внеш. воздействий, к-рые способны воспринять и сохранить на какое-то время внеш. электронные оболочки атомов; неск. порядков величины занимает диапазон газокннетических и поперечных сечений других, более сложных процессов, различны симметрия и пространств, ориентация электронных плотностей их оболочек. Все эти характеристики атомов непосредственно определяют M. в.
M. в. связано в осн. с эл--статич. и эл--магн. силами, действующими между атомами. Количественная квантовая теория M. в. потребовала, кроме того, учёта принципа Паули. T. о., M. в. определяется взаимным расположением и перемещением взаимодействующих атомов и их фрагментов (электронов или распределённых в пространстве электронных оболочек и самих ядер).
Различают химические (или валентные) и физические (невалентные) M. в. К первым относят ковалентные (или гомополярные, обменные или донорно-акцептор-ные), ионные (или гетерополярные) и металлические M. в. Ко вторым - ван-дер-ваальсовы M. в., включающие эл--статич. взаимодействия мультиполей, поляризационные (индукционные и дисперсионные), релятивистские магн. и запаздывающие эл--магн. M. в. По энергетич. и пространств, характеристикам, промежуточным между валентным и невалентным M. в., является M. в., наз. водородной связью. Хим. связи более чем на порядок сильнее физических (соответственно единицы - десятки эВ и десятые доли - единицы эВ). M. в. возбуждённых атомов может приводить к образованию короткоживущих возбуждённых молекул (эксимерных молекул). Это пример сильной (~5 эВ), но не прочной, вернее не долгой, связи. Такого типа M. в. иногда носят резонансный характер.
Обычно конкретное M. в. включает в себя в разной степени разл. типы M. в., причём относит, вклад каждого M. в. не всегда удаётся установить; это может быть связано с близкими для них зависимостями V от r , напр, для неск. видов M. в. на больших расстояниях V ~r -6 . Нек-рые из физ. M. в. более характерны для межмолекулярных взаимодействий.
Химические M. в . Ковалентное M. в. имеет направленный, локализованный и насыщенный характер. При образовании хим. ковалентной связи происходят обобществление и концентрирование пары электронов на молекулярной орбитали , к-рая имеет пространств. фиксацию относительно связывающихся атомов. В образованной общей орбитали обобществлённые электроны могли первоначально принадлежать обоим атомам (образование H 2 , N 2 , O 2 и др.) либо, при возникновении донорно-акцепторной связи, только одному из атомов - донору, свободная же орбиталь принадлежит второму атому - акцептору. В качестве доноров или акцепторов могут служить целые группы атомов. Молекулы с ковалентной связью обычно полярные, т. е. имеют пост, электрич. дипольный момент.
В результате обработки разл. рода экспериментов и прямых квантовомеханич. расчётов оказалось, что потенциал ковалентных M. в. можно представить в виде
где подгоночные параметры координаты минимума потенциала V 0 и r 0 определяются конкретными взаимодействующими атомами. Первое слагаемое в (1) связано с притяжением, второе - с отталкиванием [В. Гайтлер (W. Heitler) и Ф. Лондон (F. London), 1927].
Ионное M.в. вызвано смещением валентных электронов одного атома (аниона) к другому (катиону), между к-рыми возникает эл--статич. притяжение. Примеры ионных связей - M. в. в галогенидах щелочных металлов. Эти связи нслокализованные и ненасыщаемые. Потенциал ионного M. в. определяется ф-лой
где n = 6-9, т = 1; остальные подгоночные параметры зависят от взаимодействующих атомов. T. к. чисто ионного или ковалентного M. в. не существует, для оценки ионной составляющей в ионно-ковалентной связи вводят параметр электроотрицательность атомов элементов, к-рый определяется полусуммой потенциала ионизации и сродства к электрону. Разность электроот-рицательностой взаимодействующих атомов примерно равна доле ионной составляющей в M. в.
Металлическое M. в. отличается нелокализованностью, ненасыщаемостью и ненаправленностью связей и определяется взаимодействием обобществлённого электронного газа с ионным остовом крнсталлич. структуры. Наиб, выражены M. в. этого типа в кристаллах металлов и сплавов. Потенциал металлич. M. в. определяется выражением
где a, b 1 , b 2 , b 3 - подгоночные параметры, характеризующие конкретное M. в.
Физические (ван-дер-ваальсовы) M. в. целиком описывают взаимодействие атомов благородных газов, нек-рых органич. соединений и, кроме того, вносят вклад во взаимодействия др. типов. Электрич. взаимодействие мультиполей приводит к т.н. ориентацией н о м у взаимодействию, описываемому ф-лой
где d 1 , d 2 - дипольные моменты взаимодействующих частиц. M. в. не ограничивается взаимодействием лишь диполей.
Однако M. в. с участием квадруполей и мультиполей более высокого порядка малы и обычно ими можно пренебречь (они характерны для межмолекулярного взаимодействия). Примеры взаимодействия мультиполей - M. в. с участием возбуждённых атомов и молекул.
Поляризационное M.в. возникает при поляризац. смещении электронных оболочек взаимодействующих атомов; такие M. в. можно рассматривать как ослабленную форму чисто ионной связи. Поляризац. M. в. подразделяются на индукционные и дисперсионные. Индукц. энергия взаимодействия атомов в осн. состоянии всегда отвечает притяжению, а в возбуждённых электронных состояниях возможны и притяжение, и отталкивание; она определяется ф-лой Дебая - Фалькенхагена
Дисперсионная энергия возникает благодаря чисто квантовомеханич. флуктуациям электронной плотности, не имеющим классич. аналога [Уонг (Wong), 1927]. F. Лондон (1930) дал общую теорию дисперсионных сил, объяснившую притяжение между атомами благородных газов и отталкивание на коротких расстояниях. Ф-ла для дисперсионного M. в. получается из решения ур-ния Шрёдингера методом теории возмущений:
где v 1 , v 2 - характеристич. частоты возбуждения взаимодействующих атомов. Для сферически-симметричных систем поляризац. энергия определяется статич. поляризуемостями атомов, а дисперсионная - дина-мич. поляризуемости или силами осцилляторовквантовых переходов.
Релятивистские магнитные и запаздывающие электромагнитные M. в. необходимо учитывать на больших расстояниях между атомами. Вклады этого типа M. в. увеличиваются с ростом массы атомов и при их возбуждении (т. е. при увеличении их размеров и внутр. энергии). Прямой расчёт показывает, что M. в. магн. типа становятся заметными на расстояниях ~ (10-100)r Б (r Б - радиус Бора) даже для атомов гелия. Механизм проявления эл--магн. запаздывания объясняется рассогласованием взаимной ориентации диполей за время распространения взаимодействия.
Учёт спиновых взаимодействий, вызывающих сверхтонкое расщепление спектральных линий, также оказывается необходимым на больших расстояниях (для атомов водорода при r > 10r Б).
Водородная связь может быть как внутримолекулярной, так и межмолекулярной. Диапазон энергии H-связей перекрывает весь энергетич. диапазон M. в. и делится на области сильных, средних и слабых H-связей. Они играют важную роль в биол. соединениях и MH. биохим. процессах. Особенность Н-свя-зи обусловлена тем, что благодаря малому радиусу (на порядок величины меньший, чем радиусы др. ионов) ион H + способен попадать в небольшие области между атомами. Напр., связь между молекулами воды определяется через протоны, к-рые одновременно связаны с "собственным" кислородом ковалентной внутримолекулярной связью и с кислородом др. молекулы ионной межмолекулярной связью (рис. 1).

В табл. 1 приведены энергии связи и равновесные расстояния между атомами А и В, H и А при разл. типах M. в.
Эксимерные M. в. Атомы инертных газов (и нек-рых др. элементов, напр. Hg) в возбуждённом состоянии проявляют свойства, сходные со свойствами атомов щелочных металлов. В частности, они образуют эксимерные молекулы с временем жизни от 4*10 -9 с (для ArF) до 4*10 -6 с (для Ar 2).
ния, включающие атомы галогенов, имеют энергии связи, близкие к соответствующим молекулам. В табл. 2 приведены равновесные расстояния г„ между атомами и энергии диссоциации D нек-рых эксимерных молекул и соответствующих им молекул галогенидов щелочных металлов.
| Табл. 2. | ||
| Молекулы | D , эВ | |
| Kr*F | 2,27 | 5,54 |
| RbF | 2,27 | 5,80 |
| Xe*F | 2,49 | 5,30 |
| CsF | 2,35 | 5,66 |
| Хе*Сl | 2,94 | 4,53 |
| CsCl | 2,91 | 4,87 |
| Хе*Вr | 2,96 | 4,30 |
| CsBr | 3,07 | 4,71 |
| Хе*I | 3,31 | 4,08 |
| CsI | 3,35 | 4,39 |
| T а б л. 3. | ||
| Система | V 0 , мэB | |
| H-He | 0,46 | 3,6 |
| H-Ne | 2,82 | 3,18 |
| H-Ar | 4,80 | 3,56 |
| H-Kr | 6,08 | 3,70 |
| H-Xe | 6,81 | 3,95 |
| Не- Не | 0,93 | 2,965 |
| Ne - Ne | 3,62 | 3,102 |
| Ar-Ar | 12,10 | 3,76 |
| Kr-Kr | 17,00 | 4,03 |
| Xe-Xe | 24,20 | 4,36 |
В эксимерной молекуле Ar 2 F атомы связаны одновременно по ионному (фтор и возбуждённый аргон) ц по ковалентному (атомы аргона) типам хил. связи.
К эксимерным M. в. следует отнести и резонансные M. в. между одинаковыми атомами, один из к-рых возбужден и поэтому имеет деформированную электронную оболочку. Разнообразие M. в. обусловлено особенностями деформаций плотностей электронных оболочек взаимодействующих атомов. Большое число существующих разл. представлений потенциалов M. в. (только для упругих M. в. их имеется неск. десятков) лишь частично удовлетворяет практику, т. к. ни одна из предложенных ф-л не универсальна. Различные V(R )имеют зону применимости либо по типам атомов, либо по расстояниям между ними, либо они привязаны к определ. типу первичной эксперим. информации. Значения параметров V вычисляются методом подгонки, обеспечивающей наилучшее согласие с выбранной матем. моделью явления.
Одной из наиб, универсальных оказалась ф-ла модифициров. потенциала Данема:
где V 0 - глубина потенциальной ямы; r 0 - равновесное значение г , соответствующее минимуму V ; b 0 , b п - подгоночные параметры. Имеется относительно большая устойчивость числовых значений V 0 и r 0 при переходе к разл. представлениям V . Затруднённость аналитич. аппроксимации V исё чаще вынуждает ограничиваться численным табличным или графич. представлением V = V (r ), где r i - межатомное расстояние и др. координаты взаимного расположения взаимодействующих атомов. На рис. 2 представлен безразмерный потенциал M. в. одинаковых атомов благородных газов. В таких координатах прекрасно соблюдается закон соответственных состояний. В табл. 3 приведены значения V 0 и r 0 также и для разл. пар атомов. В реальных атомно-молекулярных образованиях принцип парной аддитивности, при к-рой потенциал M. в. равен сумме парных потенциалов всех участников M. в., строго не выполняется, т. к. заряды нельзя считать точечными, их плотность имеет непрерывное пространственно-временное распределение, возмущаемое внеш. и собств. полями. Этот принцип приблизительно выполняется лишь для модифициров. парных потенциалов. В этом случае берутся парные потенцна-лы не изолированных пар взаимодействующих объектов, а их потенциалы в условиях, максимально приближённых к исследуемым. Приближение парного аддитивного потенциала часто используют для оценочных расчётов. Так, на основе аналитпч. выражения для потенциала M. в. получены [Дж. К. Максвелл (J. С. Maxwell), Л. Больцман (L. Boltzmann)] явные выражения для коэф. диффузии, теплопроводности, вязкости (см. в ст. Газ) , а позднее - коэф. вириальных разложений. Квантовомеханнч. расчёты реальных (наиб, простых) систем осуществлены с помощью адиабатич. приближения, учитывающего перемещение ядер (более медленное, чем движение электронов). Однако для M. в. атомов, быстро движущихся относительно друг друга, это приближение неприменимо. Адиабатич. приближение справедливо, когда время взаимодействия a/v (a - размер системы, v - скорость относит, перемещения атомов) много больше времени перехода между термами взаимодействующей системы (параметр Месси). На больших расстояниях при малых v для расчёта M. в. возбуждённых, ионизованных и др. систем иногда используют асимптотич. подход к решению ур-ния Шрёдингера.
Рис. 2. Безразмерный потенциал взаимодействия симметричных пар атомов благородных газов. Отклонения от закона соответственных состояний для различных атомов укладываются в различную ширину линии графика.

Долгое время полагали, что потенциал M. в. зависит лишь от расстояния между взаимодействующими частицами, т. е. размерами самих частиц и их взаимной ориентацией пренебрегали, атомы считали сферически-симметричными. В настоящее время вводятся в рассмотрение анизотропные потенциалы M. в., к-рые более актуальны для межмолекулярного взаимодействия, но играют также важную роль для M. в. гюляризов. атомов. На рис. 3 приведены зависимости от температуры второго вири-ального коэф., контролирующего характер M. в. для поляризованного и неполяризованного 3 He.
Одно из проявлений анизотропии M. в.- образование молекул и кристаллов.

Рис. 3. Температурная зависимость второго вириального коэффициента В (см 3 /моль) для поляризованного и неполярнзованного 3 He.
При их вхождении в более сложные системы симметрия отдельных структурных единиц может сохраниться или измениться в зависимости от симметрии их положения в образованных ими молекулах и кристаллах. Эти вопросы разрешаются в соответствии с принципом Кюри и принципом минимума энергии нового образования. Потенциал V в простейших системах (атомы и ионы водорода и гелия) может быть определён из решения ур-ния Шрёдингера. В подавляющем большинстве случаев V находится путем решения т. н. обратных задач по экспериментально найденным величинам, непосредственно зависящим от V . Наиб, точные значения потенциалов получают с помощью эксперим. данных по рассеянию молекулярных и атомных пучков ; значение F находят также с помощью эмпирически полученных вириальных коэффициентов, из спектросконич. данных, из нек-рых модельных расчётов.
ЭЛЕКТРОМАГНИТНЫЕ ИЗЛУЧЕНИЯ
Электромагни́тное излуче́ние (электромагнитные волны) - распространяющееся в пространстве возмущение (изменение состояния)электромагнитного поля (то есть, взаимодействующих друг с другом электрического и магнитного полей).
Среди электромагнитных полей вообще, порожденных электрическими зарядами и их движением, принято относить собственно к излучению ту часть переменных электромагнитных полей, которая способна распространяться наиболее далеко от своих источников - движущихся зарядов, затухая наиболее медленно с расстоянием.
Электромагнитное излучение подразделяется на
· радиоволны (начиная со сверхдлинных),
· инфракрасное излучение,
· видимый свет,
· ультрафиолетовое излучение,
· рентгеновское излучение и жесткое (гамма-излучение) (см. ниже, см. также рисунок).
Электромагнитное излучение способно распространяться практически во всех средах. В вакууме (пространстве, свободном от вещества и тел, поглощающих или испускающих электромагнитные волны) электромагнитное излучение распространяется без затуханий на сколь угодно большие расстояния, но в ряде случаев достаточно хорошо распространяется и в пространстве, заполненном веществом (несколько изменяя при этом свое поведение).
ЛАЗЕРНОЕ ИЗЛУЧЕНИЕ
Лазерные излучения - электромагнитные излучения, возникающие при вынужд. возбуждении квантовых систем. Лазеры генерируют электромагнитные излучения ультрафиолетового, видимого и ультракрасного диапазонов с длиной волны 0,2-1000 мкм. Л.и. применяют при сварке, резке, пайке, производстве отверстий и др. процессах обработки металлов, пластмасс и пр. строит, материалов. При эксплуатации лазерных установок организм человека подвергается опасному воздействию тепловых, световых, механич. и электрич. факторов. Степень поражения при этом зависит от параметров Л.и.: энергии, мощности и плотности энергии излучения, длительности и частоты импульсов, длины волны и пр. Облучения большой интенсивности приводят к повреждению кожного покрова, внутр. тканей и органов. Поражающее действие Л.и. представляет серьезную опасность для глаз.
Для защиты от Л.и. следует применять комплекс технич., санитарно-гигиенич. и организац. мер. В частности, не должны превышаться предельно допустимые уровни облучения. Лазерные установки должны иметь защитные устройства. Поверхности помещения и оборудования должны быть матовыми и окраш. в темные тона, исключающие отражение лазерных лучей. Операторы лазерных установок должны применять средства индивидуальной защиты (халаты из хлопчатобумажной или бязевой ткани светло-зеленого или голубого цвета, перчатки, противолазерные очки сине-зеленого или оранжевого цвета в зависимости от длины волны Л.и.).
ЗАКЛЮЧЕНИЕ
Многие тысячелетия верно служит человеку энергия, заключенная в текущей воде. Запасы ее на Земле колоссальны. Недаром некоторые ученые считают, что нашу планету правильнее было бы называть не Земля, а Вода - ведь около трех четвертей поверхности планеты покрыты водой. Огромным аккумулятором энергии служит Мировой океан, поглощающий большую ее часть, поступающую от Солнца. Здесь плещут волны, происходят приливы и отливы, возникают могучие океанские течения. Рождаются могучие реки, несущие огромные массы воды в моря и океаны. Понятно, что человечество в поисках энергии не могло пройти мимо столь гигантских ее запасов.
Водородная энергетика
Водородная энергетика на нашей планете могла бы решить много проблем в области причинения вреда окружающей среде и замены углеводородов, так как воды на нашей планете 3/4. Для получения механической энергии мы могли бы использовать Водородные двигатели(тот же двигатель внутреннего сгорания, но только вместо бензина или дизеля использовать воду). Ещё одно направление водородной энергетики это Топливный элемент , чем то напоминающий гальванический элемент, только вещество(вода) подается извне. На сегодняшний день для производства водорода требуется больше энергии, чем возможно получить при его использовании, поэтому считать его источником энергии нельзя. Он является лишь средством хранения и доставки энергии.
Список использованной литературы
Водород — простейший химический элемент во Вселенной. Его атом состоит всего из одного протона в ядре и одного электрона. Несмотря на свою физическую и химическую простоту, водород является основным элементом мироздания, благодаря ему горят и светятся звезды, наша планета покрыта водой, а сложнейшие органические соединения дали начало самому удивительному явлению во Вселенной — .
Вконтакте
Особенности вещества
В природе встретить водород в составе других элементов таблицы Менделеева можно повсюду. Самым ярким примером такого соединения является такое вещество, как .
Водород имеет три изотопа:
- протий Н (тот самый первый элемент таблицы Менделеева, привычный нам всем водород);
- дейтерий (так называемый тяжелый водород, содержащий в ядре не только протон, но и нейтрон);
- тритий — радиоактивный изотоп водорода, ядро которого состоит из протона и двух нейтронов.
Водородная связь характерна и присутствует в большинстве органических соединений. Соединяясь с хлором, водород образует хлорную кислоту, с кислородом — воду, с азотом — аммиак. Данные явления, обнаруженные в конце 19 века, были открыты русскими химиками М. Ильинским и Н. Бекетовым.
Ученые установили, что содержащая водород группа атомов чаще всего образует стабильные объединения с заряженным отрицательно атомом, который может входить в состав той или ной молекулы (не исключено, что даже в ту же самую). Данная дополнительная «сцепка» называется водородной связью.
Природа явления
Дадим определение водородной связи (в.с.). Это взаимодействие между отрицательно заряженными частицами молекул, реализованным атомом водорода.
Если чертой обозначить связь ковалентного типа, а тремя точками — водородную, то символически можно отобразить в.с. между молекулами А и В таким образом: .
Природу данного межатомного явления понять довольно просто. Атом Н несет положительные заряды δ+, если он встречает на своем пути заряженный отрицательно и обладающий зарядом δ−, то вступает с ним в электростатический контакт.
Важно! Чаще всего в.с. заметно слабее по сравнению с ковалентными. Однако они намного крепче, чем стандартное молекулярное притяжение частиц, свойственное твердым и жидким телам.
Ковалентность
Несмотря на то, что в.с. может протекать в рамках двух частиц пары совершенно разных молекул, водородная химическая не является молекулярной связью. Свойство направления и насыщения — одно из качеств в.с., которое делает ее очень похожей на ковалентную. Отметим, что во многих теориях, в.с. считается видом и это совершенно никак не влияет на результаты, поэтому можно считать данное мнение корректным. Более того, сама природа в.с. очень близка к ковалентной.
Это можно легко продемонстрировать при помощи традиционных химических методов, рассчитывающих орбитали внутри молекул. В этом исчислении она будет представлять собой трехцентровые двухэлектронные связи. В очередной раз это доказывает, что отнесение ВС к разновидности ковалентной не несет ничего антинаучного.

Процесс образования
Каков способ образования. Образуются водородные связи между электроотрицательными атомами, один из которых имеет свободную электронную пару.
Самым убедительным признаком в.с. является дистанция между атомом Н и вторым атомом. Все дело в том, что дистанция между атомами меньше, чем сумма двух атомарных радиусов. Не смотря на часто встречающуюся асимметрию (когда в , дистанция превышает расстояние ) все равно сумма радиусов атомов больше, чем расстояние между ними.
Да, асимметрия в в.с. встречается часто, однако существуют и симметричные конструкции, например HF. Угол между первым и вторым атомом в системе приближен к 180 градусам. Вспоминая фтороводороды HF, следует заметить, что соединение с фтором — одно из самых крепких. HF представляет собой ион симметричного типа ![]() . В нем энергия водородных соединений составляет порядка 150 килоджоулей в одном моле. Ковалентная связь фтороводорода приблизительно такая же. В воде Н 2 О в.с. значительно меньше — около 20 килоджоулей на моль.
. В нем энергия водородных соединений составляет порядка 150 килоджоулей в одном моле. Ковалентная связь фтороводорода приблизительно такая же. В воде Н 2 О в.с. значительно меньше — около 20 килоджоулей на моль.
Соединение частиц через водород найдено в большом количестве различных соединений. Химическая связь часто возникает между фтором, азотом и , так как последние являются самыми электроотрицательными элементами. Редко обнаруживается между хлором, серой и прочими элементами, не являющимися металлами.
Важно! Азот и кислород — основа жизни, эти элементы содержатся в особо высокой концентрации в углеводах, белках и нуклеиновой кислоте. Если бы между этими веществами не было прочного контакта через атом Н, жизнь на Земле была бы невозможна.
Межмолекулярная водородная связь — разновидность образования крепкой структуры, связывающей через атом Н одну молекулу с другой. Ярким примером является муравьиная кислота. Она представляет собой молекулу, состоящую из двух или более простых молекул (димер).

Внутримолекулярная ВС — разновидность, при которой атом Н является связующим звеном в рамках одной молекулы.
То же самое относится к фтороводороду, который находится в газообразном состоянии. Он содержит такие полимерные структуры, которые могут состоять из четырех простых молекул НF, объединенных друг с другом через водород.
Примеры водородной межмолекулярной конструкции искать не приходится: растворимость глюкозы, фруктозы, сахарозы в водном растворе объясняются именно при помощи водорода и его соединительным свойствам. Молекулярные структуры живых организмов (молекула , например) содержат миллионы сложных конструкций, связанных водородом.
Функция соединений
Насколько важна социальная роль данных связей. Рассмотрим несколько веществ, которые существуют благодаря водородному соединению. Мы будем сравнивать эти молекулы с водой. Чтобы наши размышления были честными, мы будем выбирать для сравнения исключительно неметаллы. Эти вещества называются халькогеноводородами.
Например, теллур. Водородное соединение H 2 Te кипит при температуре -2 градуса. Что касается, селена, то H 2 Se кипит при температуре -42 градуса, а серный халькогеноводород H 2 S кипит при -60 градусах. Поразительно то, что вода кипит при +100 градусах.
Внимание! Если бы не было в.с., а кислород не обладал настолько «цепкими» качествами, при существующем климате на Земле не существовало бы воды в жидком состоянии. Такая высокая температура кипения — непосредственное следствие водородной связи.
«Сцепление» атомов кислорода с водородом показано на следующем изображении.

Но на этом удивительные свойства воды не заканчиваются. Следует также помнить о ее плавлении. И снова водородная связь — именно из-за нее при плавлении плотность начинает расти. При таянии льда, каждое десятое водородное соединение разрушается, из-за чего молекулы воды приближаются друг к другу.
Типы и свойства водородной связи.
Водородная связь. Самоподготовка к ЕГЭ и ЦТ по химии
Вывод
Образования водородной связи влияют на кислотность веществ. К примеру, плавиковая кислота НF является достаточно слабой. При этом другие галогеноводородные кислоты довольно сильны. Причина этого в том, что Н соединен сразу с двумя атомами F, а это не дает им возможности отцепиться. Именно благодаря этому, НF- единственная кислота, образующая кислую соль NaHF 2 .
2. Определение водородной связи
Связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы, называется водородной связью.
Может возникнуть вопрос: почему именно водород образует такую специфическую химическую связь?
Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород приобретает сравнительно высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, выходящий в состав других молекул (HF, H 2 O, NH 3).
Рассмотрим некоторые примеры. Обычно мы изображаем состав воды химической формулой H 2 O. Однако это не совсем точно. Правильнее было бы состав воды обозначать формулой (H 2 O)n, где n = 2,3,4 и т. д. Это объясняется тем, что отдельные молекулы воды связаны между собой посредством водородных связей.
Водородную связь принято обозначать точками. Она гораздо более слабая, чем ионная или ковалентная связь, но более сильная, чем обычное межмолекулярное взаимодействие.
Наличие водородных связей объясняет увеличения объема воды при понижении температуры. Это связано с тем, что при понижении температуры происходит укрепление молекул и поэтому уменьшается плотность их «упаковки».
При изучении органической химии возникал и такой вопрос: почему температуры кипения спиртов гораздо выше, чем соответствующих углеводородов? Объясняется это тем, что между молекулами спиртов тоже образуются водородные связи.
Повышение температуры кипения спиртов происходит также вследствие укрупнения их молекул. Водородная связь характерна и для многих других органических соединений (фенолов, карбоновых кислот и др.). Из курсов органической химии и общей биологии известно, что наличием водородной связи объясняется вторичная структура белков, строение двойной спирали ДНК, т. е. явление комплементарности.
3. Виды водородной связи
Существует два вида водородной связи внутримолекулярная и межмолекулярная водородные связи. Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений. Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
4. Энергия водородной связи
Существуют несколько подходов к характеристике водородных связей. Основной критерий – это энергия водородного связывания (R–X–H…B–Y), которая зависит как от природы атомов Х и В, так и общего строения молекул RXH и BY. Большей частью она составляет 10–30 кДж/моль, но в некоторых случаях может достигать 60–80 кДж/моль и даже выше. По энергетическим характеристикам различают сильные и слабые водородные связи. Энергия образования сильных водородных связей составляет 15–20 кДж/моль и более. К ним относят связи О–H…О в воде, спиртах, карбоновых кислотах, связи О–Н…N, N–H…O и N–H…N в соединениях, содержащих гидроксильные, амидные и аминные группы, например в белках. Слабые водородные связи имеют энергию образования менее 15 кДж/моль. Нижним пределом энергии водородной связи является 4–6 кДж/моль, например связи С–Н…О в кетонах, эфирах, водных растворах органических соединений.
Наиболее прочные водородные связи образуются в случаях, когда маленький водород (жесткая кислота) одновременно связан с двумя малыми по размеру сильно электроотрицательными атомами (жесткие основания). Орбитальное соответствие обеспечивает лучшее кислотно-основное взаимодействие и приводит к образованию более прочных водородных связей. То есть образование сильных и слабых водородных связей можно объяснить с позиций концепции жестких и мягких кислот и оснований (принцип Пирсона, принцип ЖМКО).
Энергия Н-связи возрастает с увеличением положительного заряда на атоме водорода связи Х-Н и с повышением протоноакцепторности атома В (его основности). Хотя образование водородной связи рассматривается с позиций кислотно-основного взаимодействия, однако энергия образования Н-комплексов нестрого коррелируется как со шкалой кислотности, так и со шкалой основности.
Подобная картина наблюдается и в случае меркаптанов и спиртов. Меркаптаны являются более сильными кислотами, чем спирты, однако более прочные ассоциаты образуют спирты. Причина таких кажущихся аномалий вполне объяснима, если учесть, что кислотность определятся величиной pКа по результатам полной схемы кислотно-основного взаимодействия (до образования сольватированных ионов), а образование молекулярного комплекса с Н-связью только первый этап этого процесса, не предусматривающий разрыва связи Х–Н. В инертных растворителях кислотно-основное взаимодействие обычно останавливается на стадии Н-комплекса.
Что касается основности органических соединений и их способности принимать участие в образовании Н-связи, то здесь тоже наблюдаются большие различия. Так, при одной и той же способности к образованию водородных связей степень основности аминов на 5 порядков выше, чем у пиридинов, и на 13 порядков выше, чем у замещенных карбонильных соединений.
На основе экспериментальных данных установлена линейная корреляция между степенью переноса заряда и энергией межмолекулярных Н-связей, являющаяся важным доводом в пользу донорно-акцепторной природы последних. Существенное влияние на образование водородной связи могут оказывать стерические факторы. Например, орто-замещенные фенолы менее склонны к самоассоциации, чем соответствующие мета- и пара-изомеры, полностью отсутствует ассоциация у 2,6-ди-трет.-бутилфенола. С повышением температуры количество молекулярных комплексов в смеси уменьшается, и они значительно реже встречаются в газовой фазе.
В начале курсовой было отмечено, что водородная связь занимает промежуточное положение между истинной (валентной) химической связью и слабым межмолекулярным взаимодействием. Куда ближе? Ответ неоднозначный, так как диапазон колебаний энергий Н-связей довольно широк. Если же речь идет о сильных водородных связях, способных оказывать существенное влияние на свойства веществ, то они ближе к истинным химическим связям. И это определяется не только довольно высокой энергией Н-связи, но и тем, что она локализована в пространстве, водородный мостик имеет своих “персональных” партнеров. Направление действия водородной связи также фиксировано, хотя и не столь жестко, как для истинных химических связей.





Водородную связь от межмолекулярной. Если спектрально фиксируется образование Н-связей, а признаков ассоциации нет, это верное указание на внутримолекулярный характер водородной связи. Кроме того, межмолекулярная Н-связь (и ее спектральное проявление) исчезает при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется. Водородные...
Одной молекулы и атомами водорода другой, типа Н-Х (Х - это F, O, N, Cl, Br, I) за счет сил электростатического притяжения.
Связь между водородом и одним из этих атомов характеризуется достаточной полярностью, поскольку связующее электронное облако смещено в сторону более электроотрицательного атома. Водород в данном случае расположен на положительном конце диполя. Два и более таких диполя взаимодействуют между собой так, что ядро атома водорода одной молекулы (положительный конец диполя) притягивается неподеленной электронной парой второй молекулы. Данная связь проявляется в газах, жидкостях и твердых телах.
Она относительно прочна. Наличие водородной связи обусловливает повышение устойчивости молекул вещества, а также повышению их температуры кипения и плавления. Образование водородных связей играет важную роль как в химических, так и в биологических системах.
Водородная связь бывает внутри- и межмолекулярной (рис. 14), молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей.
| а | б |
Рис. 14. Образование водородной связи: а - внутримолекулярной; б - межмолекулярной.
Существование веществ в различных агрегатных состояниях свидетельствует о том, что между частицами (атомы, ионы, молекулы) имеет место взаимодействие, обусловленное ван-дер-ваальсовыми силами притяжения. Наиболее важной и отличительной чертой этих сил является их универсальность, так как они действуют без исключения между всеми атомами и молекулами.
Водородные связи влияют на физические (т.кип. и т.пл., летучесть, вязкость, спектральные характеристики) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C 2 H 5 OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН 3 ОСН 3 , не образующий водородных связей, лишь при 24°С (молекулярная формула обоих веществ С 2 Н 6 О).
Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH 3 OH, С 2 Н 5 ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются.
Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность.
Водородные связи и их влияние на свойства вещества
Также в настоящее время есть мнение, что водородная химическая связь бывает слабой и сильной.
Они отличаются друг от друга по энергии и длине связи (расстояние между атомами):
1. Водородные связи слабые. Энергия - 10-30 кДж/моль, длина связи - 30. Все вещества, перечисленные выше, являются примерами нормальной или слабой водородной связи.
2. Водородные связи сильные. Энергия - 400 кДж/моль, длина - 23-24.
Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже - при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед).
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений (рис. 42). Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
15) Металлическая связь.
- Металлы объединяют свойства, имеющие общий характер и отличающиеся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло- и электропроводность. Эти особенности обязаны существованию в металлах особого вида связи - металлической связи.Металлическая связь - связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи. Энергия связи - энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.