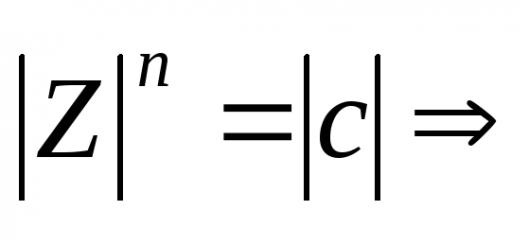Ковалентная связь - химическая связь, образованная обобществлением пары валентных электронных облаков. Обеспечивающие связь электроны называются общей электронной парой .
Св-ва ковалентной связи : направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Ионный тип связи возможен только между атомами, которые резко отличаются по свойствам. Резкое отличие в свойствах элементов приводит к тому, что атом металла полностью теряет свои валентные электроны, а атом неметалла присоединяет их. образовавшиеся положительно и отрицательно заряженный ионы в молекулах и кристаллической решетки силами электростатического притяжения. Такая связь называется ионной.
Пример образование молекулы NaCL в газовой фазе.
Неспецифические виды связи.
Металлическая связь - химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов иинтерметаллических соединений.
Механизм металлической связи: Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Другие свойства: Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Ван-дер-ваальсовы силы - силы межмолекулярного взаимодействия с энергией 0,8 - 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Внутримолекулярные химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными .
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов , в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ . Именно она определяет тип химической связи между атомами и свойства этой связи.
– это способность атома притягивать (удерживать) внешние (валентные) электроны . Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4 .
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В) , то общая электронная пара не смещается ни к одному из атомов: А: В . Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2 ), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная .
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2 ), то один из электронов практически полностью переходит к другому атому, с образованием ионов . Такая связь называется ионная .
Основные типы химических связей — ковалентная , ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – этохимическая связь, образованная за счет образования общей электронной пары А:В . При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами ) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность ,
- насыщаемость ,
- полярность ,
- поляризуемость .
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45 о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 108 о 28′.

Насыщаемость — это спосбность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется .
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.

Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ .
Пример . Рассмотрим строение молекулы водорода H 2 . Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Люьиса неплохо помогают при работе с элементами второго периода.
H . + . H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной .

Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры : H 2 (H-H), O 2 (O=O), S 8 .
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами ) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент . Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO 2 , NH 3 .
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А . + . В= А:В
2. образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В

При этом один из атомов предоставляет неподеленную электронную пару (донор ), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей .
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH 4 + , в ионах органических аминов , например, в ионе метиламмония CH 3 -NH 2 + ;
– в комплексных соединениях , химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO 3 , NaNO 3 , в некоторых других соединениях азота;

– в молекуле озона O 3 .
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении . Кратность связи достаточно легко можно определить из значения атомов, образующих молекулу.
Например , в молекуле водорода H 2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O 2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N 2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи
– это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А 2 и В 2:
Длину химической связи можно примерно оценить по радиусам атомов , образующих связь, или по кратности связи , если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например . В ряду: C–C, C=C, C≡C длина связи уменьшается.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например , в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается , т.к. увеличивается длина связи.
Ионная химическая связь

Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов .
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.

Пример . Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na + , с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na ) 2 ) 8 ) 1 — 1e = +11Na +) 2 ) 8
Пример . Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl ) 2 ) 8 ) 7 + 1e = +17Cl — ) 2 ) 8 ) 8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы , но и группы атомов . Например: ион аммония NH 4 + , сульфат-ион SO 4 2- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na + Cl — , Na 2 + SO 4 2- .
Наглядно обобщим различие между ковалентными и ионным типами связи :


Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов , образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов . Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями .
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы . Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь , т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе , создавая таким образом достаточно прочную металлическую кристаллическую решетку . При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.

Межмолекулярные взаимо-действия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляеются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами . Силы Ван-дер-Ваальса делятся на ориентационные , индукционные и дисперсионные . Энергия межмолекулярных взаимодейстий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N . Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения .
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость .
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь . Она характерна прежде всего для соединений фтора с водородом , а также кислорода с водородом , в меньшей степени азота с водородом .

Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H 2 O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H : спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например , как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H 2 O-H 2 S-H 2 Se-H 2 Te мы не наблюдаем линейное изменение температур кипения.

А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью по фазовому состоянию.
Ковалентная связь
Характеристика химической связи. Гибридизация.
ЛЕКЦИЯ №3. Химическая связь и строение молекул. Валентность.
Лишь немногие химические элементы в природных условиях находятся в одноатомном состоянии (например, инертные газы). Свободные атомы остальных элементов образуют более сложные системы – молекулы, имеющие более стабильные электронные конфигурации. Это явление носит название образование химической связи.
Химическая связь - это взаимодействие двух или нескольких атомов, в результате которого образуется химически устойчивая двух- или многоатомная система. Образование химической связи сопровождается уменьшением полной энергии системы.
В основе теории химической связи лежат представления об электронных взаимодействиях. Наиболее устойчивыми (прочными) группировками электронов являются завершенные внешние электронные слои атомов инертных газов (двухэлекронный у гелия и восьмиэлектронный у остальных благородных газов). Незавершенные внешние электронные слои всех остальных элементов являются неустойчивыми и при соединении таких атомов с другими атомами происходит перестройка их электронных оболочек. Химическая связь образуется за счет валентных электронов, но осуществляется по-разному.
Валентными называются электроны, которые участвуют в образовании химических связей, в основном это электроны последнего или предпоследнего энергетического уровня.
Существует несколько типов химической связи: ионная, металлическая, ковалентная и водородная.
Простейший пример ковалентной связи – образование молекулы водорода. Атомы водорода имеют электронную оболочку из одного непарного s-электрона, т.е. до завершения уровня не хватает одного электрона. При сближении атомов водорода до определенного расстояния происходит взаимодействие электронов с антипараллельными спинами с формированием общей электронной пары. Общая электронная пара образуется в результате частичного перекрывания s-орбиталей и при этом в области перекрывания орбиталей создается наибольшая плотность.
Связь атомов с помощью общих электронных пар называется ковалентной.
Молекула с ковалентной связью может быть записана в виде двух формул: электронной (электрон обозначается точкой) и структурной (общая электронная пара обозначается чертой).
1. Длина связи - это расстояние между ядрами атомов. Выражается в нм. Химическая связь тем прочнее, чем меньше ее длина. Однако мерой прочности связи является ее энергия.
2. Энергия связи – это то количество энергии, которое выделяется при образовании химической связи и следовательно, это та работа, которую надо затратить на разрыв связи. Выражается в кДж/моль. Энергия связи увеличивается с уменьшением длины связи.
3. Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей. Например, атом водорода, имея один неспаренный электрон, может образовывать одну связь, а атом углерода в возбужденном состоянии - не более четырех связей. Вследствие насыщаемости связей молекулы имеют определенный состав. Однако и при насыщенных ковалентных связях могут образовываться более сложные молекулы по донорно-акцепторному механизму.
4. Кратность определяется числом общих электронных пар, между атомами, т.е. количеством химических связей. В рассмотренной молекуле водорода, а также в молекулах фтора и хлора связь между атомами осуществляется за счет одной электронной пары, такая связь называется одинарной . В молекуле кислорода – двойная , а в молекуле азота – тройная.
Причем ковалентная связь может быть двух типов:
1) Если электронные облака перекрываются в направлении прямой, которая соединяет ядра атомов (т.е. по оси связи ), такая ковалентная связь называется сигма-связью . Ковалентные сигма-связи образуются при перекрывании орбиталей: s-s (молекула водорода), s-p (хлороводород) и р-р (молекула хлора).
2) Если перекрываются р-орбитали, направленные перпендикулярно оси связи, образуются две области перекрывания по обе стороны оси связи и такая связь называется пи-связью .
Несмотря на то, что энергия пи-связи меньше, чем сигма, суммарная энергия двойной, а тем более тройной связи выше одинарной.
5. Полярность связи определяется расположением общей электронной пары, если она распределяется в пространстве симметрично относительно ядер обоих атомов, то такая ковалентная связь называется неполярной . Примером, являются двухатомные молекулы, состоящие из атомов одного и того же элемента, т.е. простые вещества.
В случае же полярной ковалентной связи , молекулу образуют атомы разных элементов и электронное облако связи, в данном случае, смещено к атому с большей относительной электроотрицательностью. Например, при образовании молекулы HCl общая электронная пара смещена к атому хлора, так как он обладает большей ЭО.
ЭО – это способность атомов элементов притягивать к себе общие электронные пары. Атом, более ЭО элемента принимает эффективный отрицательный заряд d-, а второй атом – эффективный положительный заряд d+. В результате возникает диполь. Мерой полярности связи служит электрический дипольный момент .
6. Направленность ковалентной связи обуславливает пространственную структуру молекул, т.е. их геометрическую форму. Количественно направленность определяется валентным углом – это угол между химическими связями. Ковалентные связи, образуемые многовалентными атомами, всегда имеют пространственную направленность.
В большинстве случаев при образовании связи происходит обобществление электронов связываемых атомов. Такой тип химической связи называют ковалентной связью (приставка "ко-" в латинском языке означает совместность, "валенс" - имеющий силу). Связывающие электроны находятся преимущественно в пространстве между связываемыми атомами. За счет притяжения ядер атомов к этим электронам образуется химическая связь. Таким образом, ковалентная связь - это химическая связь, возникающая за счет увеличения электронной плотности в области между химически связанными атомами.
Первая теория ковалентной связи принадлежит американскому физикохимику Г.-Н. Льюису . В 1916 г. он предположил, что связи между двумя атомами осуществляется парой электронов, при этом вокруг каждого атома обычно формируется восьмиэлектронная оболочка (правило октета).
Одно из существенных свойств ковалентной связи - ее насыщаемость. При ограниченном числе внешних электронов в областях между ядрами образуется ограниченное число электронных пар вблизи каждого атома (и, следовательно, число химических связей). Именно это число тесно связано с понятием валентности атома в молекуле (валентностью называют общее число ковалентных связей, образуемых атомом). Другое важное свойство ковалентной связи - ее направленность в пространстве. Это проявляется в примерно одинаковом геометрическом строении близких по составу химических частиц. Особенностью ковалентной связи является также ее поляризуемость.
Для описания ковалентной связи используют преимущественно два метода, основанных на разных приближениях при решении уравнения Шредингера: метод молекулярных орбиталей и метод валентных связей. В настоящее время в теоретической химии используется почти исключительно метод молекулярных орбиталей. Однако метод валентных связей, несмотря на большую сложность вычислений, дает более наглядное представление об образовании и строении химических частиц.
Параметры ковалентной связи
Совокупность атомов, образующих химическую частицу, существенно отличается от совокупности свободных атомов. Образование химической связи приводит, в частности, к изменению радиусов атомов и их энергии. Происходит также перераспределение электронной плотности: повышается вероятность нахождения электронов в пространстве между связываемыми атомами.
Длина химической связи
При образовании химической связи всегда происходит сближение атомов - расстояние между ними меньше, чем сумма радиусов изолированных атомов:
r (A−B) r(A) + r (B)
Радиус атома водорода составляет 53 пм, атома фтора − 71 пм, а расстояние между ядрами атомов в молекуле HF равно 92 пм:
Межъядерное расстояние между химически связанными атомами называется длиной химической связи.
Во многих случаях длину связи между атомами в молекуле вещества можно предсказать, зная расстояния между этими атомами в других химических веществах. Длина связи между атомами углерода в алмазе равна 154 пм, между атомами галогена в молекуле хлора - 199 пм. Полусумма расстояний между атомами углерода и хлора, рассчитанная из этих данных, составляет 177 пм, что совпадает с экспериментально измеренной длиной связи в молекуле CCl 4 . В то же время это выполняется не всегда. Например, расстояние между атомами водорода и брома в двухатомных молекулах составляет 74 и 228 пм, соответственно. Среднее арифметическое этих чисел составляет 151 пм, однако реальное расстояние между атомами в молекуле бромоводорода равно 141 пм, то есть заметно меньше.
Расстояние между атомами существенно уменьшается при образовании кратных связей. Чем выше кратность связи, тем короче межатомное расстояние .
Длины некоторых простых и кратных связей
Валентные углы
Направление ковалентных связей характеризуется валентными углами - углами между линиями, соединяющими связываемые атомы. Графическая формула химической частицы не несет информации о валентных углах. Например, в сульфат-ионе SO 4 2− валентные углы между связями сера−кислород равны 109,5 o , а в тетрахлоропалладат-ионе 2− − 90 o . Совокупность длин связей и валентных углов в химической частице определяет ее пространственное строение. Для определения валентных углов используют экспериментальные методы изучения структуры химических соединений. Оценить значения валентных углов можно теоретически, исходя из электронного строения химической частицы.Энергия ковалентной связи
Химическое соединение образуется из отдельных атомов только в том случае, если это энергетически выгодно. Если силы притяжения преобладают над силами отталкивания, потенциальная энергия взаимодействующих атомов понижается, в противном случае − повышается. На некотором расстоянии (равном длине связи r 0) эта энергия минимальна.

Таким образом, при образовании химической связи энергия выделяется, при ее разрыве − поглощается. Энергия E 0 , необходимая для того, чтобы разъединить атомы и удалить их друг от друга на расстояние, на котором они не взаимодействуют, называется энергией связи . Для двухатомных молекул энергия связи определяется как энергия диссоциации молекулы на атомы. Она может быть измерена экспериментально.
В молекуле водорода энергия связи численно равна энергии, которая выделяется при образовании молекулы Н 2 из атомов Н:
Н + Н = Н 2 + 432 кДж
Эту же энергию нужно затратить, чтобы разорвать связь Н-Н:
H 2 = H + H − 432 кДж
Для многоатомных молекул эта величина является условной и отвечает энергии такого процесса, при котором данная химическая связь исчезает, а все остальные остаются без изменения. При наличии нескольких одинаковых связей (например, для молекулы воды, содержащей две связи кислород−водород) их энергию можно рассчитать, используя закон Гесса . Величины энергии распада воды на простые вещества, а также энергии диссоциации водорода и кислорода на атомы известны:
2Н 2 О = 2Н 2 + О 2 ; 484 кДж/моль
Н 2 = 2Н; 432 кДж/моль
О 2 = 2О; 494 кДж/моль
Учитывая, что в двух молекулах воды содержится 4 связи, энергия связи кислород-водород равна:
Е (О−Н) = (2 . 432 + 494 + 484) / 4 = 460,5 кДж/моль
В молекулах состава AB n последовательный отрыв атомов В сопровождается определенными (не всегда одинаковыми) затратами энергии. Например, значения энергии (кДж/моль) последовательного отщепления атомов водорода от молекулы метана существенно различаются:
| 427 | 368 | 519 | 335 | |||||
| СН 4 | → | СН 3 | → | СН 2 | → | СН | → | С |
При этом энергия связи А−В определяется как средняя величина затраченной энергии на всех стадиях:
СН 4 = С + 4Н; 1649 кДж/моль
Е (С−Н) = 1649 / 4 = 412 кДж/моль
Чем выше энергия химической связи, тем прочнее связь . Связь считается прочной, или сильной, если ее энергия превышает 500 кДж/моль (например, 942 кДж/моль для N 2), слабой - если ее энергия меньше 100 кДж/моль (например, 69 кДж/моль для NO 2). Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считают, что химическая связь не образуется, а наблюдается межмолекулярное взаимодействие (например, 2 кДж/моль для Xe 2). Прочность связи обычно уменьшается с увеличением ее длины.Одинарная связь всегда слабее, чем кратные связи - двойная и тройная - между теми же атомами.
Энергии некоторых простых и кратных связей
Полярность ковалентной связи
Полярность химической связи зависит от разности электроотрицательностей связываемых атомов.
Электроотрицательность − условная величина, характеризующая способность атома в молекуле притягивать электроны. Если в двухатомной молекуле А−В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным.
Шкала электроотрицательности была использована Л. Полингом для количественной характеристики способности атомов к поляризации ковалентных связей. Для количественного описания электроотрицательности, помимо термохимических данных, используют также данные о геометрии молекул (метод Сандерсона) или спектральные характеристики (метод Горди). Широко используют также шкалу Олреда и Рохова, в которой при расчете используют эффективный заряд ядра и атомный ковалентный радиус. Наиболее ясный физический смысл имеет метод, предложенный американским физикохимиком Р. Малликеном (1896-1986). Он определил электроотрицательность атома как полусумму его сродства к электрону и потенциала ионизации. Значения электроотрицательности, базирующиеся на методе Малликена и распространенные на широкий круг разнообразных объектов, называют абсолютными.
Самое высокое значение электроотрицательности имеет фтор. Наименее электроотрицательный элемент - цезий. Чем выше значение разности электроотрицательностей двух атомов, тем более полярной является химическая связь между ними.
В зависимости от того, как происходит перераспределение электронной плотности при образовании химической связи, различают несколько ее типов. Предельный случай поляризации химической связи - полный переход электрона от одного атома к другому. При этом образуются два иона, между которыми возникает ионная связь. Для того чтобы два атома смогли создать ионную связь, необходимо, чтобы их электроотрицательности очень сильно различались. Если электроотрицательности атомов равны (при образовании молекул из одинаковых атомов), связь называют неполярной ковалентной . Чаще всего встречается полярная ковалентная связь - она образуется между любыми атомами, имеющими разные значения электроотрицательности.
Количественной оценкой полярности ("ионности") связи могут служить эффективные заряды атомов. Эффективный заряд атома характеризует разность между числом электронов, принадлежащих данному атому в химическом соединении, и числом электронов свободного атома. Атом более электроотрицательного элемента притягивает электроны сильнее. Поэтому электроны оказываются ближе к нему, и он получает некоторый отрицательный заряд, который называют и эффективным, а у его партнера появляется такой же положительный заряд. Если электроны, образующие связь между атомами, принадлежат им в равной степени, эффективные заряды равны нулю. В ионных соединениях эффективные заряды должны совпадать с зарядами ионов. А для всех других частиц они имеют промежуточные значения.
Лучший метод оценки зарядов атомов в молекуле - решение волнового уравнения. Однако это возможно лишь при наличии малого числа атомов. Качественно распределение заряда можно оценить по шкале электроотрицательности. Используют также различные экспериментальные методы. Для двухатомных молекул охарактеризовать полярность связи и определить эффективные заряды атомов можно на основе измерения дипольного момента:
μ = q r ,
где q − заряд полюса диполя, равный для двухатомной молекулы эффективному заряду, r − межъядерное расстояние.
Дипольный момент связи является векторной величиной. Он направлен от положительно заряженной части молекулы к ее отрицательной части. На основании измерения дипольного момента было установлено, что в молекуле хлороводорода HCl на атоме водорода имеется положительный заряд +0,2 доли заряда электрона, а на атоме хлора отрицательный заряд −0,2. Значит, связь H−Cl на 20% имеет ионный характер. А связь Na−Cl является ионной на 90%.
Почему атомы могут соединяться друг с другом и образовывать молекулы? Какова причина возможного существования веществ, в состав которых входят атомы совершенно разных химических элементов? Это глобальные вопросы, затрагивающие основополагающие понятия современной физической и химической науки. Ответить на них можно, имея представление об электронном строении атомов и зная характеристики ковалентной связи, являющейся базовой основой для большинства классов соединений. Цель нашей статьи - ознакомиться с механизмами образования различных типов химической связи и соединений, содержащих их в своих молекулах.
Электронное строение атома
Электронейтральные частицы материи, являющиеся ее структурными элементами, имеют строение, зеркально отражающее устройство Солнечной системы. Как планеты вращаются вокруг центральной звезды - Солнца, так и электроны в атоме движутся вокруг положительно заряженного ядра. Для характеристики ковалентной связи значимыми будут электроны, располагающиеся на последнем энергетическом уровне и наиболее удаленные от ядра. Так как их связь с центром собственного атома минимальна, они способны легко притягиваться ядрами других атомов. Это очень важно для возникновения межатомных взаимодействий, приводящих к образованию молекул. Почему же именно молекулярная форма является основным видом существования материи на нашей планете? Давайте разберемся.

Основное свойство атомов
Способность электронейтральных частиц к взаимодействию, приводящая к выигрышу в энергии, - их важнейшая особенность. Ведь в обычных условиях молекулярное состояние вещества более стойкое, чем атомное. Основные положения современного атомно-молекулярного учения объясняют как принципы образования молекул, так и характеристики ковалентной связи. Напомним, что на атома может находиться от 1 до 8 электронов, в последнем случае слой будет завершенным, а значит, очень устойчивым. Такую структуру внешнего уровня имеют атомы благородных газов: аргона, криптона, ксенона - инертных элементов, завершающих каждый период в системе Д. И. Менделеева. Исключением здесь будет гелий, у которого на последнем уровне находится не 8, а только 2 электрона. Причина проста: в первом периоде - всего два элемента, атомы которых имеют единственный электронный слой. У всех остальных химических элементов на последнем, незавершенном слое располагается от 1 до 7 электронов. В процессе взаимодействия между собой атомы будут стремиться заполниться электронами до октета и восстановить конфигурацию атома инертного элемента. Такое состояние может быть достигнуто двумя путями: потерей собственных или принятием чужих отрицательно заряженных частиц. Эти формы взаимодействия объясняют, как определить, какая связь - ионная или ковалентная - возникнет между вступающими в реакцию атомами.

Механизмы образования стойкой электронной конфигурации
Представим, что в реакцию соединения вступают два простых вещества: металлический натрий и газообразный хлор. Образуется вещество класса солей - хлорид натрия. Оно имеет ионный тип химической связи. Почему и как она возникла? Снова обратимся к строению атомов исходных веществ. У натрия на последнем слое находится всего один электрон, слабо связанный с ядром вследствие большого радиуса атома. Энергия ионизации у всех щелочных металлов, к которым относится и натрий, мала. Поэтому электрон внешнего уровня покидает энергетический уровень, притягивается ядром атома хлора и остается в его пространстве. Это создает прецедент перехода атома Cl в форму отрицательно заряженного иона. Теперь мы имеем дело уже не с электронейтральными частицами, а с заряженными катионами натрия и анионами хлора. В соответствии с законами физики между ними возникают силы электростатического притяжения, и соединение образует ионную кристаллическую решетку. Рассмотренный нами механизм формирования ионного типа химической связи поможет более четко выяснить специфику и основные характеристики ковалентной связи.
Общие электронные пары
Если ионная связь возникает между атомами элементов, сильно отличающихся электроотрицательностью, т. е. металлами и неметаллами, то ковалентный тип появляется при взаимодействии атомов как одного и того же, так и разных неметаллических элементов. В первом случае принято говорить о неполярном, а в другом - о полярном виде ковалентной связи. Механизм их образования общий: каждый из атомов частично отдает в общее пользование электроны, которые объединяются попарно. А вот пространственное расположение электронных пар относительно ядер атомов будет неодинаковым. По этому признаку и различают типы ковалентной связи - неполярную и полярную. Наиболее часто в химических соединениях, состоящих из атомов неметаллических элементов, встречаются пары, состоящие из электронов с противоположными спинами, т. е. вращающихся вокруг своих ядер в противоположные стороны. Так как движение отрицательно заряженных частиц в пространстве ведет к образованию электронных облаков, что в конечном счете заканчивается взаимным их перекрыванием. Каковы последствия этого процесса для атомов и к чему он приводит?
Физические свойства ковалентной связи
Оказывается, что между центрами двух взаимодействующих атомов возникает двухэлектронное облако, имеющее большую плотность. Усиливаются электростатические силы притяжения между самим отрицательно заряженным облаком и ядрами атомов. Высвобождается порция энергии и уменьшаются расстояния между атомными центрами. Например, в начале образования молекулы H 2 расстояние между ядрами водородных атомов составляет 1,06 А, после перекрывания облаков и образования общей электронной пары - 0,74 А. Примеры ковалентной связи, формирующейся по вышеописанному механизму, можно встретить как среди простых, так и среди сложных неорганических веществ. Ее главная отличительная черта - наличие общих электронных пар. В итоге после возникновения ковалентной связи между атомами, например, водорода каждый из них приобретает электронную конфигурацию инертного гелия, и образовавшаяся молекула имеет устойчивую структуру.

Пространственная форма молекулы
Еще одно очень важное физическое свойство ковалентной связи - это направленность. Он нее зависит пространственная конфигурация молекулы вещества. Например, при перекрывании двух электронов со сферической формой облака вид молекулы линейный (хлороводород или бромоводород). Форма молекул воды, у которой гибридизируются s- и p- облака - угловая, а очень прочные частицы газообразного азота имеют вид пирамиды.
Строение простых веществ - неметаллов
Выяснив, какую связь называют ковалентной, какие признаки она имеет, теперь самое время разобраться с ее разновидностями. Если во взаимодействие между собой вступают атомы одного и того же неметалла - хлора, азота, кислорода, брома и т. д., то формируются соответствующие простые вещества. Их общие электронные пары располагаются на одинаковом расстоянии от центров атомов, не смещаясь. Для соединений с неполярным видом ковалентной связи присущи такие признаки: низкие температуры кипения и плавления, нерастворимость в воде, диэлектрические свойства. Далее мы выясним, для каких веществ характерна ковалентная связь, при которой происходит смещение общих электронных пар.

Электроотрицательность и ее влияние на тип химической связи
Свойство определенного элемента притягивать к себе электроны от атома другого элемента в химии называют электроотрицательностью. Шкалу величин данного параметра, предложенную Л. Полингом, можно встретить во всех учебниках по неорганической и общей химии. Наибольшее его значение - 4,1 эВ - имеет фтор, меньшее - другие активные неметаллы, а наименьший показатель характерен для щелочных металлов. Если между собой реагируют элементы, отличающиеся своей электроотрицательностью, то неизбежно один, более активный, будет притягивать к своему ядру отрицательно заряженные частицы атома более пассивного элемента. Таким образом, физические свойства ковалентной связи напрямую зависят от способности элементов отдавать электроны в общее пользование. Образующиеся при этом общие пары уже не располагаются симметрично относительно ядер, а смещаются в сторону более активного элемента.
Особенности соединений с полярной связью
К веществам, в молекулах которых совместные электронные пары несимметричны относительно ядер атомов, можно отнести галогеноводороды, кислоты, соединения халькогенов с водородом и кислотные оксиды. Это сульфатная и нитратная кислоты, оксиды серы и фосфора, сероводород, и т. д. Например, молекула хлороводорода содержит одну общую электронную пару, образованную неспаренными электронами водорода и хлора. Она смещена ближе к центру атома Cl, являющегося более электроотрицательным элементом. Все вещества с полярной связью в водных растворах диссоциируют на ионы и проводят электрический ток. Соединения, имеющие которых мы привели, имеют также более высокие температуры плавления и кипения по сравнению с простыми веществами-неметаллами.
Способы разрыва химических связей
В органической химии предельных углеводородов с галогенами идут по радикальному механизму. Смесь метана и хлора на свету и при обычной температуре реагирует таким образом, что молекулы хлора начинают расщепляться на частицы, несущие неспаренные электроны. Иначе говоря, наблюдается разрушение общей электронной пары и образование очень активных радикалов -Cl. Они способны так воздействовать на молекулы метана, что у тех происходит разрыв ковалентной связи между атомами углерода и водорода. Образуется активная частица -H, а свободная валентность атома углерода принимает радикал хлора, и первым продуктом реакции становится хлорметан. Такой механизм расщепления молекул называется гомолитическим. Если же общая пара электронов полностью переходит во владение к одному из атомов, то говорят о гетеролитическом механизме, характерном для реакций, проходящих в водных растворах. В этом случае полярные молекулы воды будут усиливать скорость разрушения химических связей растворяемого соединения.

Двойные и тройные связи
Подавляющее большинство органических веществ и некоторые неорганические соединения содержат в своих молекулах не одну, а несколько общих электронных пар. Кратность ковалентной связи уменьшает расстояние между атомами и увеличивает стабильность соединений. О них принято говорить как о химически стойких. Например, в молекуле азота имеется три пары электронов, они обозначаются в структурной формуле тремя черточками и обусловливают ее прочность. Простое вещество азот химически инертен и может реагировать с другими соединениями, например с водородом, кислородом или металлами только при нагревании или повышенном давлении, а также в присутствии катализаторов.

Двойные и тройные связи присущи таким классам органических соединений, как непредельные диеновые углеводороды, а также вещества ряда этилена или ацетилена. Кратные связи обусловливают основные химические свойства: реакции присоединения и полимеризации, идущие в местах их разрыва.
В нашей статье мы дали общую характеристику ковалентной связи и рассмотрели ее основные виды.