التوازن الكيميائي هو مثل هذه الحالة القابلة للعكس تفاعل كيميائي
أأ+ بب= جج+ دد،
حيث لا يتغير تركيز المواد المتفاعلة في خليط التفاعل مع مرور الوقت. تتميز حالة التوازن الكيميائي ثابت التوازن الكيميائي :
أين ج ط- تركيز المكونات في حالة توازنالخليط المثالي.
يمكن أيضًا التعبير عن ثابت التوازن بدلالة الكسور المولية للتوازن العاشر طعناصر:
بالنسبة للتفاعلات التي تحدث في الطور الغازي، من المناسب التعبير عن ثابت التوازن بدلالة ضغوط التوازن الجزئية بايعناصر:
ل الغازات المثالية باي = ج ط ر.تو باي = اكس اي بي، أين صهو الضغط الكلي، وبالتالي ك.ب, ك جو ك اكسترتبط بالعلاقة التالية:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
ويرتبط ثابت التوازن ص جس التفاعل الكيميائي:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
يتغير ص جأو الترددات اللاسلكيةفي تفاعل كيميائي عند ضغوط جزئية معينة (ليست بالضرورة متوازنة). بايأو التركيزات ج طيمكن حساب المكونات باستخدام المعادلة تساوي حرارة التفاعل الكيميائي (متساوي الحرارة فان هوف):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
وفق مبدأ لو شاتيليهإذا تم تأثير تأثير خارجي على نظام في حالة توازن، فإن التوازن سوف ينحرف بحيث يقلل من تأثير التأثير الخارجي. وبالتالي، فإن زيادة الضغط تؤدي إلى تحول التوازن نحو انخفاض في عدد جزيئات الغاز. إن إضافة أي مكون من مكونات التفاعل إلى خليط التوازن يؤدي إلى إزاحة التوازن نحو انخفاض كمية هذا المكون. تؤدي الزيادة (أو النقصان) في درجة الحرارة إلى تحويل التوازن نحو التفاعل الذي يحدث مع امتصاص (إطلاق) الحرارة.
يتم وصف الاعتماد الكمي لثابت التوازن على درجة الحرارة بالمعادلة إيزوبار التفاعل الكيميائي (فانت هوف الأيزوبار)
![]() (9.9)
(9.9)
و ايزوشورات التفاعل الكيميائي (فان هوف isochores)
![]() . (9.10)
. (9.10)
تكامل المعادلة (9.9) على افتراض أن ص حالتفاعل لا يعتمد على درجة الحرارة (وهذا صحيح في نطاقات درجات الحرارة الضيقة)، ويعطي:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
أين ج –ثابت التكامل وهكذا فإن الاعتماد على ln كف من 1 /تيجب أن يكون خطيًا، وميل الخط المستقيم هو - ص ح/ر.
التكامل داخل ك 1 , ك 2 و ت 1, ت 2 يعطي:
 (9.13)
(9.13)
 (9.14)
(9.14)
باستخدام هذه المعادلة، بمعرفة ثوابت التوازن عند درجتي حرارة مختلفتين، يمكننا الحساب ص حتفاعلات. وبناء على ذلك، معرفة ص حالتفاعل وثابت التوازن عند درجة حرارة معينة، يمكنك حساب ثابت التوازن عند درجة حرارة أخرى.
أمثلة
CO(ز) + 2H2 (ز) = CH3OH(ز)
عند 500 ك. و ز سبالنسبة لـ CO(g) وCH 3 OH(g) عند 500 K تساوي –155.41 كيلوجول. مول –1 و –134.20 كيلوجول. مول -1 على التوالي.
حل. يذهبتفاعلات:
ص ز س= و ز س(CH3أوه) – و ز س(CO) = -134.20 - (-155.41) = 21.21 كيلوجول. مول -1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
مثال 9-2. ثابت توازن التفاعل
يساوي ك P = 1.64 10 –4 عند 400 درجة مئوية. ما الضغط الإجمالي الذي يجب تطبيقه على خليط متساوي الأقطاب من N 2 وH 2 بحيث يتحول 10% من N 2 إلى NH 3؟ تعتبر الغازات مثالية.
حل. دع مولًا من N 2 يتفاعل. ثم
| ن 2 (ز) | + | 3 ح 2 (ز) | = | 2NH 3 (ز) | |
| الكمية الأصلية | 1 | 1 | |||
| كمية التوازن | 1– | 1–3 | 2 (المجموع: 2-2) | ||
| الكسر المولي المتوازن: |
لذلك، كس =  و ك ف = ك س . ص –2
=
و ك ف = ك س . ص –2
=  .
.
بالتعويض بـ = 0.1 في الصيغة الناتجة، نحصل على ذلك
1.64 10 –4 = ، أين ص= 51.2 أجهزة الصراف الآلي.
، أين ص= 51.2 أجهزة الصراف الآلي.
مثال 9-3. ثابت توازن التفاعل
CO(ز) + 2H2 (ز) = CH3OH(ز)
عند 500 كلفن يساوي كف = 6.09 10 –3 . تم تسخين خليط التفاعل المتكون من 1 mol CO و 2 mol H 2 و 1 mol من الغاز الخامل (N 2) إلى درجة حرارة 500 K وضغط إجمالي قدره 100 atm. احسب تكوين خليط التوازن.
حل. دع مولًا من ثاني أكسيد الكربون يتفاعل. ثم
| ثاني أكسيد الكربون (ز) | + | 2H 2 (ز) | = | CH3OH(ز) | |
| الكمية الأصلية: | 1 | 2 | 0 | ||
| كمية التوازن: | 1– | 2–2 | |||
| المجموع في خليط التوازن: | 3-2 مول من المكونات + 1 مول ن 2 = 4-2 مول | ||||
| الكسر المولي المتوازن | |||||
لذلك، كس =  و ك ف = ك س . ف-2 =
و ك ف = ك س . ف-2 = ![]() .
.
وبالتالي 6.09 10 –3 = ![]() .
.
وبحل هذه المعادلة نحصل على = 0.732. وعليه فإن الكسور المولية للمواد الموجودة في خليط التوازن تساوي: = 0.288، = 0.106، = 0.212، = 0.394.
مثال 9-4. لرد الفعل
N 2 (جم) + 3H2 (جم) = 2NH3 (جم)
عند 298 ك كف = 6.0 10 5 , أ و ح س(NH 3) = -46.1 كيلوجول. مول -1 . قدر قيمة ثابت التوازن عند 500 K.
حل. المحتوى الحراري المولي القياسي للتفاعل هو
ص ح س= 2و ح س(NH 3) = -92.2 كيلوجول. مول -1 .
ووفقا للمعادلة (9.14)، 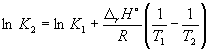 =
=
لين (6.0 10 5) + ![]() = -1.73، من أين ك 2 =
0.18.
= -1.73، من أين ك 2 =
0.18.
لاحظ أن ثابت التوازن للتفاعل الطارد للحرارة يتناقص مع زيادة درجة الحرارة، وهو ما يتوافق مع مبدأ لو شاتيليه.
مهام
- عند درجة حرارة 1273 كلفن وضغط إجمالي 30 atm في خليط متوازن
- عند درجة حرارة 2000 درجة مئوية وضغط إجمالي قدره 1 ATM، يتفكك 2% من الماء إلى هيدروجين وأكسجين. احسب ثابت التوازن للتفاعل
- ثابت توازن التفاعل
- ثابت توازن التفاعل
- تم تسخين وعاء سعة 3 لتر يحتوي على 1.79 10 –2 مول I 2 إلى درجة حرارة 973 K. وتبين أن الضغط في الوعاء عند التوازن يساوي 0.49 atm. بافتراض أن الغازات مثالية، احسب ثابت التوازن عند 973 K للتفاعل
- لرد الفعل
- لرد الفعل
- تم تسخين وعاء سعة 1 لتر يحتوي على 0.341 مول PCl 5 و0.233 مول N 2 إلى 250 درجة مئوية. وتبين أن الضغط الإجمالي في الوعاء عند التوازن يبلغ 29.33 atm. بافتراض أن جميع الغازات مثالية، احسب ثابت التوازن عند 250 درجة مئوية للتفاعل الذي يحدث في الوعاء
- ثابت توازن التفاعل
- عند 25 درجة مئوية و ز س(NH 3) = -16.5 كيلوجول. مول -1 . احسب ص جتفاعلات تكوين NH 3 عند ضغوط جزئية من N 2 و H 2 و NH 3 تساوي 3 atm و 1 atm و 4 atm على التوالي. في أي اتجاه سيسير التفاعل تلقائيًا في ظل هذه الظروف؟
- تفاعل طارد للحرارة
- ثابت التوازن لتفاعل الطور الغازي لإيزوبورنيول (C 10 H 17 OH) إلى إيزوبورنيول هو 0.106 عند 503 كلفن. تم وضع خليط من 7.5 جم من البورنيول و14.0 جم من الإيزوبورنيول في وعاء سعة 5 لتر وحفظه عند 503 كلفن حتى يتم تحقيق التوازن. احسب الكسور المولية وكتل البورنيول والأيزوبورنيول في خليط التوازن.
- التوازن في رد الفعل
- احسب الضغط الإجمالي الذي يجب تطبيقه على خليط مكون من 3 أجزاء H 2 وجزء واحد N 2 للحصول على خليط متوازن يحتوي على 10% NH 3 من حيث الحجم عند 400 درجة مئوية. ثابت التوازن للتفاعل
- عند درجة حرارة 250 درجة مئوية وضغط إجمالي قدره 1 atm، يتم فصل PCl 5 بنسبة 80% بواسطة التفاعل
- عند 2000 درجة مئوية للتفاعل
- احسب المحتوى الحراري القياسي للتفاعل الذي يكون فيه ثابت التوازن
أ) يزيد بمقدار مرتين، ب) يتناقص بمقدار مرتين عندما تتغير درجة الحرارة من 298 كلفن إلى 308 كلفن. - يتم وصف اعتماد ثابت التوازن للتفاعل 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) على درجة حرارة تتراوح بين 300 K و 600 K بالمعادلة
CO 2 (جم) + C(tv) = 2CO(g)
يحتوي على 17% (من حيث الحجم) CO 2 . ما النسبة المئوية لثاني أكسيد الكربون التي سيحتويها الغاز عند ضغط إجمالي قدره 20 atm؟ عند أي ضغط سيحتوي الغاز على 25% CO 2؟
H 2 O (g) = H 2 (g) + 1/2O 2 (g) في ظل هذه الظروف.
CO(ز) + H2O(g) = CO 2 (جم) + H2 (جم)
عند 500 درجة مئوية متساوية ك ص= 5.5. تم تسخين خليط يتكون من 1 mol CO و 5 mol H 2 O إلى درجة الحرارة هذه. احسب الكسر المولي لـ H2O في خليط التوازن.
ن 2 أو 4 (جم) = 2NO 2 (جم)
عند 25 درجة مئوية متساوية ك ص= 0.143. احسب الضغط الذي سيتم إنشاؤه في وعاء بحجم 1 لتر، حيث تم وضع 1 جم من N 2 O 4 عند درجة الحرارة هذه.
أنا 2 (ز) = 2أنا (ز).
عند 250 درجة مئوية ص جس = –2508 جول مول –1. عند أي ضغط إجمالي ستكون درجة تحويل PCl 5 إلى PCl 3 وCl 2 عند 250 درجة مئوية 30%؟
2HI(ز) = ح 2 (ز) + أنا 2 (ز)
توازن ثابت ك P = 1.83 10 –2 عند 698.6 K. ما عدد جرامات HI التي تتكون عند تسخين 10 g من I 2 و0.2 g من H 2 إلى درجة الحرارة هذه في وعاء سعة ثلاثة لترات؟ ما هي الضغوط الجزئية لـ H 2 وI 2 وHI؟
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(ز) + 2H2 (ز) = CH3OH(ز)
عند 500 كلفن يساوي كف = 6.09 10 –3 . احسب الضغط الإجمالي المطلوب لإنتاج الميثانول بإنتاجية 90% إذا تم أخذ CO وH2 بنسبة 1:2.
CO(ز) + 2H2 (ز) = CH3OH(ز)
في حالة توازن عند 500 كلفن و10 بار. إذا كانت الغازات مثالية، فكيف ستؤثر العوامل التالية على إنتاج الميثانول: أ) الزيادة ت; ب) الترويج ص; ج) إضافة غاز خامل في الخامس= ثابت؛ د) إضافة غاز خامل في ص= ثابت؛ ه) إضافة H 2 في ص= ثابت؟
2NOCl(g) = 2NO(g) + Cl2(g)
تم ضبطه عند 227 درجة مئوية وضغط إجمالي قدره 1.0 بار عندما يكون الضغط الجزئي لـ NOCl 0.64 بار (في البداية كان NOCl فقط موجودًا). احسب ص ز سلرد الفعل. عند أي ضغط إجمالي سيكون الضغط الجزئي لـ Cl 2 مساويًا لـ 0.10 بار؟
N 2 (جم) + 3H2 (جم) = 2NH3 (جم)
عند 400 درجة مئوية يساوي ك = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
ما هي درجة تفكك PCl 5 إذا أضيف N 2 إلى النظام بحيث يكون الضغط الجزئي للنيتروجين 0.9 atm؟ يتم الحفاظ على الضغط الكلي عند 1 ATM.
N 2 (ز) + O 2 (ز) = 2NO (ز)
ك ع = 2.5 10 –3 . خليط متوازن من N 2، O 2، NO وغاز خامل عند ضغط إجمالي قدره 1 بار يحتوي على 80٪ (من حيث الحجم) N 2 و 16٪ O 2. ما هي النسبة المئوية من حيث الحجم لا؟ ما هو الضغط الجزئي للغاز الخامل؟
ln ك = –1.04 –1088 /ت +1.51 10 5 /ت 2 .
في عام 1885، طور الفيزيائي والكيميائي الفرنسي لو شاتيليه، وفي عام 1887 أثبت الفيزيائي الألماني براون قانون التوازن الكيميائي وثابت التوازن الكيميائي، كما درس اعتمادهما على تأثير العوامل الخارجية المختلفة.
جوهر التوازن الكيميائي
التوازن هو حالة تعني أن الأشياء تتحرك دائمًا. يتم تقسيم المنتجات إلى مواد متفاعلة، ويتم دمج المواد المتفاعلة في المنتجات. الأشياء تتحرك، لكن التركيزات تبقى كما هي. تتم كتابة التفاعل بسهم مزدوج بدلاً من علامة المساواة لتوضيح أنه قابل للانعكاس.

الأنماط الكلاسيكية
في القرن الماضي، اكتشف الكيميائيون أنماطًا معينة توفر إمكانية تغيير اتجاه التفاعل في نفس الحاوية. إن معرفة كيفية حدوث التفاعلات الكيميائية أمر مهم للغاية بالنسبة لكل من البحوث المختبرية، والإنتاج الصناعي. حيث أهمية عظيمةلديه القدرة على السيطرة على كل هذه الظواهر. من الطبيعة البشرية التدخل في العديد من العمليات الطبيعية، وخاصة تلك القابلة للعكس، من أجل استخدامها لاحقًا لمصلحته الخاصة. ستكون معرفة التفاعلات الكيميائية أكثر فائدة إذا أتقنت التحكم فيها بشكل مثالي.
يستخدم الكيميائيون قانون فعل الكتلة في الكيمياء لحساب معدلات التفاعلات بشكل صحيح. ويوضح أنه لن يكتمل أي شيء إذا حدث في نظام مغلق. وتكون جزيئات المواد الناتجة في حركة مستمرة وعشوائية، وقد يحدث قريبا رد فعل عكسي يتم فيه استعادة جزيئات المادة الأولية.
غالبا ما تستخدم في الصناعة الأنظمة المفتوحة. تظل الأوعية والأجهزة والحاويات الأخرى التي تجري فيها التفاعلات الكيميائية مفتوحة. يعد ذلك ضروريًا حتى يكون من الممكن خلال هذه العمليات استخراج المنتج المطلوب والتخلص من منتجات التفاعل عديمة الفائدة. على سبيل المثال، يتم حرق الفحم في أفران مفتوحة، ويتم إنتاج الأسمنت في أفران مفتوحة، وتعمل الأفران العالية بإمداد ثابت من الهواء، ويتم تصنيع الأمونيا عن طريق إزالة الأمونيا نفسها بشكل مستمر.

التفاعلات الكيميائية العكوسة وغير العكوسة
بناءً على الاسم، يمكننا إعطاء التعريفات المناسبة: تعتبر التفاعلات لا رجعة فيها إذا اكتملت، ولا تغير اتجاهها وتستمر في مسار معين، بغض النظر عن انخفاض الضغط وتقلبات درجات الحرارة. هُم سمة مميزةهو أن بعض المنتجات قد تترك منطقة التفاعل. وبالتالي، على سبيل المثال، من الممكن الحصول على غاز (CaCO 3 = CaO + CO 2)، أو راسب (Cu(NO 3) 2 + H 2 S = CuS + 2HNO 3) أو غيرها. كما سيتم اعتباره غير قابل للانعكاس إذا تم إصداره أثناء العملية عدد كبير منالطاقة الحرارية، مثلاً: 4P + 5O 2 = 2P 2 O 5 + Q.
تقريبًا جميع التفاعلات التي تحدث في الطبيعة قابلة للعكس. بغض النظر عن الظروف الخارجية مثل الضغط ودرجة الحرارة، يمكن أن تحدث جميع العمليات تقريبًا في وقت واحد وفي اتجاهات مختلفة. وكما ينص قانون عمل الكتلة في الكيمياء، فإن كمية الحرارة الممتصة ستكون مساوية للكمية المنطلقة، مما يعني أنه إذا كان أحد التفاعلات طاردًا للحرارة، فإن التفاعل الثاني (العكسي) سيكون ماصًا للحرارة.
التوازن الكيميائي: ثابت التوازن الكيميائي
ردود الفعل هي "أفعال" الكيمياء، وهي الأنشطة التي يدرسها الكيميائيون. تتقدم العديد من التفاعلات حتى الاكتمال ثم تتوقف، مما يعني أن المواد المتفاعلة تتحول بالكامل إلى منتجات دون أن تتمكن من العودة إلى حالتها الأصلية. في بعض الحالات يكون التفاعل غير عكوس حقًا، على سبيل المثال عندما يتغير الاحتراق فيزيائيًا وكيميائيًا، ومع ذلك، هناك العديد من الظروف الأخرى التي لا يكون فيها التفاعل ممكنًا فحسب، بل مستمرًا أيضًا، نظرًا لأن منتجات التفاعل الأول تصبح متفاعلات في التفاعل الثاني .
تسمى الحالة الديناميكية التي يظل فيها تركيز المواد المتفاعلة والمنتجات ثابتة بالتوازن. من الممكن التنبؤ بسلوك المواد باستخدام قوانين معينة تنطبق على الصناعات التي تسعى إلى تقليل تكلفة إنتاج مواد كيميائية معينة. يعد مفهوم التوازن الكيميائي مفيدًا أيضًا في فهم العمليات التي تحافظ على صحة الإنسان أو تهددها. ثابت التوازن الكيميائي هو قيمة عامل التفاعل الذي يعتمد على القوة الأيونية ودرجة الحرارة، وهو مستقل عن تركيزات المواد المتفاعلة والمنتجات في المحلول.

حساب ثابت التوازن
وهذه الكمية لا أبعاد لها، أي أنها لا تحتوي على عدد معين من الوحدات. على الرغم من أن الحساب يُكتب عادةً لمادتين متفاعلتين ومنتجين، إلا أنه يصلح لأي عدد من المشاركين في التفاعل. يعتمد حساب وتفسير ثابت التوازن على ما إذا كان التفاعل الكيميائي يتضمن توازنًا متجانسًا أو غير متجانس. وهذا يعني أن جميع المكونات المتفاعلة يمكن أن تكون سوائل أو غازات نقية. بالنسبة للتفاعلات التي تصل إلى التوازن غير المتجانس، كقاعدة عامة، لا توجد مرحلة واحدة، بل مرحلتان على الأقل. على سبيل المثال، السوائل والغازات أو كلا السائلين.

قيمة التوازن الثابتة
بالنسبة لأي درجة حرارة معينة، هناك قيمة واحدة فقط لثابت التوازن، والذي يتغير فقط إذا تغيرت درجة الحرارة التي يحدث عندها التفاعل في اتجاه أو آخر. من الممكن وضع بعض التنبؤات حول التفاعل الكيميائي بناءً على ما إذا كان ثابت التوازن كبيرًا أم صغيرًا. إذا كانت القيمة كبيرة جدًا، فإن التوازن يفضل التفاعل إلى اليمين ويتم الحصول على منتجات أكثر من المواد المتفاعلة. يمكن تسمية رد الفعل في هذه الحالة بأنه "كامل" أو "كمي".
إذا كانت قيمة ثابت التوازن صغيرة، فإنها تفضل التفاعل إلى اليسار، حيث يكون عدد المواد المتفاعلة أكبر من النواتج المتكونة. فإذا كانت هذه القيمة تميل إلى الصفر، يمكننا أن نفترض عدم حدوث التفاعل. إذا كانت قيم ثابت التوازن للتفاعلات الأمامية والخلفية هي نفسها تقريبا، فإن كمية المواد المتفاعلة والمنتجات ستكون هي نفسها تقريبا. يعتبر هذا النوع من التفاعل قابلاً للعكس.

دعونا نفكر في رد فعل عكسي محدد
دعونا نأخذ اثنين من هؤلاء عنصر كيميائيمثل اليود والهيدروجين، اللذين عند خلطهما يعطيان مادة جديدة - يوديد الهيدروجين.
لنفترض أن v 1 هو معدل التفاعل الأمامي، وv 2 هو معدل التفاعل العكسي، وk هو ثابت التوازن. وباستخدام قانون الفعل الجماعي نحصل على العبارة التالية:
ت 1 = ك 1 * ج(ح 2) * ج(أنا 2)،
ت 2 = ك 2 * ج 2 (هاي).
عندما يتم خلط جزيئات اليود (I2) والهيدروجين (H2)، يبدأ التفاعل بينهما. في المرحلة الأولية، يكون تركيز هذه العناصر هو الحد الأقصى، ولكن بحلول نهاية التفاعل، سيكون تركيز المركب الجديد - يوديد الهيدروجين (HI) - هو الحد الأقصى. وفقا لذلك، فإن معدلات التفاعل ستكون مختلفة. في البداية سيكونون الحد الأقصى. ومع مرور الوقت، تأتي لحظة تتساوى فيها هذه القيم، وهذه حالة تسمى التوازن الكيميائي.
يُشار عادةً إلى التعبير عن ثابت التوازن الكيميائي باستخدام الأقواس المربعة: , , . بما أن السرعتين متساويتين في حالة التوازن فإن:
ك 1 = ك 2 2 ,
وهذا يعطينا معادلة ثابت التوازن الكيميائي:
ك 1 / ك 2 = 2 / = ك.

مبدأ لو شاتيلير-براون
هناك النمط التالي: إذا حدث تأثير معين على نظام في حالة توازن (تغيير ظروف التوازن الكيميائي عن طريق تغيير درجة الحرارة أو الضغط، على سبيل المثال)، فإن التوازن سوف يتحول إلى مواجهة تأثير التغيير جزئيا. بالإضافة إلى الكيمياء، ينطبق هذا المبدأ أيضا على العديد أشكال مختلفةفي مجالات الصيدلة والاقتصاد.

ثابت التوازن الكيميائي وطرق التعبير عنه
يمكن التعبير عن تعبير التوازن من حيث تركيزات المنتجات والمواد المتفاعلة. فقط المواد الكيميائيةفي المرحلتين المائية والغازية يتم تضمينها في صيغة التوازن، حيث أن تركيزات السوائل والمواد الصلبة لا تتغير. ما هي العوامل التي تؤثر على التوازن الكيميائي؟ إذا كان ينطوي على سائل نقي أو صلب، يعتبر أن لديه K = 1، وبالتالي يتوقف عن أخذه في الاعتبار، باستثناء المحاليل شديدة التركيز. على سبيل المثال، الماء النقي له نشاط 1.
مثال آخر هو الكربون الصلب، والذي يمكن أن يتشكل عن طريق تفاعل جزيئين من أول أكسيد الكربون لتكوينه ثاني أكسيد الكربونوالكربون. تشمل العوامل التي يمكن أن تؤثر على التوازن إضافة مادة متفاعلة أو منتج (يؤثر التغير في التركيز على التوازن). إضافة كاشف يمكن أن يؤدي إلى التوازن على اليمين معادلة كيميائيةحيث تظهر المزيد من أشكال المنتج. يمكن أن تؤدي إضافة المنتج إلى التوازن على اليسار مع توفر المزيد من أشكال المواد المتفاعلة.

يحدث التوازن عندما يكون التفاعل الذي يجري في كلا الاتجاهين يحتوي على نسبة ثابتة من المنتجات والمواد المتفاعلة. بشكل عام، التوازن الكيميائي ثابت، لأن النسبة الكمية للمنتجات والمواد المتفاعلة ثابتة. ومع ذلك، فإن نظرة فاحصة تكشف أن التوازن هو في الواقع عملية ديناميكية للغاية، حيث يتحرك رد الفعل في كلا الاتجاهين بوتيرة متساوية.
التوازن الديناميكي هو مثال على وظيفة الحالة المستقرة. بالنسبة لنظام في حالة مستقرة، يستمر السلوك الملاحظ حاليًا في المستقبل. ولذلك، بمجرد وصول التفاعل إلى التوازن، فإن نسبة تركيز المنتج والمواد المتفاعلة ستظل كما هي، على الرغم من استمرار التفاعل.

كيف تتحدث ببساطة عن الأشياء المعقدة؟
من الصعب جدًا فهم مفاهيم مثل التوازن الكيميائي وثابت التوازن الكيميائي. لنأخذ مثالا من الحياة. هل سبق لك أن علقت على جسر بين مدينتين ولاحظت أن حركة المرور في الاتجاه الآخر سلسة ومنتظمة، بينما أنت عالق في حركة المرور بشكل يائس؟ هذا ليس جيدا.
ماذا لو تحركت السيارات بسلاسة وبنفس السرعة على كلا الجانبين؟ هل سيظل عدد السيارات في كلا المدينتين ثابتا؟ عندما تكون سرعة الدخول والخروج إلى كلتا المدينتين هي نفسها، ويكون عدد السيارات في كل مدينة ثابتًا مع مرور الوقت، فهذا يعني أن العملية برمتها في توازن ديناميكي.
مثال
احسب ثابت التوازن الكيميائي للعكس رد فعل متجانس، CO + H 2 O = CO 2 + H 2، بناءً على حقيقة أن التركيز المتوازن للمواد:
[CO] ع = 0.045 مول/لتر،
[H2O] ع = 0.064 مول/لتر،
[CO 2 ] ع = 0.18 مول/لتر.
منح:
[CO] ع = 0.045 مول/لتر
[H 2 O] ع = 0.064 مول/لتر
[CO 2 ] ع = 0.18 مول/لتر
حل:
وبالتالي فإن النسبة المولية لمنتجات التفاعل هي 1:1
[CO 2 ] p = [H 2 ] p = 0.18 مول/لتر.
وبناء على التعبير (2.1) نحسب قيمة ثابت التوازن الكيميائي:
إلى x.r. = [CO 2 ] ص [H 2 ] ص / [CO 2 ] ص [H 2 O] ع = 0.18 0.18/0.045 0.064
إجابة: 11,25.
2. حساب تراكيز التوازن من التركيزات الأولية للمواد المتفاعلة والعكس
مثال 1.
يستمر تفاعل الغاز الانعكاسي وفقًا للمعادلة:
CO + CI 2 = COCI 2.
التركيزات الأولية للمواد المتفاعلة:
[CO] 0 = 0.03 مول/لتر؛
0 = 0.02 مول/لتر.
وبعد الوصول إلى حالة التوازن أصبح تركيز أول أكسيد الكربون كما يلي:
[CO] ع = 0.021 مول/لتر.
احسب تركيزات التوازن للمواد المتبقية وقيمة ثابت التوازن الكيميائي.
منح:
[CO] 0 = 0.03 مول/لتر
[C1 2 ] 0 = 0.02 مول/لتر
[CO] ع = 0.021 مول/لتر
ف , ص , ك س . ع – ؟
حل:
بحلول وقت التوازن، كان التغير في تركيز ثاني أكسيد الكربون:
∆[CO] = [CO] 0 – [CO] ع = 0.03 – 0.021 = 0.009 مول/لتر.
بما أن النسبة المولية للمواد المشاركة في التفاعل هي 1:1:1، فإن التغير في تركيز جميع المواد هو نفسه:
[C1 2 ] p = [C1 2 ] 0 – ∆[C1 2 ] = 0.02 – 0.009 = 0.011 مول/لتر,
[SOS1 2] ع = 0.009 مول/لتر،
K x Р = [ССО1 2 ] Р / [СО] Р [С1 2 ] Р = 0.009/0.021 · 0.011 = 39.
سنقوم بإدخال نتائج الحسابات في الجدول، حيث تعني العلامات "+" و "-" زيادة أو نقصان في تركيز المادة، على التوالي.
إجابة:[C1 2 ] ع = 0.011 مول/لتر؛ [SOC1 2] ع = 0.009 مول/لتر؛ ك س ع = 39.
مثال 2.
تركيزات التوازن للمواد المشاركة في التفاعل العكسي 2NO + O 2 = 2NO 2 هي كما يلي (مول/لتر):
ف = 0.056؛
[يا 2] = 0.028؛
منح:
ف = 0.056 مول/لتر
ف = 0.028 مول/لتر
ف = 0.044 مول/لتر
0 , [O 2 ] 0 – ?
حل:
كان التركيز الأولي لأكسيد النيتريك (IV) 0 = 0، وتغيره عند لحظة التوازن هو ∆ = 0.044 مول/لتر.
النسبة المولية لـ NO وNO 2 في التفاعل هي 2:2 (1:1)، وبالتالي فإن التركيز الأولي لـ NO سيكون:
0 = ع + 0.044 = 0.056 + 0.044 = 0.1 مول/لتر.
النسبة المولية لـ O 2 و NO 2 هي 1: 2، وبالتالي فإن التركيز الأولي لـ O 2 سيكون:
[O 2 ] 0 = [O 2 ] p + 0.044/2 = 0.028 + 0.022 = 0.05 مول/لتر.
يتم تسجيل نتائج الحساب في الجدول
إجابة: 0 = 0.1 مول/لتر؛ [O 2 ] 0 = 0.05 مول/لتر.
مثال 3.
يتم إجراء تفاعل تصنيع الأمونيا وفقًا للمعادلة ZN 2 + N 2 = 2NH 3. التركيزات الأولية للمواد الأولية متساوية (مول/لتر): الهيدروجين – 0.05؛ النيتروجين - 0.04: ثابت معدل التفاعل هو 0.3. حساب: أ) معدل التفاعل الأولي؛ ب) معدل التفاعل عندما أصبح تركيز الأمونيا 0.02 مول/لتر.
منح:
أ) [H 2 ] 0 = 0.05 مول/لتر
0 = 0.04 مول/لتر
ب) = 0.02 مول/لتر
حل:
أ) وفقا لقانون عمل الكتلة نجد معدل التفاعل الأولي:
υ 0 = ك 0 3 0 = 3 10 –1 3 = 1.5 10 –6 مول/لتر ث.
ب) بناءً على معادلة التفاعل، فإن النسبة المولية للهيدروجين والأمونيا هي 3:2. تؤدي زيادة تركيز الأمونيا بمقدار 0.02 مول/لتر إلى انخفاض تركيز الهيدروجين بمقدار 0.03 مول/لتر (0.02 – 3/2 = 0.03).
وهكذا، بحلول الوقت الذي زاد فيه تركيز الأمونيا بمقدار 0.02 مول/لتر، انخفض تركيز الهيدروجين إلى 0.02 مول/لتر (0.05 - 0.03 = 0.02). النسبة المولية للنيتروجين والأمونيا هي 1:2. سينخفض تركيز النيتروجين بمقدار 0.01 مول (0.02 – 1/2 = 0.01) ويصبح مساويًا لـ 0.03 مول/لتر (0.04 – 0.01 = 0.03). سينخفض معدل التفاعل أيضًا مع انخفاض تركيز المواد المتفاعلة:
υ = ك 3 = 3 10 –1 3 = 7.2 10 –8 مول/لتر ث.
إجابة:أ) 1.5 10 –6 مول/لتر ث؛ ب) 7.2 10 –8 مول/لتر ث.
مثال 4.
يتم التفاعل وفقاً للمعادلة 2NO + O 2 = 2NO 2، وبعد فترة من بدء التفاعل، أصبحت تراكيز جميع المواد المشاركة في التفاعل: = 0.04 مول/لتر؛ [O 2 ] = 0.01 مول/لتر؛ = 0.02 مول/لتر. احسب التركيزات الأولية للمواد البادئة ومعدل التفاعل الأولي إذا كان ثابت معدل التفاعل k = 1.
منح:
0.04 مول/لتر
[O 2 ] = 0.01 مول/لتر
0.02 مول/لتر
0 , 0 , س 0 – ?
حل:
وفقا لمعادلة التفاعل، فإن النسبة المولية لـ NO و NO 2 هي 2:2 (1:1).
أدت الزيادة في تركيز منتج التفاعل NO 2 إلى 0.02 مول/لتر إلى انخفاض تركيز NO بمقدار 0.02 مول. لذلك، كان التركيز الأولي لأكسيد النيتريك (II) هو:
0 = +0.02 = 0.04 + 0.02 = 0.06 مول/لتر.
النسبة المولية لـ O 2 و NO 2 هي 1: 2، لذا فإن زيادة تركيز NO 2 إلى 0.02 مول تسبب في انخفاض تركيز الأكسجين بمقدار 0.01 مول (0.02 1/2 = 0.01). ونتيجة لذلك، كان تركيز الأكسجين الأولي:
[O 2 ] 0 = [O 2 ] + 0.01 = 0.01 + 0.01 = 0.02 مول/لتر.
معدل التفاعل الأولي
υ 0 = ك 0 2 0 = 1 2 = 7.2 · 10 –5 مول/لتر·ث.
إجابة: 0 = 0.06 مول/لتر؛ [O 2 ] 0 = 0.02 مول/لتر؛
× 0 = 7.2 10 –5 مول/لتر ث.
معظم التفاعلات الكيميائية قابلة للعكس، أي. تتدفق في وقت واحد في اتجاهين متعاكسين. وفي الحالات التي تحدث فيها التفاعلات الأمامية والعكسية بنفس المعدل، يحدث التوازن الكيميائي. على سبيل المثال، في التفاعل المتجانس القابل للعكس: H 2 (g) + I 2 (g) ↔ 2HI (g)، تعتمد نسبة معدلات التفاعلات الأمامية والعكسية وفقًا لقانون عمل الكتلة على نسبة التركيزات من المواد المتفاعلة وهي: سرعة التفاعل الأمامي: υ 1 = k 1 [H 2 ]. معدل التفاعل العكسي: υ 2 = k 2 2.
إذا كانت H 2 و I 2 مواد أولية، ففي اللحظة الأولى يتم تحديد معدل التفاعل الأمامي من خلال تركيزاتها الأولية، ويكون معدل التفاعل العكسي صفرًا. ومع استهلاك H 2 وI 2 وتكوين HI، يقل معدل التفاعل الأمامي ويزداد معدل التفاعل العكسي. وبعد مرور بعض الوقت، يتم تعادل كلا المعدلين، ويتم إنشاء التوازن الكيميائي في النظام، أي. يصبح عدد جزيئات HI المنتجة والمستهلكة لكل وحدة زمنية هو نفسه.
بما أنه في حالة التوازن الكيميائي تكون معدلات التفاعلات الأمامية والعكسية مساوية لـ V 1 = V 2، إذن k 1 = k 2 2.
وبما أن k 1 وk 2 ثابتان عند درجة حرارة معينة، فإن النسبة بينهما ستكون ثابتة. وبالرمز K نحصل على:

يُطلق على K ثابت التوازن الكيميائي، وتسمى المعادلة أعلاه قانون فعل الكتلة (Guldberg - Waale).
في الحالة العامةلتفاعل بالشكل aA+bB+…↔dD+eE+… ثابت التوازن يساوي ![]() . للتفاعل بين المواد الغازيةغالبًا ما تستخدم التعبير الذي يتم فيه تمثيل المواد المتفاعلة بواسطة الضغوط الجزئية المتوازنة ص. للتفاعل المذكور
. للتفاعل بين المواد الغازيةغالبًا ما تستخدم التعبير الذي يتم فيه تمثيل المواد المتفاعلة بواسطة الضغوط الجزئية المتوازنة ص. للتفاعل المذكور  .
.
تحدد حالة التوازن الحد الذي يستمر عنده التفاعل تلقائيًا في ظل ظروف معينة (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
العلاقة بين تركيزات التوازن لا تعتمد على المواد التي يتم أخذها كمواد أولية (على سبيل المثال، H 2 و I 2 أو HI)، أي. يمكن الاقتراب من حالة التوازن من كلا الجانبين.
يعتمد ثابت التوازن الكيميائي على طبيعة الكواشف وعلى درجة الحرارة؛ لا يعتمد ثابت التوازن على الضغط (إذا كان مرتفعًا جدًا) أو على تركيز الكواشف.
التأثير على ثابت التوازن لعوامل درجة الحرارة والإنثالبي والإنتروبيا. يرتبط ثابت التوازن بالتغير في الجهد متساوي الضغط القياسي للتفاعل الكيميائي ∆G o بواسطة المعادلة البسيطة ∆G o =-RT ln K.
يوضح أن القيم السلبية الكبيرة لـ ∆G o (∆G o<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0)، فإن المواد الأولية هي التي تسود في خليط التوازن. تتيح هذه المعادلة حساب K من قيمة ∆G o، ومن ثم تركيزات التوازن (الضغوط الجزئية) للكواشف. إذا أخذنا في الاعتبار أن ∆G o =∆Н o -Т∆S o ، فبعد بعض التحولات نحصل عليها ![]() . يتضح من هذه المعادلة أن ثابت التوازن حساس للغاية للتغيرات في درجات الحرارة. إن تأثير طبيعة الكواشف على ثابت التوازن يحدد اعتمادها على عوامل المحتوى الحراري والإنتروبيا.
. يتضح من هذه المعادلة أن ثابت التوازن حساس للغاية للتغيرات في درجات الحرارة. إن تأثير طبيعة الكواشف على ثابت التوازن يحدد اعتمادها على عوامل المحتوى الحراري والإنتروبيا.
مبدأ لو شاتيليه
يتم الحفاظ على حالة التوازن الكيميائي في ظل ظروف ثابتة معينة في أي وقت. عندما تتغير الظروف، تنتهك حالة التوازن، لأنه في هذه الحالة تتغير معدلات العمليات المعاكسة بدرجات متفاوتة. ومع ذلك، بعد مرور بعض الوقت، يصل النظام مرة أخرى إلى حالة التوازن، ولكن هذه المرة تتوافق مع الظروف الجديدة المتغيرة.
يتم تحديد إزاحة التوازن اعتمادًا على التغيرات في الظروف بشكل عام من خلال مبدأ لو شاتيليه (أو مبدأ تحريك التوازن): إذا تأثر نظام في حالة توازن من الخارج بتغيير أي من الشروط التي تحدد موضع التوازن، فإنه ينحرف في اتجاه العملية، مما يؤدي إلى إضعاف تأثير التأثير الناتج.
وبالتالي فإن ارتفاع درجة الحرارة يؤدي إلى تحول في التوازن في اتجاه العمليات التي يصاحب سيرها امتصاص الحرارة، وانخفاض درجة الحرارة يعمل في الاتجاه المعاكس. وبالمثل، فإن زيادة الضغط تؤدي إلى إزاحة التوازن في اتجاه العملية مصحوبًا بانخفاض في الحجم، ويعمل انخفاض الضغط في الاتجاه المعاكس. على سبيل المثال، في نظام التوازن 3H 2 + N 2 2H 3 N، ∆H o = -46.2 kJ، تؤدي الزيادة في درجة الحرارة إلى تعزيز تحلل H 3 N إلى هيدروجين ونيتروجين، نظرًا لأن هذه العملية ماصة للحرارة. تؤدي زيادة الضغط إلى إزاحة التوازن نحو تكوين H 3 N، لأنه في نفس الوقت يتناقص الحجم.
إذا تمت إضافة كمية معينة من أي من المواد المشاركة في التفاعل إلى نظام في حالة توازن (أو على العكس من ذلك، تمت إزالتها من النظام)، فإن معدلات التفاعلات الأمامية والعكسية تتغير، ولكنها تتساوى تدريجيًا مرة أخرى. وبعبارة أخرى، يعود النظام إلى حالة التوازن الكيميائي. في هذه الحالة الجديدة، ستختلف تركيزات التوازن لجميع المواد الموجودة في النظام عن تركيزات التوازن الأصلية، ولكن النسبة بينهما ستبقى كما هي. وبالتالي، في نظام في حالة توازن، من المستحيل تغيير تركيز إحدى المواد دون التسبب في تغيير في تركيزات جميع المواد الأخرى.
وفقًا لمبدأ Le Chatelier، فإن إدخال كميات إضافية من الكاشف في نظام التوازن يؤدي إلى تحول في التوازن في الاتجاه الذي يتناقص فيه تركيز هذه المادة، وبالتالي يزيد تركيز منتجات تفاعلها.
تعتبر دراسة التوازن الكيميائي ذات أهمية كبيرة سواء للبحث النظري أو لحل المشكلات العملية. ومن خلال تحديد موضع التوازن لدرجات الحرارة والضغوط المختلفة، من الممكن اختيار الظروف الأكثر ملاءمة للعملية الكيميائية. عند الاختيار النهائي لظروف العملية، يتم أيضًا أخذ تأثيرها على سرعة العملية في الاعتبار.
مثال 1.حساب ثابت التوازن للتفاعل من تركيزات التوازن من المواد المتفاعلة.
احسب ثابت التوازن للتفاعل A + B 2C، إذا كانت تركيزات التوازن [A] = 0.3 mol∙l -1؛ [V]=1.1mol∙l -1; [C]=2.1mol∙l -1.
حل.التعبير عن ثابت التوازن لهذا التفاعل له الصيغة: . دعونا نستبدل هنا تركيزات التوازن المشار إليها في بيان المشكلة: =5.79.
مثال 2. حساب تركيزات التوازن للمواد المتفاعلة. يتم التفاعل وفقًا للمعادلة A + 2B C.
حدد تركيزات التوازن للمواد المتفاعلة إذا كانت التركيزات الأولية للمواد A وB هي على التوالي 0.5 و0.7 موللتر -1، وثابت توازن التفاعل K p = 50.
حل.لكل مول من المادتين A و B، يتم تشكيل 2 مول من المادة C. إذا كان النقصان في تركيز المادتين A و B يُشار إليه بـ X مول، فإن الزيادة في تركيز المادة ستكون مساوية 2X مول. التركيزات التوازنية للمواد المتفاعلة ستكون:
C A = (about.5-x)mol∙l -1; C B = (0.7-x) مول∙لتر -1؛ C C = 2x مول∙لتر -1
س 1 =0.86; × 2 = 0.44
وفقا لشروط المشكلة، فإن القيمة × 2 صالحة. ومن ثم فإن التركيزات التوازنية للمواد المتفاعلة هي:
C A =0.5-0.44=0.06mol∙l -1؛ C B = 0.7-0.44=0.26mol∙l -1؛ C C =0.44∙2=0.88mol∙l -1.
مثال 3.تحديد التغير في طاقة جيبس ∆G o للتفاعل بقيمة ثابت التوازن K r. احسب طاقة جيبس وحدد إمكانية حدوث التفاعل CO + Cl 2 = COCl 2 عند 700 K إذا كان ثابت التوازن يساوي Kp = 1.0685∙10 -4. الضغط الجزئي لجميع المواد المتفاعلة هو نفسه ويساوي 101325 Pa.
حل.∆G 700 = 2.303∙RT ![]() .
.
لهذه العملية:
منذ ∆اذهب<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
مثال 4. التحول في التوازن الكيميائي. في أي اتجاه سوف يتحول التوازن في النظام N 2 +3H 2 2NH 3 -22kcal:
أ) مع زيادة تركيز N 2؛
ب) مع زيادة تركيز H 2؛
ج) مع زيادة درجة الحرارة.
د) متى ينخفض الضغط؟
حل.إن زيادة تركيز المواد على الجانب الأيسر من معادلة التفاعل، حسب قاعدة لوشاتيلييه، يجب أن تسبب عملية تميل إلى إضعاف التأثير وتؤدي إلى انخفاض التركيزات، أي. سوف ينتقل التوازن إلى اليمين (الحالتان أ و ب).
رد فعل تخليق الأمونيا هو طارد للحرارة. تؤدي الزيادة في درجة الحرارة إلى تحول في التوازن إلى اليسار - نحو تفاعل ماص للحرارة، مما يضعف التأثير (الحالة ج).
إن انخفاض الضغط (الحالة د) سوف يؤدي إلى تفاعل يؤدي إلى زيادة في حجم النظام، أي. نحو تكوين N 2 و H 2.
مثال 5.كم مرة سيتغير معدل التفاعل الأمامي والخلفي في النظام 2SO 2 (g) + O 2 (g) 2SO 3 (r) إذا انخفض حجم خليط الغاز بمقدار ثلاث مرات؟ في أي اتجاه سيتحول توازن النظام؟
حل.دعونا نشير إلى تركيزات المواد المتفاعلة: = أ، =ب،=مع.وفقا لقانون عمل الكتلة، فإن معدلات التفاعلات الأمامية والعكسية قبل التغير في الحجم متساوية
v pr = Ka 2 b، v arr = K 1 s 2
بعد تقليل حجم النظام المتجانس ثلاث مرات، يزداد تركيز كل من المواد المتفاعلة ثلاث مرات: = 3 أ,[يا2]= 3 ب؛ = 3ث.عند التركيزات الجديدة، تكون السرعة v"np للتفاعلات الأمامية والعكسية:
v" np = K(3a) 2 (3b) = 27 Ka 2 b; v o 6 p = K 1 (3c) 2 = 9K 1 c 2.
![]() ;
; ![]()
ونتيجة لذلك، زادت سرعة التفاعل الأمامي 27 مرة، والتفاعل العكسي تسع مرات فقط. تحول توازن النظام نحو تكوين SO 3.
مثال 6.احسب عدد المرات التي سيزداد فيها معدل التفاعل الذي يحدث في الطور الغازي عندما تزيد درجة الحرارة من 30 إلى 70 درجة مئوية، إذا كان معامل درجة حرارة التفاعل 2.
حل.يتم تحديد اعتماد معدل التفاعل الكيميائي على درجة الحرارة بواسطة قاعدة فانت هوف التجريبية وفقًا للصيغة
وبالتالي، فإن معدل التفاعل عند 70 درجة مئوية أكبر 16 مرة من معدل التفاعل عند 30 درجة مئوية.
مثال 7.ثابت التوازن لنظام متجانس
CO(g) + H2O(g) CO2(g) + H2(g) عند 850 درجة مئوية يساوي 1. احسب تركيزات جميع المواد في حالة التوازن إذا كانت التركيزات الأولية هي: [CO] ISH = 3 مول/لتر، [H 2 O] RI = 2 مول/لتر.
حل.في حالة الاتزان تكون معدلات التفاعلات الأمامية والعكسية متساوية، وتكون نسبة ثوابت هذه المعدلات ثابتة ويسمى ثابت التوازن للنظام المعطى:
الخامسنب = ك 1[CO] [H 2 O]؛ الخامسس ب ع = ل 2 [CO 2] [H 2]؛
![]()
في بيان المشكلة يتم إعطاء التركيزات الأولية، بينما في التعبير ك صيشمل فقط تركيزات التوازن لجميع المواد في النظام. لنفترض أنه في لحظة التوازن التركيز [CO 2 ] P = Xمول/لتر. ووفقا لمعادلة النظام، فإن عدد مولات الهيدروجين المتكونة سيكون أيضا Xمول/لتر. لنفس العدد من الشامات (xيتم استهلاك مول/لتر) CO وH2O للتكوين Xمولات ثاني أكسيد الكربون و H2. وبالتالي فإن التركيزات التوازنية لجميع المواد الأربع (مول/لتر):
[CO 2 ] P = [H 2 ] P = العاشر؛[CO] P = (3 - س)؛ ف = (2x).
وبمعرفة ثابت التوازن، نوجد قيمته X،ثم التركيزات الأولية لجميع المواد:
![]() ; س 2 = 6-2س-3س + س 2; 5س = 6، ل = 1.2 مول/لتر.
; س 2 = 6-2س-3س + س 2; 5س = 6، ل = 1.2 مول/لتر.
يمكن تقسيم جميع التفاعلات الكيميائية إلى تفريغو لا رجعة فيه.تشمل التفاعلات العكسية تلك التفاعلات التي، عند درجة حرارة معينة، تسير بمعدل ملحوظ في اتجاهين متعاكسين - للأمام والخلف. التفاعلات العكسية لا تستمر حتى الاكتمال، ولا يتم استهلاك أي من المواد المتفاعلة بشكل كامل. مثال على ذلك سيكون رد الفعل
وفي نطاق درجة حرارة معينة، يكون هذا التفاعل قابلاً للعكس. لافتة " » هي علامة على الرجوع.
ردود الفعل التي لا رجعة فيها هي تلك التفاعلات التي تستمر فقط في اتجاه واحد حتى الاكتمال، أي. حتى يتم استهلاك أحد المواد المتفاعلة بشكل كامل. مثال على التفاعل الذي لا رجعة فيه هو تفاعل تحلل كلورات البوتاسيوم:
من المستحيل تكوين كلورات البوتاسيوم من كلوريد البوتاسيوم والأكسجين في الظروف العادية.
حالة التوازن الكيميائي. ثابت التوازن الكيميائي
دعونا نكتب معادلة بعض التفاعلات العكسية في الصورة العامة:
بحلول الوقت الذي بدأ فيه التفاعل، كانت تركيزات المواد البادئة A وB عند الحد الأقصى. أثناء التفاعل يتم استهلاكها ويتناقص تركيزها. علاوة على ذلك، ووفقا لقانون عمل الكتلة، فإن معدل رد الفعل المباشر
سوف يتناقص. (هنا وأدناه، يشير السهم الموجود في الأعلى إلى اتجاه العملية.) في اللحظة الأولية، كانت تركيزات منتجات التفاعل D و E مساوية للصفر. وأثناء التفاعل تزداد، ويزداد معدل التفاعل العكسي من الصفر حسب المعادلة:
في التين. 4.5 يوضح التغير في السرعات الأمامية والخلفية
ردود الفعل مع مرور الوقت. وبعد الزمن t تصبح هذه السرعات متساوية - -» 
أرز. 4.5.التغير في معدل التفاعلات الأمامية (1) والعكسية (2) مع مرور الوقت: - في غياب المحفز: .......... - في وجود المحفز
وتسمى هذه الحالة بالتوازن الكيميائي. التوازن الكيميائي هو الحالة الأكثر استقرارًا والمحددة للعمليات التلقائية.ويمكن أن تستمر إلى أجل غير مسمى إذا لم تتغير الظروف الخارجية. في الأنظمة المعزولة في حالة التوازن، تصل إنتروبيا النظام إلى الحد الأقصى وتبقى ثابتة، أي. دي إس = 0. في ظل الظروف متساوية الضغط ومتساوي الحرارة، فإن القوة الدافعة للعملية، طاقة جيبس، في حالة التوازن تأخذ قيمة دنيا ولا تتغير أكثر، أي. دي جي = 0.
تسمى تركيزات المشاركين في التفاعل في حالة التوازن بالتوازن.كقاعدة عامة، يتم الإشارة إليها من خلال صيغ المواد المقابلة، محاطة بين قوسين مربعين، على سبيل المثال، يُشار إلى تركيز توازن الأمونيا على النقيض من التركيز الأولي غير المتوازن C^NH^.
بما أن معدلات العمليات المباشرة والعكسية في التوازن متساوية، فإننا نساوي الطرفين الأيمن من المعادلات (4.44) و
- -^ أنا-
- (4.45)، استبدال تسمية التركيز: A: [A]""[B]" = ?[D] /; )










