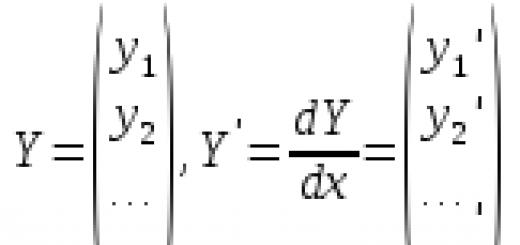Электрохимия
Активность ионов. Ионная сила раствора. Зависимость коэффициента активности иона от ионной силы раствора. Теория Дебая-Хюккеля.
Активность (ионов) - эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется коэффициентом активности: γ = a/c.
Ионная сила раствора - мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
где cB - молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая - Хюккеля. Основное уравнение этой теории (предельный закон Дебая - Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде: где γ - коэффициент активности, А - постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
Отношение активности (a) к общей концентрации вещества в растворе (c, в моль/л), то есть активность ионов при концентрации 1 моль/л, называется коэффициентом активности :
В бесконечно разбавленных водных растворах неэлектролитов коэффициент активности равен единице. Опыт показывает, что по мере увеличения концентрации электролита величины f уменьшаются, проходят через минимум, а затем снова увеличиваются и становятся существенно большими единицы в крепких растворах. Такой ход зависимости f от концентрации определяется двумя физическими явлениями.
Первое особенно сильно проявляется при малых концентрациях и обусловлено электростатическим притяжением между противоположно заряженными ионами. Силы притяжения между ионами преобладают над силами отталкивания, т.е. в растворе устанавливается ближний порядок, при котором каждый ион окружен ионами противоположного знака. Следствием этого является усиление связи с раствором, что находит отражение в уменьшении коэффициента активности. Естественно, что взаимодействие между ионами возрастает при увеличении их зарядов.
При возрастании концентрации все большее влияние на активность электролитов оказывает второе явление, которое обусловлено взаимодействием между ионами и молекулами воды (гидратацией). При этом в относительно концентрированных растворах количество воды становится недостаточным для всех ионов и начинается постепенная дегидратация, т.е. связь ионов с раствором уменьшается, следовательно, увеличиваются коэффициенты активности.
Известны некоторые закономерности, касающиеся коэффициентов активности. Так, для разбавленных растворов (приблизительно до m = 0,05) соблюдается соотношение 1 - f = k√m. В несколько более разбавленных растворах (т ≈ 0,01) величины f не зависят от природы ионов. Это обусловлено тем, что ионы находятся на таких расстояниях друг от друга, на которых взаимодействие определяется только их зарядами.
При более высоких концентрациях наряду с зарядом на величину активности начинает оказывать влияние и радиус ионов.
Для оценки зависимости коэффициентов активности от концентрации в растворах, где присутствует несколько электролитов, Г. Льюис и М. Рэндалл ввели понятие о ионной силе I, которая характеризует интенсивность электрического поля, действующего на ионы в растворе. Ионная сила определяется как полусумма членов, полученных умножением моляльностей каждого иона mi на квадрат его валентности Zi:
I = 1/2∑miZi. (IX.18)
ДЕБАЯ - ХЮККЕЛЯ ТЕОРИЯ , статистич. теория разбавленных растворов сильных электролитов, позволяющая рассчитать коэф. активности ионов. Основана на предположении о полной диссоциации электролита на ионы, которые распределены в растворителе, рассматриваемом как непрерывная среда. Каждый ион действием своего электрич. заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака - т. наз. ионную атмосферу. В отсутствие внеш. электрич. поля ионная атмосфера имеет сферич. симметрию и ее заряд равен по величине и противоположен по знаку заряду создающего ее центр. иона. Потенциал j суммарного электрич. поля, создаваемого центр. ионом и его ионной атмосферой в точке, расположенной на расстоянии r от центр. иона, м.б. рассчитан, если ионную атмосферу описывать непрерывным распределением плотности r заряда около центр. иона. Для расчета используют ур-ние Пуассона (в системе СИ):
n2j = -r/ee0,
где n2-оператор Лапласа, e - диэлектрич. проницаемость растворителя, e0 - электрич. постоянная (диэлектрич. проницаемость вакуума). Для каждого i-го сорта ионов r описывается ф-цией распределения Больцмана; тогда в приближении, рассматривающем ионы как точечные заряды (первое приближение Д.-Х.т.), решение ур-ния Пуассона принимает вид:  где z - зарядовое число центр. иона, rd - т. наз. дебаевский радиус экранирования (радиус ионной атмосферы). На расстояниях r > rd потенциал j становится пренебрежимо малым, т. е. ионная атмосфера экранирует электрич. поле центр. иона.
где z - зарядовое число центр. иона, rd - т. наз. дебаевский радиус экранирования (радиус ионной атмосферы). На расстояниях r > rd потенциал j становится пренебрежимо малым, т. е. ионная атмосфера экранирует электрич. поле центр. иона.
В отсутствие внешнего электрического поля ионная атмосфера имеет сферическую симметрию, и её заряд равен по величине и противоположен по знаку заряду создающего её центрального иона. В этой теории не уделено почти никакого внимания образованию пар противоположно заряженных ионов путём непосредственного взаимодействия между ними.
ГОУ ВПО «Уральский государственный технический университет - УПИ имени первого Президента России »
Кафедра технологии электрохимических производств
Расчет коэффициентов активности
Методические указания для выполнения по дисциплине «Введение в теорию растворов электролитов»
для студентов, обучающихся по
направлению 240100 – химическая технология и биотехнология (профиль технология электрохимических производств)
Екатеринбург
Составители:
профессор, д-р хим. наук
профессор, д-р хим. наук,
Научный редактор профессор д-р хим. наук Ирина Борисовна Мурашова
Расчет коэффициентов активности: Методические указания для выполнения расчетной работы по дисциплине «Введение в теорию растворов электролитов»/ , . Екатеринбург: УГТУ-УПИ 2009.12с.
В методических указаниях излагаются основы расчета коэффициентов активности. Показана возможность расчета этой величины на основе различных теоретических моделей.
Библиогр.: 5 назв. 1 Табл.
Подготовлено кафедрой «Технология электрохимических производств».
Варианты заданий на курсовую работу
Библиографический список
ВВЕДЕНИЕ
Теоретические представления о строении растворов впервые были сформулированы в теории электролитической диссоциации Аррениуса:
1. Электролитами называются вещества, которые при растворении в соответствующих растворителях (например, вода) распадаются (диссоциируют) на ионы. Процесс называется электролитической диссоциацией. Ионы в растворе представляют собой заряженные частиц, которые ведут себя подобно молекулам идеального газа, то есть не взаимодействуют друг с другом.
2. Не все молекулы распадаются на ионы, а только некоторая доля б, которая называется степенью диссоциации
Где n – количество распавшихся молекул, N – общее количество молекул растворенного вещества. 0<б<1
3. К процессу электролитической диссоциации применим закон действующих масс.
Теория не учитывает взаимодействия ионов с диполями воды, то есть ион-дипольное взаимодействие. Однако именно этот тип взаимодействия определяет физические основы образования ионов, объясняет причины диссоциации и устойчивость ионных систем. Теория не учитывает ион-ионного взаимодействия. Ионы заряженные частицы и в силу этого воздействуют друг на друга. Пренебрежение этим взаимодействием приводит к нарушению количественных соотношений теории Аррениуса.
В силу этого в дальнейшем возникли теория сольватации и теория межионного взаимодействия.
Современные представления о механизме образования растворов электролитов. Равновесные электроды
Процесс образования ионов и устойчивость растворов электролитов (ионных систем) невозможно объяснить без учета сил взаимодействия между ионами и молекулами растворителя (ион-дипольное взаимодействие) и ион-ионного взаимодействия. Всю совокупность взаимодействий можно формально описать, используя вместо концентраций (Ci) активности ионов (ai)
где fi – коэффициент активности i-го сорта ионов.
В зависимости от формы выражения концентраций иммется 3 шкалы активносетй и коэффициентов активности: с-шкала молярная (моль/л или Моль/м3); m – шкала моляльная (моль/кг); N – рациональная шкала (отношение числа молей растворенного вещества к общему числу молей в объеме раствора). Соответственно: f, fm, fN, a, am, aN.
При описании свойств растворов электролитов используют понятия активности соли
 (2)
(2)
и средней ионной активности
где , а и - стехиометрические коэффициенты катиона и аниона, соответственно;
С – молярная концентрация растворенного вещества;
![]() - средний коэффициент активности.
- средний коэффициент активности.
Основные положения теории растворов сильных электролитов Дебая и Гюккеля:
1. Между ионами действуют только электростатические силы.
2. При расчете кулоновского взаимодействия предполагается, что диэлектрическая проницаемость раствора и чистого растворителя равны.
3. Распределение ионов в потенциальном поле подчиняется статистике Больцмана.
В теории сильных электролитов Дебая и Гюккеля при определении коэффициентов активности рассматриваются 2 приближения.
В первом приближении при выводе выражения для среднего коэффициента активности предполагается, что ионы представляют собой материальные точки (размер иона ) и между ними действует силы электростатического взаимодействия:
![]() , (4)
, (4)
Коэффициент активности в рациональной шкале (N – концентрация, выраженная в мольных долях);
T - температура;
е – диэлектрическая проницаемость среды (растворителя);
![]() - ионная сила раствора, моль/л, k – количество видов ионов в растворе;
- ионная сила раствора, моль/л, k – количество видов ионов в растворе;
![]() .
.
Для расчета коэффициента активности в моляльной шкале используют соотношение
Моляльная концентрация растворенного вещества, моль/кг;
Молярная масса растворителя, кг/моль.
Расчет среднего коэффициента активности по первому приближению справедлив для разбавленных растворов сильных электролитов.
Во втором приближении Дебай и Гюккель учли, что ионы имею конечный размер, равный a. Под размером иона подразумевается минимальное расстояние, на которое ионы могут приблизиться друг к другу. Значения размера некоторых ионов представлены в таблице.
Таблица 1. Значения параметра а, характеризующего размер ионов
F-, Cl-, Br-, I-, CN-, NO2-, NO3-, OH-, CNS- | |||
IO3-, HCO3-, H2PO4-, HSO3-, SO42- | |||
PO43-, Fe(CN)63- | |||
Rb+, Cs+, NH4+, Tl+, Ag+ | |||
Ca2+, Cu2+, Zn2+, Sn2+, Mn2+, Fe2+, Ni2+, Co2+ | |||
Pb2+, Sr2+, Ba2+, Ra2+, Cd2+, Hg2+, | |||
Fe3+, Al3+, Cr3+, Sc3+, Y3+, La3+, In3+, Ce3+, | |||
В результате теплового движения ионы в растворе электролита располагаются вокруг иона, произвольно выбранного за центральный, в виде сферы. Все ионы раствора равноценны: каждый окружен ионной атмосферой и, в то же время, каждый центральный ион входит в состав ионной атмосферы другого иона. Гипотетическая ионная атмосфера имеет равный по величине и противоположный по знаку заряд относительно заряда центрального иона. Радиус ионной атмосферы обозначают, как .
Если размеры катиона и аниона близки, то по второму приближению Дебая и Гюккеля можно определить средний коэффициент активности:
![]() , (6)
, (6)
где , ![]() . (7)
. (7)
Выражения для коэффициентов активности катиона и аниона имеют вид:
![]() и
и ![]()
По известным коэффициентам активности отдельных ионов можно рассчитать среднеионный коэффициент активности: ![]() .
.
Теория Дебая и Гюккеля применима для разбавленных растворов. Основной недостаток этой теории состоит в том, что в учитываются только силы кулоновского взаимодействия между ионами.
Расчет коэффициентов активности по Робинсону-Стоксу и Икеда.
При выводе уравнения для среднего коэффициента активности Робинсон и Стокс учили тот факт, что ионы в растворе находятся в сольватированном состоянии:
где - активность растворителя зависит от осмотического коэффициента (ц), ![]() ;
;
Количество молекул растворителя, связанных с одной молекулой растворенного вещества; бi – число гидратации i-го иона.
Икеда предложил более простую формулу для расчета моляльного среднеионного коэффициента активности
Уравнение Робинсона-Стокса позволяет рассчитывать коэффициенты активности 1-1 валентных электролитов до концентрации 4 кмоль/м3 с точностью до 1%.
Определение среднеионного коэффициента активности электролита в смеси электролитов.
Для случая, когда в растворе имеется два электролита В и Р часто выполняется правило Харнеда:
![]() , (10)
, (10)
где среднеионный коэффициент активности электролита В в присутствии электролита Р
Среднеионный коэффициент активности В в отсутствие Р,
![]() - полная моляльность электролита, которая рассчитывается как сумма моляльных концентраций электролитов В и Р,
- полная моляльность электролита, которая рассчитывается как сумма моляльных концентраций электролитов В и Р,
Здесь hB и hP – количество молекул растворителя, связанных с одной молекулой электролита В и Р, соответственно, а - осмотические коэффициенты электролитов В и Р.
Тематика курсовых работ по дисциплине
для студентов заочной формы обучения
№ варианта | Электролит | Концентрация, моль/м3 | Температура, 0С |
Активность компонентов раствора - это концентрация компонентов, рассчитанная с учетом их взаимодействия в растворе. Термин «активность» был предложен в 1907 году американским ученым Льюисом в качестве величины, использование которой поможет сравнительно просто описать свойства реальных растворов.
Инструкция
Существуют разнообразные экспериментальные методы определения активности компонентов раствора. Например, по повышению температуры кипения исследуемого раствора. Если эта температура (обозначьте ее символом T) выше, чем температура кипения чистого растворителя (То), то натуральный логарифм активности растворителя вычисляется по следующей формуле: lnA = (-?H/RT0T) х?T. Где, ?Н – теплота испарения растворителя в температурном интервале между То и Т.
Можете определить активность компонентов раствора по понижению температуры замерзания исследуемого раствора. В этом случае, натуральный логарифм активности растворителя рассчитывается по следующей формуле: lnA = (-?H/RT0T) х?T, где, ?H – теплота замерзания раствора в интервале между температурой замерзания раствора (Т) и температурой замерзания чистого растворителя (То).
Рассчитайте активность с помощью метода изучения равновесия химической реакции с газовой фазой. Предположим, у вас проходит химическая реакция между расплавом оксида какого-нибудь металла (обозначьте его общей формулой МеО) и газом. Например: МеО + Н2 = Ме + Н2О - то есть оксид металла восстанавливается до чистого металла, с образованием воды в виде водяного пара.
В этом случае константа равновесия реакции рассчитывается следующим образом: Кр = (pH2O х Аме) / (рН2 х Амео), где p – парциальное давление паров водорода и воды соответственно, А – активности чистого металла и его оксида соответственно.
Вычислите активность методом вычисления электродвижущей силы гальванического элемента, образованного раствором или расплавом электролита. Этот способ считается одним из самых точных и надежных для определения активности.
Оборачиваемость капитала – это скорость прохождения денежными средствами различных стадий производства и обращения. Чем больше скорость обращения капитала, тем большую прибыль получит организация, что говорит о росте ее деловой активности.

Инструкция
Оборачиваемость активов в оборотах рассчитайте делением размера выручки на среднегодовую стоимость активов.
где А – среднегодовая стоимость активов (всего капитала)-
В – выручка за анализируемый период (год).
Найденный показатель укажет, какое количество оборотов совершают средства, вложенные в имущество организации за анализируемый период. При росте значения данного показателя повышается деловая активность фирмы.
Разделите длительность анализируемого периода на оборачиваемость активов, тем самым вы найдете длительность одного оборота. При анализе следует учесть, что чем меньше значение данного показателя, тем лучше для организации.
Для наглядности используйте таблицы.
Рассчитайте коэффициент закрепления оборотных активов, который равен средней сумме оборотных активов за анализируемый период, деленных на выручку организации.
Данный коэффициент говорит о том, сколько оборотных средств затрачено на 1 рубль реализованной продукции.
Теперь сделайте расчет продолжительности операционного цикла, который равен длительности оборота сырья и материалов, плюс длительность оборота готовой продукции, плюс длительность оборота незавершенного производства, а также длительность оборота дебиторской задолженности.
Данный показатель должен рассчитываться за несколько периодов. Если замечена тенденция к его росту, это говорит об ухудшении состояния деловой активности компании, т.к. при этом замедляется оборачиваемость капитала. Поэтому у компании повышаются потребности в денежных средствах, и она начинает испытывать финансовые затруднения.
Помните, что продолжительность финансового цикла - это продолжительность операционного цикла за минусом длительности оборота кредиторской задолженности.
Чем меньшее значение имеет данный показатель, тем выше деловая активность.
На оборачиваемость капитала влияет и коэффициент устойчивости экономического роста. Этот показатель считается по формуле:
(Чпр-Д)/ Ск
где Чпр - чистая прибыль компании;
Д – дивиденды;
Ск - собственный капитал.
Данный показатель характеризует средний темп роста развития организации. Чем выше его значение, тем лучше, так как это говорит о развитии предприятии, расширении и росте возможностей для повышения его деловой активности в последующих периодах.
Полезный совет
Понятие «активность» тесно связано с понятием «концентрация». Их взаимоотношение описывается формулой: В = А/С, где А – активность, С – концентрация, В – «коэффициент активности».
Любая физическая или умственная активность требует энергии, поэтому расчет дневной нормы калорий в день для женщины или мужчины должен учитывать не только пол, вес, но и образ жизни.
Мы ежедневно тратим энергию на метаболизм (обмен веществ в покое) и на движение (физическая нагрузка). Схематично это выглядит так:
Энергия = Е основного обмена + Е физической нагрузки
Энергия основного обмена, или базовый уровень метаболизма(БРМ) - Basal Metabolic Rate (BMR) – это энергия нужна для жизнедеятельности (метаболизма) организма без физической нагрузки. Базовый уровень метаболизма величина, что зависит от веса, роста и возраста человека. Чем выше человек, и чем больше его вес, тем больше энергии нужно для обмена веществ, тем выше базовый уровень метаболизма. И, наоборот, ниже, худее люди будут иметь более низкий базовый уровень метаболизма.
Для мужчин
= 88,362 + (13,397 * вес, кг) + (4,799 * рост, см) - (5,677 * возраст, годы)
Для женщин
= 447,593 + (9.247 * вес, кг) + (3,098 * рост, см) - (4.330 * возраст, годы)
Например, женщина с весом 70 кг, ростом 170 см, 28 лет, требует для основного обмена веществ (базового метаболизма)
= 447,593 + (9.247 * 70) + (3,098 *170) - (4.330 *28)
=447,593+647,29+526,66–121,24=1500,303 ккал
Еще можно свериться с таблицей: Суточные энергозатраты взрослого населения без физической активности согласно Норм физиологических потребностей населения в основных пищевых веществах и энергии.
Физически неактивный человек тратит 60–70% дневной энергии на основной обмен, а остальные 30–40% на физическую активность.
Как рассчитать общее количество энергии, расходуемой организмом в день
Напомним, что общая энергия – это сумма энергии основного обмена веществ (или базовый уровень метаболизма), и энергии, что идет для движения (физической активности).
Для вычисления общей энергии расходов с учетом физической нагрузки существует Коэффициент физической активности
.
Что такое коэффициент физической активности (КФА)
Коэффициент физической активности (КФА) = Уровень физической активности - Physical Activity Level (PAL) - это соотношение общих энергозатрат при определенном уровне физической активности к величине основного обмена, или, проще, значение общей затраченной энергии разделить на базовый уровень метаболизма.
Чем интенсивнее физическая нагрузка, тем коэффициент физической активности будет выше.
- Люди, которые очень мало двигаются имеют КФА = 1,2. Для них общая энергия, затрачиваемая организмом будет исчисляться: Е=БРМ*1,2
- Люди, которые выполняют легкие упражнения 1–3 дня в неделю, имеют КФА = 1,375. Итак формула: Е=БРМ*1,375
- Люди, выполняющие средней тяжести упражнения, а именно 3–5 дня в неделю, имеют КФА=1,55. Формула для расчета: Е=БРМ*1,55
- Люди, которые выполняют тяжелые упражнения 6–7 дней в неделю, имеют КФА=1,725. Формула для расчета: Е=БРМ*1,725
- Люди, которые выполняют очень тяжелые упражнения дважды в день, или работники с большими физическими нагрузками, имеют КФА=1,9. Соответственно формула для расчета: Е=БРМ*1,9
Итак, чтобы посчитать общее количество энергии потраченной за день, необходимо: величину основного обмена соответственно возрасту и весу (Базовый уровень метаболизма) умножить на коэффициент физической активности согласно группы физической активности (Уровень физической активности).
Что такое энергетический баланс? И когда я похудею?
Энергетический баланс – это разница между энергией, поступившей в организм, и энергией, которую организм потратил.
Равновесие в энергетическом балансе – это, когда энергия, поступившая с пищей в организм, равна энергии затраченной организмом. В такой ситуации вес остается стабильным.
Соответственно положительный энергетический баланс – это когда энергия, поступившая от потребленной пищи больше, чем энергия нужная для жизнедеятельности организма. В состоянии положительного энергетического баланса человек набирает лишние килограммы.
Отрицательный энергетический баланс – это, когда поступило меньше энергии, чем организм потратил. Чтобы похудеть необходимо создать отрицательный энергетический баланс.
Для более точных расчетов на основе закона действия масс вместо равновесных концентраций пользуются активностями.
Эта величина введена для учета взаимного притяжения ионов, взаимодействия растворенного вещества с растворителем и других явлений, изменяющих подвижность ионов и не учитываемых теорией электролитической диссоциации.
Активность для бесконечно разбавленных растворов равна концентрации:
Для реальных растворов вследствие сильного проявления межионных сил активность меньше концентрации.
Активность молено рассматривать как величину, характеризующую степень связанности частиц электролита. Таким образом, активность является эффективной (действующей) концентрацией, проявляющей себя в химических процессах в качестве реально действующей массы в отличие от общей концентрации вещества в растворе.
Коэффициент активности. Численно активность равна концентрации, умноженной на коэффициент , называемый коэффициентом активности.
Коэффициент активности является величиной, отралеающей все имеющиеся в данной системе явления, вызывающие изменения подвижности ионов, и представляет собой отношение активности к концентрации: . При бесконечном разбавлении концентрация и активность становятся равными, а величина коэффициента активности равняется единице.
Для реальных систем коэффициент активности обычно меньше единицы. Активности и коэффициенты активности, отнесенные к бесконечно разбавленным растворам, отмечают индексом и обозначают соответственно .
Уравнение, применяемое к реальным растворам. Если подставить величину активности вместо величины концентрации данного вещества в уравнение, характеризующее равновесие реакции, то активность будет выражать влияние этого вещества на состояние равновесия.
Подстановка величин активности вместо значений концентрации в уравнения, вытекающие из закона действия масс, делает эти уравнения применимыми к реальным растворам.
Так, для реакции получим:
или, если подставить значения :
![]()
В случае применения уравнений, вытекающих из закона действия масс, к растворам сильных электролитов и к концентрированным растворам слабых электролитов или к растворам слабых электролитов в присутствии других электролитов необходимо вместо равновесных концентраций подставлять активности. Например, константа электролитической диссоциации электролита типа выражается уравнением:
![]()
При этом константы электролитической диссоциации, определяемые с помощью активностей, называют истинными или термодинамическими константами электролитической диссоциации.
Значения коэффициентов активностей. Зависимость коэффициента актйвйости от различных факторов сложна и ее определение встречает некоторые трудности, поэтому в ряде случаев (в особенности в случае растворов слабых электролитов), где не требуется большая точность, в аналитической химии ограничиваются применением закона действия масс в его классической форме.
Значения коэффициентов активности некоторых ионов приведены в табл. 1.
ТАБЛИЦА 1. Приближенные значения средних коэффициентов активности f при разной ионной силе раствора