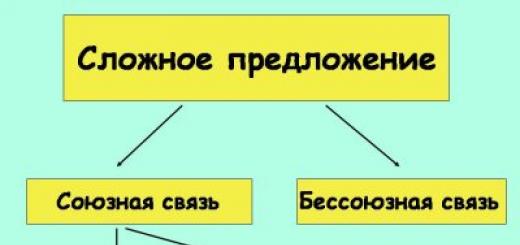
Chemische Eigenschaften von Oxiden: basisch, amphoter, sauer
Oxide sind komplexe Substanzen, bestehend aus zwei chemische Elemente, von denen einer Sauerstoff mit einer Oxidationsstufe ($-2$) ist.
Die allgemeine Formel für Oxide ist $E_(m)O_n$, wobei $m$ die Anzahl der Atome des Elements $E$ und $n$ die Anzahl der Sauerstoffatome ist. Oxide können sein fest(Sand $SiO_2$, Quarzsorten), Flüssigkeit(Wasserstoffoxid $H_2O$), gasförmig(Kohlenoxide: Kohlendioxid $CO_2$ und Kohlenmonoxid $CO$ Gase). Durch chemische Eigenschaften Oxide werden in salzbildende und nicht salzbildende Oxide eingeteilt.
Nicht salzbildend solche Oxide werden genannt, die weder mit Laugen noch mit Säuren interagieren und keine Salze bilden. Es gibt wenige von ihnen, sie beinhalten Nichtmetalle.
Salzbildend Als Oxide werden solche bezeichnet, die mit Säuren oder Basen reagieren und Salz und Wasser bilden.
Unter den salzbildenden Oxiden werden Oxide unterschieden basisch, sauer, amphoter.
Basische Oxide sind Oxide, die Basen entsprechen. Beispiel: $CaO$ entspricht $Ca(OH)_2, Na_2O entspricht NaOH$.
Typische Reaktionen basischer Oxide:
1. Basisches Oxid + Säure → Salz + Wasser (Austauschreaktion):
$CaO+2HNO_3=Ca(NO_3)_2+H_2O$.
2. Basisches Oxid + Säureoxid→ Salz (zusammengesetzte Reaktion):
$MgO+SiO_2(→)↖(t)MgSiO_3$.
3. Basisches Oxid + Wasser → Alkali (Verbindungsreaktion):
$K_2O+H_2O=2KOH$.
Säureoxide sind Oxide, die Säuren entsprechen. Dies sind Nichtmetalloxide:
N2O5 entspricht $HNO_3, SO_3 - H_2SO_4, CO_2 - H_2CO_3, P_2O_5 - H_3PO_4$, sowie Metalloxide mit hohen Oxidationsstufen: $(Cr)↖(+6)O_3$ entspricht $H_2CrO_4, (Mn_2)↖( +7 )O_7 - HMnO_4$.
Typische Reaktionen saurer Oxide:
1. Säureoxid + Base → Salz + Wasser (Austauschreaktion):
$SO_2+2NaOH=Na_2SO_3+H_2O$.
2. Saures Oxid + basisches Oxid → Salz (Verbindungsreaktion):
$CaO+CO_2=CaCO_3$.
3. Säureoxid + Wasser → Säure (Verbindungsreaktion):
$N_2O_5+H_2O=2HNO_3$.
Eine solche Reaktion ist nur möglich, wenn das Säureoxid wasserlöslich ist.
amphoter werden Oxide genannt, die je nach Bedingungen basische oder saure Eigenschaften. Dies sind $ZnO, Al_2O_3, Cr_2O_3, V_2O_5$. Amphotere Oxide verbinden sich nicht direkt mit Wasser.
Typische Reaktionen amphoterer Oxide:
1. Amphoteres Oxid + Säure → Salz + Wasser (Austauschreaktion):
$ZnO+2HCl=ZnCl_2+H_2O$.
2. Amphoteres Oxid + Base → Salz + Wasser oder Komplexverbindung:
$Al_2O_3+2NaOH+3H_2O(=2Na,)↙(\text"Natriumtetrahydroxoaluminat")$
$Al_2O_3+2NaOH=(2NaAlO_2)↙(\text"Natriumaluminat")+H_2O$.
Chemisch kann der pH-Wert einer Lösung mit Hilfe von Säure-Base-Indikatoren bestimmt werden.
Säure-Base-Indikatoren - organische Materie, dessen Farbe vom Säuregehalt des Mediums abhängt.
Die häufigsten Indikatoren sind Lackmus, Methylorange, Phenolphthalein. Lackmus wird in einer sauren Umgebung rot und in einer alkalischen Umgebung blau. Phenolphthalein ist in saurem Medium farblos, wird aber in alkalischem Medium purpurrot. Methylorange wird im sauren Milieu rot und im alkalischen Milieu gelb.
In der Laborpraxis werden oft mehrere Indikatoren gemischt, die so ausgewählt sind, dass die Farbe der Mischung über einen weiten Bereich von pH-Werten variiert. Mit ihrer Hilfe können Sie den pH-Wert der Lösung mit einer Genauigkeit von bis zu eins bestimmen. Diese Mischungen werden genannt universelle Indikatoren.
Es gibt spezielle Geräte - pH-Meter, mit denen Sie den pH-Wert von Lösungen im Bereich von 0 bis 14 mit einer Genauigkeit von 0,01 pH-Einheiten bestimmen können.
Salzhydrolyse
Wenn einige Salze in Wasser gelöst werden, wird das Gleichgewicht des Wasserdissoziationsprozesses gestört und dementsprechend ändert sich der pH-Wert des Mediums. Das liegt daran, dass Salze mit Wasser reagieren.
Salzhydrolyse – chemische Austauschwechselwirkung gelöster Salzionen mit Wasser, die zur Bildung schwach dissoziierender Produkte (Moleküle schwacher Säuren oder Basen, Anionen saurer Salze oder Kationen basischer Salze) führt und von einer Änderung des pH-Werts des Mediums begleitet wird.
Betrachten Sie den Prozess der Hydrolyse, abhängig von der Art der Basen und Säuren, die das Salz bilden.
Salze, die durch starke Säuren und starke Basen gebildet werden (NaCl, kno3, Na2so4 usw.).
Sagen wir dass bei der Reaktion von Natriumchlorid mit Wasser eine Hydrolysereaktion unter Bildung einer Säure und einer Base auftritt:
NaCl + H 2 O ↔ NaOH + HCl
Für ein korrektes Verständnis der Natur dieser Wechselwirkung schreiben wir die Reaktionsgleichung in ionischer Form, wobei wir berücksichtigen, dass die einzige schwach dissoziierende Verbindung in diesem System Wasser ist:
Na + + Cl – + HOH ↔ Na + + OH – + H + + Cl –
Bei der Reduktion identischer Ionen bleibt die Wasserdissoziationsgleichung auf der linken und rechten Seite der Gleichung:
H 2 O ↔ H + + OH -
Wie zu sehen ist, gibt es keine überschüssigen H + - oder OH – -Ionen in der Lösung im Vergleich zu ihrem Gehalt in Wasser. Außerdem werden keine anderen schwach dissoziierenden oder schwerlöslichen Verbindungen gebildet. Daher schließen wir das Salze, die durch starke Säuren und Basen gebildet werden, unterliegen keiner Hydrolyse, und die Reaktion von Lösungen dieser Salze ist die gleiche wie in Wasser, neutral (pH = 7).
Bei der Erstellung von Ionenmolekulargleichungen für Hydrolysereaktionen ist Folgendes erforderlich:
1) Schreiben Sie die Salzdissoziationsgleichung auf;
2) Bestimmen Sie die Natur des Kations und Anions (finden Sie das Kation einer schwachen Base oder das Anion einer schwachen Säure);
3) Schreiben Sie die Ionen-Molekül-Gleichung der Reaktion auf, vorausgesetzt, dass Wasser ein schwacher Elektrolyt ist und dass die Summe der Ladungen in beiden Teilen der Gleichung gleich sein muss.
Salze aus einer schwachen Säure und einer starken Base
(N / A 2 CO 3 , k 2 S, CH 3 COONa und Andere .)
Betrachten Sie die Hydrolysereaktion von Natriumacetat. Dieses Salz zerfällt in Lösung in Ionen: CH 3 COONa ↔ CH 3 COO – + Na + ;
Na + ist ein Kation einer starken Base, CH 3 COO – ist ein Anion einer schwachen Säure.
Na + -Kationen können keine Wasserionen binden, da NaOH, eine starke Base, vollständig in Ionen zerfällt. Anionen der schwachen Essigsäure CH 3 COO - binden Wasserstoffionen zu leicht dissoziierter Essigsäure:
CH 3 COO – + HOH ↔ CH 3 COOH + OH –
Es ist ersichtlich, dass sich infolge der Hydrolyse von CH 3 COONa ein Überschuss an Hydroxidionen in der Lösung bildete und die Reaktion des Mediums alkalisch wurde (рН > 7).
Daraus lässt sich also schließen Salze, die von einer schwachen Säure und einer starken Base gebildet werden, werden am Anion hydrolysiert ( Ein n - ). In diesem Fall binden Salzanionen H-Ionen + , und OH-Ionen reichern sich in der Lösung an - , die ein alkalisches Milieu (pH > 7) verursacht:
An n - + HOH ↔ Han (n -1) - + OH -, (bei n = 1 wird HAn gebildet - eine schwache Säure).
Die Hydrolyse von Salzen, die durch zweibasige und dreibasige schwache Säuren und starke Basen gebildet werden, verläuft schrittweise
Betrachten Sie die Hydrolyse von Kaliumsulfid. K 2 S dissoziiert in Lösung:
K 2 S ↔ 2K + + S 2–;
K + ist ein Kation einer starken Base, S 2 ist ein Anion einer schwachen Säure.
Kaliumkationen nehmen an der Hydrolysereaktion nicht teil, nur Anionen der schwachen Schwefelwasserstoffsäure interagieren mit Wasser. Bei dieser Reaktion werden in der ersten Stufe schwach dissoziierende HS - -Ionen und in der zweiten Stufe schwach saures H 2 S gebildet:
1. Stufe: S 2– + HOH ↔ HS – + OH –;
2. Stufe: HS – + HOH ↔ H 2 S + OH –.
Die in der ersten Stufe der Hydrolyse gebildeten OH-Ionen verringern die Wahrscheinlichkeit einer Hydrolyse in der nächsten Stufe erheblich. Ergebend praktischer Wert hat normalerweise einen Prozess, der nur auf der ersten Stufe geht, die in der Regel bei der Bewertung der Hydrolyse von Salzen unter normalen Bedingungen begrenzt ist.
In Aufgabe 18 der OGE in Chemie demonstrieren wir Kenntnisse zu Indikatoren und pH sowie qualitative Reaktionen auf Ionen in Lösung.
Theorie zur Aufgabe Nr. 18 OGE in Chemie
Indikatoren
Indikator - Chemische Substanz die je nach pH-Wert des Mediums ihre Farbe ändert.
Die bekanntesten Indikatoren sind Phenolphthalein, Methylorange, Lackmus und der Universalindikator. Ihre Farben in Abhängigkeit von der Umgebung im Bild unten:
Und hier sind die Farben der Indikatoren detaillierter mit Beispielen aus dem Leben:

Wir haben die Indikatoren herausgefunden, gehen wir zu qualitativen Reaktionen auf Ionen über.
Qualitative Reaktionen auf Ionen
Qualitative Reaktionen in Kationen und Anionen sind in der folgenden Tabelle aufgeführt.

Wie bewältige ich Aufgabe 18 im OGE-Test in Chemie?
Dazu müssen Sie eine qualitative Reaktion auf eine der angebotenen Optionen auswählen und sicherstellen, dass dieses Reagenz nicht mit der zweiten Substanz reagiert.
Analyse typischer Optionen für die Aufgabe Nr. 18 OGE in Chemie
Die erste Version der Aufgabe
Ordnen Sie die beiden Substanzen einem Reagenz zu, das zur Unterscheidung dieser Substanzen verwendet werden kann.
Substanzen:
A) Na2CO3 und Na2SiO3
B) K2CO3 und Li2CO3
C) Na2SO4 und NaOH
Reagens:
1) CuCl2
4) K3PO4
Betrachten wir jeden Fall.
Na2CO3 und Na2SiO3
- mit Kupferchlorid läuft die Reaktion in beiden Fällen nicht ab, da sich Carbonat und Kupfersilikat in wässriger Lösung zersetzen
- Mit Salzsäure Bei Natriumcarbonat wird Gas freigesetzt und bei Silikat bildet sich ein Niederschlag - das ist qualitative Reaktion auf Silikate
- bei Phosphat gibt es auch keine qualitativen Reaktionen auf Natrium
K2CO3 und Li2CO3
- diese Substanzen reagieren nicht mit Kupferchlorid (tatsächlich fällt Kupferhydroxid aus, aber zwei Reagenzien können durch diese Reaktion nicht unterschieden werden)
- beide reagieren mit Salzsäure unter Freisetzung von Kohlendioxid
- diese Substanzen reagieren nicht mit Magnesiumoxid, und Magnesiumoxid geht keine Ionenaustauschreaktionen ein
- mit Phosphat Lithium fällt in Form von Phosphat aus aber kein kalium
Wir haben noch die letzte Option - das ist Kupferchlorid. Tatsächlich fällt Kupferhydroxid mit Natriumhydroxid aus, aber es findet keine Reaktion mit Sulfat statt.
Eine Lektion, die mit einem Notizbuch für die praktische Arbeit von I. I. Novoshinsky, N. S. Novoshinskaya zum Lehrbuch Chemie Klasse 8 in der MOU "Secondary School No. 11" in Severodvinsk, Region Archangelsk, von einem Chemielehrer O. A. Olkina in Klasse 8 (parallel ).
Der Zweck des Unterrichts: Bildung, Festigung und Kontrolle der Fähigkeiten der Schüler, die Reaktion der Umgebung von Lösungen anhand verschiedener Indikatoren, einschließlich natürlicher, zu bestimmen, wobei ein Notizbuch für die praktische Arbeit von I. I. Novoshinsky, N. S. Novoshinskaya zum Lehrbuch Chemie Klasse 8 verwendet wird .
Unterrichtsziele:
- Lehrreich. Festlegen der folgenden Konzepte Indikatoren, Reaktion der Umgebung (Typen), pH-Wert, Filtrat, Filterung basierend auf der Ausführung von Aufgaben praktische Arbeit. Verifizieren das Wissen der Schüler, die die Abhängigkeit „Lösung eines Stoffes (Formel) – pH-Wert ( numerischer Wert) ist die Reaktion des Mediums“. Informieren Sie die Schüler über Möglichkeiten, den Säuregehalt der Böden in der Region Archangelsk zu reduzieren.
- Entwicklung. Förderung der Entwicklung des logischen Denkens der Studierenden auf der Grundlage der Analyse der im Rahmen der praktischen Arbeit erzielten Ergebnisse, ihrer Verallgemeinerung sowie der Fähigkeit, Schlussfolgerungen zu ziehen. Bestätigen Sie die Regel: Die Praxis beweist die Theorie oder widerlegt sie. Die ästhetischen Qualitäten der Persönlichkeit der Studierenden auf der Grundlage vielfältiger Lösungsvorschläge weiterzuentwickeln sowie das Interesse der Kinder am Studienfach „Chemie“ zu fördern.
- Pflegend. Entwickeln Sie die Fähigkeiten der Schüler weiter, um praktische Arbeitsaufgaben auszuführen und dabei die Arbeitsschutz- und Sicherheitsvorschriften einzuhalten, einschließlich der korrekten Durchführung von Filter- und Heizprozessen.
Praktikum Nr. 6 „Bestimmung des pH-Wertes des Mediums“.
Zweck für Schüler: Lernen, die Reaktion der Umgebung von Lösungen verschiedener Objekte (Säuren, Laugen, Salze, Bodenlösung, einige Lösungen und Säfte) zu bestimmen sowie Pflanzenobjekte als natürliche Indikatoren zu untersuchen.
Ausstattung und Reagenzien: Reagenzglasgestell, Stöpsel, Glasstab, Ringgestell, Filterpapier, Schere, Chemietrichter, Becherglas, Mörser und Stößel aus Porzellan, feine Reibe, sauberer Sand, Universalindikatorpapier, Testlösung, Erde, Gekochtes Wasser, Früchte, Beeren und anderes Pflanzenmaterial, eine Lösung aus Natriumhydroxid und Schwefelsäure, Natriumchlorid.
Während des Unterrichts
Leute! Wir haben bereits Konzepte wie die Reaktion des Mediums wässriger Lösungen sowie Indikatoren kennengelernt.
Welche Arten von Reaktionen im Umfeld wässriger Lösungen kennen Sie?
- neutral, alkalisch und sauer.
Was sind Indikatoren?
- Substanzen, mit denen Sie die Reaktion der Umgebung bestimmen können.
Welche Indikatoren kennen Sie?
- in Lösungen: Phenolphthalein, Lackmus, Methylorange.
- trocken: Universalindikatorpapier, Lackmuspapier, Methylorangenpapier
Wie kann die Reaktion einer wässrigen Lösung bestimmt werden?
- nass und trocken.
Welchen pH-Wert hat die Umgebung?
- pH-Wert von Wasserstoffionen in Lösung (pH=– lg )
Erinnern wir uns, welcher Wissenschaftler das Konzept des pH-Werts der Umwelt eingeführt hat?
- Der dänische Chemiker Sorensen.
Gut erledigt!!! Öffnen Sie nun das Heft für die praktische Arbeit auf Seite 21 und lesen Sie Aufgabe Nummer 1.
Aufgabe Nummer 1. Bestimmen Sie den pH-Wert der Lösung mit einem Universalindikator.
Denken wir an die Regeln beim Arbeiten mit Säuren und Laugen!
Schließe das Experiment ab Aufgabe 1 ab.
Machen Sie eine Schlussfolgerung. Wenn die Lösung also pH = 7 hat, ist das Medium bei pH neutral< 7 среда кислотная, при pH >7 alkalische Umgebung.
Aufgabe Nummer 2. Holen Sie sich die Bodenlösung und bestimmen Sie ihren pH-Wert mit einem Universalindikator.
Lesen Sie die Aufgabe auf Seite 21-22, erledigen Sie die Aufgabe gemäß dem Plan, tragen Sie die Ergebnisse in die Tabelle ein.
Erinnern Sie sich an die Sicherheitsregeln beim Arbeiten mit Heizgeräten (Alkohol).
Was ist Filtern?
- Gemischtrennverfahren, das auf unterschiedlichen basiert Bandbreite poröses Material - das Filtrat in Bezug auf die Partikel, aus denen die Mischung besteht.
Was ist ein Filtrat?
- es ist eine klare Lösung, die nach Filtration erhalten wird.
Präsentieren Sie die Ergebnisse in Form einer Tabelle.
Wie ist die Reaktion des Bodenlösungsmediums?
- Sauer
Was muss getan werden, um die Bodenqualität in unserer Region zu verbessern?
- CaCO 3 + H 2 O + CO 2 \u003d Ca (HCO 3) 2
Anwendung von Düngemitteln, die eine alkalische Reaktion der Umgebung haben: gemahlener Kalkstein und andere Karbonatmineralien: Kreide, Dolomit. Im Pinezhsky-Distrikt der Region Archangelsk gibt es Vorkommen eines solchen Minerals wie Kalkstein in der Nähe von Karsthöhlen, so dass es verfügbar ist.
Machen Sie eine Schlussfolgerung. Die Reaktion der Umgebung auf die resultierende Bodenlösung pH = 4 ist leicht sauer, daher ist eine Kalkung erforderlich, um die Bodenqualität zu verbessern.
Aufgabe Nummer 3. Bestimmen Sie den pH-Wert einiger Lösungen und Säfte mit einem Universalindikator.
Lesen Sie die Aufgabe auf Seite 22, lösen Sie die Aufgabe gemäß dem Algorithmus, tragen Sie die Ergebnisse in die Tabelle ein.
Saft Quelle |
Saft Quelle |
||
Kartoffel |
Silikatkleber |
||
frischer Kohl |
Tafelessig |
||
Sauerkraut |
Sodalösung trinken |
||
Orange |
|||
Frische Rüben |
|||
Gekochte Rüben |
Machen Sie eine Schlussfolgerung. So haben verschiedene natürliche Objekte unterschiedliche Bedeutungen pH: pH 1?7 - saures Milieu (Zitrone, Preiselbeere, Orange, Tomate, Rübe, Kiwi, Apfel, Banane, Tee, Kartoffel, Sauerkraut, Kaffee, Silikatkleber).
pH 7-14 alkalische Umgebung (frischer Kohl, Natronlösung).
pH = 7 neutrales Medium (Kaki, Gurke, Milch).
Aufgabe Nummer 4. Studieren Sie Gemüseindikatoren.
Welche Pflanzenobjekte können als Indikatoren dienen?
- Beeren: Säfte, Blütenblätter: Extrakte, Gemüsesäfte: Hackfrüchte, Blätter.
- Substanzen, die die Farbe der Lösung in verschiedenen Umgebungen verändern können.
Lesen Sie die Aufgabe auf Seite 23 und lösen Sie sie gemäß dem Plan.
Trage die Ergebnisse in eine Tabelle ein.
Pflanzenmaterial (natürliche Indikatoren) |
Mörtelfarbe natürlicher Indikator |
||
Saure Umgebung |
Natürliche Farbe der Lösung (neutrales Medium) |
Alkalische Umgebung |
|
Cranberrysaft) |
violett |
||
Erdbeeren (Saft) |
Orange |
pfirsichrosa |
|
Heidelbeeren (Saft) |
rot-violett |
Blau Lila |
|
Schwarzer Johannisbeersaft) |
rot-violett |
Blau Lila |
|
Machen Sie eine Schlussfolgerung. Abhängig vom pH-Wert der Umgebung erhalten natürliche Indikatoren: Preiselbeeren (Saft), Erdbeeren (Saft), Blaubeeren (Saft), schwarze Johannisbeeren (Saft) die folgenden Farben: in einer sauren Umgebung - rot und orange Farbe, in neutral - rot, pfirsich - pink und lila, in einer alkalischen Umgebung von rosa über blau - violett bis violett.
Folglich kann die Farbintensität des natürlichen Indikators durch die Reaktion des Mediums einer bestimmten Lösung beurteilt werden.
Räumen Sie Ihren Arbeitsplatz auf, wenn Sie fertig sind.
Leute! Heute war eine sehr ungewöhnliche Stunde! Mochtest du?! Können die in dieser Lektion erlernten Informationen im Alltag verwendet werden?
Erledigen Sie nun die Aufgabe, die in Ihren Übungsheften angegeben ist.
Aufgabe zur Kontrolle. Verteilen Sie die Substanzen mit den unten angegebenen Formeln in Abhängigkeit vom pH-Wert ihrer Lösungen in Gruppen: HCl, H 2 O, H 2 SO 4, Ca (OH) 2, NaCl, NaOH, KNO 3, H 3 PO 4, KOH.
pH 17 - mittel (sauer), haben Lösungen (HCl, H 3 PO 4, H 2 SO 4).
pH 714 mittel (alkalisch), haben Lösungen (Ca(OH) 2 , KOH, NaOH).
pH = 7 mittel (neutral), haben Lösungen (NaCl, H 2 O, KNO 3).
Bewertung für die Arbeit __________
Je nachdem, welche H + - oder OH - -Ionen in einer wässrigen Lösung im Überschuss vorhanden sind, werden folgende Arten (Charakteristika) von Lösungsmedien unterschieden:
1) sauer
2) alkalisch
3) neutral
Bei saure Natur der Umgebung die Lösung enthält einen Überschuss an Wasserstoffkationen H + , und die Konzentration an Hydroxidionen ist nahe Null.
Bei alkalische Umgebung In der Lösung befindet sich ein Überschuss an Hydroxidionen OH - und die Konzentration an H + -Kationen liegt nahe bei Null.
Bei neutrale Umgebung Lösung sind die Konzentrationen an H + - und OH-Ionen gleich und praktisch gleich Null (0,0000001 mol / l).
Es gibt einige organische Substanzen, deren Farbe sich je nach Art des Mediums ändert. Dieses Phänomen ist Breite Anwendung in Chemie. Einige der häufigsten Indikatoren sind Lackmus, Phenolphthalein und Methylorange (Methylorange). Welche Farbe diese Substanzen je nach Art des Mediums haben, ist in der folgenden Tabelle dargestellt:
Indikatorfarbe |
|||
Indikator |
in einer neutralen Umgebung |
in einer sauren Umgebung |
in einer alkalischen Umgebung |
| Lackmus | violett | rot
|
blau
|
| Phenolphthalein | farblos | farblos | Purpur
|
| Orangenschnaps (Orangenschnaps) |
Orange
|
rosa
|
gelb
|
Wie Sie sehen, ist eine spezifische Eigenschaft von Phenolphthalein, dass dieser Indikator keine Unterscheidung zwischen neutralen und sauren Umgebungen ermöglicht – in beiden Umgebungen ist er in keiner Weise gefärbt. Diese Eigenschaft ist zweifellos ein Nachteil, jedoch wird Phenolphthalein aufgrund seiner außergewöhnlichen Empfindlichkeit gegenüber sogar einem leichten Überschuss an OH – -Ionen weit verbreitet verwendet.
Offensichtlich können mit Hilfe von Indikatoren Säuren, Laugen und destilliertes Wasser voneinander unterschieden werden. Es ist jedoch zu bedenken, dass saure, alkalische und neutrale Medien nicht nur in Lösungen von Säuren, Laugen und destilliertem Wasser zu beobachten sind. Die Lösungsumgebung kann auch in Salzlösungen unterschiedlich sein, abhängig von ihrem Verhältnis zur Hydrolyse.
So kann beispielsweise eine Lösung von Natriumsulfit von einer Lösung von Natriumsulfat unter Verwendung von Phenolphthalein unterschieden werden. Natriumsulfit ist ein Salz, das aus einer starken Base und einer schwachen Säure gebildet wird, also werden seine Lösungen haben alkalische Reaktion Umgebung. Phenolphthalein wird in seiner Lösung purpurrot. Natriumsulfat hingegen wird aus einer starken Base und einer starken Säure gebildet, d.h. unterliegt keiner Hydrolyse und wässrige Lösungen wird eine neutrale Reaktionsumgebung haben. Bei Natriumsulfatlösung bleibt Phenolphthalein farblos.