Alkane- gesättigte (gesättigte) Kohlenwasserstoffe. Ein Vertreter dieser Klasse ist Methan ( CH 4). Alles nachfolgend gesättigte Kohlenwasserstoffe unterscheiden sich um CH 2- eine Gruppe, die als homologe Gruppe bezeichnet wird, und Verbindungen werden als Homologe bezeichnet.
Allgemeine Formel - MITNH 2 N +2 .
Struktur von Alkanen.
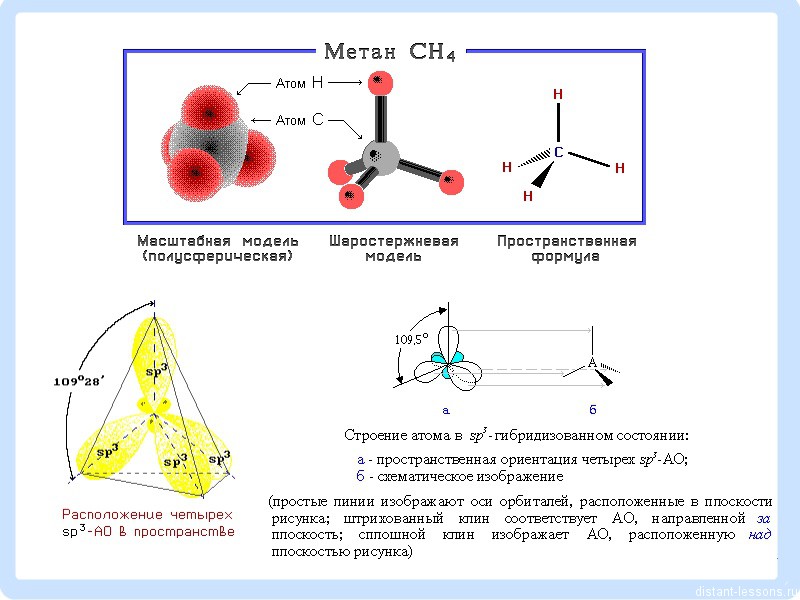
Jedes Kohlenstoffatom ist drin S. 3- Hybridisierung, Formen 4 σ - Kommunikation (1 S-S und 3 S-N). Die Form des Moleküls hat die Form eines Tetraeders mit einem Winkel von 109,5°.
Die Bindung entsteht durch die Überlappung von Hybridorbitalen, wobei die maximale Überlappungsfläche im Raum auf der Verbindungsgeraden der Atomkerne liegt. Dies ist die effizienteste Überlappung, daher gilt die σ-Bindung als die stärkste.
Isomerie von Alkanen.
Für Alkane Charakteristisch ist die Isomerie des Kohlenstoffgerüsts. Grenzverbindungen können unterschiedlich dauern geometrische Formen, während der Winkel zwischen den Bindungen beibehalten wird. Zum Beispiel,

Die verschiedenen Positionen der Kohlenstoffkette werden als Konformationen bezeichnet. Unter normalen Bedingungen wandeln sich die Konformationen von Alkanen durch Rotation frei ineinander um C-C-Verbindungen, weshalb sie oft als Rotationsisomere bezeichnet werden. Es gibt zwei Hauptkonformationen – „gehemmt“ und „verfinstert“:

Isomerie des Kohlenstoffgerüsts von Alkanen.
Die Anzahl der Isomere nimmt mit zunehmendem Wachstum der Kohlenstoffkette zu. Butan hat beispielsweise zwei Isomere:

Für Pentan - 3, für Heptan - 9 usw.
Wenn ein Molekül Alkan Wenn man ein Proton (Wasserstoffatom) abzieht, erhält man ein Radikal:
Physikalische Eigenschaften von Alkanen.
Unter normalen Bedingungen - C 1 -C 4- Gase , Von 5 bis Von 17- Flüssigkeiten und Kohlenwasserstoffe mit mehr als 18 Kohlenstoffatomen - Feststoffe.
Wenn die Kette wächst, erhöhen sich die Siede- und Schmelzpunkte. Verzweigte Alkane haben mehr niedrige Temperaturen kochender als normal.
Alkane unlöslich in Wasser, aber löslich in unpolaren organischen Lösungsmitteln. Leicht miteinander vermischen.
Herstellung von Alkanen.
Synthesemethoden zur Herstellung von Alkanen:
1. Aus ungesättigten Kohlenwasserstoffen – die „Hydrierungs“-Reaktion findet unter dem Einfluss eines Katalysators (Nickel, Platin) und bei einer Temperatur statt:

2. Aus Halogenderivaten - Wurtz-Reaktion: die Wechselwirkung von Monohalogenalkanen mit Natriummetall, was zu Alkanen mit der doppelten Anzahl an Kohlenstoffatomen in der Kette führt:
3. Aus Salzen von Carbonsäuren. Wenn ein Salz mit einem Alkali reagiert, entstehen Alkane, die im Vergleich zur ursprünglichen Carbonsäure ein Kohlenstoffatom weniger enthalten:
4. Produktion von Methan. In einem Lichtbogen in einer Wasserstoffatmosphäre:
C + 2H 2 = CH 4.
Im Labor wird Methan wie folgt gewonnen:
Al 4 C 3 + 12H 2 O = 3CH 4 + 4Al(OH) 3.
Chemische Eigenschaften von Alkanen.
Unter normalen Bedingungen sind Alkane chemisch inerte Verbindungen; sie reagieren nicht mit konzentrierter Schwefel- und Salpetersäure, mit konzentriertem Alkali oder mit Kaliumpermanganat.
Stabilität wird durch die Stärke der Bindungen und ihre Unpolarität erklärt.
Verbindungen neigen nicht zu Bindungsbruchreaktionen (Additionsreaktionen); sie sind durch Substitution gekennzeichnet.
1. Halogenierung von Alkanen. Unter dem Einfluss eines Lichtquants beginnt die radikalische Substitution (Chlorierung) des Alkans. Allgemeines Schema:
Die Reaktion folgt einem Kettenmechanismus, bei dem es Folgendes gibt:
A) Einleitung der Schaltung:

B) Kettenwachstum:

B) Offener Stromkreis:
Insgesamt kann es wie folgt dargestellt werden:

2. Nitrierung (Konovalov-Reaktion) von Alkanen. Die Reaktion findet bei 140 °C statt:
Die Reaktion verläuft am einfachsten mit dem tertiären Kohlenstoffatom als mit dem primären und sekundären.
3. Isomerisierung von Alkanen. Unter bestimmten Bedingungen können sich Alkane normaler Struktur in verzweigte umwandeln:

4. Cracken von Alkanen. Unter der Einwirkung hoher Temperaturen und Katalysatoren können höhere Alkane ihre Bindungen aufbrechen und Alkene und niedere Alkane bilden:

5. Oxidation von Alkanen. IN unterschiedliche Bedingungen und mit verschiedenen Katalysatoren kann die Oxidation eines Alkans zur Bildung von Alkohol, Aldehyd (Keton) und Essigsäure führen. Unter Bedingungen vollständiger Oxidation läuft die Reaktion vollständig ab – bis Wasser entsteht und Kohlendioxid:

Anwendung von Alkanen.
Alkane gefunden Breite Anwendung in der Industrie, bei der Synthese von Öl, Kraftstoff usw.
Organische Chemie ist die Chemie des Kohlenstoffs, dessen Wertigkeit 4 ist. Das heißt, jedes Kohlenstoffatom bildet 4 Bindungen (Sigma-Bindungen). Das könnte eine Verbindung sein - C - C - , könnte es sein -C-H-Bindung. Es wird eine Einfachbindung betrachtet reich, d.h. maximale Überlappung der Elektronendichte zwischen Atomen wird erreicht.
Gesättigte Kohlenwasserstoffe gehören zur Klasse der Alkane(Kohlenwasserstoffe mit gesättigten Bindungen)
Sigma-Bindung (σ-)
Kohlenstoffatome befinden sich in einem Zustand Sp³-Hybridisierung:
Diese. Klassenstoffe Alkane(Paraffine – alter Name) – aliphatische (nichtzyklische) gesättigte Kohlenwasserstoffe, in denen Kohlenstoffatome durch einfache (einfache, gesättigte) Bindungen in geraden oder verzweigten Ketten miteinander verbunden sind. Winkel dazwischen C-C-Verbindungen beläuft sich auf 109°28′, daher Moleküle normaler Alkane mit eine große Anzahl Kohlenstoffatome haben eine Zickzackstruktur
Allgemeine Formel von Alkanen: C n H 2n+2, Wo N = Anzahl der Kohlenstoffatome.
Nomenklatur der Stoffe der Klasse der Alkane ist zweiteilig aufgebaut.
Der erste Teil „spricht“ über die Anzahl der Kohlenstoffatome, der zweite über die -C-C-Bindung. Bei Alkanen ist der zweite Teil immer -ein, und Sie müssen den ersten Teil lernen:
Physikalische Eigenschaften von Alkanen:
C1-C4 – gasförmige Stoffe;
C5-C17 – Flüssigkeiten;
C18-... - Feststoffe.
Chemische Eigenschaften
Alkane sind chemisch recht stabil. Zwischen den Atomen besteht eine gesättigte Bindung, daher sind Stoffe der Klasse der Alkane nur sehr schwach aktiv.
Das Maximum, das sie tun können, ist:
Substitutionsreaktionen: Die Reaktion läuft im Licht nach einem radikalischen Mechanismus ab:
C2H6 + Cl2 = C2H5Cl + HCl, eine solche Substitution kann bis zum vollständigen Ersatz der Wasserstoffatome durch Chloratome erfolgen: C2Cl6.
Die Wurtz-Reaktion ist eine „benannte“ Kettenverlängerungsreaktion:
C2H5Cl + 2Na +ClC2H5 → C4H10 + 2NaCl (Butan wurde aus Ethan gewonnen)
Konovalov-Reaktion: mit verdünnter Salpetersäure unter Druck
С2H6 + HNO3 (HO-NO2) → С2H5NO2 + H2O
Zersetzungsreaktionen (Cracken): lange Stoffe der Klasse Alkane zerfallen in Alkan (kürzer) und Alken:
CH 3 -CH 2 -CH 3 (Propan) - 400°C > CH 4 (Methan) + CH 2 =CH 2 (Ethylen)
Oxidation von Alkanen (Verbrennung): wie alle organische Substanz, Alkane verbrennen zu Kohlendioxid und Wasser:
2C2H6 + 7O2 = 4CO2 + 6H2O
Herstellung von Stoffen der Klasse der Alkane:
Aus anorganische Stoffe:
Hydrolyse von Aluminiumcarbid:
Al4C3 + 12H2O = 4Al(OH)3 +3CH4 (Methan)
C+2H2 = CH4 (bei Bluthochdruck und Temperatur)
Hydrierung von Alkenen:
C2H4 + H2 = C2H6 (Ethan)
Eine weitere „nominelle“ Reaktion: Kolbe-Reaktion: Elektrolyse von Carbonsäuresalzen:
2СH3COONa -(Elektrolyse)-→ СH3-CH3 (Ethan) + 2СO2 +2Na
Salzreaktion Carbonsäuren mit ähnlichen Alkalien:
C2H 5 COONa + NaOH – t° > C2H6 + Na 2 CO 3
Alkantest
1. Propan und 3,3-Dimethylhexan haben eine allgemeine Formel:
CnH2n
СnH2n+2
СnH2n-2
СnH2n-4
2. Hat keine Isomere:
Pentan
Butan
Hexan
Propan
3. Wählen Sie die Eigenschaften von Alkanen aus:
oxidieren, mit Wasser reagieren, Bromwasser verfärben
reagieren mit Halogenen, Halogenwasserstoffen und oxidierenden Säuren
reagieren mit Chlor im Licht, mit Salpetersäure unter Druck unter Spaltung
leicht Substitutionsreaktionen eingehen
4. Beim Verbrennen von Alkanen entstehen:
CO2 und H2O
Alkane mit weniger Kohlenstoffatomen
Alkene– das sind Kohlenwasserstoffe, deren Moleküle EINE Doppel-C=C-Bindung haben.
Allgemeine Formel von Alkenen:
CnH2n
Art der Hybridisierung des Kohlenstoffatoms einer Doppelbindung – sp 2 . Die übrigen Kohlenstoffatome im Alkenmolekül haben sp 3 - Hybridisierung.
Das Molekül hat eine flache Struktur, der Winkel zwischen σ-Bindungen beträgt 120 0
Die Länge einer Doppelbindung ist kürzer als die Länge einer Einfachbindung.
Alken-Nomenklatur: Im Namen erscheint ein Suffix -DE.
Erstes Mitglied Homologe serie– C 2 H 4 (Ethen).
Für die einfachsten Alkene werden auch historische Namen verwendet:
Ethylen (Ethen),
Propylen (Propen),
Die folgenden einwertigen Alkenreste werden häufig in der Nomenklatur verwendet:
CH 2 -CH=CH 2
Arten der Isomerie von Alkenen:
1. Isomerie des Kohlenstoffgerüsts:(ausgehend von C 4 H 8 – Buten und 2-Methylpropen)
2. Isomerie der Mehrfachbindungsposition:(ausgehend von C 4 H 8): Buten-1 und Buten-2.
3. Interklassenisomerie: Mit Cycloalkane(beginnend mit Propen):
C 4 H 8 – Buten und Cyclobutan.
4. Raumisomerie von Alkenen:
Dadurch, dass eine freie Rotation um die Doppelbindung unmöglich ist, wird sie möglich cis-trans- Isomerie .
Alkene mit jeweils zwei Kohlenstoffatomen an einer Doppelbindung verschiedene Substituenten, kann in Form von zwei Isomeren existieren, die sich in der Anordnung der Substituenten relativ zur π-Bindungsebene unterscheiden:
Chemische Eigenschaften von Alkenen.
Alkene zeichnen sich aus durch:
Additionsreaktionen an eine Doppelbindung,
Oxidationsreaktionen,
Substitutionsreaktionen in der „Seitenkette“.
1. Doppelbindungsadditionsreaktionen: Die schwächere π-Bindung wird aufgebrochen und es entsteht eine gesättigte Verbindung.
Dies sind elektrophile Additionsreaktionen – A E.
1) Hydrierung:
CH 3 -CH = CH 2 + H 2 CH 3 -CH 2 -CH 3
2) Halogenierung:
CH 3 -CH = CH 2 + Br 2 (Lösung) CH 3 -CHBr -CH 2 Br
Verfärbung von Bromwasser – qualitative Reaktion zu einer Doppelbindung.
3) Hydrohalogenierung:
CH 3 -CH = CH 2 + HBr CH 3 -CHBr -CH 3
(MARKOVNIKOVS REGEL: Wasserstoff bindet an das am stärksten hydrierte Kohlenstoffatom).
4) Hydratation – Zugabe von Wasser:
CH 3 -CH = CH 2 + HOH CH 3 -CH -CH 3
(Die Annexion erfolgt auch nach der Markownikow-Regel)
2. Zugabe von Bromwasserstoff zu Anwesenheit von Peroxiden (Harash-Effekt) - das ist eine radikale Ergänzung - A R
CH 3 -CH = CH 2 + HBr - (H 2 O 2) CH 3 -CH 2 -CH 2 Br
(Die Reaktion mit Bromwasserstoff in Gegenwart von Peroxid erfolgtgegen Markownikows Herrschaft )
3. Verbrennung– vollständige Oxidation Alkene mit Sauerstoff zu Kohlendioxid und Wasser.
C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O
4. Milde Oxidation von Alkenen – Wagner-Reaktion : Reaktion mit einer kalten wässrigen Lösung von Kaliumpermanganat.
3CH 3 - CH=CH 2 + 2KMnO 4 + 4H 2 O 2MnO2 + 2KOH + 3 CH 3 - CH-CH 2
ô ô
OH OH
( Diol entsteht)
Entfärbung von Alkenen wässrige Lösung Kaliumpermanganat ist eine qualitative Reaktion auf Alkene.
5. Schwere Oxidation von Alkenen– heiße neutrale oder saure Lösung von Kaliumpermanganat. Kommt mit der Spaltung der C=C-Doppelbindung.
1. Wenn Kaliumpermanganat in einer sauren Umgebung wirkt, entsteht je nach Struktur des Alkengerüsts:
Fragment der Kohlenstoffkette an der Doppelbindung
Was wird daraus?
=CH 2
CO 2
= CH – R
R– C OOH-Carbonsäure
= C–R
ô
R
Keton R – C – R
║
Ö
CH 3 -MIT -1 N=MIT -2 H 2 +2 KMn +7 O 4 + 3H 2 SO 4
CH 3 -C +3 OOH+ C +4 O 2 + 2Mn +2 SO 4 + K 2 SO 4 + 4H 2 O
2. Wenn die Reaktion auftritt neutrale Umgebung Wenn es erhitzt wird, dann bekommen wir es entsprechend Kalium Salz:
Kettenfragment an einer Doppelbindung
Was wird daraus?
=CH 2
K 2 C O 3
= CH – R
R– C OO K - Carbonsäuresalz
= C–R
ô
R
Keton R – C – R
║
Ö
3CH 3 MIT -1 N=MIT-2 N 2 +10 K MnO 4 -t 3CH 3 C +3 OO K + + 3K 2 C +4 O 3 + 10MnO 2 +4H 2 O+ K OH
6. Oxidation Sauerstoff von Ethylen in Gegenwart von Palladiumsalzen.
CH 2 =CH 2 + O 2 –(kat) CH 3 CHO
(Essigsäurealdehyd)
7. Chlorierung und Bromierungzur Seitenkette: Wird die Reaktion mit Chlor im Licht oder bei hoher Temperatur durchgeführt, wird Wasserstoff in der Seitenkette ersetzt.
CH 3 -CH = CH 2 + Cl 2 – (leicht) CH 2 -CH = CH 2 +HCl
8. Polymerisation:
n CH 3 - CH= CH 2 (-CH–CH 2 -)n
Propylen Polypropylen
CH 3
Gewinnung von Alkenen
ICH . Knacken Alkane:
C 7 H 16 –(t) CH 3 - CH =CH 2 + C 4 H 10
Alkenalkan
II. Dehydrohalogenierung von Halogenalkanen unter Einwirkung einer alkoholischen Alkalilösung - Reaktion BESEITIGUNG.
Zaitsevs Regel: Die Abstraktion eines Wasserstoffatoms erfolgt bei Eliminierungsreaktionen überwiegend vom am wenigsten hydrierten Kohlenstoffatom.
III . Dehydrierung von Alkoholen Bei erhöhten Temperaturen (über 140 °C) in Gegenwart wasserentfernender Reagenzien – Aluminiumoxid oder konzentrierte Schwefelsäure – kommt es zu einer Eliminierungsreaktion.
CH 3 - CH-CH 2 -CH 3 – (H 2 SO 4,t>140 o) H 2 Ö+CH 3 - CH=CH-CH 3
OH
(befolgt auch Zaitsevs Regel)
IV . Dehalogenierung von Dihalogenalkanen mit Halogenatomen an benachbarten Kohlenstoffatomen, unter Einwirkung aktiver Metalle.
CH 2 Br-CH Br-CH3+ Mg CH 2 =CH-CH 3 + Mg Br 2
Auch Zink kann verwendet werden.
V . Dehydrierung von Alkanen bei 500°C:
VI. Unvollständige Hydrierung von Dienen und Alkinen
C 2 H 2 + H 2 (Nachteil) – (kat) C 2 H 4
Charakteristische chemische Eigenschaften von Kohlenwasserstoffen: Alkane, Alkene, Diene, Alkine, aromatische Kohlenwasserstoffe
Alkane
Alkane sind Kohlenwasserstoffe, in deren Molekülen die Atome durch Einfachbindungen verbunden sind und die der allgemeinen Formel $C_(n)H_(2n+2)$ entsprechen.
Homologe Reihe von Methan
Wie du bereits weißt, Homologe- Dies sind Stoffe, die in Struktur und Eigenschaften ähnlich sind und sich durch eine oder mehrere $CH_2$-Gruppen unterscheiden.
Gesättigte Kohlenwasserstoffe bilden die homologe Reihe von Methan.
Isomerie und Nomenklatur
Alkane zeichnen sich durch die sogenannten aus Strukturisomerie. Strukturisomere unterscheiden sich voneinander in der Struktur des Kohlenstoffgerüsts. Wie Sie bereits wissen, ist Butan das einfachste Alkan, das durch Strukturisomere gekennzeichnet ist:
Schauen wir uns die Grundlagen der IUPAC-Nomenklatur für Alkane genauer an:
1. Auswahl des Hauptstromkreises.
Die Namensbildung eines Kohlenwasserstoffs beginnt mit der Definition der Hauptkette – der längsten Kette von Kohlenstoffatomen im Molekül, die sozusagen seine Grundlage bildet.
2.
Den Atomen der Hauptkette werden Nummern zugeordnet. Die Nummerierung der Atome der Hauptkette beginnt an dem Ende, dem der Substituent am nächsten liegt (Strukturen A, B). Befinden sich die Substituenten in gleichem Abstand vom Kettenende, beginnt die Nummerierung an dem Ende, an dem sich mehr davon befinden (Struktur B). Befinden sich unterschiedliche Substituenten in gleichem Abstand von den Enden der Kette, beginnt die Nummerierung an dem Ende, dem der ältere Substituent am nächsten liegt (Struktur D). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$ ) usw.
Bitte beachten Sie, dass der Name des Substituenten durch Ersetzen des Suffixes gebildet wird -ein anhängen -il im Namen des entsprechenden Alkans.
3. Bildung des Namens.
Am Anfang des Namens stehen Zahlen – die Nummern der Kohlenstoffatome, an denen sich die Substituenten befinden. Wenn an einem bestimmten Atom mehrere Substituenten vorhanden sind, wird die entsprechende Zahl im Namen zweimal durch ein Komma getrennt wiederholt ($2,2-$). Nach der Zahl wird die Zahl der Substituenten mit einem Bindestrich angegeben ( di- zwei, drei- drei, Tetra- vier, Penta- fünf) und der Name des Stellvertreters ( Methyl, Ethyl, Propyl). Dann, ohne Leerzeichen oder Bindestriche, der Name der Hauptkette. Die Hauptkette wird als Kohlenwasserstoff bezeichnet – ein Mitglied der homologen Reihe von Methan ( Methan, Ethan, Propan usw.).

Die Namen der Stoffe, deren Strukturformeln oben angegeben sind, lauten wie folgt:
— Struktur A: $2$ -Methylpropan;
— Struktur B: $3$ -Ethylhexan;
— Struktur B: $2,2,4$ -Trimethylpentan;
— Struktur G: $2$ -Methyl$4$-Ethylhexan.
Physikalische und chemische Eigenschaften von Alkanen
Physikalische Eigenschaften. Die ersten vier Vertreter der homologen Reihe von Methan sind Gase. Das einfachste davon ist Methan, ein farb-, geschmacks- und geruchloses Gas (der Geruch von Gas, wenn man es wahrnimmt, muss man 104 $ nennen, wird durch den Geruch von Mercaptanen bestimmt – schwefelhaltige Verbindungen, die speziell dem verwendeten Methan zugesetzt werden Haushalts- und Industriegasgeräte, damit Personen, die sich in der Nähe befinden, das Leck anhand des Geruchs erkennen können.
Kohlenwasserstoffe mit einer Zusammensetzung von $С_5Н_(12)$ bis $С_(15)Н_(32)$ sind Flüssigkeiten; schwerere Kohlenwasserstoffe sind Feststoffe.
Die Siede- und Schmelzpunkte von Alkanen steigen mit zunehmender Länge der Kohlenstoffkette allmählich an. Alle Kohlenwasserstoffe sind in Wasser schlecht löslich; flüssige Kohlenwasserstoffe sind übliche organische Lösungsmittel.
Chemische Eigenschaften.
1. Substitutionsreaktionen. Die charakteristischsten Reaktionen für Alkane sind Substitutionsreaktionen freier Radikale, bei denen ein Wasserstoffatom durch ein Halogenatom oder eine Gruppe ersetzt wird.
Lassen Sie uns die Gleichungen der charakteristischsten Reaktionen präsentieren.
Halogenierung:
$CH_4+Cl_2→CH_3Cl+HCl$.
Bei überschüssigem Halogen kann die Chlorierung weitergehen, bis hin zum vollständigen Ersatz aller Wasserstoffatome durch Chlor:
$CH_3Cl+Cl_2→HCl+(CH_2Cl_2)↙(\text"Dichlormethan (Methylenchlorid)")$,
$CH_2Cl_2+Cl_2→HCl+(CHСl_3)↙(\text"Trichlormethan(Chloroform)")$,
$CHCl_3+Cl_2→HCl+(CCl_4)↙(\text"Tetrachlorkohlenstoff(Tetrachlorkohlenstoff)")$.
Die dabei entstehenden Stoffe werden häufig als Lösungsmittel und Ausgangsstoffe in organischen Synthesen verwendet.
2. Dehydrierung (Abspaltung von Wasserstoff). Wenn Alkane bei hohen Temperaturen (400–600 °C) über einen Katalysator ($Pt, Ni, Al_2O_3, Cr_2O_3$) geleitet werden, wird ein Wasserstoffmolekül abgespalten und ein Alken gebildet:
$CH_3 – CH_3→CH_2=CH_2+H_2$
3. Reaktionen, die mit der Zerstörung der Kohlenstoffkette einhergehen. Alle gesättigten Kohlenwasserstoffe brennen unter Bildung von Kohlendioxid und Wasser. Gasförmige Kohlenwasserstoffe, die in bestimmten Anteilen mit Luft vermischt sind, können explodieren. Die Verbrennung gesättigter Kohlenwasserstoffe ist eine exotherme Reaktion freier Radikale, die sehr ausgeprägt ist sehr wichtig bei Verwendung von Alkanen als Kraftstoff:
$СН_4+2О_2→СО_2+2Н_2O+880 kJ.$
IN Gesamtansicht Die Verbrennungsreaktion von Alkanen kann wie folgt geschrieben werden:
$C_(n)H_(2n+2)+((3n+1)/(2))O_2→nCO_2+(n+1)H_2O$
Thermische Spaltung von Kohlenwasserstoffen:
$C_(n)H_(2n+2)(→)↖(400-500°C)C_(n-k)H_(2(n-k)+2)+C_(k)H_(2k)$
Der Prozess erfolgt über einen Mechanismus freier Radikale. Eine Temperaturerhöhung führt zur homolytischen Spaltung der Kohlenstoff-Kohlenstoff-Bindung und zur Bildung freier Radikale:
$R – CH_2CH_2:CH_2 – R→R – CH_2CH_2·+·CH_2 – R$.
Diese Radikale interagieren miteinander und tauschen ein Wasserstoffatom aus, um ein Alkanmolekül und ein Alkenmolekül zu bilden:
$R – CH_2CH_2·+·CH_2 – R→R – CH=CH_2+CH_3 – R$.
Dem industriellen Prozess der Kohlenwasserstoffspaltung liegen thermische Zersetzungsreaktionen zugrunde. Dieser Prozess ist der wichtigste Schritt der Ölraffinierung.
Wenn Methan auf eine Temperatur von 1000 °C erhitzt wird, beginnt die Pyrolyse von Methan – die Zersetzung in einfache Substanzen:
$CH_4(→)↖(1000°C)C+2H_2$
Beim Erhitzen auf eine Temperatur von 1500 °C ist die Bildung von Acetylen möglich:
$2CH_4(→)↖(1500°C)CH=CH+3H_2$
4. Isomerisierung. Beim Erhitzen linearer Kohlenwasserstoffe mit einem Isomerisierungskatalysator (Aluminiumchlorid) entstehen Stoffe mit verzweigtem Kohlenstoffgerüst:
5. Aromatisierung. Alkane mit sechs oder mehr Kohlenstoffatomen in der Kette cyclisieren in Gegenwart eines Katalysators zu Benzol und seinen Derivaten:

Was ist der Grund dafür, dass Alkane radikalische Reaktionen eingehen? Alle Kohlenstoffatome in Alkanmolekülen befinden sich in einem Zustand der $sp^3$-Hybridisierung. Die Moleküle dieser Substanzen werden aus kovalenten unpolaren $C-C$-Bindungen (Kohlenstoff-Kohlenstoff) und schwach polaren $C-H$-Bindungen (Kohlenstoff-Wasserstoff) aufgebaut. Sie enthalten keine Bereiche mit erhöhter oder verringerter Elektronendichte oder leicht polarisierbaren Bindungen, d. h. Bei solchen Bindungen kann sich die Elektronendichte unter dem Einfluss äußerer Faktoren (elektrostatische Ionenfelder) verschieben. Folglich reagieren Alkane nicht mit geladenen Teilchen, weil Bindungen in Alkanmolekülen werden durch den heterolytischen Mechanismus nicht aufgebrochen.
Alkene
Ungesättigt sind Kohlenwasserstoffe, die in ihren Molekülen mehrere Bindungen zwischen Kohlenstoffatomen enthalten. Unbegrenzt sind Alkene, Alkadiene (Polyene), Alkine. Auch zyklische Kohlenwasserstoffe mit einer Doppelbindung im Ring (Cycloalkene) sowie Cycloalkane mit wenigen Kohlenstoffatomen im Ring (drei oder vier Atome) haben einen ungesättigten Charakter. Die Eigenschaft der Ungesättigtheit ist mit der Fähigkeit dieser Stoffe verbunden, Additionsreaktionen, vor allem Wasserstoff, unter Bildung gesättigter oder gesättigter Kohlenwasserstoffe – Alkane – einzugehen.
Alkene sind azyklische Kohlenwasserstoffe, die im Molekül neben Einfachbindungen eine Doppelbindung zwischen Kohlenstoffatomen enthalten und der allgemeinen Formel $C_(n)H_(2n)$ entsprechen.
Sein zweiter Name ist Olefine- Alkene wurden in Analogie zu ungesättigten Fettsäuren (Ölsäure, Linolsäure) gewonnen, deren Reste Bestandteil flüssiger Fette sind - Öle (von lat. Oleum- Öl).
Homologe Reihe von Ethen
Unverzweigte Alkene bilden die homologe Reihe des Ethens (Ethylen):
$С_2Н_4$ - Ethen, $С_3Н_6$ - Propen, $С_4Н_8$ - Buten, $С_5Н_(10)$ - Penten, $С_6Н_(12)$ - Hexen usw.
Isomerie und Nomenklatur
Alkene zeichnen sich wie Alkane durch Strukturisomerie aus. Strukturisomere unterscheiden sich voneinander in der Struktur des Kohlenstoffgerüsts. Das einfachste Alken, das durch Strukturisomere gekennzeichnet ist, ist Buten:

Eine Sonderform der Strukturisomerie ist die Positionsisomerie der Doppelbindung:
$CH_3 – (CH_2)↙(Buten-1) – CH=CH_2$ $CH_3 – (CH=CH)↙(Buten-2) – CH_3$
Um eine einzelne Kohlenstoff-Kohlenstoff-Bindung ist eine nahezu freie Rotation der Kohlenstoffatome möglich, sodass Alkanmoleküle eine große Vielfalt an Formen annehmen können. Eine Drehung um die Doppelbindung ist unmöglich, was zum Auftreten einer anderen Art von Isomerie bei Alkenen führt – der geometrischen oder cis-trans-Isomerie.

Cis- Isomere unterscheiden sich von Trance- Isomere räumliche Anordnung Fragmente des Moleküls (in diesem Fall Methylgruppen) relativ zur Ebene der $π$-Bindung und folglich Eigenschaften.
Alkene sind isomer zu Cycloalkanen (Interklassenisomerie), zum Beispiel:

Die IUPAC-Nomenklatur für Alkene ähnelt der für Alkane.
1. Auswahl des Hauptstromkreises.
Die Benennung eines Kohlenwasserstoffs beginnt mit der Identifizierung der Hauptkette – der längsten Kette von Kohlenstoffatomen im Molekül. Bei Alkenen muss die Hauptkette eine Doppelbindung enthalten.
2. Nummerierung der Hauptkettenatome.
Die Nummerierung der Atome der Hauptkette beginnt an dem Ende, dem die Doppelbindung am nächsten liegt. Der korrekte Verbindungsname lautet beispielsweise:

$5$-Methylhexen-$2$, nicht $2$-Methylhexen-$4$, wie man erwarten könnte.
Wenn die Position der Doppelbindung den Beginn der Nummerierung der Atome in der Kette nicht bestimmen kann, wird sie wie bei gesättigten Kohlenwasserstoffen durch die Position der Substituenten bestimmt.

3. Bildung des Namens.
Die Namen von Alkenen werden auf die gleiche Weise gebildet wie die Namen von Alkanen. Geben Sie am Ende des Namens die Nummer des Kohlenstoffatoms an, an dem die Doppelbindung beginnt, und ein Suffix, das angibt, dass die Verbindung zur Klasse der Alkene gehört – -en.
Zum Beispiel:

Physikalische und chemische Eigenschaften von Alkenen
Physikalische Eigenschaften. Die ersten drei Vertreter der homologen Alkenreihe sind Gase; Stoffe der Zusammensetzung $С_5Н_(10)$ - $С_(16)Н_(32)$ - Flüssigkeiten; Höhere Alkene sind Feststoffe.
Die Siede- und Schmelzpunkte steigen naturgemäß mit zunehmender Temperatur an Molekulargewicht Verbindungen.
Chemische Eigenschaften.
Additionsreaktionen. Erinnern wir uns daran Besonderheit Vertreter ungesättigte Kohlenwasserstoffe— Alkene ist die Fähigkeit, Additionsreaktionen einzugehen. Die meisten dieser Reaktionen verlaufen nach dem Mechanismus
1. Hydrierung von Alkenen. Alkene sind in der Lage, in Gegenwart von Hydrierungskatalysatoren Wasserstoff zu addieren, Metalle - Platin, Palladium, Nickel:
$CH_3 – CH_2 – CH=CH_2+H_2(→)↖(Pt)CH_3 – CH_2 – CH_2 – CH_3$.
Diese Reaktion findet bei atmosphärischem und erhöhtem Druck statt und erfordert keine hohe Temperatur, weil ist exotherm. Wenn die Temperatur steigt, können dieselben Katalysatoren eine Rückreaktion auslösen – die Dehydrierung.
2. Halogenierung (Anlagerung von Halogenen). Die Wechselwirkung eines Alkens mit Bromwasser oder einer Lösung von Brom in einem organischen Lösungsmittel ($CCl_4$) führt zu einer schnellen Verfärbung dieser Lösungen infolge der Addition eines Halogenmoleküls an das Alken und der Bildung von Dihalogenalkanen:
$CH_2=CH_2+Br_2→CH_2Br – CH_2Br$.
3.
$CH_3-(CH)↙(Propen)=CH_2+HBr→CH_3-(CHBr)↙(2-Brompropen)-CH_3$
Diese Reaktion gehorcht Markownikows Regel:
Wenn ein Halogenwasserstoff an ein Alken addiert wird, wird der Wasserstoff an das stärker hydrierte Kohlenstoffatom addiert, d. h. das Atom, an dem sich mehr Wasserstoffatome befinden, und das Halogen an das weniger hydrierte.
Die Hydratisierung von Alkenen führt zur Bildung von Alkoholen. Eines davon liegt beispielsweise der Zugabe von Wasser zu Ethen zugrunde Industrielle Methoden Gewinnung von Ethylalkohol:
$(CH_2)↙(Ethen)=CH_2+H_2O(→)↖(t,H_3PO_4)CH_3-(CH_2OH)↙(Ethanol)$
Beachten Sie, dass ein primärer Alkohol (mit einer Hydroxogruppe am primären Kohlenstoff) nur gebildet wird, wenn Ethen hydratisiert wird. Bei der Hydratisierung von Propen oder anderen Alkenen entstehen sekundäre Alkohole.

Auch diese Reaktion verläuft nach der Regel von Markownikow: Ein Wasserstoffkation bindet an ein stärker hydriertes Kohlenstoffatom und eine Hydroxogruppe an ein weniger hydriertes Kohlenstoffatom.
5. Polymerisation. Ein Sonderfall der Addition ist die Polymerisationsreaktion von Alkenen:
$nCH_2(=)↙(Ethen)CH_2(→)↖(UV-Licht, R)(...(-CH_2-CH_2-)↙(Polyethylen)...)_n$
Diese Additionsreaktion erfolgt über einen Mechanismus freier Radikale.
6. Oxidationsreaktion.
Wie alle organische Verbindungen, Alkene verbrennen in Sauerstoff zu $СО_2$ und $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2+2Н_2О$.
Allgemein:
$C_(n)H_(2n)+(3n)/(2)O_2→nCO_2+nH_2O$
Im Gegensatz zu Alkanen, die in Lösungen resistent gegen Oxidation sind, werden Alkene leicht durch Kaliumpermanganatlösungen oxidiert. In neutralen oder alkalischen Lösungen werden Alkene zu Diolen (zweiwertigen Alkoholen) oxidiert und an die Atome, zwischen denen vor der Oxidation eine Doppelbindung bestand, werden Hydroxylgruppen angehängt:

Alkadiene (Dienkohlenwasserstoffe)
Alkadiene sind azyklische Kohlenwasserstoffe, die im Molekül neben Einfachbindungen zwei Doppelbindungen zwischen Kohlenstoffatomen enthalten und der allgemeinen Formel $C_(n)H_(2n-2)$ entsprechen.
Abhängig von relative Position Doppelbindungen gibt es drei Arten von Dienen:
- Alkadiene mit kumuliert Anordnung der Doppelbindungen:
- Alkadiene mit konjugiert Doppelbindungen;
$CH_2=CH—CH=CH_2$;
- Alkadiene mit isoliert Doppelbindungen
$CH_2=CH—CH_2—CH=CH_2$.
Diese drei Arten von Alkadienen unterscheiden sich in Struktur und Eigenschaften erheblich voneinander. Das zentrale Kohlenstoffatom (das Atom, das zwei Doppelbindungen bildet) in Alkadienen mit kumulierten Bindungen befindet sich im Zustand der $sp$-Hybridisierung. Es bildet zwei $σ$-Bindungen, die auf derselben Linie liegen und in entgegengesetzte Richtungen gerichtet sind, und zwei $π$-Bindungen, die in senkrechten Ebenen liegen. $π$-Bindungen werden aufgrund der nichthybridisierten p-Orbitale jedes Kohlenstoffatoms gebildet. Die Eigenschaften von Alkadienen mit isolierten Doppelbindungen sind sehr spezifisch, weil konjugierte $π$-Bindungen beeinflussen sich gegenseitig erheblich.
p-Orbitale, die konjugierte $π$-Bindungen bilden, bilden praktisch ein einziges System (es wird als $π$-System bezeichnet), weil p-Orbitale benachbarter $π$-Bindungen überlappen teilweise.
Isomerie und Nomenklatur
Alkadiene zeichnen sich sowohl durch Strukturisomerie als auch durch cis- und trans-Isomerie aus.
Strukturisomerie.
— Isomerie des Kohlenstoffgerüsts:

— Isomerie der Position von Mehrfachbindungen:
$(CH_2=CH—CH=CH_2)↙(Butadien-1,3)$ $(CH_2=C=CH—CH_3)↙(Butadien-1,2)$
Cis-, Trans- Isomerie (räumlich und geometrisch)
Zum Beispiel:
Alkadiene sind isomere Verbindungen aus den Klassen der Alkine und Cycloalkene.
Bei der Namensbildung eines Alkadiens wird die Anzahl der Doppelbindungen angegeben. Die Hauptkette muss unbedingt zwei Mehrfachbindungen enthalten.
Zum Beispiel:

Physikalische und chemische Eigenschaften von Alkadienen
Physikalische Eigenschaften.
Unter normalen Bedingungen sind Propandien-1,2 und Butadien-1,3 Gase, 2-Methylbutadien-1,3 ist eine flüchtige Flüssigkeit. Alkadiene mit isolierten Doppelbindungen (das einfachste davon ist Pentadien-1,4) sind Flüssigkeiten. Höhere Diene sind Feststoffe.
Chemische Eigenschaften.
Die chemischen Eigenschaften von Alkadienen mit isolierten Doppelbindungen unterscheiden sich kaum von den Eigenschaften von Alkenen. Alkadiene mit konjugierten Bindungen weisen einige Besonderheiten auf.
1. Additionsreaktionen. Alkadiene sind in der Lage, Wasserstoff, Halogene und Halogenwasserstoffe zu addieren.
Eine Besonderheit der Addition an Alkadiene mit konjugierten Bindungen ist die Möglichkeit, Moleküle sowohl in den Positionen 1 und 2 als auch in den Positionen 1 und 4 zu addieren.

Das Verhältnis der Produkte hängt von den Bedingungen und der Art und Weise der Durchführung der entsprechenden Reaktionen ab.
2.Polymerisationsreaktion. Die wichtigste Eigenschaft Diene sind die Fähigkeit, unter dem Einfluss von Kationen oder freien Radikalen zu polymerisieren. Die Polymerisation dieser Verbindungen ist die Grundlage synthetischer Kautschuke:
$nCH_2=(CH—CH=CH_2)↙(Butadien-1,3)→((... —CH_2—CH=CH—CH_2— ...)_n)↙(\text"synthetischer Butadienkautschuk")$ .
Die Polymerisation konjugierter Diene verläuft als 1,4-Addition.
In diesem Fall erweist sich die Doppelbindung als zentral in der Einheit und die Elementareinheit kann wiederum beide annehmen cis-, so und Trance- Aufbau

Alkine
Alkine sind azyklische Kohlenwasserstoffe, die im Molekül neben Einfachbindungen auch eine Dreifachbindung zwischen Kohlenstoffatomen enthalten und der allgemeinen Formel $C_(n)H_(2n-2)$ entsprechen.
Homologe Reihe von Ethin
Geradkettige Alkine bilden die homologe Reihe von Ethin (Acetylen):
$С_2Н_2$ - Ethin, $С_3Н_4$ - Propin, $С_4Н_6$ - Butin, $С_5Н_8$ - Pentin, $С_6Н_(10)$ - Hexin usw.
Isomerie und Nomenklatur
Alkine zeichnen sich wie Alkene durch Strukturisomerie aus: Isomerie des Kohlenstoffgerüsts und Isomerie der Position der Mehrfachbindung. Das einfachste Alkin, das durch Strukturisomere der Mehrfachbindungsposition der Alkinklasse gekennzeichnet ist, ist Butin:
$СН_3 – (СН_2)↙(Butin-1) – С≡СН$ $СН_3 – (С≡С)↙(Butin-2) – СН_3$
Eine Isomerie des Kohlenstoffgerüsts in Alkinen ist möglich, beginnend mit Pentin:

Da eine Dreifachbindung eine lineare Struktur der Kohlenstoffkette voraussetzt, sind geometrische ( cis-, trans-) Isomerie ist für Alkine unmöglich.
Das Vorhandensein einer Dreifachbindung in Kohlenwasserstoffmolekülen dieser Klasse wird durch das Suffix widergespiegelt -In, und seine Position in der Kette ist die Nummer des Kohlenstoffatoms.
Zum Beispiel:

Verbindungen einiger anderer Klassen sind isomer zu Alkinen. Also, chemische Formel$С_6Н_(10)$ haben Hexin (Alkin), Hexadien (Alkadien) und Cyclohexen (Cycloalken):

Physikalische und chemische Eigenschaften von Alkinen
Physikalische Eigenschaften. Die Siede- und Schmelzpunkte von Alkinen und Alkenen steigen natürlicherweise mit zunehmendem Molekulargewicht der Verbindungen.
Alkine haben einen spezifischen Geruch. Sie sind in Wasser löslicher als Alkane und Alkene.
Chemische Eigenschaften.
Additionsreaktionen. Alkine sind ungesättigte Verbindungen und gehen Additionsreaktionen ein. Hauptsächlich Reaktionen elektrophile Addition.
1. Halogenierung (Anlagerung eines Halogenmoleküls). Ein Alkin ist in der Lage, zwei Halogenmoleküle (Chlor, Brom) zu binden:
$CH≡CH+Br_2→(CHBr=CHBr)↙(1,2-Dibromethan),$
$CHBr=CHBr+Br_2→(CHBr_2-CHBr_2)↙(1,1,2,2-Tetrabromethan)$
2. Hydrohalogenierung (Zugabe von Halogenwasserstoff). Die Additionsreaktion eines Halogenwasserstoffs, die über einen elektrophilen Mechanismus abläuft, verläuft ebenfalls in zwei Stufen, und in beiden Stufen ist die Markownikow-Regel erfüllt:
$CH_3-C≡CH+Br→(CH_3-CBr=CH_2)↙(2-Brompropen),$
$CH_3-CBr=CH_2+HBr→(CH_3-CHBr_2-CH_3)↙(2,2-Dibrompropan)$
3. Hydratation (Zugabe von Wasser). Von großer Bedeutung für die industrielle Synthese von Ketonen und Aldehyden ist die sogenannte Wasseranlagerungsreaktion (Hydratation). Kucherovs Reaktion:
4. Hydrierung von Alkinen. Alkine addieren Wasserstoff in Gegenwart von Metallkatalysatoren ($Pt, Pd, Ni$):
$R-C≡C-R+H_2(→)↖(Pt)R-CH=CH-R,$
$R-CH=CH-R+H_2(→)↖(Pt)R-CH_2-CH_2-R$
Da die Dreifachbindung zwei reaktive $π$-Bindungen enthält, addieren Alkane schrittweise Wasserstoff:
1) Trimerisierung.
Wenn Ethin über Aktivkohle geleitet wird, entsteht ein Produktgemisch, darunter Benzol:

2) Dimerisierung.
Neben der Trimerisierung von Acetylen ist auch dessen Dimerisierung möglich. Unter dem Einfluss einwertiger Kupfersalze entsteht Vinylacetylen:
$2HC≡CH→(HC≡C-CH=CH_2)↙(\text"Buten-1-in-3(vinylacetylen)")$
Dieser Stoff wird zur Herstellung von Chloropren verwendet:
$HC≡C-CH=CH_2+HCl(→)↖(CaCl)H_2C=(CCl-CH)↙(Chloropren)=CH_2$
Durch Polymerisation wird Chloroprenkautschuk erhalten:
$nH_2C=CCl-CH=CH_2→(...-H_2C-CCl=CH-CH_2-...)_n$
Oxidation von Alkinen.
Ethin (Acetylen) verbrennt in Sauerstoff und setzt dabei sehr viel frei große Menge Hitze:
$2C_2H_2+5O_2→4CO_2+2H_2O+2600kJ$ Auf dieser Reaktion basiert die Wirkungsweise eines Sauerstoff-Acetylen-Brenners, dessen Flamme eine sehr hohe Temperatur (über $3000°C$) aufweist, was den Einsatz zum Schneiden ermöglicht und Schweißen von Metallen.
An der Luft verbrennt Acetylen mit einer rauchigen Flamme, weil Der Kohlenstoffgehalt in seinem Molekül ist höher als in den Molekülen von Ethan und Ethen.
Alkine verfärben wie Alkene angesäuerte Lösungen von Kaliumpermanganat; In diesem Fall wird die Mehrfachbindung zerstört.
Reaktionen, die die wichtigsten Methoden zur Herstellung sauerstoffhaltiger Verbindungen charakterisieren
1. Hydrolyse von Haloalkanen. Sie wissen bereits, dass es bei der Wechselwirkung von Alkoholen mit Halogenwasserstoffen zur Bildung von Halogenalkanen kommt reversible Reaktion. Daher ist es klar, dass Alkohole durch gewonnen werden können Hydrolyse von Halogenalkanen- Reaktionen dieser Verbindungen mit Wasser:
$R-Cl+NaOH(→)↖(H_2O)R-OH+NaCl+H_2O$
Mehrwertige Alkohole können durch Hydrolyse von Halogenalkanen erhalten werden, die mehr als ein Halogenatom pro Molekül enthalten. Zum Beispiel:
2. Hydratisierung von Alkenen– Anlagerung von Wasser über die $π$-Bindung eines Alkenmoleküls – ist Ihnen bereits bekannt, zum Beispiel:
$(CH_2=CH_2)↙(Ethen)+H_2O(→)↖(H^(+))(C_2H_5OH)↙(Ethanol)$
Die Hydratisierung von Propen führt gemäß der Markownikow-Regel zur Bildung eines sekundären Alkohols – Propanol-2:

3. Hydrierung von Aldehyden und Ketonen. Sie wissen bereits, dass die Oxidation von Alkoholen unter milden Bedingungen zur Bildung von Aldehyden oder Ketonen führt. Es ist offensichtlich, dass Alkohole durch Hydrierung (Reduktion mit Wasserstoff, Anlagerung von Wasserstoff) von Aldehyden und Ketonen gewonnen werden können:

4. Oxidation von Alkenen. Glykole können, wie bereits erwähnt, durch Oxidation von Alkenen mit einer wässrigen Lösung von Kaliumpermanganat gewonnen werden. Beispielsweise entsteht Ethylenglykol (Ethandiol-1,2) durch die Oxidation von Ethylen (Ethen):
$CH_2=CH_2+[O]+H_2O(→)↖(KMnO_4)HO-CH_2-CH_2-OH$
5. Spezifische Methoden zur Herstellung von Alkoholen. Einige Alkohole werden mit für sie einzigartigen Methoden gewonnen. So wird Methanol industriell durch die Wechselwirkung von Wasserstoff mit Kohlenmonoxid (II) (Kohlenmonoxid) bei erhöhtem Druck und hoher Temperatur an der Oberfläche eines Katalysators (Zinkoxid) hergestellt:
$CO+2H_2(→)↖(t,p,ZnO)CH_3-OH$
Die für diese Reaktion erforderliche Mischung Kohlenmonoxid und Wasserstoff, auch Synthesegas ($CO + nH_2O$) genannt, wird durch Überleiten von Wasserdampf über heiße Kohle gewonnen:
$C+H_2O(→)↖(t)CO+H_2-Q$
6. Fermentation von Glukose. Diese Methode zur Herstellung von Ethylalkohol (Weinalkohol) ist dem Menschen seit der Antike bekannt:
$(C_6H_(12)O_6)↙(Glukose)(→)↖(Hefe)2C_2H_5OH+2CO_2$
Methoden zur Herstellung von Aldehyden und Ketonen
Es können Aldehyde und Ketone hergestellt werden Oxidation oder Dehydrierung von Alkoholen. Beachten wir noch einmal, dass durch Oxidation oder Dehydrierung von primären Alkoholen Aldehyde und von sekundären Alkoholen Ketone entstehen können:

Kucherovs Reaktion. Durch die Hydratationsreaktion entsteht aus Acetylen Acetaldehyd und aus Acetylenhomologen werden Ketone gewonnen:

Beim Erhitzen Kalzium oder Bariumsalze Carbonsäuren bilden ein Keton und ein Metallcarbonat:

Methoden zur Herstellung von Carbonsäuren
Carbonsäuren können durch Oxidation primärer Aldehydalkohole hergestellt werden:

Aromatische Carbonsäuren entstehen durch Oxidation von Benzolhomologen:

Auch bei der Hydrolyse verschiedener Carbonsäurederivate entstehen Säuren. Also während der Hydrolyse Ester Es entstehen Alkohol und Carbonsäure. Wie oben erwähnt, sind säurekatalysierte Veresterungs- und Hydrolysereaktionen reversibel:
Die Hydrolyse des Esters unter dem Einfluss einer wässrigen Alkalilösung verläuft irreversibel; in diesem Fall entsteht aus dem Ester keine Säure, sondern deren Salz.
– Dies sind gesättigte (oder gesättigte) nichtzyklische Kohlenwasserstoffe, in denen alle Bindungen vorliegeneinzel.
Allgemeine Formel:
C n H 2 n +2
Alle Kohlenstoffatome in Alkanen haben sp 3 - Hybridisierung.
Die ersten vier Mitglieder der homologen Reihe von Alkanen sind Gase, C5–C17 sind Flüssigkeiten und ab C18 sind Feststoffe. Alle Alkane sind leichter als Wasser, unlöslich in Wasser und vermischen sich nicht damit.
Chemische Eigenschaften.
1) Die Bindung von Kohlenstoff und Wasserstoff in Alkanen ist niedrigpolar.
2) Daher ist sein Reaktionsabbruch nur durch einen homolytischen Mechanismus möglich:
Dies ist nur unter rauen Bedingungen möglich.
3) Gesättigte (gesättigte) Kohlenwasserstoffe haben keine Fähigkeit, Additionsreaktionen einzugehen. Sie zeichnen sich aus durch Substitutionsreaktionen Wasserstoffatome und Spaltung. Diese Reaktionen erfolgen entweder mit Hitze, unter Licht oder unter Verwendung von Katalysatoren.
Alkane reagiere nicht mit konzentrierten Säuren, Laugen, Kaliumpermanganat, Bromwasser.
I. Substitutionsreaktionen.
1) Halogenierung: radikalische Substitution.
Chlor und Brom bei Licht oder Hitze.
A) Chlorierung: Der Prozess ist schnell, daher verläuft er wahllos, es entsteht eine Mischung von Substitutionsprodukten:
CH 3 - CH 2 - CH 3 + Cl 2 – (leicht) CH 3 -CH 2 -CH 2 Cl + CH 3 -CHCl-CH 3 + HCl
B) Bromierung:
CH 3 CH 3
CH 3 -CH 2 -CH -CH 3 +Br 2 – (leicht) CH 3 -CH 2 -C -CH 3 + HBr
Die Bromierung ist ein langsamerer und selektiverer Prozess.
Bromierungsselektivität:
tertiäres > sekundäres > primäres Kohlenstoffatom.
Mechanismus des radikalen Ersatzes: Kettenfreies Radikal.
Freie Radikale R ∙ ist ein SEHR AKTIVES Teilchen, das trägt ein ungepaartes Elektron und dazu neigen, eine Bindung mit einem anderen Atom einzugehen.
1) Schaltungsinitiierung (Start): Ein Chlormolekül wird durch die Einwirkung eines Lichtquants in zwei Radikale zerlegt. Cl · :
2) Kettenentwicklung: Das Chlorradikal abstrahiert ein Wasserstoffatom vom Alkan. Dabei entsteht ein Zwischenteilchen – ein Alkylradikal, das wiederum ein Chloratom vom Cl 2 -Molekül abstrahiert. In diesem Fall entsteht erneut ein Chlorradikal und der Vorgang wiederholt sich – die Kette geht weiter:
3) Offener Kreislauf: die Verbindung zweier Radikale zu einem Molekül.
2) Nitrierung
(Reaktion von M.I. Konovalov):
Der Reaktionsmechanismus ist ebenfalls radikal.
Erhitzen auf 140 °C mit verdünnter (10 %) Salpetersäure:
CH 3 CH 3
CH 3 -CH 2 -CH-CH 3 + HNO 3 CH 3 -CH 2 -C-CH 3 + H 2 O
Selektivität der Nitrierung: NEIN 2
tertiäres > sekundäres > primäres Kohlenstoffatom.
3) Cracken – Umwandlung von Alkanen unter Hitzeeinwirkung.
a) Bei langkettigen Alkanen entstehen beim Cracken ein Alkan und ein Alken. Darüber hinaus entsteht bei einer Länge von mehr als 5 C-Atomen ein Gemisch aus Kohlenwasserstoffen unterschiedlicher Länge.
CH 3 –CH 2 –CH 2 –CH 3 - 400°C CH 3 -CH 3 + CH 2 =CH 2
B) Methan-Cracking geschieht auf zwei mögliche Arten:
1. Langzeiterhitzung von Methan: CH 4 - 1500° C C+2H2
2. Sofortiges Erhitzen auf 1500 Grad und sofortiges Abkühlen:
2CH 4 - 1500° C H–C ≡ C –H + 3H 2
Acetylen
4) Isomerisierung – Umlagerung des Kohlenstoffgerüsts unter Bildung anderer Isomere: beim Erhitzen mit AlCl 3 -Katalysator.
CH 3 -CH 2 -CH 2 -CH 3 -(100 o, AlCl 3) CH 3 -CH -CH 3
5) Oxidation:
1) Verbrennung:
CH 4 + 2O 2 ⇆ CO 2 + 2H 2 O
C 5 H 12 + 8O 2 ⇆ 5CO 2 + 6H 2 O
2) Katalytische Oxidation:
Methan: CH 4 + O 2 - (Katalysator) eine Mischung aus CH 3 OH, HSON und HCOOH
Butan: C 4 H 10 + O 2 - (Katalysator) 2 CH 3 COOH (Essigsäure)
6) Dehydrierung und Cyclisierung.
1) Kurze Alkane werden zu Alkenen oder Dienen dehydriert:
C 2 H 6 – (Kat., t) C 2 H 4 + H 2
CH 3 -CH 2 -CH 2 -CH 3 – (kat. Cr 2 O 3, t) Butadien + H 2
2) In Gegenwart eines Katalysators werden Hexan und Heptan in Benzol bzw. Toluol umgewandelt.
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 – (Kat.Pt, t) + 4 H 2
Quittung:
1) Wurtz-Reaktion: Wirkung von metallischem Natrium auf Monohalogenderivate von Kohlenwasserstoffen:
2CH 3 -CH 2 Br + 2Na CH 3 -CH 2 -CH 2 -CH 3 +2NaBr
Das Kohlenstoffgerüst verdoppelt sich. Die Reaktion eignet sich zur Herstellung symmetrischer Alkane.
2) Decarboxylierung von Carbonsäuresalzen(Dumas-Reaktion): Fusion von Salzen von Carbonsäuren mit Alkalien.
So entsteht Methan durch Erhitzen von Natriumacetat mit Natriumhydroxid.
CH 3 COONa + NaOH( Verschmelzung) CH 4 +Na 2 CO 3
3) Elektrolyse von Lösungen von Carbonsäuresalzen(Kolbe-Reaktion):
2CH 3 COONa + 2H 2 O – (elektrischer Strom) 2CO 2 + H 2 + C 2 H 6 + 2NaOH
Kathode:
Wasser fließt ab: 2H 2 O + 2e N 2 + 2OH -
Anode:
Säureanionenentladung: 2CH 3 SOO - -2e 2CO 2 + CH 3 -CH 3
4) Hydrolyse von Aluminiumcarbid– Produktion von Methan.
Al 4 C 3 +12H 2 Ö 3CH 4 + 4Al(OH) 3
5) Hydrierung ungesättigter oder zyklischer Kohlenwasserstoffe in Gegenwart von Katalysatoren (Platin, Palladium, Nickel).
R–CH=CH–R’ + H 2 – Kat R–CH 2 -CH 2 -R'
(Cyclopropan) + H 2 – Pd CH 3 -CH 2 -CH 3 (Propan)
6) Alkane können aus Erdöl durch Cracken oder fraktionierte Destillation gewonnen werden.










