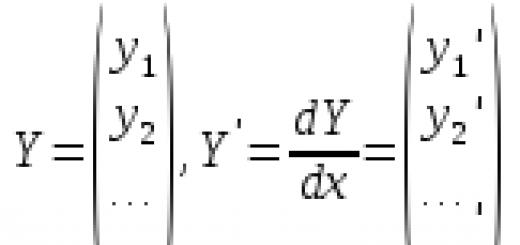Формальный заряд атома в соединениях — вспомогательная величина, обычно ее используют в описаниях свойств элементов в химии. Этот условный электрический заряд и есть степень окисления. Его значение изменяется в результате многих химических процессов. Хотя заряд является формальным, он ярко характеризует свойства и поведение атомов в окислительно-восстановительных реакциях (ОВР).
Окисление и восстановление
В прошлом химики использовали термин «окисление», чтобы описать взаимодействие кислорода с другими элементами. Название реакций произошло от латинского наименования кислорода - Oxygenium. Позже выяснилось, что другие элементы тоже окисляют. В этом случае они восстанавливаются — присоединяют электроны. Каждый атом при образовании молекулы изменяет строение своей валентной электронной оболочки. В этом случае появляется формальный заряд, величина которого зависит от количества условно отданных или принятых электронов. Для характеристики этой величины ранее применяли английский химический термин "oxidation number", который в переводе означает «окислительное число». При его использовании исходят из допущения, что связывающие электроны в молекулах или ионах принадлежат атому, обладающему более высоким значением электроотрицательности (ЭО). Способность удерживать свои электроны и притягивать их от других атомов хорошо выражена у сильных неметаллов (галогенов, кислорода). Противоположными свойствами обладают сильные металлы (натрий, калий, литий, кальций, другие щелочные и щелочноземельные элементы).
Определение степени окисления
Степенью окисления называют заряд, который атом приобрел бы в том случае, если бы принимающие участие в образовании связи электроны полностью сместились к более электроотрицательному элементу. Есть вещества, не имеющие молекулярного строения (галогениды щелочных металлов и другие соединения). В этих случаях степень окисления совпадает с зарядом иона. Условный или реальный заряд показывает, какой процесс произошел до того, как атомы приобрели свое нынешнее состояние. Положительное значение степени окисления — это общее количество электронов, которые были удалены из атомов. Отрицательное значение степени окисления равно числу приобретенных электронов. По изменению состояния окисления химического элемента судят о том, что происходит с его атомами в ходе реакции (и наоборот). По цвету вещества определяют, какие произошли перемены в состоянии окисления. Соединения хрома, железа и ряда других элементов, в которых они проявляют разную валентность, окрашены неодинаково.
Отрицательное, нулевое и положительное значения степени окисления

Простые вещества образованы химическими элементами с одинаковым значением ЭО. В этом случае связывающие электроны принадлежат всем структурным частицам в равной степени. Следовательно, в простых веществах элементам несвойственно состояние окисления (Н 0 2 , О 0 2 , С 0). Когда атомы принимают электроны или общее облако смещается в их сторону, заряды принято писать со знаком "минус". Например, F -1 ,О -2 , С -4 . Отдавая электроны, атомы приобретают реальный или формальный положительный заряд. В оксиде OF 2 атом кислорода отдает по одному электрону двум атомам фтора и находится в состоянии окисления О +2 . Считают, что в молекуле или многоатомном ионе более электроотрицательные атомы получают все связывающие электроны.
Сера — элемент, проявляющий разные валентность и степени окисления
Химические элементы главных подгрупп зачастую проявляют низшую валентность равную VIII. Например, валентность серы в сероводороде и сульфидах металлов — II. Для элемента характерны промежуточные и высшая валентность в возбужденном состоянии, когда атом отдает один, два, четыре или все шесть электронов и проявляет соответственно валентности I, II, IV, VI. Такие же значения, только со знаком "минус" или "плюс", имеют степени окисления серы:
- в сульфиде фтора отдает один электрон: -1;
- в сероводороде низшее значение: -2;
- в диоксиде промежуточное состояние: +4;
- в триоксиде, серной кислоте и сульфатах: +6.
В своем высшем состоянии окисления сера только принимает электроны, в низшей степени — проявляет сильные восстановительные свойства. Атомы S +4 могут проявлять в соединениях функции восстановителей или окислителей в зависимости от условий.

Переход электронов в химических реакциях
При образовании кристалла поваренной соли натрий отдает электроны более электроотрицательному хлору. Степени окисления элементов совпадают с зарядами ионов: Na +1 Cl -1 . Для молекул, созданных путем обобществления и смещения электронных пар к более электроотрицательному атому, применимы только представления о формальном заряде. Но можно предположить, что все соединения состоят из ионов. Тогда атомы, притягивая электроны, приобретают условный отрицательный заряд, а отдавая, — положительный. В реакциях указывают, какое число электронов смещается. Например, в молекуле диоксида углерода С +4 О - 2 2 указанный в верхнем правом углу индекс при химическом символе углерода отображает количество электронов, удаленных из атома. Для кислорода в этом веществе характерно состояние окисления -2. Соответствующий индекс при химическом знаке О — количество добавленных электронов в атоме.

Как подсчитать степени окисления
Подсчет количества отданных и присоединенных атомами электронов может отнять много времени. Облегчают эту задачу следующие правила:
- В простых веществах степени окисления равны нулю.
- Сумма окисления всех атомов или ионов в нейтральном веществе равна нулю.
- В сложном ионе сумма степеней окисления всех элементов должна соответствовать заряду всей частицы.
- Более электроотрицательный атом приобретает отрицательное состояние окисления, которое записывают со знаком "минус".
- Менее электроотрицательные элементы получают положительные степени окисления, их записывают со знаком "плюс".
- Кислород в основном проявляет степень окисления, равную -2.
- Для водорода характерное значение: +1, в гидридах металлов встречается: Н-1.
- Фтор — наиболее электроотрицательный из всех элементов, его состояние окисления всегда равно -4.
- Для большинства металлов окислительные числа и валентности совпадают.

Степень окисления и валентность
Большинство соединений образуются в результате окислительно-восстановительных процессов. Переход или смещение электронов от одних элементов к другим приводит к изменению их состояния окисления и валентности. Зачастую эти величины совпадают. В качестве синонима к термину «степень окисления» можно использовать словосочетание «электрохимическая валентность». Но есть исключения, например, в ионе аммония азот четырехвалентен. Одновременно атом этого элемента находится в состоянии окисления -3. В органических веществах углерод всегда четырехвалентен, но состояния окисления атома С в метане СН 4 , муравьином спирте СН 3 ОН и кислоте НСООН имеют другие значения: -4, -2 и +2.
Окислительно-восстановительные реакции

К окислительно-восстановительным относятся многие важнейшие процессы в промышленности, технике, живой и неживой природе: горение, коррозия, брожение, внутриклеточное дыхание, фотосинтез и другие явления.
При составлении уравнений ОВР подбирают коэффициенты, используя метод электронного баланса, в котором оперируют следующими категориями:
- степени окисления;
- восстановитель отдает электроны и окисляется;
- окислитель принимает электроны и восстанавливается;
- число отданных электронов должно быть равно числу присоединенных.
Приобретение электронов атомом приводит к понижению его степени окисления (восстановлению). Утрата атомом одного или нескольких электронов сопровождается повышением окислительного числа элемента в результате реакций. Для ОВР, протекающих между ионами сильных электролитов в водных растворах, чаще используют не электронный баланс, а метод полуреакций.
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
В нейтральной молекуле сумма степеней окисления всех элементов равна нулю, а в ионе - заряду иона.
Несколько простых примеров на определение степеней окисления
Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3).
Решение . Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х - искомая степень окисления. Составляем простейшее уравнение: х + 3 (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 (+1) + х + 4 (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .
Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3) 3 .
Решение . Алгоритм остается неизменным. В состав "молекулы" нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 (+3) + 3х + 9 (-2) = 0. Ответ: Al +3 (N +5 O -2 3) 3 .
Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4) 3- .
Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5 . Определите степени окисления всех элементов в (NH 4) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота - нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую "молекулу", а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1) 2 S +6 O 4 -2 .
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте "разделить" молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Пример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH.
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Не смешивайте понятия "валентность" и "степень окисления"!
Степень окисления часто путают с валентностью . Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность - нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую "экзотику" здесь обсуждать не будем);
- степень окисления - формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие "валентность", наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему "Степень окисления"
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный тип.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе - заряду иона .
1. Степени окисления металлов в соединениях всегда положительные.
2. Высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключение составляют: Au +3 (I группа), Cu +2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru .
3. Степени окисления неметаллов зависят от того, с каким атомом он соединён:
- если с атомом металла, то степень окисления отрицательная;
- если с атомом неметалла то степень окисления может быть и положительная, и отрицательная. Это зависит от электроотрицательности атомов элементов.
4. Высшую отрицательную степень окисления неметаллов можно определить вычитанием из 8 номера группы, в которой находится данный элемент, т.е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы.
5. Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
Элементы с неизменными степенями окисления.
|
Элемент |
Характерная степень окисления |
Исключения |
|
Гидриды металлов: LIH -1 |
||
|
Степенью окисления называют условный заряд частицы в предположении, что связь полностью разорвана (имеет ионных характер). H - Cl = H + + Cl - , Связь в соляной кислоте ковалентная полярная. Электронная пара в большей степени смещена в сторону атома Cl - , т.к. он более электроотрицацельный элемент. Как определить степень окисления?Электроотрицательность - это способность атомов притягивать к себе электроны других элементов. Степень окисления указывается над элементом: Br 2 0 , Na 0 , O +2 F 2 -1 , K + Cl - и т.д. Она может быть отрицательной и положительной. Степень окисления простого вещества (несвязанное, свободное состояние) равна нулю. Степень окисления кислорода у большинстве соединений равна -2 (исключение составляют пероксиды Н 2 О 2 , где она равна -1 и соединения с фтором - O +2 F 2 -1 , O 2 +1 F 2 -1 ). - Степень окисления простого одноатомного иона равна его заряду: Na + , Ca +2 . Водород в своих соединениях имеет степень окисления равную +1 (исключения составляют гидриды - Na + H - и соединения типа C +4 H 4 -1 ). В связях «металл-неметалл» отрицательную степень окисления имеет тот атом, который обладает большей электрооприцательностью (данные об элеткроотрицательности приведены в шкале Полинга): H + F - , Cu + Br - , Ca +2 (NO 3 ) - и т.д. Правила определения степени окисления в химических соединениях.Возьмем соединение KMnO 4 , необходимо определить степень окисления у атома марганца. Рассуждения:
К + Mn X O 4 -2 Пусть Х - неизвестная нам степень окисления марганца. Количество атомов калия - 1, марганца - 1, кислорода - 4. Доказано, что молекула в целом электронейтральна, поэтому ее общий заряд должен быть равен нулю. 1*(+1) + 1*(X ) + 4(-2) = 0, Х = +7, Значит, степень окисления марганца в перманганате калия = +7. Возьмем другой пример оксида Fe 2 O 3 . Необходимо определить степень окисления атома железа. Рассуждение:
2*(Х) + 3*(-2) = 0, Вывод: степень окисления железа в данном оксиде равна +3. Примеры. Определить степени окисления всех атомов в молекуле. 1. K 2 Cr 2 O 7 . Степень окисления К +1 , кислорода О -2 . Учитывая индексы: О=(-2)×7=(-14), К=(+1)×2=(+2). Т.к. алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, то число положительных степеней окисления равно числу отрицательных. Степени окисления К+О=(-14)+(+2)=(-12). Из этого следует, что у атома хрома число положительных степеней равно 12, но атомов в молекуле 2, значит на один атом приходится (+12):2=(+6). Ответ: К 2 + Cr 2 +6 O 7 -2 . 2. (AsO 4) 3- . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е. - 3. Составим уравнение: х+4×(- 2)= - 3 . Ответ: (As +5 O 4 -2) 3- . |
Химия подготовка к ЗНО и ДПА
Комплексное издание
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Степень окисления
Степень окисления - это условный заряд на атоме в молекуле или кристалле, который возник на нем, когда бы все полярные связи, созданные им, имели ионный характер.
На отличие от валентности, степени окисления может быть положительным, отрицательным или равняться нулю. В простых ионных соединениях степень окисления совпадает с зарядами ионов. Например, в натрий хлориде
NaCl (Na + Cl - ) Натрий имеет степень окисления +1, а Хлор -1, в кальций оксиде СаО (Са +2 О -2) Кальций проявляет степень окисления +2, а Оксисен - -2. Это правило распространяется на все основные оксиды: степень окисления металлического элемента равен заряду иона металла (Натрия +1, Бария +2, Алюминия +3), а степень окисления Кислорода равна-2. Степень окисления обозначают арабскими цифрами, которые ставят над символом элемента, подобно валентности, причем вначале указывают знак заряда, а потом его численное значение:Если модуль степени окисления равна единице, то число «1» можно не ставить и писать только знак:
Na + Cl - .Степень окисления и валентность - родственные понятия. Во многих соединениях абсолютная величина степени окисления элементов совпадает с их валентностью. Однако существует немало случаев, когда валентность отличается от степени окисления.
В простых веществах - неметалах существует ковалентная неполярная связь, совместная электронная пара смещается к одному из атомов, поэтому степень окисления элементов в простых веществ всегда равна нулю. Но атомы друг с другом связаны, то есть проявляют определенную валентность, как, например, в кислороде валентность Кислорода равна II, а в азоте валентность Азота - III:
В молекуле водород пероксида валентность Кислорода также равна II, а Водорода - И:
Определение возможных степеней окисления элементов
Степени окисление, какие элементы могут проявлять в различных соединениях, в большинстве случаев можно определить по строению внешнего электронного уровня или по местом элемента в Периодической системе.
Атомы металлических элементов могут только отдавать электроны, поэтому в соединениях они проявляют положительные степени окисления. Его абсолютное значение во многих случаях (за исключением d -элементов) равен числу электронов на внешнем уровне, то есть номера группы в Периодической системе. Атомы d -элементов могут также отдавать электроны с передзовнішнього уровня, а именно - с незаполненных d -орбиталей. Поэтому для d -элементов определить все возможные степени окисления значительно сложнее, чем для s - и р-элементов. С уверенностью можно утверждать, что большинство d -элементов проявляют степень окисления +2 благодаря электронам внешнего электронного уровня, а максимальная степень окисления в большинстве случаев равен номеру группы.
Атомы неметаллических элементов могут проявлять как положительные, так и отрицательные степени окисление, в зависимости от того, с атомом какого элемента они образуют связь. Если элемент более электроотрицательным, то он проявляет негативное степень окисления, а если менее электроотрицательный - положительный.
Абсолютное значение степени окисления неметаллических элементов можно определить по строению внешнего электронного слоя. Атом способен принять столько электронов, чтобы на его внешнем уровне расположилось восемь электронов: неметаллические элементы VII группы принимают один электрон и проявляют степень окисления -1, VIгруппы - два электроны и проявляют степень окисления -2 и т.д.
Неметаллические элементы способны отдавать разное число электронов: максимум столько, сколько расположено на внешнем энергетическом уровне. Иначе говоря, максимальный степень окисления неметаллических элементов равна номеру группы. Благодаря промотуванню электронов на внешнем уровне атомов число неспаренных электронов, которые атом может отдавать в химических реакциях, бывает разным, поэтому неметаллические элементы способны обнаруживать различные промежуточные значения степени окисления.
Возможны степени окисления s - и р-элементов
|
Группа ПС |
|||||||
|
Высшую степень окисления |
|||||||
|
Промежуточный степень окисления |
|||||||
|
Ниже степень окисления |
Определение степеней окисления в соединениях
Любая электронейтральная молекула, поэтому сумма степеней окисления атомов всех элементов должна равняться нулю. Определим степень окисления в сульфур(И V ) оксиде SO 2 тауфосфор(V ) сульфіді P 2 S 5 .
Сульфур(И V ) оксид SO 2 образован атомами двух элементов. Из них электроотрицательности большая у Кислорода, поэтому атомы Кислорода будут иметь негативный степень окисления. Для Кислорода он равен-2. В этом случае Сульфур оказывает положительное степень окисления. В различных соединениях Сульфур может проявлять разные степени окисления, поэтому в этом случае его необходимо вычислить. В молекуле SO 2 два атома Кислорода со степенью окисления -2, поэтому общий заряд атомов Кислорода равна-4. Для того, чтобы молекула была електронейтральною, атом Серы имеет полностью нейтрализовать заряд обоих атомов Кислорода, поэтому степень окисления Серы равна +4:
В молекуле фосфор(V ) сульфида P 2 S 5 более електронегативним элементом является Сульфур, то есть он проявляет негативное степень окисления, а Фосфор - положительный. Для Серы негативный степень окисления составляет только 2. Вместе пять атомов Серы несут отрицательный заряд, равный-10. Поэтому два атома Фосфора имеют нейтрализовать этот заряд с общим зарядом +10. Поскольку атомов Фосфора в молекуле два, то каждый должен иметь степень окисления +5:
Сложнее вычислять степень окисления не в бинарных соединениях - солях, основаниях и кислотах. Но для этого также следует воспользоваться принципом электронейтральности, а еще помнить о том, что в большинстве соединений степень окисления Кислорода составляет -2, Водорода +1.
Рассмотрим это на примере калий сульфата K 2 SO 4 . Степень окисления Калия в соединениях может быть только +1, а Кислорода -2:
С принципа электронейтральности вычисляем степень окисления Серы:
2(+1) + 1 (х) + 4 (-2) = 0, откуда х = +6.
При определении степеней окисления элементов в соединениях следует придерживаться таких правил:
1. Степень окисления элемента в простом веществе равна нулю.
2. Фтора - наиболее электроотрицательный химический элемент, поэтому степень окисления Фтора в всех соединениях равна-1.
3. Оксиген - наиболее электроотрицательный элемент после Фтора, поэтому степень окисления Кислорода во всех соединениях, кроме фторидов, отрицательный: в большинстве случаев он равна -2, а в пероксидах - -1.
4. Степень окисления Водорода в большинстве соединений равна +1, а в соединениях с металлическими элементами (гидридах) - -1.
5. Степень окисления металлов в соединениях всегда положительный.
6. Более электроотрицательный элемент всегда имеет отрицательный степень окисления.
7. Сумма степеней окисления всех атомов в молекуле равна нулю.
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
ОПРЕДЕЛЕНИЕ
Число электронов, смещенных от атома данного элемента или к атому данного элемента в соединении называют степенью окисления .
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная - число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N 2 , H 2 , Cl 2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na +1 I -1 , Mg +2 Cl -1 2 , Al +3 F -1 3 , Zr +4 Br -1 4 .
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Высшая степень окисления
Для элементов, проявляющих в своих соединениях различные степени окисления, существуют понятия высшей (максимальной положительной) и низшей (минимальной отрицательной) степеней окисления. Высшая степень окисления химического элемента обычно численно совпадает с номером группы в Периодической системе Д. И. Менделеева. Исключения составляют фтор (степень окисления равна -1, а элемент расположен в VIIA группе), кислород (степень окисления равна +2, а элемент расположен в VIA группе), гелий, неон, аргон (степень окисления равна 0, а элементы расположены в VIII группе), а также элементы подгруппы кобальта и никеля (степень окисления равна +2, а элементы расположены в VIII группе), для которых высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3).
Примеры решения задач
ПРИМЕР 1
- В сероводороде степень окисления серы равна (-2), а в простом веществе - сере - 0:
Изменение степени окисления серы: -2 → 0, т.е. шестой вариант ответа.
- В простом веществе - сере — степень окисления серы равна 0, а в SO 3 - (+6):
Изменение степени окисления серы: 0 → +6, т.е. четвертый вариант ответа.
- В сернистой кислоте степень окисления серы равна (+4), а в простом веществе - сере - 0:
1×2 +x+ 3×(-2) =0;
Изменение степени окисления серы: +4 → 0, т.е. третий вариант ответа.
ПРИМЕР 2
| Задание | Валентность III и степень окисления (-3) азот проявляет в соединении: а) N 2 H 4 ; б) NH 3 ; в) NH 4 Cl; г) N 2 O 5 |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем поочередно определять валентность и степень окисления азота в предложенных соединениях.
а) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 4-м (1×4 = 4). Разделим полученное значение на число атомов азота в молекуле: 4/2 = 2, следовательно, валентность азота равна II. Этот вариант ответа неверный. б) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 3-м (1×3 = 3). Разделим полученное значение на число атомов азота в молекуле: 3/1 = 2, следовательно, валентность азота равна III. Степень окисления азота в аммиаке равна (-3): Это верный ответ. |
| Ответ | Вариант (б) |