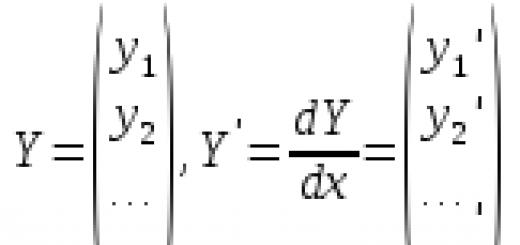Реакция Вюрца
Реакция Вюрца имеет ограниченное применение, поскольку она приводит к соединению двух алкильных групп и, таким образом, к алкану с большим числом атомов углерода, чем в исходных веществах. Таким образом можно получить этан из бромистого метила, н-бутан из бромистого этила и 2,3-диметилбутан из бромистого изопропила.
Реакция Вюрца пригодна только для синтеза симметричных алканов R-R. Например, этим методом нельзя получить с хорошим выходом пропан. Если натрий реагирует со смесью бромистого метила и бромистого этила, то действительно образуется пропан; но он будет в смеси с этаном, образовавшимся при соединении двух метильных групп, и н-бутаном, образовавшимся из двух этильных групп. Значительное количество реагентов расходуется на образование ненужных продуктов; кроме того, возникает проблема разделения. Следовательно, реакция Вюрца непригодна для синтеза несимметричных алканов R-R (R и R - различные алкильные группы).
Хотя многие реакции простых алкилгалогенидов можно распространить и на более сложные галогенсодержащие соединения, это не относится к реакции Вюрца. Металлический натрий - очень реакционноспособное вещество, и он будет реагировать не только с галогеном, но и с любой другой группой, которая может быть в более сложном соединении. Например, реакцию Вюрца нельзя применять для соединений, в которых, кроме галогена, имеется НО-группа, поскольку натрий будет реагировать с гидроксильной группой быстрее, чем с галогеном.
Механизм реакции Вюрца сложный и до конца еще не выяснен, но ясно, что в реакции сначала образуется натрийорганическое соединение, аналогичное магнийорганическому соединению, описанному выше, RX + +2Na = RNa + NaX, которое затем реагирует со второй молекулой алкилгалогенида RNa + RX = R?R + NaX (Реактив Гриньяра менее реакционноспособен, чем натрийорганическое соединение: он реагирует только с некоторыми очень реакционноспособными органическими соединениями.)
Микрокристаллоскопия
Реакция среды оказывает большое, иногда даже решающее значение на протекание опыта. Выбирать среду необходимо учитывая свойства вещества. Некоторые реакции протекают только при определенном значении рН, у других колеблется чувствительность...
Мир солей
Растворы кислоты и основания смешивают в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль...
Мир солей
Этот способ подходит, например, в том случае, если образуется нерастворимая соль...
Мир солей
Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью...
Обмен углеводов в организме животного
С6Н12О6 + 2АТФ + 2Фn 2С3Н6О3 + 2АТФ Глюкоза молочная к-та Следовательно...
Превращения вольфрамат–антимонатов калия и цезия
Образцы №2 и №3 были помещены в азотную кислоту на 7 суток. В результате чего наблюдалось изменение цвета образца №3, он стал лимонного цвета. С образцом №2 таких изменений не произошло. Образцы промыли дистиллированной водой от кислоты...
Реакции ацилирования
Рассмотрим реакцию алкил-д-галогенирования (превращения ацилгалогенидов в кетоны с помощью металлоорганических соединений). Ацилгалогениды гладко и в мягких условиях взаимодействуют с диалкилкупратами лития...
Реакции ацилирования
Также интересна реакция алкил-деацилоксизамещения (превращение ангидридов, сложных эфиров и амидов карбоновых кислот в кетоны с помощью металлоорганических соединений), с помощью которой можно получать кетоны из соединений других классов...
Синтез галогенорганических соединений. Реакция галоформного расщепления
При галогенирования кетонов, индуцируемому основанием, а именно: если образуется б-галогенкетон...
Синтез изобутилового эфира уксусной кислоты реакцией этерификации
Получение изобутилового эфира уксусной кислоты. К бромистому магнийэтилу, приготовленному из 8,2 г магния, 37 г бромистого этила и 200 см3 эфира медленно при охлаждении приливают 25 г изобутилового спирта. Затем смесь слабо кипятят в течение 30 мин....
Синтез непредельных карбонильных соединений
Перекрестная (смешанная) альдольная конденсация ароматических альдегидов с кетонами, приводящая к образованию б,в-ненасыщенных жирноароматических кетонов...
Синтез шестичленных кислородсодержащих гетероциклических соединений
Синтез флавонов и изофлавонов. 2.2 Реакция Ауверса Превращение кумаранонов во флавоны. Дегидробромирование 2-бром-2-(б-бромбензил)-кумарона действием спиртового раствора щелочи...
Термодинамический расчет реакции полимеризации диметилолмочевины
Анализ проведем на примере метакролеина и изопрена. Мономер 1 Мономер 2 Таблица 4 - Состав мономеров Мономер e Q метакролеин 0 1,75 изопрен -1,2 3,3 f1=0,95 f2=0,05 Таблица 5 - Состав сополимера при различных долях мономеров...
Фенолы: методы синтеза и химические свойства
Оригинальный метод введения карбоксильной группы в ароматическое кольцо был открыт Г.Кольбе в 1860 году. При нагревании сухих фенолятов натрия или лития с СО2 при 150-180оС и давлении 5 атм, образуются натриевые или литиевые соли салициловой кислоты...
Химические свойства простых циклических эфиров на примере этилоксирана
При нагревании окиси этилена при температуре около 400 °C или 150--300 °C в присутствии катализаторов (Al2O3, H3PO4 и пр.) происходит изомеризация в ацетальдегид: Радикальный механизм, предложенный Бенсоном для объяснения реакции...
РЕАКЦИЯ ВЮРЦА – химическая реакция, позволяющая получать простейшие органические соединения – предельные углеводороды. Сама реакция Вюрца заключается в конденсации алкилгалогенидов под действием металлического Na, Li или реже K: 2RHal + 2Na = R–R + 2NaHal.Иногда ее трактуют как взаимодействие RNa или RLi с R"Hal.
Реакция была открыта французским химиком-органиком Шарлем Вюрцем (Wurtz Charles (1817–1884) в 1855 при попытке получения этилнатрия из хлористого этила и металлического натрия. Несмотря на то, что реакция Вюрца приводит к образованию новой углерод-углеродной связи, она нечасто применяется в органическом синтезе. В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы, и, как видно из приведенной схемы, для получения заданного углеводорода следует брать только один алкилгалогенид, так как при конденсации двух алкилгалогенидов получается смесь всех трех возможных продуктов сочетания.
Поэтому если используется алкилгалогенид и натрий, реакцией Вюрца можно получить только углеводороды с четным количеством атомов углерода. Наиболее успешно реакция Вюрца протекает с первичными алкилйодидами. Очень низкие выходы целевого продукта получают при использовании метода Вюрца для вторичных алкилгалогенидов. Реакцию обычно проводят в диэтиловом эфире. Использование углеводородов в качестве растворителей уменьшает селективность реакции.
Однако если использовать заранее приготовленное металлоорганическое соединение, например алкиллитий, то можно получить и несимметричные продукты конденсации:
RLi + R"Hal = R – R" + LiHal
В обоих случаях реакция сопровождается образованием большого количества побочных продуктов за счет побочных процессов. Это иллюстрирует пример взаимодействия этиллития с 2-бромоктаном:
.
В этом случае 3-метилнонан и ряд побочных продуктов в указанных молярных соотношениях образуются как продукт реакции Вюрца.
Кроме натрия, в реакции Вюрца использовались такие металлы, как серебро, цинк, железо, медь и индий.
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций для построения карбоциклических систем. Так из 1,3-дибромпропана под действием металлического цинка и йодида натрия (в качестве промотора реакции) может быть получен циклопропан:

Можно построить и другие напряженные карбоциклические системы. Например, из 1,3-дибромадамантана, используя натрий-калиевый сплав, может быть получен 1,3-дегидроадамантан:
 .
.А взаимодействие 1-бром-3-хлор-циклобутана с натрием приводит к бициклобутану:
 .
.Известен ряд разновидностей реакции Вюрца, получивших свои собственные названия. Это реакция Вюрца – Фиттига и реакция Ульмана . Первая заключается в конденсации алкил- и арилгалогенида под действием натрия с образованием алкилароматического производного. В случае реакции Ульмана в конденсацию обычно вводят арилйодиды, а вместо натрия используют свежеприготовленную медь, эта реакция позволяет с высоким выходом получать различные биарильные производные, в том числе, и несимметричные, содержащие заместитель в одном из ароматических ядер:
 .
.Как полагают, механизм реакции Вюрца состоит из двух основных стадий:
1) образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
RHal + 2Na = R–Na + NaHal,
2) взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
RHal + R–Na = RR + NaHal.
В зависимости от природы R и условий проведения реакции вторая стадия процесса может протекать по ионному либо по радикальному механизму.
Источники: ресурсы Интернет
http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/REAKTSIYA_VYURTSA.html
ИМЕННЫЕ РЕАКЦИИ В ОРГАНИЧЕСКОЙ ХИМИИ
1. Реакция М.И. Коновалова
Замещение водорода нитрогруппой в алифатических, ациклических, а также в боковой цепи жирно - ароматических соединений при повышенном или нормальном давлении.
CH 3 -CH 3 + HO-NO 2 ( разб .) = (t=140 o C) CH 3 -CH 2 -NO 2 + H 2 O
2. Реакция Ш . А . Вюрца (c интез Вюрца )
Если к моногалоген-замещённому углеводороду добавить металлический натрий, то образуется два моль галогенида натрия и радикалы углеводородов соединяются между собой, т. е. происходит увеличение углеродной цепи.
2 C 2 H 5 Cl + 2 Na = 2 NaCl + C 4 H 10
3. Реакция Кольбе – Шмидта
Получение углеводородов электролизом растворов солей карбоновых кислот (электрохимический метод).
2CH 3 COONa + 2H 2 O = ( электролиз ) H 2 + 2CO 2 + C 2 H 6 + 2NaOH
4. Реакция Дюма
Способ получения метана из ацетата натрия при сплавлении с твёрдой щёлочью.
CH 3 COONa + NaOH = (t o ) Na 2 CO 3 + CH 4
5. Реакция Г . Г . Густавсона
Получение циклоалканов из дигалоген-замещённых.
CH 2 (Cl)-CH 2 -CH 2 (Cl) + Zn = (t o ) ZnCl 2 + C 3 H 6 ( циклопропан )
6. Правило В.В. Марковникова
При присоединении галогенводорода к алкену (или алкину) водород присоединяется к более гидрированному (или гидрогенизированному) атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген – к менее гидрированному.
CH 3 -CH=CH 2 + HCl = (t o , AlCl3) CH3-CH(Cl)-CH 3
7. Правило А.М. Зайцева
При отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрированного (или гидрогенизированного) атома углерода.
CH 3 -CH 2 -CH(Cl)-CH 3 + KOH ( спирт . р - р ) = (t o ) CH 3 -CH=CH-CH 3 + KCl + H 2 O
CH 3 -CH(OH)-CH 2 -CH 3 = (t=170 o C, H2SO4 конц .) CH 3 -CH=CH-CH 3 + H 2 O
8. Реакция Е . Е . Вагнера
Окисление алкенов перманганатом калия в слабощелочной среде, приводящее к образованию гликолей.
3CH 2 =CH 2 + 2KMnO 4 + 4H 2 O = 3CH 2 (OH)- CH 2 (OH) + 2MnO 2 + 2KOH
9. Реакция С.В. Лебедева
Одновременное дегидрирование и дегидратация этилового спирта в присутствии амфотерных оксидов с образование бутадиена-1,3.
2C 2 H 5 OH = (t=425 о C, Al2O3 или Cr2O3) CH 2 =CH-CH=CH 2 + 2H 2 O + H 2
10. Реакция М.Г. Кучерова
Гидратация ацетилена в присутствии солей ртути с образованием ацетальдегида.
C 2 H 2 + H 2 O = ( Hg 2+ ) CH 3 COH
11. Реакция Фриделя – Крафтса
Реакция получения гомологов бензола в присутствии хлорида алюминия.
C 6 H 6 + CH 3 Cl = (t o , AlCl3) C 6 H 5 -CH 3 + HCl
12. Реакции Н.Д. Зелинского (получение бензола)
дегидрирование циклогексана C 6 H 12 = ( t =300 о C , Pt . Pd ) C 6 H 6 + 3H 2
дегидроциклизация (или ароматизация) гексана C 6 H 14 = ( t =300 о C , Pt ) C 6 H 6 + 4 H 2
тримеризация ацетилена на активированном угле 3 C 2 H 2 = (акт. уголь) C 6 H 6
13. Реакция Вюрца – Фиттига
Взаимодействие натрия со смесью галогенбензола и галогеналкана с образованием толуола.
C 6 H 5 Cl + 2Na + CH 3 Cl = (t o ) C 6 H 5 -CH 3 + 2NaCl
14. Реакция Сергеева – Удрисома – Кружалова
Получение фенола из бензола через кумол (Кумольный способ).
I стадия . C 6 H 6 + CH 2 =CH-CH 3 = (t o , AlCl3) C 6 H 5 CH(CH 3 ) 2
II стадия . C 6 H 5 CH(CH 3 ) 2 + O 2 = (t o , H2SO4) C 6 H 5 -OH + CH 3 -C(O)-CH 3
15. Реакция А.У. Уильямсон (синтез Вильямсона)
Получения простых эфиров алкилированием алкоголятов или фенолятов алкилгалогенидами.
CH 3 ONa + CH 3 Cl = (t o ) NaCl + CH 3 -O-CH 3
16. Реакция К.С. Кирхгофа
Реакция превращения крахмала в глюкозу при каталитическом действии серной кислоты.
( C 6 H 10 O 5 ) n (+ H 2 O , ферменты) ( C 6 H 10 O 5 ) x (+ H 2 O , ферменты) C 12 H 22 O 11 (+ H 2 O , ферменты) n C 6 H 12 O 6
17. Реакция Н.Н. Зинина
Метод получения ароматических аминов (в том числе анилина) восстановлением нитросоединений.
C 6 H 5- NO 2 + 3H 2 = C 6 H 5- NH 2 + 2H 2 O
РЕАКЦИЯ ВЮРЦА – химическая реакция, позволяющая получать простейшие органические соединения – предельные углеводороды.
Сама реакция Вюрца заключается в конденсации алкилгалогенидов под действием металлического Na, Li или реже K:
2RHal + 2Na ® R–R + 2NaHal.
Иногда ее трактуют как взаимодействие RNa или RLi с R"Hal.
Реакция была открыта французским химиком-органиком Шарлем Вюрцем (Wurtz Charles (1817–1884) в 1855 при попытке получения этилнатрия из хлористого этила и металлического натрия.
Несмотря на то, что реакция Вюрца приводит к образованию новой углерод-углеродной связи, она нечасто применяется в органическом синтезе. В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы, и, как видно из приведенной схемы, для получения заданного углеводорода следует брать только один алкилгалогенид, так как при конденсации двух алкилгалогенидов получается смесь всех трех возможных продуктов сочетания. Поэтому если используется алкилгалогенид и натрий, реакцией Вюрца можно получить только углеводороды с четным количеством атомов углерода. Наиболее успешно реакция Вюрца протекает с первичными алкилйодидами. Очень низкие выходы целевого продукта получают при использовании метода Вюрца для вторичных алкилгалогенидов. Реакцию обычно проводят в диэтиловом эфире. Использование углеводородов в качестве растворителей уменьшает селективность реакции.
Однако если использовать заранее приготовленное металлоорганическое соединение, например алкиллитий, то можно получить и несимметричные продукты конденсации:
RLi + R"Hal ® R – R" + LiHal
В обоих случаях реакция сопровождается образованием большого количества побочных продуктов за счет побочных процессов. Это иллюстрирует пример взаимодействия этиллития с 2-бромоктаном:
В этом случае 3-метилнонан и ряд побочных продуктов в указанных молярных соотношениях образуются как продукт реакции Вюрца.
Кроме натрия, в реакции Вюрца использовались такие металлы, как серебро , цинк , железо , медь и индий.
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций для построения карбоциклических систем. Так из 1,3-дибромпропана под действием металлического цинка и йодида натрия (в качестве промотора реакции) может быть получен циклопропан:
Можно построить и другие напряженные карбоциклические системы. Например, из 1,3-дибромадамантана, используя натрий-калиевый сплав, может быть получен 1,3-дегидроадамантан:
А взаимодействие 1-бром-3-хлор-циклобутана с натрием приводит к бициклобутану:
Известен ряд разновидностей реакции Вюрца, получивших свои собственные названия. Это реакция Вюрца – Фиттига и реакция Ульмана. Первая заключается в конденсации алкил- и арилгалогенида под действием натрия с образованием алкилароматического производного. В случае реакции Ульмана в конденсацию обычно вводят арилйодиды, а вместо натрия используют свежеприготовленную медь, эта реакция позволяет с высоким выходом получать различные биарильные производные, в том числе, и несимметричные, содержащие заместитель в одном из ароматических ядер:
Как полагают, механизм реакции Вюрца состоит из двух основных стадий:
1) образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
RHal + 2Na ® R–Na + NaHal,
2) взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
RHal + R–Na ® RR + NaHal.
В зависимости от природы R и условий проведения реакции вторая стадия процесса может протекать по ионному либо по радикальному механизму.
Владимир Корольков
В промышленности обычно получают вещество в больших количествах, стремясь к максимальной рентабельности. Часто можно использовать не чистое органическое соединение, а смесь. В ряде случаев экономически выгодно проводить разделение даже сложных смесей, в особенности, если одновременно удается выделить и другие полезные вещества. Известно много случаев, когда оказывается прибыльна разработка уникального метода синтеза и построение специального предприятия для выпуска высокорентабельного вещества.
В лаборатории обычно необходимо синтезировать небольшие количества вещества (граммы и доли грамма). В исследованиях химикам почти всегда необходимы индивидуальные вещества, а не смеси. В отличие от промышленности время имеет большую ценность, чем цена. Кроме того, лабораторные синтезы всегда гибкие, потому что исследователь не заинтересован в многократном повторении изученного процесса. Поэтому используются методы, позволяющие быстро, с высоким выходом получить целевой продукт с минимальным содержанием примесей.
Важно, что лабораторные (но не промышленные) методы, как правило, могут быть распространены на весь класс синтезируемых соединений.
В ходе изучения курса органической химии основное внимание направлено на лабораторные методы получения. При решении задач не следует использовать промышленные методы, даже в том случае, если они используются для получения именно того вещества, синтез которого необходимо спланировать. Например, если в ходе синтеза необходимо синтезировать этилен, его следует получать, используя общие методы синтеза алкенов, хотя это соединение в огромных количествах получают крекингом.
Алкены и алкины в присутствии гетерогенных катализаторов, таких как Pt, Pd, Ni, легко присоединяют один или два моль водорода при незначительном нагревании и невысоком давлении. При этом количественно образуются алканы с тем же углеродным скелетом.
Галогенопроизводные насыщенных углеводородов могут быть восстановлены до алканов металлом в кислой среде:
Алканы могут быть получены гидролизом реактивов Гриньяра:
Приведенные выше методы позволяют синтезировать алканы, имеющие такой же углеродный скелет, как в исходной молекуле.
Для синтеза парафинов, строение углеродной цепи которых отличается от исходных веществ, известно несколько методов. Моногалогенопроизводные алканов при взаимодействии с металлическим натрием превращаются в предельные углеводороды по реакции Вюрца. В ходе реакции образуется углерод-углеродная связь между атомами углерода, связанными в исходном соединении с галогенами .

Реакция Вюрца может быть использована исключительно для синтеза симметричных алканов (R- R) с четным числом углеродных атомов . Во избежание образования смесей алканов в эту реакцию нужно вводить только одно галогенопроизводное.
Ограничения реакции Вюрца понятны из следующего примера.

В реакции образуется смесь пропана, этана и н -бутана. Поскольку скорости реакций близки, невозможно предложить условия, в которых образование пропана будет преобладающим процессом. Следовательно, две трети исходных веществ будут израсходованы впустую. Кроме того, возникает сложная проблема разделения продуктов реакции.
При распространении реакции Вюрца на более сложные галогенопроизводные следует соблюдать осторожность. Щелочные металлы обладают очень высокой реакционной способностью. Если в молекуле, кроме атома галогена, есть функциональные группы, в большинстве случаев реакция натрия или калия с ними пойдет быстрее, чем с галогеном. Не имеет смысла даже пытаться проводить реакцию Вюрца, если в молекуле наряду с галогеном есть гидрокси- (OH), карбокси- (СOOH), сульфо- (SO 3 H) и многие другие группировки.
Одним из способов получения алканов является реакция декарбоксилирования (отщепления СО 2) солей карбоновых кислот. В некоторых случаях этот процесс происходит очень легко уже при незначительном нагревании. Hасыщенные карбоновые кислоты алифатического ряда отщепляют карбоксильную группу только при прокаливании их солей со щелочью.

В результате декарбоксилирования образуется алкан, содержащий на один атом углерода меньше, чем было в исходной кислоте.
Если соль карбоновой кислоты алифатического ряда подвергнуть электролизу (анодный синтез Кольбе), то на аноде карбоксилат-анион отдает электроду один электрон, превращаясь в нестабильный радикал. Выброс СО 2 приводит к алкильному радикалу. При рекомбинации двух алкильных радикалов образуется симметричный алкан с четным числом атомов углерода.

Лекция № 8
Углеводороды
· Алкены. Гомологический ряд, номенклатура, виды изомерии. Геометрическая изомерия в ряду алкенов. Цис- и транс- изомеры, E,Z-номенклатура. Причины отсутствия свободного вращения относительно двойной связи. Физические свойства, закономерности их изменения в гомологическом ряду и спектральные характеристики алкенов.
· Методы получения: дегидрирование алканов, крекинг нефти, частичное гидрирование алкинов, дегалогенирование, дегидрогалогенирование галогеналканов и дегидратация спиртов (правило Зайцева).
Алкены (олефины, этиленовые углеводороды)
Алкены - открытоцепные углеводороды, отвечающие общей формуле C n H 2 n .и содержащие в молекуле одну двойную связь (p-связь).
По сравнению с алканами соответствующие этиленовые углеводороды образуют большее число изомеров, что связано не только с различиями в углеродных скелетах, но также с расположением двойной связи и геометрией молекулы.
Рассмотрим изомерию алкенов с четырьмя атомами углерода. Кроме структурных изомеров есть изомеры положения двойной связи (бутен-1 и бутен-2). Бутен-2 может существовать в виде двух изомеров, отличающихся пространственным расположением заместителей относительно двойной связи. Поскольку свободное вращение относительно p-связи невозможно (барьер 60 ккал) и весь фрагмент молекулы лежит в одной плоскости, метильные группы могут располагаться либо с одной стороны от двойной связи, либо с противоположных сторон. В названии первых используют приставку цис - (с одной стороны – лат.), вторых – транс - (через – лат.). Такой вид пространственной изомерии называется геометрической.