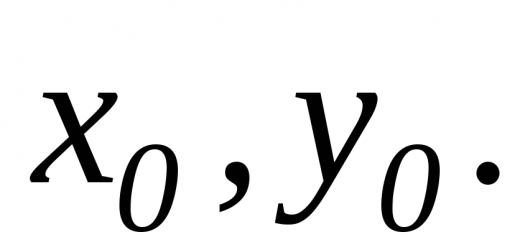أهداف الدرس:
- إعطاء فكرة عن الرابطة العطرية، وخصائصها، وتحديد العلاقة بين بنية البنزين وخصائصه؛
- تعزيز القدرة على مقارنة تكوين وبنية الهيدروكربونات من سلاسل مختلفة؛
- إدخال الخصائص الفيزيائية للبنزين.
- إظهار التأثيرات السامة للأرين على صحة الإنسان.
الخطوط العريضة للمحاضرة
- اشتقاق الصيغة الجزيئية والهيكلية للبنزين.
- تاريخ اكتشاف البنزين.
- صيغة كيكولي.
- هيكل البنزين.
- مفهوم "العطرية".
- ظهور مصطلح “المركبات العطرية”.
- الخصائص الفيزيائية للبنزين.
- الآثار السامة للأرين على جسم الإنسان.
- تعزيز المواد المغطاة.
- العمل في المنزل.
في بداية الدرس، أطلب من الطلاب حل مسألة لاشتقاق صيغة المادة.
مهمة. عند حرق 2.5 جم من المادة، تم إطلاق 8.46 جم من ثاني أكسيد الكربون و1.73 جم من الماء. كتلة 1 لتر من المادة 3.5 جم حدد الصيغة الجزيئية والتركيبية المحتملة للمادة.
عند حل المشكلة، يستنتج الطلاب الصيغة الجزيئية للمادة – C 6 H 6 . ينشأ موقف إشكالي: "ما هي البنية التي يمكن أن يمتلكها جزيء البنزين؟" بناءً على المعرفة حول الهيدروكربونات غير المشبعة، يقترح الطلاب الصيغ الهيكلية الممكنة لها:
NS C-CH 2 -CH 2 - C CH
H 2 C = CH -C C-CH = CH 2 وغيرها.
يستنتج الطلاب أن البنزين مركب غير مشبع بدرجة عالية ويتذكرون ردود الفعل النوعية لعدم التشبع.
أدعو الطلاب إلى اختبار الفرضية المتعلقة بعدم تشبع البنزين أثناء التجربة. بعد إجراء تفاعلات البنزين مع ماء البروم ومحلول برمنجنات البوتاسيوم، توصل الطلاب إلى استنتاج مفاده أن البنزين، كونه نظامًا غير مشبع، لا يعطي تفاعلات عالية الجودة لعدم التشبع، لذلك لا يمكن تصنيفه على أنه هيدروكربون غير مشبع .
ما البنية التي يمتلكها جزيء البنزين، وإلى أي فئة من الهيدروكربونات يمكن تصنيفه؟
قبل الإجابة على هذا السؤال، أقدم للطلاب تاريخ اكتشاف البنزين، وهو أمر مثير للاهتمام للغاية. ظهرت الإضاءة بالغاز لأول مرة في لندن بين عامي 1812 و1815. تم تسليم الغاز المضيء المستخرج من دهون الحيوانات البحرية في اسطوانات حديدية. وكانت هذه الأسطوانات توضع عادة في قبو المنزل، ومنه يتم توزيع الغاز عبر أنابيب في جميع أنحاء الغرفة. وسرعان ما لوحظ وجود ظرف مزعج للغاية - في البرد الشديد، فقد الغاز قدرته على إنتاج ضوء ساطع عند الاحتراق. لجأ أصحاب مصنع الغاز في عام 1825 إلى فاراداي للحصول على المشورة، الذين وجدوا أن تلك المكونات القادرة على الاحتراق بلهب ساطع تتجمع في قاع الاسطوانة على شكل طبقة سائلة شفافة. أثناء دراسة هذا السائل، اكتشف فاراداي هيدروكربون جديد - البنزين. تم إعطاء اسم هذه المادة بواسطة Liebig - (تشير اللاحقة -ol إلى طبيعتها الزيتية، من الكلمة اللاتينية oleum - النفط).
في عام 1865، اقترح العالم الألماني كيكولي بنية جزيء البنزين، والذي حلم به على شكل ثعبان يعض ذيله:

لكن هذه الصيغة، رغم أنها تتوافق مع التركيب العنصري للبنزين، إلا أنها لا تتوافق مع العديد من ميزاته:
- البنزين لا يعطي ردود فعل نوعية لعدم التشبع.
- ويتميز البنزين بتفاعلات الاستبدال وليس الإضافة؛
- صيغة كيكولي غير قادرة على تفسير تساوي المسافات بين ذرات الكربون، والذي يحدث في جزيء البنزين الحقيقي.
وللخروج من هذه الصعوبة، اعترف كيكولي بوجود حركة مستمرة للروابط المزدوجة في البنزين.

إن استخدام أساليب البحث الفيزيائية والكمية الحديثة جعل من الممكن خلق فهم شامل لبنية البنزين.
تكون ذرات الكربون الموجودة في جزيء البنزين في حالة التكافؤ الثاني (sp 2). تشكل كل ذرة كربون روابط مع ذرتي كربون أخريين وذرة هيدروجين واحدة تقع في نفس المستوى. زوايا الرابطة بين الروابط الثلاثة هي 120 درجة. وبالتالي، فإن جميع ذرات الكربون الست تقع في نفس المستوى، وتشكل شكلًا سداسيًا منتظمًا (الشكل 1):

أرز. 1. مخطط تشكيل -الاتصالات
في جزيء البنزين
تحتوي كل ذرة كربون على مدار واحد غير هجين. توجد ستة مدارات من هذا القبيل بشكل متعامد مع مستوى الروابط ومتوازية مع بعضها البعض (الشكل 2). تتفاعل جميع الإلكترونات الستة مع بعضها البعض، لتشكل سحابة إلكترون واحدة. وهكذا يحدث الاقتران الدائري في جزيء البنزين. توجد أعلى كثافة إلكترون في هذا النظام المترافق أعلى وأسفل مستوى الحلقة (الشكل 3):
ونتيجة لهذا التداخل الموحد للمدارات 2p لجميع ذرات الكربون الستة، يحدث "محاذاة" الروابط المفردة والمزدوجة - طول الرابطة هو 0.139 نانومتر. هذه القيمة متوسطة بين طول الرابطة المفردة في الألكانات (0.154 نانومتر) وطول الرابطة المزدوجة في الألكينات (0.133 نانومتر). أي أن جزيء البنزين يفتقر إلى الروابط الكلاسيكية المزدوجة والمفردة.
يعطي الاقتران الدائري كسبًا للطاقة قدره 150 كيلوجول/مول. تشكل هذه القيمة طاقة الاقتران - كمية الطاقة التي يجب إنفاقها لتعطيل النظام العطري للبنزين.
يشرح هذا الهيكل الإلكتروني جميع ميزات البنزين. على وجه الخصوص، لماذا يصعب إدخال البنزين في تفاعلات الإضافة - وهذا يؤدي إلى انتهاك الاقتران. ردود الفعل هذه ممكنة في ظل ظروف قاسية.
حاليًا، لا توجد طريقة واحدة لتصوير جزيء البنزين بيانيًا مع الأخذ في الاعتبار خصائصه الحقيقية. ولكن من أجل التأكيد على انتظام كثافة الإلكترون في جزيء البنزين، لجأوا إلى الصيغ التالية:

كما أنهم يستخدمون صيغة Kekule، مع الأخذ في الاعتبار عيوبها.
تسمى مجموعة خصائص البنزين عادة بالعطرية. وبشكل عام، فإن ظاهرة العطرية صاغها الفيزيائي الألماني هوكل: يجب أن يظهر المركب خصائص عطرية إذا كان جزيئه يحتوي على حلقة مسطحة بها إلكترونات (4n+2)، حيث يمكن أن تأخذ n القيم 0، 1، 2، 3، الخ. ووفقا لهذه القاعدة، فإن الأنظمة التي تحتوي على 6، 10، 14 إلكترونًا تكون عطرية.
ومن أمثلة هذه المركبات النفثالين (ن=2) والأنثراسين (ن=3).
بعد مراجعة بنية البنزين، نناقش إجابات الأسئلة مع الطلاب:
- هل يمكن تصنيف البنزين على أنه هيدروكربونات غير مشبعة؟ برر جوابك.
- إلى أي فئة من الهيدروكربونات ينتمي البنزين؟
- ما المقصود بمصطلح "المركب العطري"؟
- ما هي الهيدروكربونات التي تسمى العطرية؟
بعد ذلك، سأعرّف الطلاب على أصل مصطلح "المركبات العطرية". أبلغكم أن هذا الاسم نشأ في الفترة الأولى من تطور الكيمياء. وقد لوحظ أنه يتم الحصول على مركبات البنزين أثناء تقطير بعض المواد ذات الرائحة الطيبة (العطرية) - الراتنجات الطبيعية والبلسم. ومع ذلك، فإن معظم المركبات العطرية عديمة الرائحة أو كريهة الرائحة. ولكن تم الحفاظ على هذا المصطلح في الكيمياء. الهيدروكربونات العطرية (أرينات) هي مواد تحتوي جزيئاتها على حلقة بنزين واحدة أو أكثر - مجموعات حلقية من ذرات الكربون ذات طابع خاص من الروابط.
بعد ذلك، يتعرف الطلاب على الخصائص الفيزيائية للبنزين من خلال العمل مع الأدبيات التعليمية. وهم يعرفون أن البنزين سائل ويمكن أن يكون أيضًا في حالة بخار (أثناء اختبار الرائحة). أقدم للطلاب البنزين في الحالة الصلبة. نقطة انصهار البنزين هي 5.5 درجة مئوية. بناءً على هذه المعلومات، قمت بتوضيح تحول البنزين السائل إلى كتلة بلورية بيضاء. للقيام بذلك، وضعت 4-5 مل من البنزين في أنبوب اختبار في وعاء مملوء بالثلج أو الجليد. بعد بضع دقائق، لاحظ الطلاب تغيرًا في حالة تجميع البنزين. بناءً على الملاحظات، يقترح الطلاب أن هذه المادة يجب أن تحتوي على شبكة بلورية جزيئية.
ألفت انتباه الطلاب إلى حقيقة أن البنزين مادة شديدة السمية. واستنشاق أبخرةه يسبب الدوخة والصداع. عند التركيزات العالية من البنزين، من الممكن حدوث حالات فقدان الوعي. أبخرته تهيج العيون والأغشية المخاطية.
يخترق البنزين السائل الجسم بسهولة عبر الجلد، مما قد يؤدي إلى التسمم. ولذلك، فإن العمل مع البنزين ومماثلاته يتطلب عناية خاصة.
أستخدم المادة المتعلقة بموضوع "البنزين" لشرح أضرار التدخين. أظهرت الدراسات التي أجريت على مادة تشبه القطران يتم الحصول عليها من دخان التبغ أنها تحتوي بالإضافة إلى النيكوتين على هيدروكربونات عطرية مثل البنزوبيرين،

لها خصائص مسرطنة قوية، أي أن هذه المواد تعمل كعوامل مسببة للسرطان. يتسبب قطران التبغ عند ملامسته للجلد والرئتين في تكوين أورام سرطانية. المدخنون هم أكثر عرضة للإصابة بسرطان الشفة واللسان والحنجرة والمريء. هم أكثر عرضة للمعاناة من الذبحة الصدرية واحتشاء عضلة القلب. وألاحظ أن المدخن يطلق نحو 50% من المواد السامة في الفضاء المحيط به، مما يخلق حوله حلقة من "المدخنين السلبيين" الذين يصابون بسرعة بالصداع والغثيان والضيق العام، ومن ثم قد يصابون بأمراض مزمنة.
في نهاية الدرس أقوم بإجراء مسح أمامي حول الأسئلة التالية:


العمل في المنزل: ص 55-58، ص 61 رقم 1، 2 وفقًا للكتاب المدرسي من تأليف E. E. Nifantiev، L. A. Tsvetkova "الكيمياء 10-11".
التركيب الكيميائي
تشكل ذرات الكربون الموجودة في جزيء البنزين شكلا سداسيا مسطحا منتظما، على الرغم من أنه عادة ما يتم رسمه على شكل مستطيل.
تم تأكيد بنية جزيء البنزين أخيرًا من خلال تفاعل تكوينه من الأسيتيلين. تصور الصيغة الهيكلية ثلاث روابط كربون-كربون مفردة وثلاثية مزدوجة بالتناوب. لكن مثل هذه الصورة لا تنقل البنية الحقيقية للجزيء. في الواقع، روابط الكربون-الكربون في البنزين متكافئة، ولها خصائص تختلف عن تلك الموجودة في الروابط الفردية أو المزدوجة. يتم تفسير هذه الميزات من خلال التركيب الإلكتروني لجزيء البنزين.
الهيكل الإلكتروني للبنزين
كل ذرة كربون في جزيء البنزين تكون في حالة تهجين sp2. وهو متصل بذرتي كربون مجاورتين وذرة هيدروجين بواسطة ثلاث روابط y. ونتيجة لذلك، يتم تشكيل مسدس مسطح: جميع ذرات الكربون الست وجميع روابط y C--C و C--H تقع في نفس المستوى. السحابة الإلكترونية للإلكترون الرابع (p-electron)، والتي لا تشارك في التهجين، لها شكل الدمبل وموجهة بشكل عمودي على مستوى حلقة البنزين. تتداخل سحب الإلكترون p هذه من ذرات الكربون المجاورة فوق مستوى الحلقة وتحته. ونتيجة لذلك، تشكل ستة إلكترونات p سحابة إلكترونية مشتركة ورابطة كيميائية واحدة لجميع ذرات الكربون. توجد منطقتان من مستوى الإلكترون الكبير على جانبي مستوى y-bond.
تتسبب سحابة الإلكترون p في تقليل المسافة بين ذرات الكربون. في جزيء البنزين هما متساويان ويساويان 0.14 نانومتر. في حالة الرابطة الفردية والمزدوجة، ستكون هذه المسافات 0.154 و0.134 نانومتر، على التوالي. وهذا يعني أنه لا توجد روابط مفردة أو مزدوجة في جزيء البنزين. جزيء البنزين عبارة عن دورة مستقرة مكونة من ستة أعضاء من مجموعات CH متطابقة تقع في نفس المستوى. جميع الروابط بين ذرات الكربون في البنزين متكافئة، وهو ما يحدد الخصائص المميزة لحلقة البنزين. وينعكس هذا بدقة أكبر في الصيغة البنائية للبنزين على شكل مسدس منتظم بداخله دائرة (I). (ترمز الدائرة إلى تكافؤ الروابط بين ذرات الكربون.) ومع ذلك، غالبًا ما تُستخدم صيغة كيكولي التي تشير إلى الروابط المزدوجة (II).
الهيدروكربونات العطرية– مركبات الكربون والهيدروجين التي يحتوي جزيئها على حلقة بنزين. أهم ممثلي الهيدروكربونات العطرية هم البنزين ومماثلاته - منتجات استبدال ذرة هيدروجين واحدة أو أكثر في جزيء البنزين بمخلفات الهيدروكربون.
هيكل جزيء البنزين
تم اكتشاف أول مركب عطري، البنزين، في عام 1825 من قبل م. فاراداي. تم إنشاء صيغته الجزيئية - C 6 H 6. إذا قارنا تركيبته بتركيبة هيدروكربون مشبع يحتوي على نفس العدد من ذرات الكربون - الهكسان (C 6 H 14)، فيمكننا أن نرى أن البنزين يحتوي على ثماني ذرات هيدروجين أقل . وكما هو معروف فإن ظهور روابط ودورات متعددة يؤدي إلى انخفاض عدد ذرات الهيدروجين في جزيء الهيدروكربون. في عام 1865، اقترح ف. كيكولي صيغته البنائية على شكل سيكلوهكسانثرين - 1، 3، 5.

وبالتالي، فإن الجزيء المقابل صيغة كيكولييحتوي على روابط مزدوجة، لذلك يجب أن يكون البنزين غير مشبع، أي أنه يجب أن يخضع بسهولة لتفاعلات الإضافة: الهدرجة، والبرومة، والترطيب، وما إلى ذلك.
ومع ذلك، فقد أظهرت بيانات العديد من التجارب أن البنزين يدخل في تفاعلات الإضافة فقط في ظل ظروف قاسية (في درجات حرارة عالية وإضاءة) ومقاوم للأكسدة. وأكثر التفاعلات المميزة له هي تفاعلات الاستبدال، وبالتالي فإن البنزين أقرب في طبيعته إلى الهيدروكربونات الهامشية.
في محاولة لشرح هذه التناقضات، اقترح العديد من العلماء خيارات مختلفة لبنية البنزين. تم تأكيد بنية جزيء البنزين أخيرًا من خلال تفاعل تكوينه من الأسيتيلين. في الواقع، روابط الكربون-كربون في البنزين متكافئة، وخصائصها لا تشبه خصائص الروابط الفردية أو المزدوجة.
يُشار إلى البنزين حاليًا إما بصيغة Kekule أو بالمسدس الذي تظهر فيه الدائرة.
![]()
إذن ما الذي يميز بنية البنزين؟ وبناء على بيانات وحسابات الباحثين، تم التوصل إلى أن ذرات الكربون الست جميعها في حالة واحدة sp 2 - التهجين والكذب في نفس الطائرة. غير مهجن ص- مدارات ذرات الكربون التي تشكل روابط مزدوجة (صيغة كيكولي) تكون متعامدة مع مستوى الحلقة ومتوازية مع بعضها البعض.
أنها تتداخل مع بعضها البعض، وتشكل نظام π واحد. وبالتالي، فإن نظام الروابط المزدوجة المتناوبة الموضح في صيغة كيكولي هو نظام دوري من الروابط المترافقة والمتداخلة. يتكون هذا النظام من منطقتين حلقيتين (تشبهان الدونات) ذات كثافة إلكترونية تقعان على جانبي حلقة البنزين. وبالتالي، فمن المنطقي أكثر تصوير البنزين على أنه مسدس منتظم بدائرة في المركز (نظام π) بدلاً من سيكلوهيكساترين -1،3،5. 
اقترح العالم الأمريكي L. Pauling تمثيل البنزين في شكل هيكلين حدوديين يختلفان في توزيع كثافة الإلكترون ويتحولان باستمرار إلى بعضهما البعض، أي اعتباره مركبًا متوسطًا، "متوسط" بين هيكلين.
تؤكد قياسات طول السندات هذه الافتراضات. وقد وجد أن جميع روابط CC في البنزين لها نفس الطول (0.139 نانومتر). وهي أقصر قليلاً من روابط CC المفردة (0.154 نانومتر) وأطول من الروابط المزدوجة (0.132 نانومتر).
هناك أيضًا مركبات تحتوي جزيئاتها على عدة هياكل حلقية.

الايزومرية والتسميات
تتميز متجانسات البنزين بـ إيزومرية موقف العديد من البدائل. أبسط تماثل للبنزين - التولوين (ميثيل بنزين) - لا يحتوي على مثل هذه الأيزومرات. يتم تقديم المتماثل التالي كأربعة أيزومرات:

أساس اسم الهيدروكربون العطري مع بدائل صغيرة هو الكلمة البنزين. يتم ترقيم الذرات الموجودة في الحلقة العطرية من أعلى إلى أدنى بديل:

وفقا للتسمية القديمة، يتم استدعاء الموضعين 2 و 6 تقويم العظام, 4 - زوج-و 3 و 5 - الأحكام الفوقية.
الخصائص الفيزيائية
في الظروف العادية، يعتبر البنزين وأبسط متجانساته سوائل شديدة السمية ذات رائحة كريهة مميزة. أنها تذوب بشكل سيئ في الماء، ولكن بشكل جيد في المذيبات العضوية.
الخواص الكيميائية للبنزين
ردود الفعل الاستبدال. تخضع الهيدروكربونات العطرية لتفاعلات الاستبدال.
1. البرومة.عند التفاعل مع البروم في وجود عامل محفز، بروميد الحديد (ΙΙΙ)، يمكن استبدال إحدى ذرات الهيدروجين في حلقة البنزين بذرة البروم:

2. نترات البنزين ومماثلاته. عندما يتفاعل الهيدروكربون العطري مع حمض النيتريك في وجود حمض الكبريتيك (يسمى خليط من حمض الكبريتيك والنيتريك خليط النترات)، يتم استبدال ذرة الهيدروجين بمجموعة نيترو -NO2:

عن طريق تقليل النيتروبنزين المتكون في هذا التفاعل، يتم الحصول على الأنيلين، وهي مادة تستخدم للحصول على أصباغ الأنيلين:

سمي هذا التفاعل على اسم الكيميائي الروسي زينين.
تفاعلات الإضافة.يمكن للمركبات العطرية أيضًا أن تخضع لتفاعلات إضافة إلى حلقة البنزين. في هذه الحالة، يتم تشكيل الهكسان الحلقي أو مشتقاته.
1. الهدرجة. تحدث الهدرجة الحفزية للبنزين عند درجة حرارة أعلى من هدرجة الألكينات:
![]()
2. الكلورة.يحدث التفاعل عند إضاءته بالأشعة فوق البنفسجية وهو عبارة عن جذر حر:

متجانسات البنزين
يتوافق تكوين جزيئاتها مع الصيغة C n H 2 n-6. أقرب متجانسات البنزين هي:
جميع متجانسات البنزين التي تلي التولوين لها أيزومرات. يمكن أن ترتبط الأيزومرية بعدد وبنية البديل (1، 2)، وبموضع البديل في حلقة البنزين (2، 3، 4). مركبات الصيغة العامة C8H10:

وفقًا للتسمية القديمة المستخدمة للإشارة إلى الموقع النسبي لبديلين متطابقين أو مختلفين على حلقة البنزين، يتم استخدام البادئات أورثو- (مختصر o-) - توجد البدائل في ذرات الكربون المجاورة، ميتا-(م-) – من خلال ذرة كربون واحدة و زوج— (ص-) - البدائل ضد بعضهم البعض.
الأعضاء الأولون في سلسلة البنزين المتجانسة هم سوائل ذات رائحة معينة. فهي أخف من الماء. إنها مذيبات جيدة.
تتفاعل متجانسات البنزين البدائل (البروم، النتروجين). يتأكسد التولوين بواسطة برمنجنات عند تسخينه:

تُستخدم متجانسات البنزين كمذيبات لإنتاج الأصباغ ومنتجات وقاية النباتات والمواد البلاستيكية والأدوية.



















مذكرة للمحاضرة 5





محاضرة 5
الهيدروكربونات العطرية
الكلمات المفتاحية: الهيدروكربونات العطرية، الأرينات، تهجين sp2، سحابة إلكترونية مفردة، الاقتران الدائري، آلية تفاعل الاستبدال الأيوني، الاستبدال الإلكتروفيلي، النترتة، الهلجنة، ألكلة فريدل كرافت، الألكلة مع الألكينات، الهدرجة، الأكسدة.
بنية جزيء البنزين. العطرية
الهيدروكربونات العطرية (arenes) هي هيدروكربونات تحتوي جزيئاتها على حلقة بنزين واحدة أو أكثر.
أبسط ممثل للهيدروكربونات العطرية هو البنزين، وصيغته الجزيئية هي C6H6. لقد ثبت أن جميع ذرات الكربون الموجودة في جزيء البنزين تقع في نفس المستوى، وتشكل شكلًا سداسيًا منتظمًا (الشكل 1). ترتبط كل ذرة كربون بذرة هيدروجين واحدة. أطوال جميع روابط الكربون الكربونية هي نفسها وتبلغ 0.139 نانومتر.
تم اقتراح الصيغتين أ) و ب) في عام 1865 من قبل الكيميائي الألماني أوغست كيكولي. على الرغم من أنها لا تنقل بدقة بنية جزيء البنزين، إلا أنها لا تزال تستخدم حتى اليوم وتسمى صيغ كيكولي.
تاريخياً، جاء اسم "الهيدروكربونات العطرية" لأن العديد من مشتقات البنزين، التي كانت أول من تم عزلها من المصادر الطبيعية، كانت ذات رائحة طيبة.
حاليًا، يعني مفهوم "العطرية" في المقام الأول الطبيعة الخاصة لتفاعل المواد، والتي بدورها يتم تحديدها من خلال السمات الهيكلية لجزيئات هذه المركبات.
ما هي هذه الميزات؟
وفقا للصيغة الجزيئية C 6 H 6، فإن البنزين مركب غير مشبع، ومن المتوقع أن يخضع لتفاعلات إضافة نموذجية للألكينات. ومع ذلك، في الظروف التي تخضع فيها الألكينات لتفاعلات إضافة سريعة، لا يتفاعل البنزين أو يتفاعل ببطء. البنزينلا يعطي تفاعلات نوعية مميزة مميزة للهيدروكربونات غير المشبعة: فهو لا يغير لون ماء البروم والمحلول المائي لبرمنجنات البوتاسيوم.
يتم تفسير طبيعة التفاعل هذه من خلال وجود نظام مترافق في الحلقة العطرية - نظام واحد ص-سحابة الإلكترون.
في جزيء البنزين، تكون كل ذرة كربون في حالتها س 2- التهجين ويرتبط بثلاثة س- روابط تحتوي على ذرتين كربون وذرة هيدروجين واحدة. يقع إلكترون التكافؤ الرابع لذرة الكربون ص-مداري عمودي على مستوى الجزيء. يحدث التداخل الجانبي في جزيء البنزين ر- مدارات كل ذرة كربون مع ر- مدارات ذرات الكربون المجاورة (الشكل 2). ونتيجة لهذا الاقتران، أ سحابة إلكترون واحدة، الموجود أعلى وأسفل مستوى حلقة البنزين - يتم تنفيذه زميل دائري.
مثل هذا النظام الدوري ذو السحابة المشتركة المكونة من ستة إلكترونات يكون مستقرًا للغاية وملائمًا للطاقة؛ لذلك، يدخل البنزين بشكل تفضيلي في تلك التفاعلات التي يتم فيها الاحتفاظ بالحلقة العطرية.
 أ أ |  ب ب |
أرز. 2. التركيب الإلكتروني لجزيء البنزين: أ) مخطط التداخل ر-المدارات. ب) سحابة إلكترون واحدة.
دعونا نؤكد مرة أخرى أنه في جزيء البنزين من المستحيل التمييز بين ثلاث روابط مزدوجة وثلاث روابط مفردة. يتم توزيع كثافة الإلكترون بالتساوي في الجزيء، وجميع الروابط بين ذرات الكربون هي نفسها تمامًا. ولذلك، يجب أن نتذكر أن صيغة كيكولي، التي غالبا ما تستخدم لتصوير البنزين، هي تعسفية ولا تعكس البنية الحقيقية لجزيئه.
لذا فإن المركبات العطرية هي تلك التي تحتوي جزيئاتها على مجموعة حلقية مستقرة ذات طابع رابطة خاص. نظرًا لوجود صيغة جزيئية تشير إلى درجة عالية من عدم التشبع، إلا أن هذه المواد لا تتفاعل كغير مشبعة، ولكنها تدخل في الغالب في تفاعلات الاستبدال مع الحفاظ على النظام العطري.
متجانسات البنزين،
الأيزوميريا، التسمية
الصيغة العامة للسلسلة المتجانسة من الهيدروكربونات العطرية هي C n H 2 n -2.
أقرب متماثل للبنزين هو ميثيل بنزين. في كثير من الأحيان يستخدمون اسمه التافه - التولوين:

لا يحتوي البنزين والتولوين على أيزومرات عطرية. وتتميز هذه المواد فقط الايزومرية بين الطبقات. وبالتالي، فإن الهيدروكربونات غير الحلقية غير القابلة للتحويل التي تحتوي على رابطتين ثلاثيتين أو رابطتين مزدوجتين وثلاثية واحدة في الجزيء تتوافق مع الصيغة الجزيئية C 6 H 6، وبالتالي فهي متصاوغة للبنزين، على سبيل المثال:
![]()
![]()
بدءًا من الأرينات التي تحتوي على ثماني ذرات كربون، تنشأ احتمالية حدوث الأيزومرية بسبب التركيب والترتيب النسبي لجذور الهيدروكربون.إذا تم توصيل بديلين بحلقة البنزين، فيمكن أن يكونا في ثلاثة مواضع مختلفة بالنسبة لبعضهما البعض: جنبًا إلى جنب (يُشار إلى هذا الموضع بالبادئة تقويمي-) من خلال ذرة كربون واحدة ( ميتا-)، ومتقابلان ( زوج-). ثنائي ميثيل بنزين، الذي ترد صيغه البنائية للأيزومرات أدناه، له اسم تافه الزيلين
وبالتالي، فإن الصيغة الجزيئية C 8 H 8 تتوافق مع أربعة هيدروكربونات عطرية متصاوغة:



نوع الدرس:درس تعلم مواد جديدة.
نوع الدرس:محاضرة إشكالية.
الهدف التعليمي الرئيسي للدرس:تحقيق فهم لمحتوى المادة التعليمية من قبل جميع الطلاب.
أهداف تعلم الدرس:
- تعميق المعرفة حول الهيدروكربونات؛
- تعريف الطلاب بنوع جديد من الروابط الكيميائية المميزة لهذه المجموعة من المركبات، باستخدام البنزين كمثال؛ إعطاء مفهوم العطرية.
الأهداف التطويرية للدرس:
- تطوير قدرة الطلاب على إبراز الأشياء الأساسية والأساسية في المواد التعليمية والمقارنة والتعميم والتنظيم وإقامة علاقات السبب والنتيجة ؛
- تعزيز تنمية الصفات القوية الإرادة والعاطفية للفرد ؛
- إيلاء اهتمام خاص لتنمية الاهتمام بالموضوع وكلام الطلاب.
الأهداف التعليمية للدرس:تعزيز تشكيل الأفكار ذات النظرة العالمية:
- مادية العالم؛
- استمرارية عملية الإدراك.
معدات الدرس:
- الكواشف: البنزين، محلول KMnO 4، ماء البروم؛
- نموذج الكرة والعصا لجزيء البنزين (وفقًا لكيكولي)؛
- الملاحظات الداعمة والجداول.
خلال الفصول الدراسية
نقش للدرس:
"التعليم ليس مقدار المعرفة،
ولكن في الفهم الكامل والتطبيق الماهر لكل شيء
ماذا تعرف."
أ. ديستيرويج.
في الدرس الأخير طلبت منهم تكرار حل المسائل المتعلقة بإيجاد صيغة المادة وتوصيف المواد للصفوف المدروسة.
نحن نحل المشكلات للعثور على الصيغة الجزيئية للمادة وتوصيف المواد التي تتوافق مع التركيب الناتج.
إلى السبورة:
طلاب 1+2 (حل المسائل باستخدام البطاقات).
المهمة رقم 1
اشتق صيغة مادة تحتوي على 82.75% كربون و 17.25% هيدروجين. كثافة البخار النسبية لهذه المادة في الهواء هي 2.
المهمة رقم 2
حدد الصيغة الجزيئية للهيدروكربون الذي تكون فيه نسبة الكربون 85.7% والهيدروجين 14.3%. الكثافة النسبية للمادة بالنسبة للهيدروجين هي 28.

الصف + الطالب على السبورة:
المهمة رقم 3
ما هي الصيغة الجزيئية لمادة يكون فيها الجزء الكتلي من الكربون 93.2%. الكثافة النسبية للهيدروجين هي 39.
الجواب: الصيغة الحقيقية C6H6
وعند حل المسألة الثالثة حصلنا على التركيبة C6H6. إلى أي فئة من فئات الهيدروكربونات المعروفة يمكن تصنيف هذه المادة؟
لا يمكننا أن نعزو هذه المادة إلى أي من فئات الهيدروكربونات المدروسة.
إذن، المشكلة! والتي يجب أن نحلها معًا. اليوم نحن دعونا نتعرف على مجموعة جديدة من الهيدروكربونات تسمى العطريات.
موضوع الدرس: الهيدروكربونات العطرية (أرين). البنزين. هيكل الجزيء.
مهامنا الرئيسية اليوم:
- تعميق المعرفة حول الهيدروكربونات، وتوسيع فهم تنوع المركبات العضوية.
- تعرف على نوع جديد من الروابط الكيميائية المميزة لهذه المجموعة من الهيدروكربونات.
مخطط المحاضرة:
- الساحات هي واحدة من فئات الهيدروكربونات.
- تاريخ اكتشاف البنزين.
- هيكل جزيء البنزين.
أ) هيكل البنزين حسب كيكول؛
ب) أفكار حديثة حول التركيب الإلكتروني للبنزين.
ج) مفهوم النواة العطرية والرابطة الواحدة والنصف.
د/ض ق. 51-53، أكمل ملاحظات المحاضرة.
سنتعرف اليوم في الدرس على مجموعة جديدة من الهيدروكربونات تسمى العطريات أو الأرينات.
عطريةتمت تسمية هذه الهيدروكربونات لأن الممثلين الأوائل المعروفين لها كان لديهم متعة يشم.فيما بعد تبين أن معظم المواد كيميائية خصائص تنتمي إلى نفس المجموعة وليس لها رائحة عطرية. ومع ذلك، فإن الاسم الشائع التاريخي لهذه المركبات بقي معهم حتى يومنا هذا.
أبسط ممثل للهيدروكربونات العطرية هو البنزين.
تمت دراسة الفئات السابقة من الهيدروكربونات على أساس علاقات السبب والنتيجة: التكوين – البنية – الخصائص – التطبيق .سنترك هذا المبدأ المنطقي نفسه في الوقت الحالي.
مُجَمَّعالمواد نحن المثبتة– ج 6 ح 6 . هذا بنزين. البنزين أيضًا عبارة عن هيدروكربون، ولكنه هيدروكربون يختلف اختلافًا جوهريًا عن تلك التي تمت مناقشتها. ما هو البنزين؟
دعونا نتعرف على تاريخ اكتشاف البنزين. (رسائل الطلاب).
الطالب الأول.
في عام 1825، قام M. Faraday بعزل سائل يتكون من الكربون والهيدروجين من الغاز المضيء، والذي تم إنتاجه في ذلك الوقت في إنجلترا من الفحم. وبعد سنوات قليلة (في عام 1834)
E. Mitscherlich، عند تقطير حمض البنزويك، حصل على مادة مطابقة لمادة فاراداي، أطلق عليها اسم البنزين من أجل التأكيد على الارتباط الوراثي مع حمض البنزويك، وأثبت أنه يحتوي على التركيبة العنصرية C 6 H 6 (في البلدان الأنجلوسكسونية هذا الاسم لا يزال محتفظًا بالبنزين).
في وقت لاحق، أوصى J. Liebig بإعطاء هذا المركب اسمًا متجذرًا - البنزين (تشير النهاية - ol إلى طابعه الزيتي من الكلمة اللاتينية oleim - Oil). في عام 1845، قام إيه في هوفمان بعزل البنزين لأول مرة من قطران الفحم.
الطالب الثاني.
"عيد ميلاد" نظرية بنية البنزين كمركب عطري هو 27 يناير 1865، وهو اليوم الذي نُشرت فيه معلومات حول "دستور المواد العطرية" في نشرة جمعية باريس الكيميائية.
دعنا ننتقل إلى المرحلة التالية: دعونا نحدد بنية جزيء البنزين.كما سبق أن حددنا، لا يمكن تصنيف البنزين كأحد فئات الهيدروكربونات المعروفة. ولكن دعونا نحاول أن نتخيل ما هي المتغيرات من صيغتها:

يمكنك أيضًا التوصل إلى أيزومرات تختلف في موضع الروابط المزدوجة والثلاثية.
الآن لدينا ما يسمى فرضية العمل.دعونا نحاول التحقق من ذلك. إذا تمكنا من إثبات صحة أحد الهياكل المقترحة لدينا، ستتحول الفرضية إلى نظرية،إذا لم يكن الأمر كذلك، فسنفكر أكثر.
هناك جدا رد فعل بسيطأيّ يسمحتحديد التوفر بسرعة وبشكل موثوق روابط مزدوجة أو ثلاثيةفي الهيدروكربونات غير المشبعة. أيّ؟
هذا هو إضافة البروم في روابط متعددة. إذا افترضنا أن الصيغة الثالثة صحيحة، فيجب الحصول على المركب التالي: CH 2 Br-CHBr-CBr 2 -CBr 2 -CH 2 Br-CH 2 Br
يكفي هز الهيدروكربون غير المشبع بماء البروم عدة مرات، وسيتغير لون المحلول الأصفر.
تجربة مظاهرة.
رج البنزين مع ماء البروم - بدون تأثير!
لذلك لنا الافتراضات غير صحيحة.
يمكنك محاولة إضافة البروم إلى جزيء البنزين، ولكن هيدروجين.في ظروفنا هذا لا يمكن القيام به. ولكن إذا تم ذلك في جهاز خاص فوق محفز، فيمكن الحصول على الهيدروكربون بالصيغة من البنزين ![]()
إذا تصرفت عليه بماء البروم - رد الفعل سلبي.ثم يبقى أن نفترض أن الهيدروكربون مع6 ن 12 له هيكل دوري مغلق. تتكون هذه الحلقة من ست مجموعات CH 2:

فيما يبدو البنزيننفس لديه دوريبناء. وصيغة ذلك تقترح نفسها:

مع سندات مزدوجة؟ لكن ماء البروم!؟؟؟
علينا أن يفترضأن ثلاث روابط مزدوجة مجتمعة في حلقة واحدة مكونة من ستة أعضاء تتصرف بطريقة ما بطريقة جديدة.
تم تأكيد صيغة البنزين - وهو مسدس ذو ثلاث روابط مزدوجة توليفالبنزين من الأسيتيلين.تنتج ثلاث جزيئات من الأسيتيلين حلقة بنزين واحدة. في هذه الحالة، ستذهب إحدى روابط الأسيتيلين الثلاثة لتكوين رابطة بسيطة مع ذرة الكربون في جزيء آخر، ويبقى اثنان. والنتيجة هي تناوب الروابط المزدوجة والمفردة.

هذا، أو شيء من هذا القبيل، كان المنطق الذي استخدمه الكيميائي الألماني فيدريخ أوغست كيكولي عندما توصل لأول مرة في عام 1865 إلى استنتاج مفاده أن البنزين هو شكل سداسي به روابط مزدوجة ومفردة بالتناوب.
قوبلت صيغة كيكولي بالعاصفة المناقشات,والتي لم تهدأ لعقود عديدة. والواقع أن بعض خصائص البنزين، هذه الصيغة جيدة شرح، وبعضها لها يتناقض.
اتضح أن البنزين لا يزال، في ظل ظروف معينة، إضافة الهالوجيناتعلى سبيل المثال، ست ذرات كلور عبر الروابط المزدوجة الثلاثة. ولكن من ناحية أخرى، الذرات هيدروجينفي البنزين يمكن أن يكون بسهولة جدا استبدالإلى مجموعات أخرى (سنتحدث عن هذا لاحقًا). هذه القدرة هي إحدى الخصائص الرئيسية للبنزين في المجمع، وهو ما يسمى العطرية. العطرية (أي القدرة من السهل استبدال ذرات الهيدروجين)لا يمكن تفسيره بأي حال من الأحوال بصيغة كيكولي. إضافي. لكل بنزين غير بديل، إذا حكمنا من خلال هذه الصيغة، يجب أن يكون هناك اثنين من الايزومرات. على سبيل المثال، بالنسبة للأورثو زيلين، هذه هي الأيزومرات:

لا أحد حقا لا يمكن عزلاثنين من ايزومرات أورثو زيلين. كان على مبتكر نظرية بنية البنزين أن يقدم "توضيحات" لصيغته. اقترح كيكولي هذا المضاعفة لم يتم تأمين الاتصالاتفي البنزين، وفي كل وقت متحرك.

الجدلحول نظرية بنية البنزين توقفتقبل بضعة عقود فقط. ماذا يكون أفكار حديثة حولإلكتروني بناءالبنزين؟
قام الكيميائي الألماني إي. هوكل بتطبيق نظرية ميكانيكا الكم على المركبات العطرية وأظهر أن كل ذرة كربون في حالة تهجين SP². ماذا يعني ذلك؟
فصل(طالب في السبورة).

من بين الإلكترونات الأربعة لكل كربون، يشكل إلكترون واحد S وإلكترونان P ثلاثة مدارات SP² متطابقة تمامًا - وهي مدارات هجينة تقع في نفس المستوى بزاوية 120 درجة لبعضها البعض. يتم استخدام اثنين من هذه المدارات للتداخل مع نفس المدارات لذرتي كربون متجاورتين، ويتم استخدام واحد لتكوين ذرة الهيدروجين.
تتشكل كل هذه الإلكترونات النواة الإلكترونية للبنزين.

فوق وتحت كل ذرة كربون تقع المجلد الثامن ف – الإلكترون.
لنتخيل الآن أنه يوجد في حلقة البنزين ثمانية إلكترونات P في أزواج تداخل "الجوانب"أولئك. تشكل ثلاث روابط مزدوجة. هذا هو النموذج الإلكتروني للبنزين، الموصوف على الورق بواسطة صيغة كيكولي. (إظهار نموذج الكرة والعصا).
إذا كانت صيغة كيكولي صحيحة، إذن مسافةفي جزيء البنزين بين ذرتي الكربون المتجاورتين يجب أن تكون مختلفة: 0.154 نانومتربين الذرات التي لا تتداخل سحبها p و 0.133 نانومتربين ذرات الكربون ص- تواصل.
لكن دراسة البنزين بالطرق الفيزيائية أظهرت أن جميع المسافات في الجزيء متطابقة تمامًا وأن طول الرابطة C – C يساوي 0.140 نانومتر،أولئك. متوسط القيمة بين أطوال الروابط المفردة والمزدوجة. ومن المنطقي أن نفترض أن كل إلكترون ثمانية هو مدار يتداخل على قدم المساواةوفي نفس الوقت مع نفس الثمانية من الجيران.
عند إسقاطها على مستوى الجزيء، ستظهر هذه السحب الإلكترونية دوائر متداخلة(اعرض في الجدول). ولا يشكل الجزيء ثلاثة منفصلة ص- اتصالات، و متحد ص- النظام الإلكترونيمن ستة إلكترونات مشتركة بين جميع ذرات الكربون. تحت تأثير هذا المشترك للجزيء ص- السحابة الإلكترونية و سيتم تقصير المسافةبين ذرات الكربون 0.154 إلى 0.140 نانومتر.
يُعرض في الجدول (أظهر) نموذج مقياس (حجمي) لجزيء البنزين. وبما أن كثافة الإلكترون موزعة بالتساوي في الجزيء، فإن جميع الروابط بين ذرات C تكون متماثلة تمامًا.
وهكذا الكيميائية مجال الاتصالاتفي البنزين، ليس مفردًا أو مزدوجًا، بل كما يقولون واحد ونصف،متوسطة في الطبيعة. وتسمى هذه الاتصالات أيضًا عطرية،هم أقوى ص- روابط(ولهذا السبب لا يتغير لون ماء البروم - ولا تتم إضافة ذرات البروم).
لإظهار انتظام التوزيع الكهربائي. غالبًا ما يتم تصوير الكثافة في جزيء البنزين وصيغته الهيكلية على أنها مسدس مع دائرةداخل:
ويسمى هذا الهيكل البنزينأو جوهر العطرية.وتسمى الهيدروكربونات، في تركيب الجزيئات التي تحتوي على حلقة عطرية الهيدروكربونات العطرية.
في الواقع، يحتوي هذا الهيكل من جزيء البنزين على السمات الهيكلية لكل من الهيكلين الأول والثاني ويمثل نظامًا جديدًا نوعيًا. لنقم بإجراء تشبيه بناءً على معرفتك البيولوجية: هجين من الحصان والحمار - بغل. ويحتوي البغل على خصائص كل من الحصان والحمار، ولكنه حيوان جديد تمامًا له خصائص فريدة خاصة به. ولذلك، إذا أردنا أن نصف هذا الحيوان لشخص لم ير بغلًا من قبل، فيمكننا أن نتحدث عن حصان، عن حمار، ثم نقول: البغل شيء بينهما.
ولكن حتى الآن ما زالوا يستخدمون صيغة Kekule في كثير من الأحيان، مع الأخذ في الاعتبار أنها تنقل فقط بنية الجزيء بشكل مشروط.
دعونا نلخص:(توحيد المعرفة)
- ما هي الهيدروكربونات التي تسمى العطرية؟
- ما نوع التهجين الذي يميز النواة العطرية؟
- ما هي حلقة البنزين؟
- كيف هي واحدة ص- اتصال؟
- ما هي الزوايا الواقعة بين اتجاهات الروابط في الحلقة العطرية؟
- ما هي المسافة بين ذرات الكربون؟
- ما هي الروابط التي تسمى العطرية (واحدة ونصف)؟
الدرس انتهى! مع السلامة!