Predavanje: Tvari molekulske i nemolekularne strukture. Tip kristalna rešetka. Ovisnost svojstava tvari o njihovom sastavu i strukturi
Molekularne i nemolekularne tvari
Po strukturi kemijske tvari dijele se u dvije skupine: one koje se sastoje od molekula nazivaju se molekularni, i sadrži atome i ione – nemolekularni.
Molekularne tvari imaju niske točke taljenja/vrelišta. Mogu biti u tri agregatna stanja: tekuće, kruto, plinovito. Ova skupina uključuje većinu jednostavne tvari nemetali, kao i njihovi međusobni spojevi. Veze između atoma molekulskih tvari su kovalentne.
Nemolekularne tvari imaju visoke točke taljenja/vrelišta. U čvrstom su stanju. To su, kao što ste pogodili, jednostavne metalne tvari, njihovi spojevi s nemetalima, nemetali uključuju bor, ugljik - dijamant, fosfor (crni i crveni), silicij. Nemolekularne tvari tvore ionske, atomske i molekularne kristale, čiji raspored čestica ima jasan slijed i tvori rešetku.
Vrste kristalnih rešetki
Postoje četiri vrste kristalnih rešetki, ovisno o vrsti čestica smještenih u čvorovima rešetke:

1) Ionskikristalna rešetka karakteristična je za spojeve s ionskim tipom kemijske veze. Kationi i anioni nalaze se na mjestima rešetke. Primjeri tvari s ovom vrstom kristalne rešetke su soli, oksidi i hidroksidi tipičnih metala. To su tvrde, ali krte tvari. Karakterizira ih vatrostalnost. Otapaju se u vodi i električki su vodljivi.

2) Nuklearni rešetka ima atome u svojim čvorovima. Čestice tvore kovalentne nepolarne i polarne veze. Od jednostavnih tvari ovoj vrsti kristalne rešetke pripadaju ugljik u stanju grafita i dijamanta, bora, silicija i germanija. Iz složene tvari Na primjer, silicijev oksid (kvarc, gorski kristal) ima atomsku rešetku. To su vrlo tvrde, vatrostalne tvari, rijetko uobičajene u prirodi. Ne otapaju se u vodi.

3) Molekularni Kristalnu rešetku tvore molekule koje zajedno drže slabe sile međumolekulskog privlačenja. Stoga tvari ove vrste rešetke karakteriziraju niska tvrdoća, krhkost i niske temperature taljenja. Na primjer, ovo je voda u ledenom stanju. Najsolidnije organski spojevi imaju ovu vrstu rešetke. Vrsta veze u spoju je kovalentna.
Molekularna i nemolekularna struktura tvari. Struktura tvari

U kemijske interakcije Ne ulaze pojedinačni atomi ili molekule, već tvari. Tvari se klasificiraju prema vrsti veze molekularni I nemolekularna struktura. Tvari sastavljene od molekula nazivaju se molekularne tvari. Veze između molekula u takvim tvarima su vrlo slabe, mnogo slabije nego između atoma unutar molekule, a već pri relativno niskim temperaturama dolazi do pucanja – tvar prelazi u tekućinu, a potom u plin (sublimacija joda). Talište i vrelište tvari koje se sastoje od molekula rastu s porastom Molekularna težina. DO molekularne tvari uključuju tvari s atomskom strukturom (C, Si, Li, Na, K, Cu, Fe, W), među njima postoje metali i nemetali. Na tvari nemolekularna struktura uključuju ionske spojeve. Većina spojeva metala s nemetalima ima ovu strukturu: sve soli (NaCl, K 2 SO 4), neki hidridi (LiH) i oksidi (CaO, MgO, FeO), baze (NaOH, KOH). Ionske (nemolekularne) tvari imaju visoka tališta i vrelišta.

Čvrste tvari: amorfne i kristalne
Krute tvari se dijele na kristalan i amorfan.
Amorfne tvari nemaju jasno talište – zagrijavanjem postupno omekšavaju i prelaze u tekuće stanje. Na primjer, plastelin i razne smole su u amorfnom stanju.
Kristalne tvari karakteriziraju se ispravan položaj one čestice od kojih se sastoje: atomi, molekule i ioni – na strogo određenim točkama u prostoru. Kada se te točke povežu ravnim linijama, formira se prostorni okvir koji se naziva kristalna rešetka. Točke u kojima se nalaze kristalne čestice nazivaju se čvorovi rešetke. Ovisno o vrsti čestica smještenih u čvorovima kristalne rešetke i prirodi njihove povezanosti, razlikuju se četiri vrste kristalnih rešetki: ionske, atomske, molekularne i metalne.
Kristalne rešetke nazivamo ionskim, na čijim se čvorovima nalaze ioni. Tvore ih tvari s ionskim vezama, koje mogu vezati i jednostavne ione Na+, Cl - i složene SO 4 2-, OH -. Posljedično, soli i neki oksidi i hidroksidi metala imaju ionske kristalne rešetke. Na primjer, kristal natrijevog klorida izgrađen je od izmjeničnih pozitivnih iona Na + i negativnih Cl - iona, tvoreći rešetku u obliku kocke. Veze između iona u takvom kristalu vrlo su stabilne. Stoga se tvari s ionskom rešetkom odlikuju relativno velikom tvrdoćom i čvrstoćom, vatrostalne su i nehlapljive.
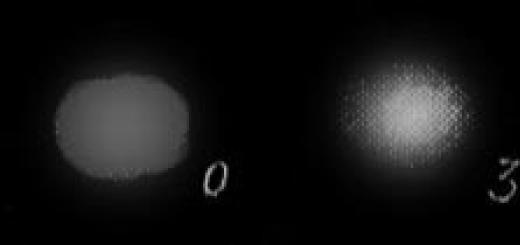
Kristalna rešetka - a) i amorfna rešetka - b).
 Kristalna rešetka - a) i amorfna rešetka - b).
Kristalna rešetka - a) i amorfna rešetka - b). Atomske kristalne rešetke
Atomski nazivaju se kristalne rešetke, u čijim se čvorovima nalaze pojedinačni atomi. U takvim rešetkama atomi su međusobno povezani vrlo jake kovalentne veze. Primjer tvari s ovom vrstom kristalne rešetke je dijamant, jedna od alotropskih modifikacija ugljika. Većina tvari s atomskom kristalnom rešetkom ima vrlo visoka tališta (na primjer, za dijamant je preko 3500 °C), jake su i tvrde te praktički netopljive.


Molekulske kristalne rešetke
Molekularni nazvane kristalne rešetke, u čijim se čvorovima nalaze molekule. Kemijske veze u ovim molekulama mogu biti polarne (HCl, H 2 O) i nepolarne (N 2, O 2). Unatoč činjenici da su atomi unutar molekula povezani vrlo jakim kovalentnim vezama, između samih molekula djeluju slabe sile međumolekulskog privlačenja. Stoga tvari s molekularnom kristalnom rešetkom imaju nisku tvrdoću, niska tališta i hlapljive su. Većina čvrstih organskih spojeva ima molekularne kristalne rešetke (naftalen, glukoza, šećer).
 Molekularna kristalna rešetka ( ugljični dioksid)
Molekularna kristalna rešetka ( ugljični dioksid)
Metalne kristalne rešetke
Tvari sa metalna veza imaju metalne kristalne rešetke. U čvorovima takvih rešetki postoje atoma i iona(bilo atoma ili iona u koje se atomi metala lako pretvaraju, dajući svoje vanjske elektrone "za opću upotrebu"). Ovaj unutarnja struktura metala određuje njihova karakteristična fizikalna svojstva: kovnost, duktilnost, električnu i toplinsku vodljivost, karakterističan metalni sjaj.

Varalice


Kemijska struktura (struktura) odnosi se na poredak relativnog rasporeda u prostoru atoma koji čine molekulu i vrste kemijskih veza između njih. Tvorac teorije strukture organskih spojeva A.M. Butlerov (1828–1886). Ukratko, glavne odredbe Butlerove teorije mogu se formulirati na sljedeći način:
1) Kemijska svojstva organski spojevi nisu određeni toliko svojim sastavom koliko svojom strukturom;
2) različiti atomi i skupine atoma u organskoj molekuli međusobno utječu jedni na druge;
3) kemijska struktura molekule može se prikazati samo jednom formulom, koja izražava sva kemijska svojstva dane tvari.
1.4. Izomeri. Vrste izomerije
Izomerija– pojava postojanja više tvari istog elementarnog sastava i molekulske mase.
Izomeri– molekule isti sastav, ali različite strukture i, prema tome, s različitim svojstvima.
Primjer ovisnosti svojstava tvari o njihovoj kemijskoj strukturi dan je u tablici. 2.
Tablica 2
Ovisnost svojstava o kemijskoj strukturi
Ove dvije izomerne tvari također imaju oštro različite biološke učinke na organizme.
Koncept "strukture" uključuje tri aspekta:
(A) Kemijski struktura– vrstu i redoslijed izmjene atoma u molekuli;
(B) Elektronička struktura– vrsta kemijskih veza među atomima (–; =; );
(U) Prostorna struktura– priroda međusobnog rasporeda atoma jednih prema drugima u prostoru.
Sukladno tome, postoje tri skupine izvora izomerije.
Razlika kemijska struktura:
Izomerija C-kostura
(a) (b) 


n-butan

 izobutan ciklopentan metil-c-butan
izobutan ciklopentan metil-c-butan
Različiti položaji funkcionalnih skupina


OH [propanol-1] OH [propanol-2]
Različite vrste funkcionalnih skupina (metamerizam)
izomeri 



kiselina] aminoetanska kiselina]
Vidi također primjer iz tablice. 2.
B) Razlika u elektroničkoj strukturi:
Različite vrste i položaji višestrukih veza
(izomeri 

[butadien-1,3] [butin-1] [butin-2]
Uobičajene strukturne formule odražavaju samo ova dva (A i B) aspekta strukture molekula.
C) PROSTORNA IZOMERIJA (ili stereoizomerija):
Takvi izomeri imaju isti redoslijed veza između atoma, ali se razlikuju u prostornom rasporedu svojih sastavnih atoma ili skupina atoma. Za prikaz prostorne strukture koriste se posebne tehnike.
To uključuje:
(5) Cis-trans izomerija– različit raspored atoma u odnosu na dvostruku vezu (a) ili ravninu prstena (b):
Primjer (a) – buten-2 stereoizomeri:


[cis-buten-2] [trans-buten-2]
Primjer (b) – stereoizomeri:

cis oblik trans oblik
(6) Optička (zrcalna) izomerija
Ovaj fenomen je posljedica prisutnosti asimetričnih ugljikovih atoma u molekulama; razmotreno u odjeljcima “Hidroksikiseline” i “Ugljikohidrati”.
(7) Konformacijska izomerija
Većinu tvari karakterizira sposobnost, ovisno o uvjetima, da budu u jednom od tri agregatna stanja: kruto, tekuće ili plinovito.
Na primjer, voda pri normalnom tlaku u temperaturnom području 0-100 o C je tekućina, na temperaturama iznad 100 o C može postojati samo u plinovitom stanju, a na temperaturama ispod 0 o C je kruta tvar.
Tvari u čvrstom stanju dijele se na amorfne i kristalne.
Karakteristične značajke amorfne tvari je odsutnost jasnog tališta: njihova fluidnost postupno raste s porastom temperature. Amorfne tvari uključuju spojeve poput voska, parafina, većine plastike, stakla itd.
Ipak, kristalne tvari imaju određeno talište, tj. tvar kristalne strukture prelazi iz krutog u tekuće stanje ne postupno, već naglo, nakon postizanja određene temperature. Primjeri kristalnih tvari uključuju kuhinjsku sol, šećer i led.
Razlika u fizička svojstva ah amorfnih i kristalnih krutina određen je prvenstveno strukturnim značajkama takvih tvari. Koja je razlika između tvari u amorfnom i kristalno stanje, najlakše je razumjeti iz sljedeće ilustracije:
Kao što vidite, u amorfnoj tvari, za razliku od kristalne, nema reda u rasporedu čestica. Ako u kristalnoj tvari mentalno spojite dva atoma blizu jedan drugome ravnom linijom, možete vidjeti da će iste čestice ležati na ovoj liniji u strogo određenim intervalima:
Dakle, u slučaju kristalnih tvari, možemo govoriti o takvom konceptu kao što je kristalna rešetka.
Kristalna rešetka nazvan prostorni okvir koji povezuje točke u prostoru u kojima se nalaze čestice koje tvore kristal.
Točke u prostoru u kojima se nalaze čestice koje tvore kristal nazivaju se čvorovi kristalne rešetke .
Ovisno o tome koje se čestice nalaze u čvorovima kristalne rešetke, razlikuju se: molekularni, atomski, ionski I metalne kristalne rešetke .
U čvorovima molekularna kristalna rešetka
Kristalna rešetka leda kao primjer molekularne rešetkePostoje molekule unutar kojih su atomi povezani jakim kovalentnim vezama, ali se same molekule drže jedna blizu druge slabim međumolekulskim silama. Zbog tako slabih međumolekularnih interakcija, kristali s molekularnom rešetkom su krhki. Takve se tvari razlikuju od tvari s drugim vrstama strukture po znatno nižim točkama taljenja i vrelišta; ne provode struja, mogu i ne moraju biti topljivi u različitim otapalima. Otopine takvih spojeva mogu ili ne moraju provoditi električnu struju, ovisno o klasi spoja. Spojevi s molekularnom kristalnom rešetkom uključuju mnoge jednostavne tvari - nemetale (stvrdnuti H 2, O 2, Cl 2, ortorombski sumpor S 8, bijeli fosfor P 4), kao i mnoge složene tvari - vodikovi spojevi nemetali, kiseline, oksidi nemetala, većina organska tvar. Treba napomenuti da ako je tvar u plinovitom ili tekućem stanju, neprikladno je govoriti o molekularnoj kristalnoj rešetki: ispravnije je koristiti termin molekularni tip strukture.
Dijamantna kristalna rešetka kao primjer atomske rešetkeU čvorovima atomska kristalna rešetka
postoje atomi. Štoviše, svi čvorovi takve kristalne rešetke međusobno su "povezani" jakim kovalentnim vezama u jedan kristal. Zapravo, takav kristal je jedna divovska molekula. Zbog svojih strukturnih značajki, sve tvari s atomskom kristalnom rešetkom su čvrste, imaju visoka tališta, kemijski su neaktivne, netopljive ni u vodi ni u organskim otapalima, a njihove taline ne provode električnu struju. Treba imati na umu da tvari s atomskim tipom strukture uključuju bor B, ugljik C (dijamant i grafit), silicij Si od jednostavnih tvari i silicij dioksid SiO 2 (kvarc), silicij karbid SiC, bor nitrid BN od složenih tvari.
Za tvari sa ionska kristalna rešetka
mjesta rešetke sadrže ione međusobno povezane preko ionske veze.
Budući da su ionske veze prilično jake, tvari s ionskom rešetkom imaju relativno visoku tvrdoću i vatrostalnost. Najčešće su topljivi u vodi, a njihove otopine, kao i taline, provode električnu struju.
Tvari s ionskom kristalnom rešetkom uključuju metalne i amonijeve soli (NH 4 +), baze i metalne okside. Siguran znak ionske strukture tvari je prisutnost istodobnih atoma u njenom sastavu tipičan metal i nemetala.
 Kristalna rešetka natrijeva klorida kao primjer ionske rešetke
Kristalna rešetka natrijeva klorida kao primjer ionske rešetke
uočeno u kristalima slobodnih metala, na primjer, natrija Na, željeza Fe, magnezija Mg itd. U slučaju metalne kristalne rešetke, njeni čvorovi sadrže katione i atome metala, između kojih se kreću elektroni. U ovom slučaju, pokretni elektroni povremeno se vežu za katione, neutralizirajući tako njihov naboj, a pojedinačni neutralni metalni atomi zauzvrat "otpuštaju" neke od svojih elektrona, pretvarajući se, pak, u katione. Zapravo, "slobodni" elektroni ne pripadaju pojedinačnim atomima, već cijelom kristalu.
Takve strukturne značajke dovode do činjenice da metali dobro provode toplinu i električnu struju i često imaju visoku duktilnost (kovkost).
Raspon temperatura taljenja metala vrlo je velik. Na primjer, talište žive je približno minus 39 °C (tekućina u normalnim uvjetima), a volframa je 3422 °C. Treba napomenuti da su u normalnim uvjetima svi metali osim žive krutine.
Teme Kodifikator jedinstvenog državnog ispita: Tvari molekulske i nemolekularne strukture. Vrsta kristalne rešetke. Ovisnost svojstava tvari o njihovom sastavu i strukturi.
Molekularno kinetička teorija
Sve molekule sastoje se od sićušnih čestica koje se nazivaju atomi. Svi trenutno otkriveni atomi prikupljeni su u periodnom sustavu.
Atom je najmanja, kemijski nedjeljiva čestica tvari koja zadržava svoja kemijska svojstva. Atomi se međusobno povezuju kemijske veze. Već smo pogledali a. Obavezno proučite teoriju na temu: Vrste kemijskih veza prije proučavanja ovog članka!
Sada pogledajmo kako se čestice u materiji mogu povezati.
Ovisno o položaju čestica jedna u odnosu na drugu, svojstva tvari koje tvore mogu se jako razlikovati. Dakle, ako su čestice smještene jedna od druge daleko(udaljenost između čestica mnogo je veća od veličine samih čestica), praktički ne djeluju jedna na drugu, kreću se u prostoru kaotično i kontinuirano, tada imamo posla s plin .
Ako se čestice nalaze Zatvoriti jedni drugima, ali kaotičan, više međusobno komunicirati, izvoditi intenzivno oscilatorna kretanja u jednom položaju, ali može skočiti na drugi položaj, onda je ovo model strukture tekućine .
Ako se čestice nalaze Zatvoriti jedni drugima, ali više na uredan način, I više komunicirati međusobno, ali se kreću samo unutar jednog ravnotežnog položaja, praktički bez pomicanja u druge situacija s kojom se onda bavimo čvrsta .

Većina poznatih kemijskih tvari i smjesa mogu postojati u čvrstom, tekućem i plinovita stanja. Najjednostavniji primjer je voda. U normalnim uvjetima to tekućina, na 0 o C se smrzava - prelazi iz tekućeg stanja u teško, a na 100 o C vrije - prelazi u plinovita faza- vodena para. Štoviše, mnoge tvari pod normalnim uvjetima su plinovi, tekućine ili krute tvari. Na primjer, zrak - mješavina dušika i kisika - u normalnim je uvjetima plin. Ali kada visoki krvni tlak i niskim temperaturama dušik i kisik kondenziraju i prelaze u tekuću fazu. Tekući dušik se aktivno koristi u industriji. Ponekad izolirani plazma, i tekući kristali, kao zasebne faze.

Objašnjena su mnoga svojstva pojedinih tvari i smjesa relativni položajčestice u prostoru jedna u odnosu na drugu!
Ovaj članak ispituje Svojstva čvrste tvari , ovisno o njihovoj strukturi. Osnovna fizikalna svojstva čvrstih tijela: talište, električna vodljivost, toplinska vodljivost, mehanička čvrstoća, duktilnost itd.
Temperatura topljenja
- to je temperatura pri kojoj tvar prelazi iz krute faze u tekuću fazu i obrnuto.
je sposobnost tvari da se deformira bez razaranja.

Električna provodljivost je sposobnost tvari da provodi struju.
Struja je uređeno kretanje nabijenih čestica. Dakle, struju mogu provoditi samo tvari koje sadrže mobilne nabijene čestice. Prema sposobnosti provođenja struje tvari se dijele na vodiče i dielektrike. Vodiči su tvari koje mogu provoditi struju (tj. sadrže pokretne nabijene čestice). Dielektrici su tvari koje praktički ne provode struju.

U čvrstoj tvari mogu se nalaziti čestice tvari kaotičan, ili urednije O. Ako se čestice čvrste tvari nalaze u prostoru kaotičan, tvar se zove amorfan. Primjeri amorfnih tvari – ugljen, tinjac staklo.

Ako su čestice čvrste tvari poredane u prostoru na uredan način, tj. oblik ponavljajućih trodimenzionalnih geometrijskih struktura, takva se tvar naziva kristal, a sama struktura – kristalna rešetka . Većina tvari koje poznajemo su kristali. Same čestice nalaze se u čvorovi kristalna rešetka.
Kristalne tvari se posebno razlikuju po vrsta kemijske veze između čestica u kristalu – atomski, molekularni, metalni, ionski; Po geometrijski oblik najjednostavnija ćelija kristalne rešetke - kubična, heksagonalna itd.
Ovisno o vrsta čestica koje tvore kristalnu rešetku , razlikovati atomska, molekularna, ionska i metalna kristalna struktura .
Atomska kristalna rešetka

Atomska kristalna rešetka nastaje kada se lociraju čvorovi kristala atomi. Atomi su međusobno čvrsto povezani kovalentne kemijske veze. Sukladno tome, takva će kristalna rešetka biti vrlo izdržljiva, nije ga lako uništiti. Atomsku kristalnu rešetku mogu formirati atomi visoke valencije, tj. S veliki broj veze sa susjednim atomima (4 ili više). U pravilu su to nemetali: jednostavne tvari - silicij, bor, ugljik (alotropske modifikacije dijamant, grafit) i njihovi spojevi (bor ugljik, silicijev oksid (IV) itd..). Budući da se među nemetalima uglavnom javljaju kovalentne kemijske veze, slobodni elektroni(kao i druge nabijene čestice) u tvarima s atomskom kristalnom rešetkom u većini slučajeva br. Stoga su takve tvari obično vrlo slabo provode struju, tj. su dielektrici. Ovo su opći obrasci, od kojih postoji niz iznimaka.

Komunikacija između čestica u atomskim kristalima: .
U čvorovima kristala s atomskom kristalnom strukturom koja se nalazi atomi.
Fazno stanje atomski kristali u normalnim uvjetima: u pravilu, čvrste tvari .
Supstance, tvoreći atomske kristale u čvrstom stanju:
- Jednostavne tvari visoka valencija (nalazi se u sredini periodnog sustava): bor, ugljik, silicij itd.
- Složene tvari sastavljene od ovih nemetala: silicij (silicijev oksid, kvarcni pijesak) SiO 2; silicijev karbid (korund) SiC; bor karbid, bor nitrid itd.
Fizička svojstva tvari s atomskom kristalnom rešetkom:
— snaga;
— vatrostalnost (visoka točka taljenja);
— niska električna vodljivost;
— niska toplinska vodljivost;
— kemijska inertnost (neaktivne tvari);
- netopljivost u otapalima.

Molekularna kristalna rešetka- ovo je rešetka, na čijim čvorovima postoje molekule. Drži molekule u kristalu slabe sile međumolekularnog privlačenja (van der Waalsove sile, vodikove veze ili elektrostatsko privlačenje). Prema tome, takva kristalna rešetka, u pravilu, prilično lako uništiti. Tvari s molekularnom kristalnom rešetkom – topljiv, lomljiv. Što je veća sila privlačenja između molekula, to je talište tvari veće. Temperature taljenja tvari s molekularnom kristalnom rešetkom u pravilu nisu veće od 200-300 K. Stoga, u normalnim uvjetima, većina tvari s molekularnom kristalnom rešetkom postoji u obliku plinovi ili tekućine. Molekularnu kristalnu rešetku, u pravilu, tvore u čvrstom obliku kiseline, oksidi nemetala, drugi binarni spojevi nemetala, jednostavne tvari koje tvore stabilne molekule (kisik O 2, dušik N 2, voda H 2 O, itd.), organske tvari. U pravilu su to tvari s kovalentnom polarnom (rjeđe nepolarnom) vezom. Jer elektroni su uključeni u kemijske veze, tvari s molekularnom kristalnom rešetkom - dielektrici, ne provode dobro toplinu.

Komunikacija između čestica u molekularnim kristalima: m međumolekularne, elektrostatičke ili međumolekularne sile privlačenja.
U čvorovima kristala s molekularnom kristalnom strukturom koja se nalazi molekule.
Fazno stanje molekularni kristali u normalnim uvjetima: plinovi, tekućine i čvrste tvari.
Supstance, stvarajući u čvrstom stanju molekularni kristali:
- Jednostavne nemetalne tvari koje tvore male, jake molekule (O2, N2, H2, S8, itd.);
- Složene tvari (spojevi nemetala) s polarnom kovalentnom vezom (osim oksida silicija i bora, spojeva silicija i ugljika) - voda H 2 O, sumporov oksid SO 3 itd.
- Monatomski plemeniti plinovi (helij, neon, argon, kripton i tako dalje.);
- Većina organskih tvari koje nemaju ionske veze — metan CH4, benzen C6H6 itd.
Fizička svojstva tvari s molekularnom kristalnom rešetkom:
- topljivost ( niske temperature topljenje):
— visoka kompresibilnost;
— molekularni kristali u krutom obliku, kao i u otopinama i talinama, ne provode struju;
- fazno stanje u normalnim uvjetima - plinovi, tekućine, čvrste tvari;
— visoka volatilnost;
- niska tvrdoća.
Ionska kristalna rešetka

Ako postoje nabijene čestice u kristalnim čvorovima – ioni, možemo razgovarati o ionska kristalna rešetka . Tipično, ionski kristali se izmjenjuju pozitivni ioni(kationi) i negativni ioni(anioni), pa se čestice drže u kristalu sile elektrostatičkog privlačenja . Ovisno o vrsti kristala i vrsti iona koji tvore kristal, takve tvari mogu biti prilično izdržljiv i vatrostalan. U čvrstom stanju u ionskim kristalima obično nema pokretnih nabijenih čestica. Ali kada se kristal otapa ili topi, ioni se oslobađaju i mogu se kretati pod vanjskim utjecajem električno polje. Oni. Samo otopine ili taline provode struju ionski kristali. Ionska kristalna rešetka karakteristična je za tvari s ionska kemijska veza. Primjeri takve tvari - sol NaCl, kalcijev karbonat– CaCO 3 itd. Ionska kristalna rešetka, u pravilu, nastaje u čvrstoj fazi soli, baze, kao i metalni oksidi i binarni spojevi metala i nemetala.

Komunikacija između čestica u ionskim kristalima: .
U čvorovima kristala s ionskom rešetkom koja se nalazi ioni.
Fazno stanje ionski kristali u normalnim uvjetima: u pravilu, čvrste tvari.
Kemijske tvari s ionskom kristalnom rešetkom:
- Soli (organske i anorganske), uključujući amonijeve soli (Na primjer, amonijev klorid NH4Cl);
- baze;
- Metalni oksidi;
- Binarni spojevi koji sadrže metale i nemetale.
Fizikalna svojstva tvari s ionskom kristalnom strukturom:
— visoko talište (vatrostalnost);
— otopine i taline ionskih kristala su vodiči struje;
— većina spojeva je topiva u polarnim otapalima (voda);
- stanje čvrste faze za većinu spojeva u normalnim uvjetima.

I na kraju, karakteriziraju se metali posebna vrsta prostorna struktura – metalna kristalna rešetka, koji je zbog metalna kemijska veza . Atomi metala prilično slabo drže valentne elektrone. U kristalu formiranom od metala istovremeno se odvijaju sljedeći procesi: Neki atomi odustaju od elektrona i postaju pozitivno nabijeni ioni; ove elektroni se nasumično kreću u kristalu; neke elektrone privlače ioni. Ti se procesi odvijaju istovremeno i kaotično. Tako, nastaju ioni , kao u formiranju ionske veze, i nastaju zajednički elektroni kako u obrazovanju kovalentna veza. Slobodni elektroni kreću se nasumično i kontinuirano kroz cijeli volumen kristala, poput plina. Zato se ponekad nazivaju " elektronski plin " Zbog dostupnosti veliki broj pokretne nabijene metalne čestice provodi struju i toplinu. Talište metala jako varira. Karakterizirani su i metali osebujan metalni sjaj, savitljivost, tj. sposobnost promjene oblika bez razaranja pod jakim mehaničkim stresom, jer kemijske veze međutim, nisu uništeni.

Komunikacija između čestica : .
U čvorovima kristala s metalnom rešetkom koja se nalazi metalni ioni i atomi.
Fazno stanje metali u normalnim uvjetima: obično čvrste tvari(iznimka je živa, tekućina u normalnim uvjetima).
Kemijske tvari s metalnom kristalnom rešetkom - jednostavne tvari – metali.
Fizička svojstva tvari s metalnom kristalnom rešetkom:
— visoka toplinska i električna vodljivost;
— savitljivost i plastičnost;
- metalni sjaj;
- metali su obično netopljivi u otapalima;
- Većina metala su čvrste tvari pod normalnim uvjetima.
Usporedba svojstava tvari s različitim kristalnim rešetkama
Tip kristalne rešetke (ili nedostatak kristalne rešetke) omogućuje procjenu osnovnih fizičkih svojstava tvari. Za grubu usporedbu tipičnih fizikalnih svojstava spojeva s različitim kristalnim rešetkama, vrlo je prikladno koristiti kemikalije s karakteristična svojstva . Za molekularnu rešetku to je, na primjer, ugljični dioksid, za atomsku kristalnu rešetku - dijamant, za metal - bakar, a za ionsku kristalnu rešetku - sol, natrijev klorid NaCl.

Zbirna tablica strukture nastalih jednostavnih tvari kemijski elementi iz glavnih podskupina periodnog sustava (elementi sporednih podskupina su metali, dakle, imaju metalnu kristalnu rešetku).

Konačna tablica odnosa između svojstava tvari i njihove strukture: