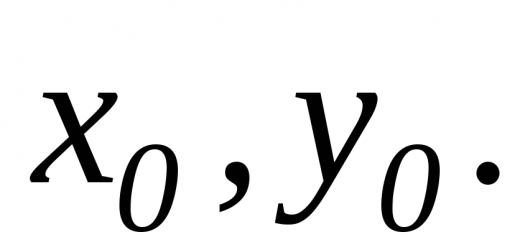Vorlesung Nr. 6
Molekülenergie
Atom Das kleinste Teilchen eines chemischen Elements, das seine chemischen Eigenschaften besitzt, wird genannt.
Ein Atom besteht aus einem positiv geladenen Kern und Elektronen, die sich in seinem Feld bewegen. Die Ladung des Kerns ist gleich der Ladung aller Elektronen. Ion Ein bestimmtes Atom ist ein elektrisch geladenes Teilchen, das entsteht, wenn Atome Elektronen verlieren oder aufnehmen.
Molekül ist das kleinste Teilchen einer homogenen Substanz, das seine grundlegenden chemischen Eigenschaften besitzt.
Moleküle bestehen aus gleichen oder unterschiedlichen Atomen, die durch interatomare chemische Bindungen miteinander verbunden sind.
Um die Gründe zu verstehen, warum elektrisch neutrale Atome ein stabiles Molekül bilden können, beschränken wir uns auf die Betrachtung der einfachsten zweiatomigen Moleküle, die aus zwei gleichen oder verschiedenen Atomen bestehen.
Die Kräfte, die ein Atom in einem Molekül halten, werden durch die Wechselwirkung äußerer Elektronen verursacht. Wenn sich Atome zu einem Molekül verbinden, bleiben die Elektronen der inneren Schalen in ihrem vorherigen Zustand.
Wenn Atome weit voneinander entfernt sind, interagieren sie nicht miteinander. Je näher die Atome einander kommen, desto stärker werden ihre gegenseitigen Anziehungskräfte. In Abständen, die mit der Größe von Atomen vergleichbar sind, treten gegenseitige Abstoßungskräfte auf, die es den Elektronen eines Atoms nicht ermöglichen, zu tief in die Elektronenhüllen eines anderen Atoms einzudringen.
Abstoßende Kräfte haben eine geringere Reichweite als anziehende Kräfte. Das bedeutet, dass mit zunehmendem Abstand zwischen Atomen die Abstoßungskräfte schneller abnehmen als die Anziehungskräfte.
Der Graph der Anziehungskraft, der Abstoßungskraft und der resultierenden Wechselwirkungskraft zwischen Atomen als Funktion des Abstands sieht folgendermaßen aus:
Die Wechselwirkungsenergie der Elektronen in einem Molekül wird durch die gegenseitige Anordnung der Atomkerne bestimmt und ist also eine Funktion des Abstands
Zur Gesamtenergie des gesamten Moleküls gehört auch die kinetische Energie der bewegten Kerne.
Somit,
![]() .
.
Dies bedeutet, dass es sich um die potentielle Energie der Wechselwirkung zwischen Kernen handelt.
Dann stellt es die Wechselwirkungskraft zwischen Atomen in einem zweiatomigen Molekül dar.
Dementsprechend hat der Graph der Abhängigkeit der potentiellen Wechselwirkungsenergie von Atomen in einem Molekül vom Abstand zwischen Atomen die Form:

Der interatomare Gleichgewichtsabstand in einem Molekül wird aufgerufen Verbindungslänge. Die Größe D heißt molekulare Dissoziationsenergie oder Bindungsenergie. Sie entspricht numerisch der Arbeit, die geleistet werden muss, um die chemischen Bindungen von Atomen in Moleküle aufzubrechen und sie außerhalb der Wirkung interatomarer Kräfte zu entfernen. Die Dissoziationsenergie ist gleich der Energie, die bei der Bildung des Moleküls freigesetzt wird, hat jedoch ein umgekehrtes Vorzeichen. Die Dissoziationsenergie ist negativ und die bei der Bildung eines Moleküls freigesetzte Energie ist positiv.
Die Energie eines Moleküls hängt von der Art der Bewegung der Kerne ab. Diese Bewegung kann in translatorische, rotatorische und oszillierende Bewegung unterteilt werden. Bei kleinen Abständen zwischen Atomen in einem Molekül und einem ausreichend großen Gefäßvolumen, das den Molekülen zur Verfügung steht, Vorwärtsenergie hat ein kontinuierliches Spektrum und sein Durchschnittswert ist gleich, das heißt.
Rotationsenergie hat ein diskretes Spektrum und kann Werte annehmen
![]() ,
,
wobei I die Rotationsquantenzahl ist;
J ist das Trägheitsmoment des Moleküls.
Energie der Schwingungsbewegung hat auch ein diskretes Spektrum und kann Werte annehmen
![]() ,
,
wo ist die Schwingungsquantenzahl;
– Eigenfrequenz dieser Art von Schwingung.
Wenn die niedrigste Schwingungsebene null Energie hat
 Die Energie der Rotations- und Translationsbewegung entspricht der kinetischen Energieform, die Energie der oszillierenden Bewegung entspricht der potentiellen Energieform. Folglich können die Energieschritte der Schwingungsbewegung eines zweiatomigen Moleküls in einem Diagramm dargestellt werden.
Die Energie der Rotations- und Translationsbewegung entspricht der kinetischen Energieform, die Energie der oszillierenden Bewegung entspricht der potentiellen Energieform. Folglich können die Energieschritte der Schwingungsbewegung eines zweiatomigen Moleküls in einem Diagramm dargestellt werden.
Die Energieschritte der Rotationsbewegung eines zweiatomigen Moleküls sind ähnlich angeordnet, nur der Abstand zwischen ihnen ist viel kleiner als der der gleichen Schritte der Schwingungsbewegung.
Haupttypen interatomarer Bindungen
Es gibt zwei Arten von Atombindungen: ionisch (oder heteropolar) und kovalent (oder homöopolar).
Ionenverbindung tritt auf, wenn Elektronen in einem Molekül so angeordnet sind, dass in der Nähe eines der Kerne ein Überschuss und in der Nähe des anderen ein Mangel entsteht. Somit scheint das Molekül aus zwei Ionen mit entgegengesetzten Vorzeichen zu bestehen, die voneinander angezogen werden. Beispiele für Moleküle mit Ionenbindungen sind NaCl, KCl, RbF, CsJ usw. gebildet durch die Kombination von Atomen von Elementen ICH-Oh und VII-te Gruppe des Periodensystems von Mendelejew. In diesem Fall erhält ein Atom, das sich selbst ein oder mehrere Elektronen hinzugefügt hat, eine negative Ladung und wird zu einem negativen Ion, und ein Atom, das die entsprechende Anzahl an Elektronen abgibt, wird zu einem positiven Ion. Die Gesamtsumme der positiven und negativen Ladungen der Ionen ist Null. Daher sind ionische Moleküle elektrisch neutral. Die Kräfte, die für die Stabilität des Moleküls sorgen, sind elektrischer Natur.
Damit eine Ionenbindung stattfinden kann, ist es notwendig, dass die Energie der Elektronenentfernung, also die Arbeit zur Erzeugung eines positiven Ions, geringer ist als die Summe der bei der Bildung negativer Ionen freigesetzten Energie und der Energie ihrer gegenseitigen Bindung Attraktion.
Es liegt auf der Hand, dass die Bildung eines positiven Ions aus einem neutralen Atom dann am wenigsten Arbeit erfordert, wenn Elektronen auftreten, die sich in der sich aufbauenden Elektronenhülle befinden.
Andererseits wird die größte Energie freigesetzt, wenn sich ein Elektron an Halogenatome anlagert, denen ein Elektron fehlt, bevor sie die Elektronenhülle füllen. Daher wird durch die Übertragung von Elektronen eine Ionenbindung gebildet, die zur Bildung gefüllter Elektronenhüllen in den resultierenden Ionen führt.
Eine andere Art der Verbindung - kovalente Bindung.
Bei der Bildung von Molekülen, die aus identischen Atomen bestehen, ist die Bildung entgegengesetzt geladener Ionen unmöglich. Daher ist eine Ionenbindung nicht möglich. Allerdings gibt es in der Natur Stoffe, deren Moleküle aus identischen Atomen bestehen H 2, O 2, N 2 usw. Bindung in Stoffen dieser Art nennt man kovalent oder homöopolar(homeo – anders [Griechisch]). Darüber hinaus werden kovalente Bindungen auch in Molekülen mit unterschiedlichen Atomen beobachtet: Fluorwasserstoff HF, Stickoxid NEIN, Methan CH 4 usw.
Die Natur kovalenter Bindungen kann nur auf der Grundlage der Quantenmechanik erklärt werden. Die quantenmechanische Erklärung basiert auf der Wellennatur des Elektrons. Die Wellenfunktion der Außenelektronen eines Atoms hört mit zunehmendem Abstand vom Atomzentrum nicht abrupt auf, sondern nimmt allmählich ab. Wenn sich Atome einander nähern, überlappen sich die unscharfen Elektronenwolken der Außenelektronen teilweise, wodurch sie sich verformen. Eine genaue Berechnung der Zustandsänderung von Elektronen erfordert die Lösung der Schrödinger-Wellengleichung für das System aller an der Wechselwirkung beteiligten Teilchen. Die Komplexität und Umständlichkeit dieses Weges zwingt uns, uns hier auf eine rein qualitative Betrachtung von Phänomenen zu beschränken.
 Im einfachsten Fall S- Zustand eines Elektrons, die Elektronenwolke ist eine Kugel mit einem bestimmten Radius. Wenn in einem kovalenten Molekül beide Elektronen ihre Plätze tauschen, entsteht Elektron 1, das zuvor zum Kern gehörte. A", wird an die Stelle des Elektrons 2 wandern, das zum Kern gehörte " B", und Elektron 2 einen umgekehrten Übergang durchführt, ändert sich am Zustand des kovalenten Moleküls nichts.
Im einfachsten Fall S- Zustand eines Elektrons, die Elektronenwolke ist eine Kugel mit einem bestimmten Radius. Wenn in einem kovalenten Molekül beide Elektronen ihre Plätze tauschen, entsteht Elektron 1, das zuvor zum Kern gehörte. A", wird an die Stelle des Elektrons 2 wandern, das zum Kern gehörte " B", und Elektron 2 einen umgekehrten Übergang durchführt, ändert sich am Zustand des kovalenten Moleküls nichts.
Das Pauli-Prinzip ermöglicht die Existenz zweier Elektronen im gleichen Zustand mit entgegengesetzten Spins. Die Verschmelzung von Regionen, in denen sich beide Elektronen befinden können, bedeutet die Entstehung einer besonderen Quantenmechanik zwischen ihnen Austauschinteraktion. In diesem Fall kann jedes der Elektronen im Molekül abwechselnd zu dem einen oder anderen Kern gehören.
Wie Berechnungen zeigen, ist die Austauschenergie eines Moleküls positiv, wenn die Spins der wechselwirkenden Elektronen parallel sind, und negativ, wenn sie nicht parallel sind.
Der kovalente Bindungstyp wird also durch ein Elektronenpaar mit entgegengesetzten Spins bereitgestellt. Wenn wir bei einer Ionenbindung von der Übertragung von Elektronen von einem Atom auf ein anderes sprachen, dann erfolgt die Verbindung hier durch die Verallgemeinerung von Elektronen und die Schaffung eines gemeinsamen Raums für ihre Bewegung.
Molekulare Spektren
Molekülspektren unterscheiden sich stark von Atomspektren. Während Atomspektren aus einzelnen Linien bestehen, bestehen Molekülspektren aus Banden, die an einem Ende scharf und am anderen Ende unscharf sind. Daher werden auch Molekülspektren genannt gestreifte Spektren.
Banden in Molekülspektren werden im infraroten, sichtbaren und ultravioletten Frequenzbereich elektromagnetischer Wellen beobachtet. In diesem Fall sind die Streifen in einer bestimmten Reihenfolge angeordnet und bilden eine Streifenreihe. Es gibt eine Reihe von Serien im Spektrum.
Die Quantenmechanik liefert eine Erklärung für die Natur molekularer Spektren. Die theoretische Interpretation der Spektren mehratomiger Moleküle ist sehr komplex. Wir beschränken uns darauf, nur zweiatomige Moleküle zu betrachten.
Zuvor haben wir festgestellt, dass die Energie eines Moleküls von der Art der Bewegung der Atomkerne abhängt, und drei Arten dieser Energie identifiziert: Translations-, Rotations- und Vibrationsenergie. Darüber hinaus wird die Energie eines Moleküls auch durch die Art der Elektronenbewegung bestimmt. Diese Art von Energie heißt elektronische Energie und ist Bestandteil der Gesamtenergie des Moleküls.
Somit beträgt die Gesamtenergie des Moleküls:
Eine Änderung der Translationsenergie kann nicht zum Auftreten einer Spektrallinie im Molekülspektrum führen, daher werden wir diese Art von Energie bei der weiteren Betrachtung von Molekülspektren ausschließen. Dann
Nach der Bohrschen Frequenzregel ( III– Bohrs Postulat) ist die Frequenz des von einem Molekül emittierten Quants, wenn sich sein Energiezustand ändert, gleich
![]() .
.
Das haben Erfahrungen und theoretische Studien gezeigt
Daher ändert es sich nur bei schwachen Erregungen, bei stärkeren –, bei noch stärkeren –. Lassen Sie uns die verschiedenen Arten von Molekülspektren genauer besprechen.
Rotationsspektrum von Molekülen
Beginnen wir mit der Erforschung der Absorption elektromagnetischer Wellen mit kleinen Energieanteilen. Solange der Wert des Energiequants nicht dem Abstand zwischen den beiden nächstgelegenen Niveaus entspricht, wird das Molekül nicht absorbieren. Wenn wir die Frequenz schrittweise erhöhen, erreichen wir Quanten, die ein Molekül von einem Rotationsschritt zum nächsten bringen können. Dies geschieht im Bereich der Infrarotwellen in der Größenordnung von 0,1–1 mm.
![]() ,
,
wobei und die Werte der Rotationsquantenzahl auf dem -ten und -ten Energieniveau sind.
Rotationsquantenzahlen und können Werte annehmen, d.h. ihre möglichen Änderungen werden durch die Auswahlregel begrenzt
Die Absorption eines Quants durch ein Molekül überträgt dieses von einem Rotationsenergieniveau auf ein anderes, höheres und führt zum Auftreten einer Spektrallinie im Rotationsabsorptionsspektrum. Mit abnehmender Wellenlänge (d. h. der Anzahl ändert sich) erscheinen in diesem Bereich immer mehr neue Linien des Absorptionsspektrums. Die Gesamtheit aller Linien gibt einen Eindruck von der Verteilung der Rotationsenergiezustände des Moleküls.
Bisher haben wir das Absorptionsspektrum des Moleküls betrachtet. Auch das Emissionsspektrum des Moleküls ist möglich. Das Auftreten von Linien im Rotationsemissionsspektrum ist mit dem Übergang des Moleküls vom oberen zum unteren Rotationsenergieniveau verbunden.
Rotationsspektren ermöglichen es, interatomare Abstände in einfachen Molekülen mit großer Genauigkeit zu bestimmen. Wenn man das Trägheitsmoment und die Masse der Atome kennt, ist es möglich, die Abstände zwischen Atomen zu bestimmen. Für ein zweiatomiges Molekül
Schwingungs-Rotations-Spektrum von Molekülen
Die Absorption elektromagnetischer Wellen durch eine Substanz im Infrarotbereich mit einer Wellenlänge von Mikrometern führt zu Übergängen zwischen Schwingungsenergieniveaus und führt zum Auftreten eines Schwingungsspektrums des Moleküls. Wenn sich jedoch die Schwingungsenergieniveaus eines Moleküls ändern, ändern sich gleichzeitig auch seine Rotationsenergiezustände. Übergänge zwischen zwei Schwingungsenergieniveaus gehen mit Änderungen der Rotationsenergiezustände einher. In diesem Fall erscheint ein Schwingungs-Rotations-Spektrum des Moleküls.
Wenn ein Molekül gleichzeitig schwingt und rotiert, wird seine Energie durch zwei Quantenzahlen bestimmt und:
![]() .
.
Unter Berücksichtigung der Auswahlregeln für beide Quantenzahlen erhalten wir die folgende Formel für die Frequenzen des Schwingungs-Rotations-Spektrums (die vorherige Formel /h und Verwerfen des vorherigen Energieniveaus, d. h. Terme in Klammern):
![]() .
.
Dabei entspricht das Vorzeichen (+) Übergängen von einer niedrigeren zu einer höheren Rotationsebene und das Vorzeichen (-) der entgegengesetzten Position. Der Schwingungsanteil der Frequenz bestimmt den Spektralbereich, in dem sich das Band befindet; Der Rotationsanteil bestimmt die Feinstruktur des Bandes, d.h. Aufspaltung einzelner Spektrallinien.
Nach klassischen Konzepten kann die Rotation oder Vibration eines zweiatomigen Moleküls nur dann zur Emission elektromagnetischer Wellen führen, wenn das Molekül ein Dipolmoment ungleich Null aufweist. Diese Bedingung ist nur für Moleküle erfüllt, die aus zwei verschiedenen Atomen bestehen, d. h. für asymmetrische Moleküle.
Ein symmetrisches Molekül, das aus identischen Atomen besteht, hat ein Dipolmoment von Null. Daher können Vibration und Rotation eines solchen Moleküls nach der klassischen Elektrodynamik keine Strahlung verursachen. Die Quantentheorie führt zu ähnlichen Ergebnissen.
Elektronisches Schwingungsspektrum von Molekülen
Die Absorption elektromagnetischer Wellen im sichtbaren und ultravioletten Bereich führt zu Übergängen des Moleküls zwischen verschiedenen elektronischen Energieniveaus, d. h. zum Auftreten des elektronischen Spektrums des Moleküls. Jedes elektronische Energieniveau entspricht einer bestimmten räumlichen Verteilung von Elektronen oder, wie man sagt, einer bestimmten Konfiguration von Elektronen mit diskreter Energie. Jede Elektronenkonfiguration entspricht vielen Schwingungsenergieniveaus.
Ein Übergang zwischen zwei elektronischen Ebenen geht mit vielen begleitenden Übergängen zwischen Schwingungsebenen einher. So entsteht das elektronische Schwingungsspektrum des Moleküls, bestehend aus Gruppen enger Linien.
Jedem Schwingungsenergiezustand ist ein System von Rotationsniveaus überlagert. Daher wird die Frequenz eines Photons während eines Elektronen-Schwingungs-Übergangs durch eine Änderung aller drei Energiearten bestimmt:
![]() .
.
Frequenz – bestimmt die Position des Spektrums.
Das gesamte elektronische Schwingungsspektrum ist ein System aus mehreren Gruppen von Bändern, die sich oft überlappen und ein breites Band bilden.
Die Untersuchung und Interpretation von Molekülspektren ermöglicht das Verständnis der detaillierten Struktur von Molekülen und wird häufig für die chemische Analyse eingesetzt.
Raman-Streuung
Dieses Phänomen liegt darin begründet, dass im Streuspektrum, das beim Durchgang von Licht durch Gase, Flüssigkeiten oder transparente kristalline Körper auftritt, neben der Streuung von Licht mit konstanter Frequenz eine Reihe höherer oder niedrigerer Frequenzen auftreten, die den Frequenzen von entsprechen Schwingungs- oder Rotationsübergänge streuender Moleküle.
Für das Phänomen der Raman-Streuung gibt es eine einfache quantenmechanische Erklärung. Der Prozess der Lichtstreuung durch Moleküle kann als inelastischer Zusammenstoß von Photonen mit Molekülen betrachtet werden. Während einer Kollision kann ein Photon einem Molekül nur solche Energiemengen abgeben oder von diesem empfangen, die den Unterschieden zwischen seinen beiden Energieniveaus entsprechen. Wenn ein Molekül bei der Kollision mit einem Photon von einem Zustand niedrigerer Energie in einen Zustand höherer Energie wechselt, verliert es seine Energie und seine Frequenz nimmt ab. Dadurch entsteht im Spektrum des Moleküls eine Linie, die gegenüber der Hauptlinie zu längeren Wellenlängen hin verschoben ist. Wenn ein Molekül nach einer Kollision mit einem Photon von einem Zustand mit höherer Energie in einen Zustand mit niedrigerer Energie übergeht, entsteht im Spektrum eine Linie, die gegenüber der Hauptlinie zu kürzeren Wellenlängen hin verschoben ist.
Raman-Streuungsstudien liefern Informationen über die Struktur von Molekülen. Mit dieser Methode lassen sich die Eigenschwingungsfrequenzen von Molekülen einfach und schnell bestimmen. Es ermöglicht uns auch, die Art der Symmetrie des Moleküls zu beurteilen.
Lumineszenz
Können die Moleküle eines Stoffes in einen angeregten Zustand gebracht werden, ohne dass sich ihre mittlere kinetische Energie erhöht, d. h. Ohne Erwärmung kommt es zum Leuchten dieser Körper bzw. zum Leuchten.
Es gibt zwei Arten von Lumineszenz: Fluoreszenz Und Phosphoreszenz.
Fluoreszenz sogenannte Lumineszenz, die unmittelbar nach dem Ende der Wirkung des Lumineszenzerregers stoppt.
Bei der Fluoreszenz kommt es zu einem spontanen Übergang von Molekülen von einem angeregten Zustand in einen niedrigeren Zustand. Diese Art von Leuchten hat eine sehr kurze Dauer (ca. 10 -7 Sekunden).
Phosphoreszenz sogenannte Lumineszenz, die nach der Einwirkung des Lumineszenzerregers ihr Leuchten noch lange beibehält.
Während der Phosphoreszenz bewegt sich ein Molekül von einem angeregten Zustand in einen metastabilen Zustand. Metastabil Dies ist ein Niveau, von dem aus ein Übergang auf ein niedrigeres Niveau unwahrscheinlich ist. Eine Emission kann auftreten, wenn das Molekül wieder auf das angeregte Niveau zurückkehrt.
Der Übergang von einem metastabilen Zustand in einen angeregten Zustand ist nur bei zusätzlicher Anregung möglich. Ein solcher zusätzlicher Erreger kann die Temperatur der Substanz sein. Bei hohen Temperaturen erfolgt dieser Übergang schnell, bei niedrigen Temperaturen langsam.
Wie wir bereits erwähnt haben, spricht man von Lumineszenz unter Lichteinfluss Photolumineszenz, unter dem Einfluss von Elektronenbeschuss – Kathodolumineszenz, unter dem Einfluss eines elektrischen Feldes – Elektrolumineszenz, unter dem Einfluss chemischer Umwandlungen - Chemilumineszenz.
Quantenverstärker und Strahlungsgeneratoren
Mitte der 50er Jahre unseres Jahrhunderts begann die rasante Entwicklung der Quantenelektronik. 1954 erschienen in der UdSSR die Werke der Akademiker N. G. Basov und A. M. Prokhorov, in dem ein Quantengenerator ultrakurzer Radiowellen im Zentimeterbereich genannt wird Maser(Mikroware-Verstärkung durch stimulierte Strahlungsemission). Eine Reihe von Generatoren und Verstärkern für Licht im sichtbaren und infraroten Bereich, die in den 60er Jahren auf den Markt kamen, wurde als „Generator“ bezeichnet optische Quantengeneratoren oder Laser(Lichtverstärkung durch stimulierte Emission von Strahlung).
Beide Arten von Geräten basieren auf der Wirkung stimulierter oder stimulierter Strahlung.
Schauen wir uns diese Art von Strahlung genauer an.
Diese Art von Strahlung ist das Ergebnis der Wechselwirkung einer elektromagnetischen Welle mit den Atomen der Substanz, durch die die Welle läuft.
In Atomen erfolgen Übergänge von höheren Energieniveaus zu niedrigeren spontan (oder spontan). Unter dem Einfluss einfallender Strahlung sind solche Übergänge jedoch sowohl in Vorwärts- als auch in Rückwärtsrichtung möglich. Diese Übergänge werden aufgerufen gezwungen oder induziert. Bei einem erzwungenen Übergang von einem der angeregten Niveaus zu einem niedrigen Energieniveau emittiert das Atom zusätzlich zu dem Photon, unter dessen Einfluss der Übergang erfolgte, ein Photon.
In diesem Fall stimmt die Ausbreitungsrichtung dieses Photons und damit aller angeregten Strahlung mit der Ausbreitungsrichtung der externen Strahlung überein, die den Übergang verursacht hat, d. h. Die stimulierte Emission stimmt streng mit der Fahremission überein.
Somit verstärkt das neue Photon, das aus der stimulierten Emission resultiert, das durch das Medium hindurchtretende Licht. Gleichzeitig mit der induzierten Emission findet jedoch der Prozess der Lichtabsorption statt, weil Das treibende Photon wird von einem Atom absorbiert, das sich auf einem niedrigen Energieniveau befindet, und das Atom bewegt sich auf ein höheres Energieniveau. Und
Der Vorgang des Überführens der Umgebung in einen inversen Zustand wird aufgerufen gepumpt Verbesserung der Umgebung. Es gibt viele Methoden zum Pumpen eines Verstärkungsmediums. Die einfachste davon ist das optische Pumpen eines Mediums, bei dem Atome durch Bestrahlung mit Licht einer solchen Frequenz von einer niedrigeren Ebene auf eine höhere angeregte Ebene übertragen werden.
In einem Medium mit inversem Zustand übersteigt die stimulierte Emission die Lichtabsorption durch Atome, wodurch der einfallende Lichtstrahl verstärkt wird.
Betrachten wir ein Gerät, das solche Medien verwendet, als Wellengenerator im optischen Bereich oder verwendet Laser.
 Sein Hauptbestandteil ist ein Kristall aus künstlichem Rubin, einem Aluminiumoxid, in dem einige Aluminiumatome durch Chromatome ersetzt sind. Wenn ein Rubinkristall mit Licht der Wellenlänge 5600 bestrahlt wird, bewegen sich Chromionen auf das obere Energieniveau.
Sein Hauptbestandteil ist ein Kristall aus künstlichem Rubin, einem Aluminiumoxid, in dem einige Aluminiumatome durch Chromatome ersetzt sind. Wenn ein Rubinkristall mit Licht der Wellenlänge 5600 bestrahlt wird, bewegen sich Chromionen auf das obere Energieniveau.
Der Rückübergang in den Grundzustand erfolgt in zwei Stufen. Im ersten Stadium geben angeregte Ionen einen Teil ihrer Energie an das Kristallgitter ab und gehen in einen metastabilen Zustand über. Auf dieser Ebene bleiben die Ionen länger als auf der oberen Ebene. Dadurch wird ein inverser Zustand eines metastabilen Niveaus erreicht.
 |
Die Rückkehr der Ionen in den Grundzustand wird von der Emission zweier roter Linien begleitet: und . Dieser Rückfluss erfolgt lawinenartig unter dem Einfluss von Photonen gleicher Wellenlänge, d.h. mit stimulierter Emission. Diese Rückkehr erfolgt viel schneller als bei der spontanen Emission, sodass das Licht verstärkt wird.
Der im Laser verwendete Rubin hat die Form eines Stabes mit einem Durchmesser von 0,5 cm und einer Länge von 4-5 cm. Die flachen Enden dieses Stabes sind poliert und versilbert, sodass sie zwei einander zugewandte Spiegel bilden von ihnen sind durchscheinend. Der gesamte Rubinstab befindet sich in der Nähe einer gepulsten Elektronenröhre, die zum optischen Pumpen des Mediums dient. Photonen, deren Bewegungsrichtungen kleine Winkel mit der Achse des Rubins bilden, werden an seinen Enden mehrfach reflektiert.
Daher wird ihr Weg im Kristall sehr lang sein und Photonenkaskaden in dieser Richtung werden die größte Entwicklung erfahren.
Photonen, die spontan in andere Richtungen emittiert werden, verlassen den Kristall durch seine Seitenfläche, ohne weitere Strahlung zu verursachen.
Wenn der axiale Strahl intensiv genug wird, tritt ein Teil davon durch das durchscheinende Ende des Kristalls nach außen aus.
Im Inneren des Kristalls entsteht eine große Wärmemenge. Daher muss es intensiv gekühlt werden.
Laserstrahlung weist eine Reihe von Eigenschaften auf. Es zeichnet sich aus durch:
1. zeitliche und räumliche Kohärenz;
2. streng monochromatisch;
3. hohe Leistung;
4. Strahlenge.
Die hohe Kohärenz der Strahlung eröffnet breite Perspektiven für den Einsatz von Lasern für die Funkkommunikation, insbesondere für die gerichtete Funkkommunikation im Weltraum. Wenn eine Möglichkeit gefunden wird, Licht zu modulieren und zu demodulieren, wird es möglich sein, eine große Menge an Informationen zu übertragen. Somit könnte ein Laser im Hinblick auf die Menge der übertragenen Informationen das gesamte Kommunikationssystem zwischen der Ost- und Westküste der Vereinigten Staaten ersetzen.
Die Winkelbreite des Laserstrahls ist so gering, dass man durch Teleskopfokussierung einen Lichtfleck mit einem Durchmesser von 3 km auf der Mondoberfläche erzeugen kann. Die hohe Leistung und Enge des Strahls ermöglicht es, bei der Fokussierung mit einer Linse eine Energieflussdichte zu erhalten, die 1000-mal höher ist als die Energieflussdichte, die durch Fokussierung des Sonnenlichts erreicht werden kann. Solche Lichtstrahlen können zum Bearbeiten und Schweißen, zur Beeinflussung des Ablaufs chemischer Reaktionen usw. eingesetzt werden.
Das oben Genannte erschöpft nicht alle Möglichkeiten des Lasers. Es handelt sich um eine völlig neue Art von Lichtquelle und es ist immer noch schwierig, sich alle möglichen Anwendungsbereiche vorzustellen.
MOLEKULARSPEKTRAEN, elektromagnetische Emissions- und Absorptionsspektren. Strahlung und Kombination Streuung des Lichts freier oder schwach gebundener Moleküle. Sie sehen aus wie eine Reihe von Bändern (Linien) im Röntgen-, UV-, sichtbaren, IR- und Radiowellenbereich (einschließlich Mikrowellen) des Spektrums. Die Lage der Banden (Linien) in den Emissionsspektren (Emissions-Molekülspektren) und der Absorption (Absorptions-Molekülspektren) wird durch Frequenzen v (Wellenlängen l = c/v, wobei c die Lichtgeschwindigkeit ist) und Wellenzahlen = 1 charakterisiert /l; sie wird durch die Differenz der Energien E" und E bestimmt: jene Zustände des Moleküls, zwischen denen ein Quantenübergang stattfindet:
![]()
(h-Planck-Konstante). Mit Kombination Bei der Streuung ist der Wert hv gleich der Differenz der Energien der einfallenden und gestreuten Photonen. Die Intensität der Bänder (Linien) hängt von der Anzahl (Konzentration) der Moleküle einer bestimmten Art, der Besetzung der Energieniveaus E" und E: und der Wahrscheinlichkeit des entsprechenden Übergangs ab.
Die Wahrscheinlichkeit von Übergängen mit Emission oder Absorption von Strahlung wird hauptsächlich durch das Quadrat des elektrischen Matrixelements bestimmt. Übergangsdipolmoment, und bei genauerer Betrachtung - durch die Quadrate der magnetischen Matrixelemente. und elektrisch Quadrupolmomente des Moleküls (siehe Quantenübergänge). Mit Kombination Bei der Lichtstreuung hängt die Übergangswahrscheinlichkeit mit dem Matrixelement des induzierten Übergangsdipolmoments des Moleküls zusammen, d. h. mit dem Matrixelement der Polarisierbarkeit des Moleküls.
Bedingungen sagen. Systeme, deren Übergänge in Form bestimmter Molekülspektren auftreten, sind unterschiedlicher Natur und unterscheiden sich stark in der Energie. Die Energieniveaus bestimmter Typen liegen weit voneinander entfernt, sodass das Molekül bei Übergängen hochfrequente Strahlung absorbiert oder aussendet. Der Abstand zwischen Ebenen anderer Art ist gering und in einigen Fällen mangels externer. die Feldebenen verschmelzen (entarten). Bei kleinen Energieunterschieden werden Übergänge im Niederfrequenzbereich beobachtet. Beispielsweise haben die Atomkerne bestimmter Elemente ihre eigenen. Mag. Drehmoment und Elektrik Quadrupolmoment, das mit dem Spin verbunden ist. Elektronen haben auch eine magnetische Wirkung Moment, der mit ihrem Spin verbunden ist. In Abwesenheit von externen magnetische Orientierungsfelder Momente sind willkürlich, d.h. sie sind nicht quantisiert und die entsprechenden Energien. Staaten sind degeneriert. Bei der externen Anwendung Dauermagnet Feld, die Entartung wird aufgehoben und Übergänge zwischen Energieniveaus sind möglich, die im Hochfrequenzbereich des Spektrums beobachtet werden. So entstehen NMR- und EPR-Spektren (siehe Kernspinresonanz, Elektronenparamagnetische Resonanz).
Kinetische Verteilung Energien der von Mol emittierten Elektronen. Systeme erzeugen durch Bestrahlung mit Röntgenstrahlung oder harter UV-Strahlung RöntgenstrahlungSpektroskopie und Photoelektronenspektroskopie. Zusätzlich Prozesse im Pier System, verursacht durch die anfängliche Anregung, führen zum Auftreten anderer Spektren. Auger-Spektren entstehen also durch Relaxation. Elektroneneinfang von außen Muscheln von k.-l. Atom pro freiem Inneren Schale, und die freigesetzte Energie wandelt sich um. in der Kinetik Energie eines anderen Elektrons ext. von einem Atom emittierte Hülle. In diesem Fall findet ein Quantenübergang von einem bestimmten Zustand eines neutralen Moleküls in einen Zustand eines Mols statt. Ion (siehe Auger-Spektroskopie).
Traditionell werden nur mit optischen Spektren verbundene Spektren als eigentliche Molekülspektren klassifiziert. Übergänge zwischen elektronisch-schwingungsrotierenden Energieniveaus eines Moleküls, die mit drei Grundelementen verbunden sind. Arten von Energie Ebenen des Moleküls – elektronisches E el, Schwingungs-E-Zählung und Rotations-E bp, entsprechend drei Arten von internen. Bewegung in einem Molekül. Die Energie der Gleichgewichtskonfiguration eines Moleküls in einem bestimmten elektronischen Zustand wird als Aal angenommen. Die Menge möglicher elektronischer Zustände eines Moleküls wird durch die Eigenschaften seiner elektronischen Hülle und Symmetrie bestimmt. Schwingung Die Bewegungen der Kerne in einem Molekül relativ zu ihrer Gleichgewichtsposition in jedem elektronischen Zustand werden für mehrere Schwingungen quantisiert. Freiheitsgrade entsteht ein komplexes Schwingungssystem. Energieniveaus E zählen. Durch Rotation ist die Rotation des Moleküls als Ganzes als starres System verbundener Kerne gekennzeichnet. Moment der Bewegungsmenge, die quantisiert wird und eine Drehung bildet. Zustände (Rotationsenergieniveaus) E Zeit. Typischerweise liegt die Energie elektronischer Übergänge in der Größenordnung von mehreren. eV, Vibration - 10 -2 ... 10 -1 eV, Rotation - 10 -5 ... 10 -3 eV.
Abhängig von den Energieniveaus treten Übergänge mit Emission, Absorption oder Kombinationen auf. elektromagnetische Streuung Strahlung - elektronisch, Schwingung. oder rotatorisch, es gibt elektronische Schwingungen. und Rotationsmolekülspektren. Die Artikel Elektronische Spektren, Schwingungsspektren, Rotationsspektren geben Auskunft über die entsprechenden Zustände von Molekülen, Auswahlregeln für Quantenübergänge, Mol. Spektroskopie sowie welche Eigenschaften von Molekülen genutzt werden können. aus Molekülspektren gewonnen: Eigenschaften und Symmetrie elektronischer Zustände, Schwingungen. Konstanten, Dissoziationsenergie, Symmetrie des Moleküls, Rotation. Konstanten, Trägheitsmomente, Geom. Parameter, elektrisch Dipolmomente, Strukturdaten und interne Kraftfelder usw. Elektronische Absorptions- und Lumineszenzspektren im sichtbaren und UV-Bereich geben Aufschluss über die Verteilung
Spektrum ist eine Folge von Energiequanten elektromagnetischer Strahlung, die von einer Substanz beim Übergang von Atomen und Molekülen von einem Energiezustand in einen anderen absorbiert, freigesetzt, gestreut oder reflektiert werden.
Abhängig von der Art der Wechselwirkung von Licht mit Materie können die Spektren in Absorptionsspektren unterteilt werden; Emissionen (Emission); Streuung und Reflexion.
Für die untersuchten Objekte wird optische Spektroskopie, d.h. Spektroskopie im Wellenlängenbereich 10 -3 ÷10 -8 M unterteilt in atomare und molekulare.
Atomspektrum ist eine Folge von Linien, deren Position durch die Energie des Elektronenübergangs von einer Ebene zur anderen bestimmt wird.
Atomenergie kann als Summe der kinetischen Energie der Translationsbewegung und der elektronischen Energie dargestellt werden:
Wo ist die Frequenz, ist die Wellenlänge, ist die Wellenzahl, ist die Lichtgeschwindigkeit, ist das Plancksche Wirkungsquantum.
Da die Energie eines Elektrons in einem Atom umgekehrt proportional zum Quadrat der Hauptquantenzahl ist, kann die Gleichung für eine Linie im Atomspektrum wie folgt geschrieben werden:
 . .
| (4.12) |
Hier  - Elektronenenergien auf höheren und niedrigeren Niveaus; - Rydberg-Konstante;
- Elektronenenergien auf höheren und niedrigeren Niveaus; - Rydberg-Konstante;  - Spektralterme, ausgedrückt in Einheiten von Wellenzahlen (m -1, cm -1).
- Spektralterme, ausgedrückt in Einheiten von Wellenzahlen (m -1, cm -1).
Alle Linien des Atomspektrums laufen im kurzwelligen Bereich bis zu einer durch die Ionisierungsenergie des Atoms bestimmten Grenze zusammen, danach liegt ein kontinuierliches Spektrum vor.
Molekülenergie In erster Näherung kann sie als Summe aus Translations-, Rotations-, Schwingungs- und Elektronenenergie betrachtet werden:
 | (4.15) |
Für die meisten Moleküle ist diese Bedingung erfüllt. Beispielsweise unterscheiden sich für H 2 bei 291 K die einzelnen Komponenten der Gesamtenergie um eine Größenordnung oder mehr:
309,5 kJ/mol,
 =25,9 kJ/mol,
=25,9 kJ/mol,
2,5 kJ/mol,
 =3,8 kJ/mol.
=3,8 kJ/mol.
Die Energiewerte von Quanten in verschiedenen Bereichen des Spektrums werden in Tabelle 4.2 verglichen.
Tabelle 4.2 – Energie absorbierter Quanten verschiedener Bereiche des optischen Spektrums von Molekülen
Die Konzepte „Vibrationen von Kernen“ und „Rotation von Molekülen“ sind relativ. In Wirklichkeit vermitteln solche Bewegungsarten nur sehr annähernd Vorstellungen über die Verteilung von Kernen im Raum, die von der gleichen probabilistischen Natur ist wie die Verteilung von Elektronen.
Ein schematisches System der Energieniveaus im Fall eines zweiatomigen Moleküls ist in Abbildung 4.1 dargestellt.
Übergänge zwischen Rotationsenergieniveaus führen zum Auftreten von Rotationsspektren im Ferninfrarot- und Mikrowellenbereich. Übergänge zwischen Schwingungsniveaus innerhalb derselben elektronischen Ebene ergeben Schwingungs-Rotations-Spektren im nahen IR-Bereich, da eine Änderung der Schwingungsquantenzahl zwangsläufig eine Änderung der Rotationsquantenzahl mit sich bringt. Schließlich verursachen Übergänge zwischen elektronischen Niveaus das Auftreten von elektronischen Schwingungs-Rotationsspektren im sichtbaren und UV-Bereich.
Im Allgemeinen kann die Anzahl der Übergänge sehr groß sein, tatsächlich erscheinen jedoch nicht alle in den Spektren. Die Anzahl der Übergänge ist begrenzt Auswahlregeln .
Molekülspektren liefern eine Fülle von Informationen. Sie können verwendet werden:
Stoffe in der qualitativen Analyse zu identifizieren, weil jede Substanz hat ihr eigenes einzigartiges Spektrum;
Zur quantitativen Analyse;
Für die Strukturgruppenanalyse, da bestimmte Gruppen wie >C=O, _ NH 2, _ OH usw. charakteristische Banden in den Spektren ergeben;
Bestimmung der Energiezustände von Molekülen und molekularer Eigenschaften (Kernabstand, Trägheitsmoment, Eigenschwingungsfrequenzen, Dissoziationsenergien); eine umfassende Untersuchung molekularer Spektren ermöglicht Rückschlüsse auf die räumliche Struktur von Molekülen;
In kinetischen Studien, auch zur Untersuchung sehr schneller Reaktionen.

 - Energie elektronischer Wasserwaagen;
- Energie elektronischer Wasserwaagen;
Energie der Schwingungsebenen;
Energien der Rotationsebenen
Abbildung 4.1 – Schematische Anordnung der Energieniveaus eines zweiatomigen Moleküls
Bouguer-Lambert-Beer-Gesetz
Die Grundlage der quantitativen molekularen Analyse mittels molekularer Spektroskopie ist Bouguer-Lambert-Beer-Gesetz , wobei die Intensität des einfallenden und durchgelassenen Lichts mit der Konzentration und Dicke der absorbierenden Schicht verknüpft wird (Abbildung 4.2):
oder mit einem Proportionalitätsfaktor:
Integrationsergebnis:
 | (4.19) |
 . .
| (4.20) |
Wenn die Intensität des einfallenden Lichts um eine Größenordnung abnimmt
 . .
| (4.21) |
Wenn =1 mol/l, dann, d.h. Der Absorptionskoeffizient ist gleich der reziproken Dicke der Schicht, in der bei einer Konzentration gleich 1 die Intensität des einfallenden Lichts um eine Größenordnung abnimmt.
Absorptionskoeffizienten und hängen von der Wellenlänge ab. Die Art dieser Abhängigkeit ist eine Art „Fingerabdruck“ von Molekülen, der in der qualitativen Analyse zur Identifizierung eines Stoffes verwendet wird. Diese Abhängigkeit ist charakteristisch und individuell für einen bestimmten Stoff und spiegelt die charakteristischen Gruppen und Bindungen wider, aus denen das Molekül besteht.
Optische Dichte D
ausgedrückt als %
4.2.3 Rotationsenergie eines zweiatomigen Moleküls in der Starrrotator-Näherung. Rotationsspektren von Molekülen und ihre Anwendung zur Bestimmung molekularer Eigenschaften
Das Auftreten von Rotationsspektren ist darauf zurückzuführen, dass die Rotationsenergie des Moleküls quantisiert ist, d. h.
| 0 |
| A |
Da der Punkt Ö ist der Schwerpunkt des Moleküls, dann:
Einführung der Notation der reduzierten Masse:
 | (4.34) |
führt zur Gleichung
 . .
| (4.35) |
Somit ist ein zweiatomiges Molekül (Abbildung 4.7 A), das sich um eine Achse dreht oder durch den Schwerpunkt verläuft, kann vereinfacht als Teilchen mit der Masse betrachtet werden, das einen Kreis mit einem Radius um den Punkt beschreibt Ö(Abbildung 4.7 B).
Die Drehung eines Moleküls um eine Achse ergibt ein Trägheitsmoment, das praktisch gleich Null ist, da die Radien der Atome viel kleiner sind als der Kernabstand. Eine Drehung um die oder Achsen, die zueinander senkrecht zur Bindungslinie des Moleküls stehen, führt zu Trägheitsmomenten gleicher Größe:
Dabei handelt es sich um eine Rotationsquantenzahl, die nur ganzzahlige Werte annimmt
0, 1, 2…. Gemäß Auswahlregel für das Rotationsspektrum eines zweiatomigen Moleküls ist eine Änderung der Rotationsquantenzahl bei Aufnahme eines Energiequants nur um eins möglich, d.h.
wandelt Gleichung (4.37) in die Form um:
 20
20  12
12  6
6  2
2  |
Wellenzahl der Linie im Rotationsspektrum, die der Absorption eines Quants beim Übergang von entspricht J Energielevel pro Level J+1, kann mit der Gleichung berechnet werden:
Somit ist das Rotationsspektrum in der Starrrotator-Modell-Näherung ein System von Linien, die im gleichen Abstand voneinander liegen (Abbildung 4.5b). Beispiele für Rotationsspektren zweiatomiger Moleküle, die im Modell des starren Rotators geschätzt wurden, sind in Abbildung 4.6 dargestellt.
| A B |


Abbildung 4.6 – Rotationsspektren HF (A) Und CO(B)
Bei Halogenwasserstoffmolekülen wird dieses Spektrum in den fernen IR-Bereich des Spektrums verschoben, bei schwereren Molekülen in die Mikrowelle.
Basierend auf den erhaltenen Mustern des Auftretens des Rotationsspektrums eines zweiatomigen Moleküls wird in der Praxis zunächst der Abstand zwischen benachbarten Linien im Spektrum bestimmt, aus dem sie dann ermittelt werden, und zwar unter Verwendung der Gleichungen:
 , ,
| (4.45) |
Wo - Zentrifugalverzerrungskonstante
, hängt durch die Näherungsbeziehung mit der Rotationskonstante zusammen  . Die Korrektur sollte nur bei sehr großen berücksichtigt werden J.
. Die Korrektur sollte nur bei sehr großen berücksichtigt werden J.
Für mehratomige Moleküle sind im Allgemeinen drei verschiedene Trägheitsmomente möglich  . Liegen im Molekül Symmetrieelemente vor, können die Trägheitsmomente übereinstimmen oder sogar gleich Null sein. Zum Beispiel, für lineare mehratomige Moleküle(CO 2 , OCS, HCN usw.)
. Liegen im Molekül Symmetrieelemente vor, können die Trägheitsmomente übereinstimmen oder sogar gleich Null sein. Zum Beispiel, für lineare mehratomige Moleküle(CO 2 , OCS, HCN usw.)
Wo  - Position der Linie, die dem Rotationsübergang entspricht
- Position der Linie, die dem Rotationsübergang entspricht  in einem isotopensubstituierten Molekül.
in einem isotopensubstituierten Molekül.
Um die Größe der Isotopenverschiebung der Linie zu berechnen, ist es notwendig, nacheinander die reduzierte Masse des isotopensubstituierten Moleküls zu berechnen und dabei die Änderung der Atommasse des Isotops, das Trägheitsmoment, die Rotationskonstante und die Position zu berücksichtigen der Linie im Spektrum des Moleküls gemäß den Gleichungen (4.34), (4.35), (4.39) bzw. (4.43) oder schätzen Sie das Verhältnis der Wellenzahlen der Linien ab, die demselben Übergang in isotopensubstituierten und nicht isotopensubstituierten Linien entsprechen -isotopisch substituierte Moleküle und bestimmen Sie dann die Richtung und Größe der Isotopenverschiebung mit Gleichung (4.50). Wenn der Kernabstand als annähernd konstant angesehen wird  , dann entspricht das Verhältnis der Wellenzahlen dem umgekehrten Verhältnis der reduzierten Massen:
, dann entspricht das Verhältnis der Wellenzahlen dem umgekehrten Verhältnis der reduzierten Massen:
Wo ist die Gesamtzahl der Partikel, ist die Anzahl der Partikel pro ich- das Energieniveau bei Temperatur T, k– Boltzmann-Konstante, - statistische Ve Gewalt Grad der Entartung ich- dieses Energieniveaus charakterisiert die Wahrscheinlichkeit, Teilchen auf einem bestimmten Niveau zu finden.
Bei einem Rotationszustand wird die Niveaupopulation üblicherweise durch das Verhältnis der Teilchenzahl charakterisiert J- dieses Energieniveau zur Anzahl der Teilchen auf dem Nullniveau:
 , ,
| (4.53) |
Wo  - Statistisches Gewicht J- dieses Rotationsenergieniveaus entspricht der Anzahl der Projektionen des Impulses eines rotierenden Moleküls auf seine Achse – die Kommunikationslinie des Moleküls,
- Statistisches Gewicht J- dieses Rotationsenergieniveaus entspricht der Anzahl der Projektionen des Impulses eines rotierenden Moleküls auf seine Achse – die Kommunikationslinie des Moleküls,  , Null-Rotationsenergie
, Null-Rotationsenergie  . Die Funktion durchläuft beim Ansteigen ein Maximum J, wie in Abbildung 4.7 am Beispiel des CO-Moleküls dargestellt.
. Die Funktion durchläuft beim Ansteigen ein Maximum J, wie in Abbildung 4.7 am Beispiel des CO-Moleküls dargestellt.
Das Extremum der Funktion entspricht dem Niveau mit der maximalen relativen Population, deren Quantenzahlwert mit der Gleichung berechnet werden kann, die man nach Bestimmung der Ableitung der Funktion am Extremum erhält:
 . .
| (4.54) |


Abbildung 4.7 – Relative Population der Rotationsenergieniveaus
Moleküle CO bei Temperaturen 298 und 1000 K
Beispiel. Im Rotationsspektrum HI wird der Abstand benachbarter Linien bestimmt  cm -1. Berechnen Sie die Rotationskonstante, das Trägheitsmoment und den Gleichgewichtskernabstand im Molekül.
cm -1. Berechnen Sie die Rotationskonstante, das Trägheitsmoment und den Gleichgewichtskernabstand im Molekül.
Lösung
In der Näherung des starren Rotatormodells ermitteln wir gemäß Gleichung (4.45) die Rotationskonstante:
 cm -1.
cm -1.
Das Trägheitsmoment des Moleküls wird aus dem Wert der Rotationskonstante nach Gleichung (4.46) berechnet:
 kg . m 2.
kg . m 2.
Um den Gleichgewichtskernabstand zu bestimmen, verwenden wir Gleichung (4.47) und berücksichtigen dabei die Massen der Wasserstoffkerne  und Jod
und Jod  ausgedrückt in kg:
ausgedrückt in kg:
Beispiel. Im fernen IR-Bereich des Spektrums von 1 H 35 Cl wurden Linien nachgewiesen, deren Wellenzahlen sind:
Bestimmen Sie die Durchschnittswerte des Trägheitsmoments und des Kernabstands des Moleküls. Ordnen Sie die beobachteten Linien im Spektrum Rotationsübergängen zu.
Lösung
Nach dem Modell des starren Rotators ist die Differenz der Wellenzahlen benachbarter Linien des Rotationsspektrums konstant und gleich 2. Bestimmen wir die Rotationskonstante aus dem Mittelwert der Abstände benachbarter Linien im Spektrum:
![]() cm -1,
cm -1,
 cm -1
cm -1
Wir ermitteln das Trägheitsmoment des Moleküls (Gleichung (4.46)):
Wir berechnen den Gleichgewichtskernabstand (Gleichung (4.47)) unter Berücksichtigung der Massen der Wasserstoffkerne  und Chlor
und Chlor  (ausgedrückt in kg):
(ausgedrückt in kg):
Mit Gleichung (4.43) schätzen wir die Lage der Linien im Rotationsspektrum von 1 H 35 Cl ab:
Vergleichen wir die berechneten Werte der Wellenzahlen der Linien mit den experimentellen. Es stellt sich heraus, dass die im Rotationsspektrum von 1 H 35 Cl beobachteten Linien den Übergängen entsprechen:
| N Zeilen | |||||||
| , cm -1 | 85.384 | 106.730 | 128.076 | 149.422 | 170.768 | 192.114 | 213.466 |
 | 3 4 | 4 5 | 5 6 | 6 7 | 7 8 | 8 9 | 9 10 |
Beispiel. Bestimmen Sie die Größe und Richtung der Isotopenverschiebung der Absorptionslinie, die dem Übergang mit entspricht  Energieniveau im Rotationsspektrum des 1 H 35 Cl-Moleküls, wenn das Chloratom durch das 37 Cl-Isotop ersetzt wird. Der Kernabstand in den 1 H 35 Cl- und 1 H 37 Cl-Molekülen wird als gleich angesehen.
Energieniveau im Rotationsspektrum des 1 H 35 Cl-Moleküls, wenn das Chloratom durch das 37 Cl-Isotop ersetzt wird. Der Kernabstand in den 1 H 35 Cl- und 1 H 37 Cl-Molekülen wird als gleich angesehen.
Lösung
Bestimmung der Größe der Isotopenverschiebung der Linie, die dem Übergang entspricht  , berechnen wir die reduzierte Masse des 1 H 37 Cl-Moleküls unter Berücksichtigung der Änderung der Atommasse von 37 Cl:
, berechnen wir die reduzierte Masse des 1 H 37 Cl-Moleküls unter Berücksichtigung der Änderung der Atommasse von 37 Cl:
Als nächstes berechnen wir das Trägheitsmoment, die Rotationskonstante und die Position der Linie  im Spektrum des 1 H 37 Cl-Moleküls und der Isotopenverschiebungswert gemäß den Gleichungen (4.35), (4.39), (4.43) bzw. (4.50).
im Spektrum des 1 H 37 Cl-Moleküls und der Isotopenverschiebungswert gemäß den Gleichungen (4.35), (4.39), (4.43) bzw. (4.50).
Andernfalls kann die Isotopenverschiebung aus dem Verhältnis der Wellenzahlen der Linien, die demselben Übergang in Molekülen entsprechen (wir gehen davon aus, dass der Kernabstand konstant ist) und dann der Position der Linie im Spektrum mithilfe von Gleichung (4.51) abgeschätzt werden.
Für die Moleküle 1 H 35 Cl und 1 H 37 Cl ist das Verhältnis der Wellenzahlen eines bestimmten Übergangs gleich:

Um die Wellenzahl der Linie eines isotopensubstituierten Moleküls zu bestimmen, ersetzen wir den Wert der Übergangswellenzahl aus dem vorherigen Beispiel J → J+1 (3→4):
Wir schließen daraus: Die Isotopenverschiebung in den niederfrequenten bzw. langwelligen Bereich ist
85,384-83,049=2,335 cm -1.
Beispiel. Berechnen Sie die Wellenzahl und Wellenlänge der intensivsten Spektrallinie des Rotationsspektrums des 1 H 35 Cl-Moleküls. Ordnen Sie die Linie dem entsprechenden Rotationsübergang zu.
Lösung
Die intensivste Linie im Rotationsspektrum eines Moleküls ist mit der maximalen relativen Besetzung des Rotationsenergieniveaus verbunden.
Ersetzung des im vorherigen Beispiel gefundenen Wertes der Rotationskonstante für 1 H 35 Cl (  cm -1) in Gleichung (4.54) ermöglicht es uns, die Zahl dieses Energieniveaus zu berechnen:
cm -1) in Gleichung (4.54) ermöglicht es uns, die Zahl dieses Energieniveaus zu berechnen:
 .
.
Die Wellenzahl des Rotationsübergangs von diesem Niveau wird nach Gleichung (4.43) berechnet:
Wir finden die Übergangswellenlänge aus Gleichung (4.11), transformiert in Bezug auf:
4.2.4 Multivariate Aufgabe Nr. 11 „Rotationsspektren zweiatomiger Moleküle“
1. Schreiben Sie eine quantenmechanische Gleichung, um die Energie der Rotationsbewegung eines zweiatomigen Moleküls als starren Rotator zu berechnen.
2. Leiten Sie eine Gleichung zur Berechnung der Änderung der Rotationsenergie eines zweiatomigen Moleküls als starrem Rotator bei seinem Übergang in ein benachbartes, höheres Quantenniveau her  .
.
3. Leiten Sie eine Gleichung für die Abhängigkeit der Wellenzahl der Rotationslinien im Absorptionsspektrum eines zweiatomigen Moleküls von der Rotationsquantenzahl her.
4. Leiten Sie eine Gleichung her, um die Differenz der Wellenzahlen benachbarter Linien im Rotationsabsorptionsspektrum eines zweiatomigen Moleküls zu berechnen.
5. Berechnen Sie die Rotationskonstante (in cm -1 und m -1) des zweiatomigen Moleküls A durch die Wellenzahlen zweier benachbarter Linien im langwelligen Infrarotbereich des Rotationsabsorptionsspektrums des Moleküls (siehe Tabelle 4.3).
6. Bestimmen Sie die Rotationsenergie des Moleküls A auf den ersten fünf Quantenrotationsniveaus (J).
7. Zeichnen Sie schematisch die Energieniveaus der Rotationsbewegung eines zweiatomigen Moleküls als starren Rotator.
8. Zeichnen Sie in diesem Diagramm mit einer gepunkteten Linie die Rotationsquantenniveaus eines Moleküls ein, das kein starrer Rotator ist.
9. Leiten Sie eine Gleichung her, um den Gleichgewichtskernabstand basierend auf der Differenz der Wellenzahlen benachbarter Linien im Rotationsabsorptionsspektrum zu berechnen.
10. Bestimmen Sie das Trägheitsmoment (kg.m2) eines zweiatomigen Moleküls A.
11. Berechnen Sie die reduzierte Masse (kg) des Moleküls A.
12. Berechnen Sie den Gleichgewichtskernabstand () des Moleküls A. Vergleichen Sie den erhaltenen Wert mit den Referenzdaten.
13. Ordnen Sie die beobachteten Linien im Rotationsspektrum des Moleküls zu A zu Rotationsübergängen.
14. Berechnen Sie die Wellenzahl der Spektrallinie, die dem Rotationsübergang vom Niveau entspricht J für ein Molekül A(siehe Tabelle 4.3).
15. Berechnen Sie die reduzierte Masse (kg) des isotopensubstituierten Moleküls B.
16. Berechnen Sie die Wellenzahl der Spektrallinie, die dem Rotationsübergang vom Niveau zugeordnet ist J für ein Molekül B(siehe Tabelle 4.3). Kernabstände in Molekülen A Und B als gleich betrachten.
17. Bestimmen Sie die Größe und Richtung der Isotopenverschiebung in den Rotationsspektren von Molekülen A Und B für die Spektrallinie, die dem Rotationsniveauübergang entspricht J.
18. Erklären Sie den Grund für die nichtmonotone Änderung der Intensität der Absorptionslinien mit zunehmender Rotationsenergie des Moleküls
19. Bestimmen Sie die Quantenzahl des Rotationsniveaus, das der höchsten relativen Population entspricht. Berechnen Sie die Wellenlängen der intensivsten Spektrallinien der Rotationsspektren von Molekülen A Und B.
Neben den Spektren, die der Strahlung einzelner Atome entsprechen, werden auch Spektren ganzer Moleküle beobachtet (§ 61). Molekülspektren sind viel vielfältiger und komplexer aufgebaut als Atomspektren. Hier werden verdichtete Linienfolgen beobachtet, ähnlich der Spektralreihe von Atomen, jedoch mit einem anderen Frequenzgesetz und mit Linien, die so eng beieinander liegen, dass sie zu kontinuierlichen Bändern verschmelzen (Abb. 279). Aufgrund der besonderen Natur dieser Spektren werden sie gestreift genannt.
Reis. 279. Gestreiftes Spektrum
Daneben werden Abfolgen gleichabständiger Spektrallinien und schließlich Mehrlinienspektren beobachtet, in denen sich auf den ersten Blick nur schwer Muster erkennen lassen (Abb. 280). Es ist zu beachten, dass wir bei der Untersuchung des Spektrums von Wasserstoff immer eine Überlagerung des molekularen Spektrums von Ha mit dem Atomspektrum haben und besondere Maßnahmen ergriffen werden müssen, um die Intensität der von einzelnen Wasserstoffatomen emittierten Linien zu erhöhen.

Reis. 280. Molekulares Spektrum von Wasserstoff
Aus quantentechnischer Sicht wird, wie im Fall von Atomspektren, jede Linie des Molekülspektrums emittiert, wenn ein Molekül von einem stationären Energieniveau in ein anderes übergeht. Aber im Fall eines Moleküls gibt es noch viele weitere Faktoren, von denen die Energie des stationären Zustands abhängt.
Im einfachsten Fall eines zweiatomigen Moleküls setzt sich die Energie aus drei Teilen zusammen: 1) der Energie der Elektronenhülle des Moleküls; 2) die Energie der Schwingungen der Atomkerne, aus denen das Molekül entlang der sie verbindenden Geraden besteht; 3) die Rotationsenergie der Kerne um einen gemeinsamen Massenschwerpunkt. Alle drei Energiearten sind quantisiert, das heißt, sie können nur eine diskrete Wertereihe annehmen. Die Elektronenhülle eines Moleküls entsteht durch die Verschmelzung der Elektronenhüllen der Atome, aus denen das Molekül besteht. Als Grenzfall können energetische elektronische Zustände von Molekülen betrachtet werden
ein sehr starker Stark-Effekt, der durch die interatomare Wechselwirkung von Atomen entsteht, die ein Molekül bilden. Obwohl die Kräfte, die Atome zu Molekülen verbinden, rein elektrostatischer Natur sind, erwies sich ein korrektes Verständnis der chemischen Bindung nur im Rahmen der modernen wellenmechanischen Quantentheorie als möglich.
Es gibt zwei Arten von Molekülen: homöopolare und heteropolare. Mit zunehmendem Abstand zwischen den Kernen zerfallen homöopolare Moleküle in neutrale Teile. Hämopolare Moleküle umfassen Moleküle. Heteropolare Moleküle zerfallen mit zunehmendem Abstand zwischen den Kernen in positive und negative Ionen. Ein typisches Beispiel für heteropolare Moleküle sind beispielsweise Salzmoleküle usw. (Bd. I, § 121, 130, 1959; in der vorherigen Ausgabe § 115 und 124 usw. II, § 19, 22, 1959; in die vorherige Ausgabe § 21 und 24).
Die Energiezustände der Elektronenwolke eines homöopolaren Moleküls werden zu einem großen Teil durch die Welleneigenschaften der Elektronen bestimmt.
Betrachten wir ein sehr grobes Modell des einfachsten Moleküls (ein ionisiertes Wasserstoffmolekül, das zwei potenzielle „Löcher“ darstellt, die in geringem Abstand voneinander liegen und durch eine „Barriere“ getrennt sind (Abb. 281).

Reis. 281. Zwei mögliche Löcher.

Reis. 282. Wellenfunktionen eines Elektrons bei entfernten „Brunnen“.
Jedes der „Löcher“ repräsentiert eines der Atome, aus denen das Molekül besteht. Bei einem großen Abstand zwischen den Atomen hat das Elektron in jedem von ihnen quantisierte Energiewerte, die den stehenden Elektronenwellen in jedem der „Wells“ separat entsprechen (§ 63). In Abb. In Abb. 282, a und b sind zwei identische Wellenfunktionen dargestellt, die den Zustand von Elektronen beschreiben, die sich in isolierten Atomen befinden. Diese Wellenfunktionen entsprechen demselben Energieniveau.
Wenn sich Atome zu einem Molekül zusammenschließen, wird die „Barriere“ zwischen den „Löchern“ „transparent“ (§ 63), weil ihre Breite der Länge der Elektronenwelle entspricht. Infolgedessen gibt es
Austausch von Elektronen zwischen Atomen durch eine „Barriere“, und es macht keinen Sinn, über die Zugehörigkeit eines Elektrons zu dem einen oder anderen Atom zu sprechen.
Die Wellenfunktion kann nun zwei Formen haben: c und d (Abb. 283). Fall c kann näherungsweise als Ergebnis der Addition der Kurven a und b (Abb. 282) betrachtet werden, Fall als Differenz zwischen a und b, aber die Energien, die den Zuständen c und d entsprechen, sind einander nicht mehr genau gleich. Die Energie des Zustands ist etwas geringer als die Energie des Zustands. Somit entstehen aus jeder atomaren Ebene zwei molekulare elektronische Ebenen.

Reis. 283. Wellenfunktionen eines Elektrons bei engen „Töpfen“.
Bisher haben wir vom Ion eines Wasserstoffmoleküls gesprochen, das über ein Elektron verfügt. Ein neutrales Wasserstoffmolekül hat zwei Elektronen, was dazu führt, dass die relativen Positionen ihrer Spins berücksichtigt werden müssen. Gemäß dem Pauli-Prinzip scheinen sich Elektronen mit parallelen Spins gegenseitig zu „vermeiden“, daher ist die Wahrscheinlichkeitsdichte, jedes Elektron zu finden, gemäß Abb. verteilt. 284, a, d.h. Elektronen befinden sich am häufigsten außerhalb der Lücke zwischen den Kernen. Daher kann mit parallelen Spins kein stabiles Molekül gebildet werden. Im Gegenteil, antiparallele Spins entsprechen der höchsten Wahrscheinlichkeit, beide Elektronen innerhalb der Lücke zwischen den Kernen zu finden (Abb. 294, b). In diesem Fall zieht die negative elektronische Ladung beide positiven Kerne an und das gesamte System bildet als Ganzes ein stabiles Molekül.
In heteropolaren Molekülen ist das Verteilungsmuster der Elektronenladungsdichte viel klassischer. In der Nähe eines der Kerne gruppiert sich ein Elektronenüberschuss, während in der Nähe des anderen ein Elektronenmangel herrscht. So entstehen im Molekül zwei Ionen, positiv und negativ, die sich gegenseitig anziehen: zum Beispiel und
Die Symbolik der elektronischen Zustände von Molekülen weist viele Ähnlichkeiten mit der Atomsymbolik auf. Natürlich spielt in einem Molekül die Richtung der Achse, die die Kerne verbindet, die Hauptrolle. Hier wird die Quantenzahl A eingeführt, analog zu I im Atom. Die Quantenzahl charakterisiert den Absolutwert der Projektion des resultierenden Bahnimpulses der Elektronenwolke des Moleküls auf die Achse des Moleküls.
Zwischen den Werten und Symbolen molekularer elektronischer Zustände besteht eine ähnliche Entsprechung wie bei Atomen (§ 67):

Der Absolutwert der Projektion des resultierenden Spins der Elektronenwolke auf die Achse des Moleküls wird durch die Quantenzahl 2 charakterisiert, und die Projektion des gesamten Rotationsmoments der Elektronenhülle wird durch die Quantenzahl charakterisiert. Offensichtlich ist
Die Quantenzahl ähnelt der inneren Quantenzahl eines Atoms (§59 und 67).

Reis. 284. Wahrscheinlichkeitsdichte, ein Elektron an verschiedenen Punkten eines Moleküls zu finden.
Genau wie Atome weisen Moleküle eine Vielfältigkeit auf, die durch unterschiedliche Ausrichtungen des resultierenden Spins relativ zum resultierenden Bahnimpuls verursacht wird.
Unter Berücksichtigung dieser Umstände werden die elektronischen Zustände von Molekülen wie folgt geschrieben:
Dabei ist 5 der Wert des resultierenden Spins und bedeutet eines der Symbole oder A, das verschiedenen Werten der Quantenzahl A entspricht. Beispielsweise ist der Normalzustand eines Wasserstoffmoleküls 2, der Normalzustand eines Hydroxyls Molekül ist der Normalzustand eines Sauerstoffmoleküls. Bei Übergängen zwischen verschiedenen elektronischen Zuständen gelten folgende Auswahlregeln: .
Die mit Schwingungen von Kernen verbundene Schwingungsenergie eines Moleküls wird unter Berücksichtigung der Welleneigenschaften von Kernen quantisiert. Unter der Annahme, dass die Kerne in einem Molekül durch eine quasielastische Kraft gebunden sind (die potentielle Energie eines Teilchens ist proportional zum Quadrat der Verschiebung, § 63), erhalten wir aus der Schrödinger-Gleichung die folgenden zulässigen Werte der Schwingung Energie dieses Systems (harmonisch
Oszillator):
![]()
wo ist die Frequenz der natürlichen Schwingungen der Kerne, wie üblich bestimmt (Bd. I, § 57, 1959; in der vorherigen Ausgabe § 67):
![]()
wo ist die reduzierte Masse der Kerne; Massen beider Kerne; quasielastische Konstante eines Moleküls; Quantenzahl gleich Aufgrund der großen Masse liegt die Frequenz im Infrarotbereich des Spektrums.

Reis. 285. Niveaus der Schwingungsenergie eines Moleküls.
Die quasielastische Konstante hängt von der Konfiguration der Elektronenhülle ab und ist daher für verschiedene elektronische Zustände des Moleküls unterschiedlich. Diese Konstante ist umso größer, je stärker das Molekül ist, also je stärker die chemische Bindung ist.
Formel (3) entspricht einem System gleichmäßig verteilter Energieniveaus, deren Abstand zwischen ihnen beträgt. Tatsächlich beginnen bei großen Amplituden der Kernschwingungen bereits Abweichungen der Rückstellkraft vom Hookeschen Gesetz zu wirken. Dadurch rücken die Energieniveaus näher zusammen (Abb. 285). Bei ausreichend großen Amplituden zerfällt das Molekül in Teile.
Bei einem harmonischen Oszillator sind Übergänge nur bei zulässig, was der Emission oder Absorption von Licht der Frequenz entspricht. Aufgrund von Abweichungen von der Harmonik treten Übergänge auf, die entsprechen
Gemäß der Quantenbedingung für Frequenzen (§ 58) sollten in diesem Fall Obertöne auftreten, die in den Spektren von Molekülen beobachtet werden.
Schwingungsenergie ist eine relativ kleine Ergänzung zur Energie der Elektronenwolke eines Moleküls. Schwingungen von Kernen führen dazu, dass sich jede elektronische Ebene in ein System enger Ebenen verwandelt, die unterschiedlichen Werten der Schwingungsenergie entsprechen (Abb. 286). Damit ist die Komplexität des Systems der Energieniveaus eines Moleküls noch nicht erschöpft.

Reis. 286. Addition von Schwingungs- und elektronischer Energie eines Moleküls.
Es ist auch notwendig, die kleinste Komponente der molekularen Energie zu berücksichtigen – die Rotationsenergie. Die zulässigen Werte der Rotationsenergie werden nach der Wellenmechanik nach dem Prinzip der Drehmomentquantisierung bestimmt.
Nach der Wellenmechanik ist das Drehmoment (§ 59) eines jeden quantisierten Systems gleich
![]()
In diesem Fall ersetzt es und ist gleich 0, 1, 2, 3 usw.
Kinetische Energie eines rotierenden Körpers im vorherigen. Hrsg. § 42) wird sein
![]()
wobei das Trägheitsmoment co die Winkelgeschwindigkeit der Rotation ist.
Aber andererseits ist das Drehmoment gleich. Daher erhalten wir:
oder wenn wir den Ausdruck (5) ersetzen, finden wir schließlich:
![]()
In Abb. 287 zeigt die Rotationsniveaus des Moleküls; Im Gegensatz zu Schwingungs- und Atomebenen nimmt der Abstand zwischen Rotationsebenen mit zunehmender Geschwindigkeit zu. Übergänge zwischen Rotationsebenen sind zulässig und es werden Linien mit Frequenzen ausgesendet
![]()
wo Evrash entspricht entspricht
Formel (9) gibt für Frequenzen an

Reis. 287. Niveaus der Rotationsenergie eines Moleküls.
Wir erhalten äquidistante Spektrallinien, die im fernen Infrarotbereich des Spektrums liegen. Die Messung der Frequenzen dieser Linien ermöglicht die Bestimmung des Trägheitsmoments des Moleküls. Es stellte sich heraus, dass die Trägheitsmomente von Molekülen in der Größenordnung liegen. Es ist zu beachten, dass das Trägheitsmoment I selbst aufgrund der Aktion
Die Zentrifugalkräfte nehmen mit zunehmender Rotationsgeschwindigkeit des Moleküls zu. Das Vorhandensein von Rotationen führt zur Aufspaltung jedes Schwingungsenergieniveaus in eine Reihe nahe beieinander liegender Unterniveaus, die unterschiedlichen Werten der Rotationsenergie entsprechen.
Wenn ein Molekül von einem Energiezustand in einen anderen übergeht, können sich alle drei Energiearten des Moleküls gleichzeitig ändern (Abb. 288). Dadurch erhält jede Spektrallinie, die bei einem Elektronen-Schwingungs-Übergang emittiert würde, eine feine Rotationsstruktur und verwandelt sich in ein typisches Molekülband.

Reis. 288. Gleichzeitige Änderung aller drei Energiearten eines Moleküls
Solche Bänder gleichmäßig verteilter Linien werden in Dampf und Wasser beobachtet und liegen im fernen Infrarotbereich des Spektrums. Sie werden nicht im Emissionsspektrum dieser Dämpfe beobachtet, sondern in ihrem Absorptionsspektrum, da die Frequenzen, die den Eigenfrequenzen der Moleküle entsprechen, stärker absorbiert werden als andere. In Abb. 289 zeigt eine Bande im Dampfabsorptionsspektrum im nahen Infrarotbereich. Dieses Band entspricht Übergängen zwischen Energiezuständen, die sich nicht nur in der Rotationsenergie, sondern auch in der Schwingungsenergie (bei konstanter Energie der Elektronenhüllen) unterscheiden. In diesem Fall ändern sich und und Ecol gleichzeitig, was zu großen Energieänderungen führt, d. h. die Spektrallinien haben eine höhere Frequenz als im ersten betrachteten Fall.
Demnach erscheinen im Spektrum im nahen Infrarotbereich liegende Linien, ähnlich denen in Abb. 289.

Reis. 289. Absorptionsbande.
Die Mitte des Bandes ( entspricht einem Übergang bei konstantem EUR; gemäß der Auswahlregel werden solche Frequenzen vom Molekül nicht emittiert. Linien mit höheren Frequenzen – kürzeren Wellenlängen – entsprechen Übergängen, bei denen die Änderung des EUR hinzugefügt wird Die Änderung. Linien mit niedrigeren Frequenzen (rechte Seite) entsprechen der umgekehrten Beziehung: Änderung der Rotationsenergie hat das umgekehrte Vorzeichen.
Zusammen mit solchen Bändern werden Bänder beobachtet, die Übergängen mit einer Änderung des Trägheitsmoments entsprechen, jedoch mit. In diesem Fall sollten gemäß Formel (9) die Frequenzen der Linien davon abhängen und die Abstände zwischen den Linien ungleich werden. Jeder Streifen besteht aus einer Reihe von Linien, die sich zu einer Kante hin verdichten.
welches der Kopf des Streifens genannt wird. Für die Frequenz einer einzelnen im Band enthaltenen Spektrallinie gab Delander bereits 1885 eine empirische Formel der folgenden Form an:
wo ist eine ganze Zahl.
Delandres Formel folgt direkt aus den obigen Überlegungen. Delandres Formel lässt sich grafisch darstellen, wenn wir sie entlang einer Achse und entlang der anderen auftragen (Abb. 290).

Reis. 290. Grafische Darstellung der Delandre-Formel.
Unten sind die entsprechenden Linien zu sehen, die, wie wir sehen, einen typischen Streifen bilden. Da die Struktur des Molekülspektrums stark vom Trägheitsmoment des Moleküls abhängt, ist die Untersuchung von Molekülspektren eine der zuverlässigsten Methoden zur Bestimmung dieses Wertes. Die geringsten Veränderungen in der Struktur eines Moleküls können durch die Untersuchung seines Spektrums erkannt werden. Am interessantesten ist die Tatsache, dass Moleküle, die unterschiedliche Isotope (§ 86) desselben Elements enthalten, unterschiedliche Linien in ihrem Spektrum aufweisen sollten, die unterschiedlichen Massen dieser Isotope entsprechen. Dies folgt aus der Tatsache, dass die Massen der Atome sowohl die Frequenz ihrer Schwingungen im Molekül als auch dessen Trägheitsmoment bestimmen. Tatsächlich bestehen die Kupferchlorid-Bandlinien aus vier Komponenten, die vier Kombinationen der Kupferisotope 63 und 65 mit den Chlorisotopen 35 und 37 entsprechen:
Es wurden auch Linien entdeckt, die Molekülen entsprechen, die ein schweres Wasserstoffisotop enthalten, obwohl die Konzentration des Isotops in gewöhnlichem Wasserstoff gleich ist
Neben der Masse von Kernen beeinflussen auch andere Eigenschaften von Kernen die Struktur von Molekülspektren. Insbesondere die Rotationsmomente (Spins) der Kerne spielen eine sehr wichtige Rolle. Wenn in einem Molekül, das aus identischen Atomen besteht, die Rotationsmomente der Kerne gleich Null sind, fällt jede zweite Linie des Rotationsbandes aus. Dieser Effekt wird beispielsweise im Molekül beobachtet
Wenn die Rotationsmomente der Kerne ungleich Null sind, können sie einen Intensitätswechsel im Rotationsband verursachen, wobei sich schwache Linien mit starken abwechseln.)
Schließlich war es mithilfe radiospektroskopischer Methoden möglich, die Hyperfeinstruktur molekularer Spektren, die mit dem elektrischen Quadrupolmoment von Kernen verbunden sind, zu erkennen und genau zu messen.
Das elektrische Quadrupolmoment entsteht durch die Abweichung der Kernform von der Kugelform. Der Kern kann die Form eines länglichen oder abgeflachten Rotationsellipsoids haben. Ein solch geladenes Ellipsoid kann nicht mehr einfach durch eine Punktladung im Zentrum des Kerns ersetzt werden.

Reis. 291. Absorbierende Vorrichtung für „Atomuhren“: 1 – ein rechteckiger Wellenleiter mit einem Querschnitt einer Länge, der auf beiden Seiten durch gasdichte Schotte 7 verschlossen und mit Ammoniak bei niedrigem Druck gefüllt ist;
2 - Kristalldiode, die Harmonische der ihr zugeführten Hochfrequenzspannung erzeugt; 3 - Ausgangskristalldiode; 4 - Generator frequenzmodulierter Hochfrequenzspannung; 5 - Rohrleitung zur Vakuumpumpe und zum Ammoniakgasbehälter; 6 – Ausgabe an einen Impulsverstärker; 7 - Schotte; I - Kristalldioden-Stromanzeige; B - Vakuummeter.
Zusätzlich zur Coulomb-Kraft tritt im Kernfeld eine zusätzliche Kraft auf, die umgekehrt proportional zur vierten Potenz des Abstands und abhängig vom Winkel mit der Richtung der Symmetrieachse des Kerns ist. Das Auftreten zusätzlicher Kraft ist mit dem Vorhandensein eines Quadrupolmoments am Kern verbunden.
Zum ersten Mal wurde das Vorhandensein eines Quadrupolmoments in einem Kern durch konventionelle Spektroskopie anhand einiger Details der Hyperfeinstruktur von Atomlinien nachgewiesen. Diese Methoden ermöglichten es jedoch nicht, die Größe des Augenblicks genau zu bestimmen.
Bei der radiospektroskopischen Methode wird ein Wellenleiter mit dem zu untersuchenden molekularen Gas gefüllt und die Absorption von Radiowellen im Gas gemessen. Die Verwendung von Klystronen zur Erzeugung von Radiowellen ermöglicht es, Schwingungen mit einem hohen Grad an Monochromatizität zu erzeugen, die dann moduliert werden. Besonders detailliert wurde das Absorptionsspektrum von Ammoniak im Zentimeterwellenbereich untersucht. In diesem Spektrum wurde eine Hyperfeinstruktur entdeckt, die durch das Vorhandensein eines Zusammenhangs zwischen dem Quadrupolmoment des Kerns und dem elektrischen Feld des Moleküls selbst erklärt wird.
Der grundlegende Vorteil der Radiospektroskopie ist die niedrige Energie der Photonen, die den Radiofrequenzen entsprechen. Dank dessen kann die Absorption von Radiofrequenzen Übergänge zwischen extrem nahe beieinander liegenden Energieniveaus von Atomen und Molekülen erkennen. Neben nuklearen Effekten eignet sich die Radiospektroskopie-Methode sehr gut zur Bestimmung der elektrischen Dipolmomente des gesamten Moleküls durch den Stark-Effekt molekularer Linien in schwacher Elektrizität
Felder. In den letzten Jahren ist eine Vielzahl von Arbeiten erschienen, die sich der radiospektroskopischen Methode zur Untersuchung der Struktur verschiedenster Moleküle widmen. Die Absorption von Radiowellen in Ammoniak wurde zum Bau ultrapräziser „Atomuhren“ genutzt (Abb. 291).
Die Dauer des astronomischen Tages nimmt langsam zu und schwankt zudem innerhalb der Grenzen. Es ist wünschenswert, Uhren mit einem gleichmäßigeren Gang zu bauen. Eine „Atomuhr“ ist ein Quarzgenerator für Radiowellen, dessen Frequenz durch die Absorption der erzeugten Wellen in Ammoniak gesteuert wird. Bei einer Wellenlänge von 1,25 cm tritt Resonanz mit der Eigenfrequenz des Ammoniakmoleküls auf, was einer sehr scharfen Absorptionslinie entspricht. Die geringste Abweichung der Generatorwellenlänge von diesem Wert stört die Resonanz und führt zu einer starken Erhöhung der Transparenz des Gases für die Funkemission, die von den entsprechenden Geräten registriert wird und die Automatisierung aktiviert, die die Frequenz des Generators wiederherstellt. „Atomuhren“ haben sich bereits gleichmäßiger bewegt als die Erdrotation. Es wird davon ausgegangen, dass eine Genauigkeit in der Größenordnung von Bruchteilen eines Tages erreicht werden kann.

Molekülspektren, optische Emissions- und Absorptionsspektren sowie Raman-Streuung, Zugehörigkeit zu frei oder lose verbunden Moleküle. MS. haben eine komplexe Struktur. Typische M. s. - gestreift, werden sie bei der Emission und Absorption sowie bei der Raman-Streuung in Form einer Reihe mehr oder weniger schmaler Banden im ultravioletten, sichtbaren und nahen Infrarotbereich beobachtet, die sich bei ausreichendem Auflösungsvermögen der verwendeten Spektralinstrumente in a auflösen Reihe eng beieinander liegender Linien. Die spezifische Struktur von M. s. ist für verschiedene Moleküle unterschiedlich und wird im Allgemeinen komplexer, je mehr Atome im Molekül vorhanden sind. Bei sehr komplexen Molekülen bestehen die sichtbaren und ultravioletten Spektren aus wenigen breiten kontinuierlichen Banden; die Spektren solcher Moleküle sind einander ähnlich.
MS. entstehen wann Quantenübergänge zwischen Energieniveaus E' Und E'' Moleküle entsprechend dem Verhältnis
H n= E‘ - E‘’, (1)
Wo H n - Energie der emittierten absorbierten Energie Photon Frequenz n ( H -Plancksche Konstante ). Mit Raman-Streuung H n ist gleich der Differenz zwischen den Energien der einfallenden und gestreuten Photonen. MS. viel komplexer als Linienatomspektren, was durch die größere Komplexität der inneren Bewegungen in einem Molekül als in Atomen bestimmt wird. Zusammen mit der Bewegung von Elektronen relativ zu zwei oder mehr Kernen in Molekülen kommt es zu einer Schwingungsbewegung der Kerne (zusammen mit den sie umgebenden inneren Elektronen) um Gleichgewichtspositionen und einer Rotationsbewegung des Moleküls als Ganzes. Diese drei Bewegungsarten – elektronische, Vibrations- und Rotationsbewegung – entsprechen drei Arten von Energieniveaus und drei Arten von Spektren.
Nach der Quantenmechanik kann die Energie aller Bewegungsarten in einem Molekül nur bestimmte Werte annehmen, d. h. sie ist quantisiert. Gesamtenergie eines Moleküls E kann näherungsweise als Summe der quantisierten Energiewerte von drei Arten seiner Bewegung dargestellt werden:
E = E E-Mail + E zählen + E drehen (2)
Nach Größenordnung
Wo M ist die Masse des Elektrons und die Größe M hat die Größenordnung der Atomkerne in einem Molekül, d.h. m/M~ 10 -3 -10 -5, daher:
E E-Mail >> E zählen >> E drehen (4)
Gewöhnlich E el über mehrere ev(einige Hundert kJ/mol), E zählen ~ 10 -2 -10 -1 Vorabend Drehung ~ 10 -5 -10 -3 ev.
Gemäß (4) ist das System der Energieniveaus eines Moleküls durch eine Reihe weit voneinander entfernter elektronischer Niveaus (unterschiedliche Werte) gekennzeichnet E el bei E zählen = E Rotation = 0), Schwingungsniveaus, die viel näher beieinander liegen (unterschiedliche Werte). E bei einem gegebenen Wert zählen E Land E Rotation = 0) und noch dichter beieinander liegende Rotationsebenen (verschiedene Werte). E Rotation bei gegeben E el und E zählen).
Elektronische Energieniveaus ( E el in (2) entsprechen den Gleichgewichtskonfigurationen des Moleküls (im Fall eines zweiatomigen Moleküls, gekennzeichnet durch den Gleichgewichtswert). R 0 Kernabstand R. Jeder elektronische Zustand entspricht einer bestimmten Gleichgewichtskonfiguration und einem bestimmten Wert E el; der niedrigste Wert entspricht dem Grundenergieniveau.
Der Satz elektronischer Zustände eines Moleküls wird durch die Eigenschaften seiner Elektronenhülle bestimmt. Im Prinzip die Werte E el kann mit Methoden berechnet werden Quantenchemie, Allerdings kann dieses Problem nur mit Näherungsmethoden und für relativ einfache Moleküle gelöst werden. Die wichtigsten Informationen über die elektronischen Niveaus eines Moleküls (die Lage der elektronischen Energieniveaus und ihre Eigenschaften), die durch seine chemische Struktur bestimmt werden, werden durch die Untersuchung seiner Molekülstruktur gewonnen.
Ein sehr wichtiges Merkmal eines bestimmten elektronischen Energieniveaus ist der Wert Quantenzahl S, Charakterisierung des Absolutwerts des Gesamtspinmoments aller Elektronen des Moleküls. Chemisch stabile Moleküle haben normalerweise eine gerade Anzahl an Elektronen, und zwar für sie S= 0, 1, 2... (für die elektronische Hauptebene beträgt der typische Wert S= 0, und für aufgeregte - S= 0 und S= 1). Ebenen mit S= 0 heißen Singulett, mit S= 1 - Triplett (da die Wechselwirkung im Molekül zu deren Aufspaltung in c = 2 führt S+ 1 = 3 Unterebenen) . MIT freie Radikale haben in der Regel eine für sie ungerade Anzahl an Elektronen S= 1 / 2, 3 / 2, ... und der Wert ist sowohl für die Haupt- als auch die angeregte Ebene typisch S= 1 / 2 (Dublettebenen, die sich in c = 2 Unterebenen aufteilen).
Für Moleküle, deren Gleichgewichtskonfiguration symmetrisch ist, können die elektronischen Niveaus weiter klassifiziert werden. Im Fall von zweiatomigen und linearen dreiatomigen Molekülen mit einer Symmetrieachse (unendlicher Ordnung), die durch die Kerne aller Atome verläuft , Elektronische Niveaus werden durch die Werte der Quantenzahl l charakterisiert, die den Absolutwert der Projektion des gesamten Bahnimpulses aller Elektronen auf die Achse des Moleküls bestimmt. Ebenen mit l = 0, 1, 2, ... werden jeweils mit S, P, D... bezeichnet, und der Wert von c wird durch den Index oben links angezeigt (z. B. 3 S, 2 p, ...). Für Moleküle mit einem Symmetriezentrum, zum Beispiel CO 2 und C 6 H 6 , Alle elektronischen Ebenen sind in gerade und ungerade unterteilt und durch Indizes gekennzeichnet G Und u(abhängig davon, ob die Wellenfunktion bei Umkehrung im Symmetriezentrum ihr Vorzeichen behält oder ändert).
Schwingungsenergieniveaus (Werte E Anzahl) kann durch Quantisierung der Schwingungsbewegung ermittelt werden, die annähernd als harmonisch angesehen wird. Im einfachsten Fall eines zweiatomigen Moleküls (ein Schwingungsfreiheitsgrad, entsprechend einer Änderung des Kernabstands). R) wird es als harmonisch betrachtet Oszillator; seine Quantisierung ergibt gleichmäßig verteilte Energieniveaus:
E zählen = H n e (u +1/2), (5)
wobei n e die Grundfrequenz der harmonischen Schwingungen des Moleküls ist, u die Schwingungsquantenzahl ist und die Werte 0, 1, 2, ... annimmt. Für jeden elektronischen Zustand eines mehratomigen Moleküls bestehend aus N Atome ( N³ 3) und haben F Schwingungsfreiheitsgrade ( F = 3N- 5 und F = 3N- 6 für lineare bzw. nichtlineare Moleküle), stellt sich heraus F sogenannt Normalschwingungen mit Frequenzen n i ( ich = 1, 2, 3, ..., F) und ein komplexes System von Schwingungsniveaus:
![]()
Wo u i = 0, 1, 2, ... sind die entsprechenden Schwingungsquantenzahlen. Der Frequenzsatz der Normalschwingungen im elektronischen Grundzustand ist abhängig von seiner chemischen Struktur ein sehr wichtiges Merkmal eines Moleküls. Alle oder ein Teil der Atome des Moleküls nehmen an einer bestimmten Normalschwingung teil; Die Atome führen harmonische Schwingungen mit der gleichen Frequenz aus v i, aber mit unterschiedlichen Amplituden, die die Form der Schwingung bestimmen. Normalschwingungen werden entsprechend ihrer Form in Streckung (bei der sich die Längen der Bindungslinien ändern) und Biegung (bei der sich die Winkel zwischen chemischen Bindungen – Bindungswinkel – ändern) unterteilt. Die Anzahl der unterschiedlichen Schwingungsfrequenzen für Moleküle mit niedriger Symmetrie (ohne Symmetrieachsen mit einer höheren Ordnung als 2) beträgt 2, und alle Schwingungen sind nicht entartet, während es für symmetrischere Moleküle zweifach und dreifach entartete Schwingungen (Paare und Tripletts) gibt von Schwingungen, die in der Frequenz übereinstimmen). Zum Beispiel in einem nichtlinearen dreiatomigen Molekül H 2 O F= 3 und drei nicht entartete Schwingungen sind möglich (zwei Streckungen und eine Biegung). Das symmetrischere lineare dreiatomige CO 2 -Molekül hat F= 4 - zwei nicht entartete Schwingungen (Dehnung) und eine doppelt entartete Schwingung (Verformung). Für ein flaches hochsymmetrisches Molekül C 6 H 6 stellt sich heraus F= 30 - zehn nicht entartete und 10 doppelt entartete Schwingungen; Davon treten 14 Schwingungen in der Ebene des Moleküls auf (8 Streckungen und 6 Biegungen) und 6 Biegeschwingungen außerhalb der Ebene – senkrecht zu dieser Ebene. Das noch symmetrischere tetraedrische CH 4 -Molekül hat f = 9 - eine nicht entartete Schwingung (Streckung), eine zweifach entartete Schwingung (Verformung) und zwei dreifach entartete Schwingung (eine Streckung und eine Verformung).
Rotationsenergieniveaus können ermittelt werden, indem man die Rotationsbewegung eines Moleküls quantisiert und es mit Sicherheit als Festkörper behandelt Trägheitsmomente. Im einfachsten Fall eines zweiatomigen oder linearen mehratomigen Moleküls seine Rotationsenergie
![]()
Wo ICH ist das Trägheitsmoment des Moleküls relativ zu einer Achse senkrecht zur Achse des Moleküls und M- Rotationsimpuls. Gemäß den Quantisierungsregeln gilt
![]()
Wo ist die Rotationsquantenzahl? J= 0, 1, 2, ... und daher für E Rotation erhalten:
wobei die Rotationskonstante den Maßstab der Abstände zwischen den Energieniveaus bestimmt, der mit zunehmender Kernmasse und Kernabständen abnimmt.
Verschiedene Arten von M. s. entstehen bei verschiedenen Arten von Übergängen zwischen Energieniveaus von Molekülen. Nach (1) und (2)
D E = E‘ - E'' = D E el + D E zählen + D E drehen, (8)
wo ändert sich D E el, D E Graf und D E Die Rotation elektronischer, Schwingungs- und Rotationsenergien erfüllt die Bedingung:
D E el >> D E zählen >> D E drehen (9)
[Abstände zwischen Ebenen sind von der gleichen Größenordnung wie die Energien selbst E el, E ol und E Rotation, erfüllt Bedingung (4)].
Bei D E el ¹ 0, Elektronenmikroskopie wird erhalten, die im sichtbaren und ultravioletten (UV) Bereich beobachtet wird. Normalerweise bei D E el ¹ 0 gleichzeitig D E Nummer 0 und D E Drehung ¹ 0; anders D E zählen für ein gegebenes D E el entsprechen verschiedenen Schwingungsbändern und unterschiedlichen D E Drehung bei gegebenem D E el und d E zählen - einzelne Rotationslinien, in die dieser Streifen zerfällt; Es entsteht eine charakteristische Streifenstruktur.
![]()
Rotationsaufspaltung der Elektronenschwingungsbande 3805 des N 2 -Moleküls
Eine Reihe von Streifen mit einem bestimmten D E el (entspricht einem rein elektronischen Übergang mit einer Frequenz v el = D E Email/ H) wird als Streifensystem bezeichnet; Abhängig von den relativen Übergangswahrscheinlichkeiten, die mit quantenmechanischen Methoden näherungsweise berechnet werden können, weisen einzelne Bänder unterschiedliche Intensitäten auf. Bei komplexen Molekülen verschmelzen die Bänder eines Systems, die einem bestimmten elektronischen Übergang entsprechen, normalerweise zu einem breiten kontinuierlichen Band; mehrere solcher breiten Bänder können einander überlappen. Charakteristische diskrete elektronische Spektren, die in gefrorenen Lösungen organischer Verbindungen beobachtet werden . Elektronische (genauer gesagt elektronische Schwingungs-Rotations-)Spektren werden experimentell mit Spektrographen und Spektrometern mit Glasoptik (für den sichtbaren Bereich) und Quarzoptik (für den UV-Bereich) untersucht, bei denen Prismen oder Beugungsgitter verwendet werden, um Licht in a zu zerlegen Spektrum .
Bei D E el = 0 und D E Zählung ¹ 0, es werden oszillatorische Magnetresonanzen erhalten, die im Nahbereich (bis zu mehreren) beobachtet werden µm) und in der Mitte (bis zu mehreren Zehnern). µm) Infrarot (IR)-Bereich, normalerweise bei der Absorption sowie bei der Raman-Streuung von Licht. In der Regel gleichzeitig D E Drehung ¹ 0 und bei einem gegebenen E Das Ergebnis ist ein Schwingungsband, das in einzelne Rotationslinien zerfällt. Am intensivsten sind sie bei oszillierenden M. s. Streifen entsprechend D u = u’ - u'' = 1 (für mehratomige Moleküle - D u ich = u ich' - u i ''= 1 bei D u k = u k’ – u k '' = 0, wo k¹i).
Für rein harmonische Schwingungen sind diese Auswahlregeln, das Verbot anderer Übergänge wird strikt durchgeführt; für anharmonische Schwingungen treten Bänder auf, für die D u> 1 (Obertöne); Ihre Intensität ist normalerweise gering und nimmt mit zunehmendem D ab u.
Schwingungsspektren (genauer gesagt Schwingungs-Rotations-Spektren) werden experimentell im IR-Bereich in der Absorption mit IR-Spektrometern mit für IR-Strahlung transparenten Prismen oder mit Beugungsgittern sowie Fourier-Spektrometern und in der Raman-Streuung mit Spektrographen mit hoher Apertur untersucht ( für die sichtbaren Bereich) mittels Laseranregung.
Bei D E el = 0 und D E count = 0 erhält man rein rotatorische Magnetsysteme, bestehend aus einzelnen Linien. Sie werden bei Absorption aus einer Entfernung (Hunderte von) beobachtet µm)IR-Bereich und insbesondere im Mikrowellenbereich sowie in Raman-Spektren. Bei zweiatomigen und linearen mehratomigen Molekülen (sowie bei ziemlich symmetrischen nichtlinearen mehratomigen Molekülen) haben diese Linien den gleichen Abstand (auf der Frequenzskala) voneinander mit Intervallen Dn = 2 B in Absorptionsspektren und Dn = 4 B in Raman-Spektren.
Reine Rotationsspektren werden in der Absorption im fernen IR-Bereich mit IR-Spektrometern mit speziellen Beugungsgittern (Echelettes) und Fourier-Spektrometern untersucht, im Mikrowellenbereich mit Mikrowellen-(Mikrowellen-)Spektrometern , sowie in der Raman-Streuung unter Verwendung von Spektrographen mit hoher Apertur.
Methoden der molekularen Spektroskopie, die auf der Untersuchung von Mikroorganismen basieren, ermöglichen die Lösung verschiedener Probleme in der Chemie, Biologie und anderen Wissenschaften (z. B. Bestimmung der Zusammensetzung von Erdölprodukten, Polymersubstanzen usw.). In Chemie nach MS. Studieren Sie die Struktur von Molekülen. Elektronische M. s. ermöglichen es, Informationen über die elektronischen Hüllen von Molekülen zu erhalten, angeregte Niveaus und ihre Eigenschaften zu bestimmen und die Dissoziationsenergien von Molekülen zu ermitteln (durch die Konvergenz der Schwingungsniveaus eines Moleküls an den Dissoziationsgrenzen). Studium der oszillierenden M. s. ermöglicht es Ihnen, die charakteristischen Schwingungsfrequenzen zu finden, die bestimmten Arten chemischer Bindungen im Molekül (z. B. einfache Doppel- und Dreifach-C-C-Bindungen, C-H-, N-H-, O-H-Bindungen für organische Moleküle) und verschiedenen Atomgruppen (z. B. CH 2) entsprechen , CH 3 , NH 2), bestimmen die räumliche Struktur von Molekülen, unterscheiden zwischen cis- und trans-Isomeren. Hierzu werden sowohl Infrarot-Absorptionsspektren (IR) als auch Raman-Spektren (RSS) verwendet. Besonders verbreitet ist die IR-Methode als eine der effektivsten optischen Methoden zur Untersuchung der Struktur von Molekülen. In Kombination mit der SKR-Methode liefert es die umfassendsten Informationen. Die Untersuchung rotatorischer Magnetresonanzen sowie der Rotationsstruktur elektronischer und Schwingungsspektren ermöglicht die Nutzung experimentell ermittelter Werte der Trägheitsmomente von Molekülen [die aus den Werten der Rotationskonstanten gewonnen werden, vgl (7)] mit großer Genauigkeit (für einfachere Moleküle, zum Beispiel H 2 O) Parameter der Gleichgewichtskonfiguration des Moleküls zu finden – Bindungslängen und Bindungswinkel. Um die Anzahl der ermittelten Parameter zu erhöhen, werden die Spektren von Isotopenmolekülen (insbesondere bei denen Wasserstoff durch Deuterium ersetzt wird) mit den gleichen Parametern der Gleichgewichtskonfiguration, aber unterschiedlichen Trägheitsmomenten untersucht.
Als Beispiel für die Verwendung von M. s. Um die chemische Struktur von Molekülen zu bestimmen, betrachten Sie das Benzolmolekül C 6 H 6 . Studiert ihren M. s. bestätigt die Richtigkeit des Modells, wonach das Molekül flach ist und alle 6 C-C-Bindungen im Benzolring äquivalent sind und ein regelmäßiges Sechseck mit einer Symmetrieachse sechster Ordnung bilden, die durch das Symmetriezentrum des Moleküls senkrecht zu seinem verläuft Flugzeug. Elektronische M. s. Die Absorptionsbande C 6 H 6 besteht aus mehreren Bandensystemen, die Übergängen vom geraden Grund-Singulett-Niveau zu angeregten ungeraden Niveaus entsprechen, von denen das erste ein Triplett und die höheren ein Singulett-Niveau sind. Das Streifensystem ist im Bereich von 1840 am intensivsten ( E 5 - E 1 = 7,0 ev), das Bandsystem ist im Bereich von 3400 am schwächsten ( E 2 - E 1 = 3,8ev), entsprechend dem Singulett-Triplett-Übergang, der durch die Näherungsauswahlregeln für den Gesamtspin verboten ist. Übergänge entsprechen der Anregung des sogenannten. p-Elektronen sind im gesamten Benzolring delokalisiert ; Das aus elektronischen Molekülspektren erhaltene Niveaudiagramm stimmt mit näherungsweise quantenmechanischen Berechnungen überein. Oszillatorischer M. s. C 6 H 6 entsprechen dem Vorhandensein eines Symmetriezentrums im Molekül – Schwingungsfrequenzen, die im IRS erscheinen (aktiv), fehlen im SRS (inaktiv) und umgekehrt (das sogenannte alternative Verbot). Von den 20 normalen Schwingungen von C 6 H 6 4 sind im ICS aktiv und 7 im SCR aktiv, die restlichen 11 sind sowohl im ICS als auch im SCR inaktiv. Gemessene Frequenzwerte (in cm -1): 673, 1038, 1486, 3080 (in ICS) und 607, 850, 992, 1178, 1596, 3047, 3062 (in TFR). Die Frequenzen 673 und 850 entsprechen nichtebenen Schwingungen, alle anderen Frequenzen entsprechen ebenen Schwingungen. Besonders charakteristisch für planare Schwingungen sind die Frequenz 992 (entsprechend der Streckschwingung von C-C-Bindungen, bestehend aus periodischer Kompression und Streckung des Benzolrings), die Frequenzen 3062 und 3080 (entsprechend den Streckschwingungen von C-H-Bindungen) und die Frequenz 607 (entsprechend zur Biegeschwingung des Benzolrings). Die beobachteten Schwingungsspektren von C 6 H 6 (und ähnliche Schwingungsspektren von C 6 D 6) stimmen sehr gut mit theoretischen Berechnungen überein, die eine vollständige Interpretation dieser Spektren und die Ermittlung der Formen aller Normalschwingungen ermöglichten.
Auf die gleiche Weise können Sie M. s. verwenden. Bestimmen Sie die Struktur verschiedener Klassen organischer und anorganischer Moleküle, bis hin zu sehr komplexen, wie z. B. Polymermolekülen.
Vorlesung 12. Kernphysik. Der Aufbau des Atomkerns.
Kern- Dies ist der zentrale massive Teil des Atoms, um den sich Elektronen in Quantenbahnen drehen. Die Masse des Atomkerns ist etwa 4·10 3 mal größer als die Masse aller im Atom enthaltenen Elektronen. Die Kernelgröße ist sehr klein (10 -12 -10 -13). cm), was ungefähr 10 5 mal kleiner ist als der Durchmesser des gesamten Atoms. Die elektrische Ladung ist positiv und entspricht im Absolutwert der Summe der Ladungen der Atomelektronen (da das Atom als Ganzes elektrisch neutral ist).
Der Kern wurde von E. Rutherford (1911) in Experimenten zur Streuung von Alphateilchen beim Durchgang durch Materie entdeckt. Nachdem Rutherford entdeckt hatte, dass a-Teilchen häufiger als erwartet in großen Winkeln gestreut werden, schlug er vor, dass die positive Ladung des Atoms in einem kleinen Kern konzentriert ist (davor herrschten die Ideen von J. Thomson vor, wonach die positive Ladung von Das Atom wurde als gleichmäßig über sein gesamtes Volumen verteilt betrachtet. Rutherfords Idee wurde von seinen Zeitgenossen nicht sofort akzeptiert (das Haupthindernis war der Glaube an den unvermeidlichen Fall atomarer Elektronen auf den Kern aufgrund des Energieverlusts durch elektromagnetische Strahlung bei der Bewegung in der Umlaufbahn um den Kern). Maßgeblichen Anteil an ihrer Anerkennung hatte das berühmte Werk von N. Bohr (1913), das den Grundstein für die Quantentheorie des Atoms legte. Bohr postulierte die Stabilität von Umlaufbahnen als Ausgangsprinzip der Quantisierung der Bewegung atomarer Elektronen und leitete daraus dann die Gesetze der optischen Linienspektren ab, die umfangreiches empirisches Material erklärten (Balmer-Reihe usw.). Etwas später (Ende 1913) zeigte Rutherfords Schüler G. Moseley experimentell, dass sich die kurzwellige Grenze der Linienröntgenspektren von Atomen verschiebt, wenn sich die Ordnungszahl Z eines Elements im Periodensystem der Elemente ändert entspricht Bohrs Theorie, wenn wir annehmen, dass die elektrische Ladung des Kerns (in Einheiten der Elektronenladung) gleich Z ist. Diese Entdeckung durchbrach die Barriere des Misstrauens völlig: Ein neues physikalisches Objekt – der Kern – erwies sich als fest verbunden mit einer ganzen Reihe scheinbar heterogener Phänomene, die nun eine einheitliche und physikalisch transparente Erklärung erhalten haben. Nach Moseleys Arbeit wurde die Tatsache der Existenz des Atomkerns endgültig in der Physik nachgewiesen.
Kernelzusammensetzung. Zum Zeitpunkt der Entdeckung des Kerns waren nur zwei Elementarteilchen bekannt – das Proton und das Elektron. Dementsprechend wurde es als wahrscheinlich angesehen, dass der Kern aus ihnen besteht. Allerdings Ende der 20er Jahre. 20. Jahrhundert Die Proton-Elektron-Hypothese stieß auf eine ernsthafte Schwierigkeit, die als „Stickstoffkatastrophe“ bezeichnet wurde: Gemäß der Proton-Elektron-Hypothese sollte der Stickstoffkern 21 Teilchen (14 Protonen und 7 Elektronen) enthalten, von denen jedes einen Spin von 1/2 hatte . Der Spin des Stickstoffkerns hätte halbzahlig sein sollen, aber nach den Daten zur Messung optischer Molekülspektren stellte sich heraus, dass der Spin gleich 1 war.
Die Zusammensetzung des Kerns wurde nach der Entdeckung von J. Chadwick (1932) geklärt. Neutron. Die Masse des Neutrons liegt, wie sich aus Chadwicks ersten Experimenten herausstellte, nahe an der Masse des Protons und der Spin beträgt 1/2 (später festgestellt). Die Idee, dass der Kern aus Protonen und Neutronen besteht, wurde erstmals von D. D. Ivanenko (1932) in gedruckter Form zum Ausdruck gebracht und unmittelbar danach von W. Heisenberg (1932) entwickelt. Die Annahme über die Protonen-Neutronen-Zusammensetzung des Kerns wurde später experimentell vollständig bestätigt. In der modernen Kernphysik werden Proton (p) und Neutron (n) häufig unter der gemeinsamen Bezeichnung Nukleon zusammengefasst. Die Gesamtzahl der Nukleonen in einem Kern wird Massenzahl genannt A, die Anzahl der Protonen ist gleich der Ladung des Kerns Z (in Einheiten der Elektronenladung), der Anzahl der Neutronen N = A - Z. U Isotope gleiches Z, aber anders A Und N, die Kerne haben die gleichen Isobaren A und verschiedene Z und N.
Im Zusammenhang mit der Entdeckung neuer Teilchen, die schwerer als Nukleonen sind, den sogenannten. Nukleonenisobaren stellten sich heraus, dass sie auch Teil des Kerns sein sollten (intranukleare Nukleonen, die miteinander kollidieren, können sich in Nukleonenisobaren verwandeln). Im einfachsten Kernel - Deuteron , bestehend aus einem Proton und einem Neutron, sollten Nukleonen in etwa 1 % der Fälle in Form von Nukleonenisobaren verbleiben. Eine Reihe beobachteter Phänomene zeugen für die Existenz solcher isobaren Zustände in Kernen. Zusätzlich zu Nukleonen und Nukleonenisobaren, in Kernen periodisch für kurze Zeit (10 -23 -10 -24). Sek) erscheinen Mesonen , einschließlich der leichtesten von ihnen - p-Mesonen. Die Wechselwirkung von Nukleonen beruht auf mehreren Vorgängen der Emission eines Mesons durch eines der Nukleonen und seiner Absorption durch ein anderes. Emerging dh. Austauschmesonenströme beeinflussen insbesondere die elektromagnetischen Eigenschaften von Kernen. Die deutlichste Manifestation von Mesonenaustauschströmen wurde in der Reaktion der Deuteronspaltung durch hochenergetische Elektronen und g-Quanten gefunden.
Wechselwirkung von Nukleonen. Die Kräfte, die Nukleonen im Kern halten, werden genannt nuklear . Dies sind die stärksten Wechselwirkungen, die in der Physik bekannt sind. Die Kernkräfte, die zwischen zwei Nukleonen in einem Kern wirken, sind um eine Größenordnung hundertmal stärker als die elektrostatische Wechselwirkung zwischen Protonen. Eine wichtige Eigenschaft der Nuklearstreitkräfte ist ihre. Unabhängigkeit vom Ladungszustand der Nukleonen: Die Kernwechselwirkungen zweier Protonen, zweier Neutronen oder eines Neutrons und eines Protons sind gleich, wenn die relativen Bewegungszustände dieser Teilchenpaare gleich sind. Die Größe der Kernkräfte hängt vom Abstand zwischen den Nukleonen, von der gegenseitigen Ausrichtung ihrer Spins, von der Ausrichtung der Spins relativ zum Bahndrehimpuls und vom Radiusvektor ab, der von einem Teilchen zum anderen gezogen wird. Kernkräfte zeichnen sich durch einen bestimmten Wirkungsbereich aus: Das Potenzial dieser Kräfte nimmt mit der Entfernung ab R zwischen Teilchen schneller als R-2, und die Kräfte selbst sind schneller als R-3. Aus der Betrachtung der physikalischen Natur der Kernkräfte folgt, dass sie mit der Entfernung exponentiell abnehmen sollten. Der Wirkungsradius nuklearer Kräfte wird durch die sogenannte bestimmt. Compton-Wellenlänge r 0 Mesonen, die während der Wechselwirkung zwischen Nukleonen ausgetauscht werden:
hier ist m die Mesonenmasse, das Plancksche Wirkungsquantum, Mit- Lichtgeschwindigkeit im Vakuum. Die durch den Austausch von p-Mesonen verursachten Kräfte haben den größten Wirkungsradius. Für sie ist r 0 = 1,41 F (1 f = 10 -13 cm). Die Abstände zwischen den Nukleonen in Kernen liegen genau in dieser Größenordnung, aber auch der Austausch schwererer Mesonen (m-, r-, w-Mesonen usw.) trägt zu Kernkräften bei. Die genaue Abhängigkeit der Kernkräfte zwischen zwei Nukleonen vom Abstand und dem Beitrag der Kernkräfte durch den Austausch von Mesonen unterschiedlicher Art ist nicht sicher geklärt. In Mehrkernkernen sind Kräfte möglich, die nicht auf die Wechselwirkung nur von Nukleonenpaaren reduziert werden können. Die Rolle dieser sogenannten Vielteilchenkräfte in der Struktur von Kernen sind weiterhin unklar.
Kernelgrößen hängen von der Anzahl der darin enthaltenen Nukleonen ab. Die durchschnittliche Dichte der Anzahl p der Nukleonen in einem Kern (ihre Anzahl pro Volumeneinheit) ist für alle Multinukleonenkerne (A > 0) nahezu gleich. Das bedeutet, dass das Volumen des Kerns proportional zur Anzahl der Nukleonen ist A und seine lineare Größe ~A 1/3. Effektiver Kernradius R wird durch die Beziehung bestimmt:
R = ein A 1/3 , (2)
Wo ist die Konstante? A nahe bei Hz, unterscheidet sich aber davon und hängt davon ab, an welchen physikalischen Phänomenen es gemessen wird R. Beim sogenannten Ladungsradius des Kerns, gemessen durch die Streuung von Elektronen an Kernen oder durch die Lage von Energieniveaus m- Mesoatome : a = 1,12 F. Aus Interaktionsprozessen ermittelter Wirkradius Hadronen (Nukleonen, Mesonen, a-Teilchen usw.) mit Kernen, die etwas größer als die Ladung sind: ab 1.2 F bis 1,4 F.
Die Dichte der Kernmaterie ist im Vergleich zur Dichte gewöhnlicher Substanzen fantastisch hoch: Sie beträgt etwa 10 14 G/cm 3. Im Kern ist r im zentralen Teil nahezu konstant und nimmt zur Peripherie hin exponentiell ab. Für eine ungefähre Beschreibung empirischer Daten wird manchmal die folgende Abhängigkeit von r vom Abstand r vom Mittelpunkt des Kerns akzeptiert:
![]() .
.
Effektiver Kernradius R gleich R 0 + b. Der Wert b charakterisiert die Unschärfe der Kerngrenze; er ist für alle Kerne nahezu gleich (» 0,5). F). Der Parameter r 0 ist die doppelte Dichte an der „Grenze“ des Kerns, bestimmt aus der Normalisierungsbedingung (Gleichheit des Volumenintegrals von p zur Anzahl der Nukleonen). A). Aus (2) folgt, dass die Größe der Kerne in der Größenordnung von 10 bis 13 variiert cm bis 10-12 cm für schwere Kerne (Atomgröße ~ 10 -8 cm). Allerdings beschreibt Formel (2) die Zunahme der Längenabmessungen von Kernen mit zunehmender Nukleonenzahl nur grob, mit deutlicher Zunahme A. Die Größenänderung des Kerns bei Zugabe von einem oder zwei Nukleonen hängt von den Details der Struktur des Kerns ab und kann unregelmäßig sein. Insbesondere (wie Messungen der Isotopenverschiebung atomarer Energieniveaus zeigen) verringert sich manchmal sogar der Radius des Kerns, wenn zwei Neutronen hinzugefügt werden.