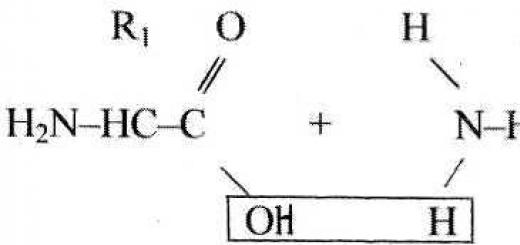
Zamonaviy belgilar kimyoviy elementlar fanga 1813 yilda Berzelius tomonidan kiritilgan. Uning taklifiga ko'ra, elementlar lotincha nomlarining bosh harflari bilan belgilanadi. Masalan, kislorod (Oxygenium) O harfi bilan, oltingugurt S harfi bilan, vodorod (Hydrogenium) H harfi bilan belgilanadi. Bir nechta elementlarning nomi bir harf bilan boshlangan hollarda keyingi elementlardan biri qo'shiladi. birinchi harfgacha. Shunday qilib, uglerod (Carboneum) C belgisiga ega, kaltsiy, mis va boshqalar.
Kimyoviy belgilar nafaqat elementlarning qisqartirilgan nomlari: ular ma'lum miqdorlarni (yoki massalarni) ham ifodalaydi, ya'ni har bir belgi elementning bitta atomini yoki uning atomlarining bir molini yoki elementning massasini (yoki proportsional) ifodalaydi. to) bu elementning molyar massasi. Masalan, C bitta uglerod atomi yoki bir mol uglerod atomi yoki uglerodning 12 massa birligini (odatda ) anglatadi.
Moddalarning formulalari nafaqat moddaning tarkibini, balki uning miqdori va massasini ham ko'rsatadi. Har bir formula moddaning bitta molekulasini yoki moddaning bir molini yoki uning molyar massasiga teng (yoki mutanosib) moddaning massasini ifodalaydi. Masalan, u yoki bir molekula suv, yoki bir mol suv yoki 18 birlik massa (odatda) suvni bildiradi.
Oddiy moddalar molekula nechta atomdan iboratligini ko'rsatadigan formulalar bilan ham ko'rsatilgan oddiy modda: masalan, vodorod formulasi. Agar oddiy moddaning molekulasining atom tarkibi aniq ma'lum bo'lmasa yoki modda turli xil miqdordagi atomlarni o'z ichiga olgan molekulalardan iborat bo'lsa, shuningdek, u molekulyar emas, balki atom yoki metall tuzilishga ega bo'lsa, oddiy modda quyidagicha belgilanadi: elementning ramzi.
Masalan, oddiy fosfor moddasi P formulasi bilan belgilanadi, chunki shartlarga qarab, fosfor har xil miqdordagi atomlarga ega bo'lgan molekulalardan iborat bo'lishi yoki polimer tuzilishga ega bo'lishi mumkin.
Moddaning formulasi uni tahlil qilish natijalari asosida aniqlanadi. Misol uchun, tahlilga ko'ra, glyukoza tarkibida (og'.) uglerod, (mat.) vodorod va (mat.) kislorod mavjud. Shuning uchun uglerod, vodorod va kislorod massalari bir-biri bilan bog'langan. Glyukoza uchun kerakli formulani belgilaylik, bu erda molekuladagi uglerod, vodorod va kislorod atomlarining soni. Bu elementlar atomlarining massalari mos ravishda teng. Shuning uchun glyukoza molekulasida uglerod, vodorod va kislorod mavjud. Bu massalarning nisbati ga teng. Ammo biz allaqachon glyukoza tahlili ma'lumotlariga asoslanib, bu munosabatni topdik. Demak:
Proporsiyaning xususiyatlariga ko'ra:
![]()
Shuning uchun glyukoza molekulasida ikkita vodorod atomi va bitta uglerod atomiga bitta kislorod atomi to'g'ri keladi. Bu shart formulalar va boshqalar bilan qondiriladi.Bu formulalarning birinchisi eng oddiy yoki empirik formula deyiladi; uning molekulyar og'irligi 30,02. Haqiqiy yoki molekulyar formulani bilish uchun siz berilgan moddaning molekulyar og'irligini bilishingiz kerak. Qizdirilganda glyukoza gazga aylanmasdan yo'q qilinadi. Ammo uning molekulyar og'irligini VII bobda tasvirlangan usullar bilan aniqlash mumkin: u 180 ga teng. Ushbu molekulyar og'irlikni eng oddiy formulaga mos keladigan molekulyar og'irlik bilan taqqoslashdan, formula glyukozaga mos kelishi aniq.
Kimyoviy formulalarni olish bilan tanishib, molekulyar massalarning aniq qiymatlari qanday aniqlanishini tushunish oson. Yuqorida aytib o'tilganidek, molekulyar og'irliklarni aniqlashning mavjud usullari ko'p hollarda to'liq aniq natijalarni bermaydi. Ammo, hech bo'lmaganda, moddaning molekulyar og'irligi va foiz tarkibini bilgan holda, molekulaning atom tarkibini ifodalovchi formulasini aniqlash mumkin. Molekulyar massa uni hosil qiluvchi atomlarning atom massalari yig’indisiga teng bo’lganligi sababli, molekulani tashkil etuvchi atomlarning atom massalarini qo’shib, moddaning molekulyar massasini aniqlaymiz. Topilgan molekulyar massaning aniqligi moddaning tahlil qilingan aniqligiga mos keladi.
Bunday daftarni saqlash zarurligi haqidagi qaror darhol emas, balki ish tajribasini to'plash bilan asta-sekin qabul qilindi.
Dastlab, bu ish kitobining oxirida bo'sh joy edi - eng muhim ta'riflarni yozish uchun bir necha sahifalar. Keyin u erda eng muhim jadvallar joylashtirildi. Keyin ko'pchilik o'quvchilarga muammolarni hal qilishni o'rganish uchun qat'iy algoritmik ko'rsatmalar kerak, ular birinchi navbatda tushunishlari va eslashlari kerakligi tushunildi.
O'shanda ish daftariga qo'shimcha ravishda kimyo bo'yicha yana bir majburiy daftar - kimyoviy lug'atni saqlash to'g'risida qaror qabul qilindi. Bir o'quv yilida ikkita bo'lishi mumkin bo'lgan ishchi daftarlardan farqli o'laroq, lug'at butun kimyo kursi uchun bitta daftardir. Eng yaxshisi, bu daftarda 48 varaq va bardoshli qopqoq bo'lsa.
Biz ushbu daftardagi materialni quyidagicha tartibga solamiz: boshida - eng muhim ta'riflar, ularni bolalar darslikdan ko'chiradi yoki o'qituvchining diktanti bilan yozadi. Masalan, 8-sinfdagi birinchi darsda bu “kimyo” fanining ta’rifi, “kimyoviy reaksiyalar” tushunchasi. 8-sinfda o'quv yilida ularning o'ttizdan ortig'i to'planadi. Men ba'zi darslarda ushbu ta'riflar bo'yicha so'rovnomalar o'tkazaman. Masalan, zanjirdagi og'zaki savol, bir talaba boshqasiga savol berganda, agar u to'g'ri javob bergan bo'lsa, u keyingi savolni allaqachon beradi; yoki bir talabaga boshqa talabalar tomonidan savol berilganda, agar u javob bera olmasa, ular o'zlari javob beradilar. Organik kimyoda bular asosan organik moddalar sinflarining ta'riflari va asosiy tushunchalar, masalan, "homologlar", "izomerlar" va boshqalar.
Ma'lumotnomamiz oxirida materiallar jadval va diagrammalar ko'rinishida keltirilgan. Oxirgi sahifada birinchi jadval "Kimyoviy elementlar. Kimyoviy belgilar." Keyin "Valentlik", "Kislotalar", "Ko'rsatkichlar", "Metal kuchlanishlarining elektrokimyoviy qatorlari", "Elektromanfiylik seriyalari" jadvallari.
Men, ayniqsa, "Kislotalarning kislota oksidlariga mos kelishi" jadvalining mazmuniga to'xtalib o'tmoqchiman:
| Kislotalarning kislota oksidlariga mos kelishi | ||||
| Kislota oksidi | Kislota | |||
| Ism | Formula | Ism | Formula | Kislota qoldig'i, valentlik |
| uglerod (II) oksidi | CO2 | ko'mir | H2CO3 | CO3(II) |
| oltingugurt (IV) oksidi | SO 2 | oltingugurtli | H2SO3 | SO3(II) |
| oltingugurt (VI) oksidi | SO 3 | oltingugurt | H2SO4 | SO 4 (II) |
| kremniy (IV) oksidi | SiO2 | kremniy | H2SiO3 | SiO3(II) |
| azot oksidi (V) | N2O5 | azot | HNO3 | NO 3 (I) |
| fosfor (V) oksidi | P2O5 | fosfor | H3PO4 | PO 4 (III) |
Ushbu jadvalni tushunmasdan va yodlamay turib, 8-sinf o'quvchilari uchun reaktsiya tenglamalarini tuzish qiyinlashadi. kislota oksidlari ishqorlar bilan.
Elektrolitik dissotsilanish nazariyasini o'rganayotganda daftar oxiriga diagramma va qoidalarni yozamiz.
Ion tenglamalarini tuzish qoidalari:
1. Suvda eriydigan kuchli elektrolitlar formulalari ion shaklida yoziladi.
2. Oddiy moddalar, oksidlar, kuchsiz elektrolitlar va barcha erimaydigan moddalar formulalari molekulyar shaklda yoziladi.
3. Tenglamaning chap tomonida yomon eriydigan moddalar formulalari ion shaklida, o'ng tomonida molekulyar shaklda yoziladi.
Organik kimyoni o'rganayotganda lug'atga uglevodorodlar bo'yicha umumiy jadvallar, kislorod va azot o'z ichiga olgan moddalar sinflari, genetik bog'lanishlar bo'yicha diagrammalar yozamiz.
| Fizik miqdorlar | |||
| Belgilanish | Ism | Birliklar | Formulalar |
| moddaning miqdori | mol | = N / N A; = m / M; V / V m (gazlar uchun) |
|
| N A | Avogadro doimiysi | molekulalar, atomlar va boshqa zarralar | N A = 6,02 10 23 |
| N | zarrachalar soni | molekulalar, atomlar va boshqa zarralar |
N = N A |
| M | molyar massa | g/mol, kg/kmol | M = m /; /M/ = M r |
| m | vazn | g, kg | m = M; m = V |
| Vm | gazning molyar hajmi | l/mol, m 3/kmol | Vm = 22,4 l / mol = 22,4 m 3 / kmol |
| V | hajmi | l, m 3 | V = V m (gazlar uchun); |
| zichlik | g/ml; | =m/V; M / V m (gazlar uchun) |
|
Maktabda kimyo fanidan dars bergan 25 yillik davr mobaynida men ishlashga majbur bo‘ldim turli dasturlar va darsliklar. Shu bilan birga, deyarli hech qanday darslik muammolarni qanday hal qilishni o'rgatilmagani har doim hayratlanarli edi. Kimyoni o'rganishni boshlashda, lug'atdagi bilimlarni tizimlashtirish va mustahkamlash uchun men va talabalarim yangi miqdorlar bilan "Jismoniy miqdorlar" jadvalini tuzamiz:
Talabalarga hisoblash masalalarini yechishni o'rgatishda u juda katta ahamiyatga ega Men buni algoritmlarga beraman. Menimcha, harakatlar ketma-ketligi bo'yicha qat'iy ko'rsatmalar zaif o'quvchiga ma'lum bir turdagi muammolarni hal qilishni tushunishga imkon beradi. Kuchli talabalar uchun bu ularning keyingi kimyoviy ta'lim va o'z-o'zini tarbiyalashda ijodiy darajaga erishish imkoniyatidir, chunki avval siz nisbatan kam miqdordagi standart texnikani ishonchli o'zlashtirishingiz kerak. Buning asosida murakkabroq masalalarni echishning turli bosqichlarida ularni to'g'ri qo'llash qobiliyati rivojlanadi. Shuning uchun men maktab kursining barcha turlari va fakultativ darslar uchun hisoblash masalalarini echish algoritmlarini tuzdim.
Men ulardan ba'zilariga misollar keltiraman.
Kimyoviy tenglamalar yordamida masalalarni yechish algoritmi.
1. Masala shartlarini qisqacha yozing va kimyoviy tenglama tuzing.
2. Kimyoviy tenglamadagi formulalar ustiga masala ma’lumotlarini yozing va formulalar ostiga mollar sonini yozing (koeffitsient bilan aniqlanadi).
3. Massa qo`yishda massasi yoki hajmi berilgan moddaning miqdorini formulalar yordamida toping:
M/M; = V / V m (gazlar uchun V m = 22,4 l / mol).
Olingan sonni tenglamadagi formula ustiga yozing.
4. Massasi yoki hajmi noma’lum moddaning miqdorini toping. Buning uchun tenglama bo'yicha fikr yuriting: shartga ko'ra mollar sonini tenglama bo'yicha mollar soni bilan solishtiring. Agar kerak bo'lsa, nisbatni tuzing.
5. Formulalar yordamida massa yoki hajmni toping: m = M; V = Vm.
Bu algoritm talaba kelajakda turli murakkablikdagi tenglamalar yordamida masalalar yecha olishi uchun o‘zlashtirishi kerak bo‘lgan asosdir.
Ortiqcha va etishmovchilik bilan bog'liq muammolar.
Agar muammoli sharoitda ikkita reaksiyaga kirishuvchi moddaning miqdori, massasi yoki hajmlari bir vaqtning o'zida ma'lum bo'lsa, bu ortiqcha va etishmovchilik bilan bog'liq muammodir.
Uni hal qilishda:
1. Quyidagi formulalar yordamida reaksiyaga kirishuvchi ikkita moddaning miqdorini topishingiz kerak:
M/M; = V/V m.
2. Olingan mol raqamlarini tenglamaning ustiga yozing. Tenglama bo'yicha ularni mollar soni bilan taqqoslab, qaysi moddaning etishmasligi haqida xulosa chiqaring.
3. Kamchilikdan kelib chiqib, keyingi hisob-kitoblarni amalga oshiring.
Nazariy jihatdan mumkin bo'lgandan amaliy olingan reaksiya mahsuloti unumining ulushiga oid masalalar.
Reaksiya tenglamalaridan foydalanib, nazariy hisob-kitoblar amalga oshiriladi va reaksiya mahsuloti uchun nazariy ma'lumotlar topiladi: nazariya. , m nazariyasi. yoki V nazariyasi. . Laboratoriyada yoki sanoatda reaktsiyalarni o'tkazishda yo'qotishlar yuzaga keladi, shuning uchun olingan amaliy ma'lumotlar amaliydir. ,
m amaliyot. yoki V amaliy. har doim nazariy jihatdan hisoblangan ma'lumotlardan kamroq. Hosildorlik ulushi (eta) harfi bilan belgilanadi va quyidagi formulalar yordamida hisoblanadi:
(bu) = amaliy. / nazariya = m amaliyot. / m nazariyasi. = V amaliy / V nazariyasi.
U birlikning ulushi yoki foiz sifatida ifodalanadi. Vazifalarning uch turini ajratish mumkin:
Agar muammo bayonida boshlang'ich moddaning ma'lumotlari va reaksiya mahsulotining unumining ulushi ma'lum bo'lsa, unda siz amaliy yechim topishingiz kerak. , m amaliy yoki V amaliy. reaktsiya mahsuloti.
Yechim jarayoni:
1. Boshlang'ich modda uchun ma'lumotlar asosida tenglama yordamida hisob-kitobni amalga oshiring, nazariyani toping. , m nazariyasi. yoki V nazariyasi. reaktsiya mahsuloti;
2. Formulalar yordamida amalda olingan reaksiya mahsulotining massasi yoki hajmini toping:
m amaliyot. = m nazariy ; V amaliy = V nazariyasi. ; mashq qilish. = nazariy .
Agar muammo bayonida boshlang'ich modda va amaliyot uchun ma'lumotlar ma'lum bo'lsa. , m amaliy yoki V amaliy. hosil bo'lgan mahsulot va siz reaksiya mahsulotining hosil ulushini topishingiz kerak.
Yechim jarayoni:
1. Boshlang‘ich moddaga oid ma’lumotlar asosida tenglama yordamida hisoblang, toping
Teor. , m nazariyasi. yoki V nazariyasi. reaktsiya mahsuloti.
2. Reaksiya mahsulotining hosil ulushini formulalar yordamida toping:
Amaliyot. / nazariya = m amaliyot. / m nazariyasi. = V amaliy /V nazariyasi.
Muammoli sharoitlarda amaliy shartlar ma'lum bo'lsa. , m amaliy yoki V amaliy. hosil bo'lgan reaktsiya mahsuloti va uning hosil ulushi, siz boshlang'ich modda uchun ma'lumotlarni topishingiz kerak.
Yechim jarayoni:
1. Nazariyani, m nazariyani toping. yoki V nazariyasi. formulalar bo'yicha reaktsiya mahsuloti:
Teor. = amaliy / ; m nazariyasi. = m amaliyot. / ; V nazariyasi. = V amaliy / .
2. Nazariyaga asoslangan tenglama yordamida hisob-kitoblarni bajaring. , m nazariyasi. yoki V nazariyasi. reaktsiya mahsuloti va boshlang'ich moddaning ma'lumotlarini toping.
Albatta, biz ushbu uch turdagi muammolarni bosqichma-bosqich ko'rib chiqamiz, ularning har birini bir qator masalalar misolida hal qilish ko'nikmalarini mashq qilamiz.
Aralashmalar va aralashmalar bilan bog'liq muammolar.

Sof modda aralashmada ko'proq bo'lgan moddadir, qolganlari aralashmalardir. Belgilar: aralashmaning massasi - m sm, massa toza modda– m p.h., aralashmalar massasi – m ga yaqin. , sof moddaning massa ulushi - p.h.
Sof moddaning massa ulushi quyidagi formula yordamida topiladi: p.h. = m h.v. / m sm, u birning kasrlarida yoki foizda ifodalanadi. Keling, 2 turdagi vazifalarni ajratamiz.
Agar masala qo’yilishida sof moddaning massa ulushi yoki aralashmalarning massa ulushi berilgan bo’lsa, aralashmaning massasi berilgan. "Texnik" so'zi ham aralashmaning mavjudligini anglatadi.
Yechim jarayoni:
1. Sof moddaning massasini quyidagi formula yordamida toping: m h.v. = h.v. m sm
Agar aralashmalarning massa ulushi berilgan bo'lsa, avval siz topishingiz kerak massa ulushi toza modda: toza = 1 - taxminan.
2. Sof moddaning massasiga asoslanib, tenglama yordamida keyingi hisob-kitoblarni bajaring.
Agar masala qo'yilishida boshlang'ich aralashmaning massasi va reaksiya mahsulotining n, m yoki V ko'rsatkichlari berilgan bo'lsa, unda siz boshlang'ich aralashmadagi sof moddaning massa ulushini yoki undagi aralashmalarning massa ulushini topishingiz kerak.
Yechim jarayoni:
1. Reaksiya mahsuloti uchun ma’lumotlar asosida tenglama yordamida hisoblang va n p.v ni toping. va m h.v.
2. Aralashmadagi sof moddaning massa ulushini quyidagi formula yordamida toping: p.h. = m h.v. / m qarang va aralashmalarning massa ulushi: taxminan. = 1 - h.v
Gazlarning hajm munosabatlari qonuni.
Gazlarning hajmlari ularning moddalar miqdori bilan bir xil bog'liq:
V 1 / V 2 = 1/2
Bu qonun gazning hajmi berilgan va boshqa gazning hajmini topish kerak bo'lgan tenglamalar yordamida masalalarni yechishda qo'llaniladi.
Aralashmadagi gazning hajm ulushi.
Vg / Vcm, bu erda (phi) - gazning hajm ulushi.
Vg – gaz hajmi, Vsm – gaz aralashmasi hajmi.
Agar masala qo’yilishida gazning hajm ulushi va aralashmaning hajmi berilgan bo’lsa, u holda birinchi navbatda gazning hajmini topish kerak: Vg = Vsm.
Gaz aralashmasining hajmi quyidagi formula yordamida topiladi: Vcm = Vg /.
Moddaning yonishi uchun sarflangan havo hajmi tenglama bo'yicha topilgan kislorod hajmi orqali topiladi:
Vair = V(O 2) / 0,21
Umumiy formulalar yordamida organik moddalar formulalarini chiqarish.
Organik moddalar gomologik qatorlarni hosil qiladi umumiy formulalar. Bu quyidagilarga imkon beradi:
1. Nisbiy molekulyar massani n soni bilan ifodalang.
M r (C n H 2n + 2) = 12 n + 1 (2n + 2) = 14n + 2.
2. n orqali ifodalangan M r ni haqiqiy M r ga tenglashtiring va n ni toping.
3. Reaksiya tenglamalarini tuzing umumiy ko'rinish va ular bo'yicha hisob-kitoblarni bajaring.
Yonish mahsulotlari asosida moddalarning formulalarini chiqarish.
1. Yonish mahsulotlarining tarkibini tahlil qiling va kuygan moddaning sifat tarkibi haqida xulosa chiqaring: H 2 O -> H, CO 2 -> C, SO 2 -> S, P 2 O 5 -> P, Na 2. CO 3 -> Na, C.
Moddada kislorod mavjudligi tekshirishni talab qiladi. Formuladagi indekslarni x, y, z bilan belgilang. Masalan, CxHyOz (?).
2. Yonish mahsulotlari tarkibidagi moddalar miqdorini formulalar yordamida toping:
n = m / M va n = V / Vm.
3. Kuygan modda tarkibidagi elementlar miqdorini toping. Masalan:
n (C) = n (CO 2), n (H) = 2 ћ n (H 2 O), n (Na) = 2 ћ n (Na 2 CO 3), n (C) = n (Na 2 CO 3) va boshqalar.
4. Agar tarkibi noma'lum bo'lgan modda yonib ketgan bo'lsa, unda kislorod bor yoki yo'qligini tekshirish kerak. Masalan, CxNyOz (?), m (O) = m in–va – (m (C) + m(H)).
b) nisbiy zichlik ma'lum bo'lsa: M 1 = D 2 M 2, M = D H2 2, M = D O2 32,
M = D havo 29, M = D N2 28 va boshqalar.
1-usul: moddaning eng oddiy formulasini (oldingi algoritmga qarang) va eng oddiy molyar massasini toping. Keyin haqiqiy molyar massani eng oddiy bilan solishtiring va formuladagi indekslarni kerakli miqdordagi marta oshiring.
2-usul: n = (e) Mr / Ar(e) formulasidan foydalanib indekslarni toping.
Agar elementlardan birining massa ulushi noma'lum bo'lsa, uni topish kerak. Buning uchun boshqa elementning massa ulushini 100% yoki birlikdan ayirish kerak.
Asta-sekin, kimyoni o'rganish jarayonida kimyoviy lug'atda muammolarni hal qilish algoritmlari to'planadi. turli xil turlari. Va talaba har doim muammoni hal qilish uchun kerakli formulani yoki kerakli ma'lumotlarni qaerdan topishni biladi.
Ko'pgina talabalar bunday daftarni saqlashni yaxshi ko'radilar, ular o'zlari uni turli xil ma'lumotnomalar bilan to'ldiradilar.
Sinfdan tashqari mashg'ulotlarga kelsak, mening o'quvchilarim va menda ham chegaradan tashqariga chiqadigan muammolarni hal qilish algoritmlarini yozish uchun alohida daftar mavjud. maktab o'quv dasturi. Xuddi shu daftarga har bir masala turi uchun 1-2 ta misol yozamiz, qolgan masalalarni esa boshqa daftarda yechamiz. Va agar siz bu haqda o'ylab ko'rsangiz, barcha universitetlarda kimyo imtihonida paydo bo'ladigan minglab turli xil muammolar orasida siz 25-30 xil muammolarni aniqlashingiz mumkin. Albatta, ular orasida juda ko'p farqlar mavjud.
Fakultativ darslarda masalalarni yechish algoritmlarini ishlab chiqishda A.A.ning qo‘llanmasi menga katta yordam berdi. Kushnareva. (Kimyodan masalalar yechishni o'rganish, - M., Maktab - matbuot, 1996).
Kimyo fanidan masalalar yecha olish qobiliyati fanni ijodiy o’zlashtirishning asosiy mezoni hisoblanadi. Aynan turli darajadagi murakkablikdagi masalalarni yechish orqali kimyo kursini samarali o‘zlashtirish mumkin.
Agar talaba barcha mumkin bo'lgan muammolar turlarini aniq tushunsa va har bir turdagi ko'p sonli muammolarni hal qilsa, u Yagona davlat imtihonida va universitetlarga kirishda kimyo imtihonini engish imkoniyatiga ega bo'ladi.
Kimyo, har qanday fan kabi, aniqlikni talab qiladi. Ushbu bilim sohasidagi ma'lumotlarni taqdim etish tizimi asrlar davomida ishlab chiqilgan va joriy standart barcha ma'lumotlarni o'z ichiga olgan optimallashtirilgan tuzilmadir. zarur ma'lumotlar davomi uchun nazariy ish har bir alohida element bilan.
Formulalar va tenglamalarni yozishda butun sonlardan foydalanish nihoyatda noqulay va bugungi kunda bu maqsadda bir yoki ikkita harf - elementlarning kimyoviy belgilaridan foydalaniladi.
Hikoya
Qadimgi dunyoda, shuningdek, o'rta asrlarda olimlar turli elementlarni ifodalash uchun ramziy tasvirlardan foydalanganlar, ammo bu belgilar standartlashtirilmagan. Faqat XIII asr Moddalar va elementlarning belgilarini tizimlashtirishga harakat qilinmoqda va 15-asrdan boshlab yangi kashf etilgan metallar nomlarining birinchi harflari bilan belgilana boshladi. Shunga o'xshash nomlash strategiyasi bugungi kungacha kimyoda qo'llaniladi.
Nomlash tizimining hozirgi holati
Bugungi kunda bir yuz yigirmadan ortiq kimyoviy elementlar ma'lum bo'lib, ularning ba'zilarini tabiatda topish juda qiyin. 19-asrning o'rtalarida fan ulardan atigi 63 tasi mavjudligini bilganligi ajablanarli emas va kimyoviy ma'lumotlarni taqdim etishning yagona nomlash tizimi ham, yaxlit tizimi ham mavjud emas edi.
Oxirgi muammoni oʻsha asrning ikkinchi yarmida rus olimi D.I.Mendeleyev oʻzidan oldingi olimlarning muvaffaqiyatsiz urinishlariga tayangan holda hal qildi. Nomlash jarayoni bugungi kunda ham davom etmoqda - 119 va undan yuqori raqamlarga ega bo'lgan bir nechta elementlar mavjud bo'lib, jadvalda ularning seriya raqamining lotincha qisqartmasi bilan shartli ravishda belgilangan. Ushbu toifadagi kimyoviy elementlarning belgilarini talaffuz qilish lotin raqamlarini o'qish qoidalariga muvofiq amalga oshiriladi: 119 - ununenniy (so'zma-so'z "bir yuz o'n to'qqizinchi"), 120 - unbiniliy ("yuz yigirmanchi") va boshqalar. .
Elementlarning aksariyati lotin, yunon, arab va nemis ildizlaridan olingan o'z nomlariga ega bo'lib, ba'zi hollarda moddalarning ob'ektiv xususiyatlarini aks ettiradi, boshqalari esa motivsiz belgilar sifatida ishlaydi.
Ayrim elementlarning etimologiyasi
Yuqorida aytib o'tilganidek, kimyoviy elementlarning ba'zi nomlari va belgilari ob'ektiv ravishda kuzatiladigan belgilarga asoslanadi.
Qorong'ida porlaydigan fosfor nomi yunoncha "yorug'lik olib kelish" iborasidan kelib chiqqan. Rus tiliga tarjima qilinganda juda ko'p "aytib beradigan" nomlar aniqlanadi: xlor - "yashil", brom - "xushbo'y hidli", rubidiy - "to'q qizil", indiy - "indigo rangli". Elementlarning kimyoviy belgilari lotin harflarida berilganligi sababli, rus tilida so'zlashuvchi uchun nomning modda bilan bevosita bog'liqligi odatda e'tibordan chetda qoladi.
Bundan tashqari, yanada nozik nomlash uyushmalari mavjud. Shunday qilib, selen nomi yunoncha "Oy" degan so'zdan kelib chiqqan. Buning sababi, tabiatda bu element tellurning sun'iy yo'ldoshi bo'lib, uning nomi yunoncha "Yer" degan ma'noni anglatadi.

Niobiy ham xuddi shunday nomlanadi. Qadimgi yunon mifologiyasiga ko'ra, Niobe Tantalning qizi. Tantal kimyoviy elementi ilgari kashf etilgan va uning xossalari niobiyga o'xshaydi - shuning uchun kimyoviy elementlarning "munosabatlar" ga mantiqiy "ota-qiz" aloqasi prognoz qilingan.
Bundan tashqari, tantal o'z nomini mashhur mifologik xarakter sharafiga olgani tasodif emas. Gap shundaki, ushbu elementni sof shaklda olish juda katta qiyinchiliklarga duch keldi, shuning uchun olimlar "Tantal uni" frazeologik birligiga murojaat qilishdi.
Yana bir qiziq tarixiy fakt platina nomi so'zma-so'z "kumush" deb tarjima qilinadi, ya'ni shunga o'xshash narsa, lekin kumush kabi qimmatli emas. Buning sababi shundaki, bu metall kumushga qaraganda ancha qiyin eriydi va shuning uchun uzoq vaqt davomida foydalanilmadi va alohida ahamiyatga ega emas edi.
Elementlarni nomlashning umumiy printsipi
Davriy jadvalni ko'rib chiqayotganda, birinchi navbatda, kimyoviy elementlarning nomlari va belgilari ko'zni qamashtiradi. Har doim bitta yoki ikkita harflar, ulardan birinchisi kapital. Harflarni tanlash elementning lotin nomi bilan belgilanadi. So'zlarning ildizlari qadimgi yunon, lotin va boshqa tillardan kelganiga qaramay, nomlash standartiga ko'ra, ularga lotincha sonlar qo'shiladi.
Qizig'i shundaki, ramzlarning aksariyati rus tilida so'zlashuvchi uchun intuitiv bo'ladi: alyuminiy, sink, kaltsiy yoki magniyni talaba birinchi marta osongina eslab qolishi mumkin. Vaziyat rus va lotin versiyalarida farq qiladigan nomlar bilan yanada murakkabroq. Talaba kremniyni kremniy, simob esa gidrargirum ekanligini eslashi uchun uzoq vaqt kerak bo'lishi mumkin. Biroq, buni eslab qolishingiz kerak - grafik tasvir har bir element moddaning lotincha nomiga qaratilgan bo'lib, unda paydo bo'ladi kimyoviy formulalar va mos ravishda Si va Hg kabi reaktsiyalar.

Bunday nomlarni eslab qolish uchun o‘quvchilarga “Kimyoviy element belgisi va uning nomini moslang” kabi mashqlarni bajarish foydali bo‘ladi.
Boshqa nomlash usullari
Ba'zi elementlarning nomlari kelib chiqadi arabcha va lotincha "stillashtirilgan". Misol uchun, natriy o'z nomini "ko'pikli modda" degan ma'noni anglatuvchi ildiz poyasidan oladi. Arabcha ildizlarni kaliy va tsirkoniy nomlarida ham kuzatish mumkin.

Uning ham ta'siri bor edi nemis tili. Undan marganets, kobalt, nikel, sink, volfram kabi elementlarning nomlari kelib chiqadi. Mantiqiy aloqa har doim ham aniq emas: masalan, nikel "mis shayton" degan ma'noni anglatadigan so'zning qisqartmasi.
Kamdan kam hollarda ismlar rus tiliga iz qog'ozi shaklida tarjima qilingan: vodorod (so'zma-so'z "suv tug'diruvchi") vodorodga, karboniy esa uglerodga aylandi.
Ismlar va joy nomlari
O'ndan ortiq elementlar turli olimlar, jumladan Albert Eynshteyn, Dmitriy Mendeleev, Enriko Fermi, Ernest Rezerford, Nils Bor, Mari Kyuri va boshqalar nomi bilan atalgan.
Ba'zi nomlar boshqa to'g'ri nomlardan kelib chiqadi: shaharlar, shtatlar, mamlakatlar nomlari. Masalan: moskovium, dubnium, evropium, tennessin. Hamma toponimlar ona rus tilida so'zlashuvchiga tanish bo'lib tuyulmaydi: madaniy tayyorgarligi bo'lmagan odam nihonium so'zida Yaponiyaning o'z nomini - Nihon (lit.: Chiqayotgan quyosh mamlakati) va hafniyada - tan olishi dargumon. Kopengagenning lotincha versiyasi. Rutenium so'zida hatto ona mamlakatingiz nomini ham topish oson ish emas. Shunga qaramay, Rossiya lotin tilida Ruteniya deb ataladi va 44-chi kimyoviy element uning nomi bilan atalgan.

Koinot jismlarining nomlari davriy sistemada ham uchraydi: Uran, Neptun, Pluton, Ceres sayyoralari Qadimgi yunon mifologiyasidagi belgilar nomlaridan tashqari (Tantal, Niobium) Skandinaviyadagilar ham bor: toriy, vanadiy.
Davriy jadval
Bugungi kunda bizga tanish bo'lgan, Dmitriy Ivanovich Mendeleev nomi bilan atalgan davriy jadvalda elementlar qatorlar va davrlarda keltirilgan. Har bir hujayrada kimyoviy element kimyoviy belgi bilan belgilanadi, uning yonida boshqa ma'lumotlar ko'rsatiladi: uning to'liq nomi, seriya raqami, elektronlarning qatlamlar bo'ylab taqsimlanishi, nisbiy atom massasi. Har bir hujayraning o'ziga xos rangi bor, bu s-, p-, d- yoki f- elementining ta'kidlanganligiga bog'liq.
Yozib olish tamoyillari
Izotoplar va izobarlarni yozishda massa raqami element belgisining yuqori chap tomoniga joylashtiriladi - yadrodagi proton va neytronlarning umumiy soni. Bunday holda, protonlar soni bo'lgan atom raqami pastki chapga joylashtiriladi.

Yuqori o'ng tomonda ionning zaryadi yozilgan va xuddi shu tomonda atomlar soni ko'rsatilgan. Kimyoviy elementlarning belgilari har doim bosh harf bilan boshlanadi.
Milliy yozish imkoniyatlari
Osiyo-Tinch okeani mintaqasida kimyoviy elementlar uchun belgilar yozishning o'ziga xos variantlari mavjud mahalliy yo'llar harflar. Xitoy yozuvlari tizimi fonetik ma'noda radikal belgilardan keyin belgilardan foydalanadi. Metalllarning belgilaridan oldin "metall" yoki "oltin" belgisi, gazlar - radikal "bug'" bilan, metall bo'lmaganlar - "tosh" ieroglifi bilan.
Evropa mamlakatlarida qayd etilgan elementlarning belgilari xalqaro jadvallarda qayd etilganidan farq qiladigan holatlar ham mavjud. Masalan, Frantsiyada azot, volfram va berilliy milliy tilda o'z nomlariga ega va tegishli belgilar bilan ko'rsatilgan.
Nihoyat
Maktabda yoki hatto oliy o'quv yurtida o'qiyotganda ta'lim muassasasi, butun davriy jadvalning mazmunini yodlash umuman shart emas. Siz formulalar va tenglamalarda eng ko'p uchraydigan elementlarning kimyoviy belgilarini yodda tutishingiz kerak va vaqti-vaqti bilan Internetda yoki darslikdan kamroq qo'llaniladiganlarini qidirib toping.

Biroq, xatolar va chalkashliklarga yo'l qo'ymaslik uchun jadvaldagi ma'lumotlar qanday tuzilganligini, kerakli ma'lumotlarni qaysi manbadan topishni bilishingiz va rus va lotin versiyalarida qaysi element nomlari farqlanishini aniq eslab qolishingiz kerak. Aks holda, tasodifan Mg marganets va N natriy bilan xato qilishingiz mumkin.
Dastlabki bosqichda mashq qilish uchun mashqlarni bajaring. Masalan, davriy jadvaldagi nomlarning tasodifiy ketma-ketligi uchun kimyoviy element belgilarini keltiring. Tajriba orttirganingizda, hamma narsa joyiga tushadi va bu asosiy ma'lumotni yodlash masalasi o'z-o'zidan yo'qoladi.
kimyoviy belgilar
KIMYOVIY BELGILAR (kimyoviy belgilar) kimyoviy elementlarning harf belgilari. Elementning lotincha nomining birinchi yoki birinchi va keyingi harflaridan biridan iborat, masalan, uglerod - C (Carboneum), kaltsiy - Ca (Kalsiy), kadmiy - Cd (Kadmiy). Nuklidlarni belgilash uchun ularning kimyoviy belgilari yuqori chapda massa raqami, ba'zan esa, masalan, pastki chapda atom raqami beriladi. Kimyoviy belgilar kimyoviy formulalarni yozish uchun ishlatiladi.
Kimyoviy belgilar
kimyoviy belgilar, kimyoviy elementlarning qisqartirilgan harf belgilari. Zamonaviy Z. x. (jadvalga qarang) elementlarning lotincha nomining birinchi harfi yoki birinchi va keyingi harflaridan biridan iborat. Kimyoviy formulalar va kimyoviy tenglamalarda har bir Z. x. element nomidan tashqari uning atom massasiga teng nisbiy massani ifodalaydi. Izobarlar va izotoplarni Z. x ga belgilash. yuqori chapdan (ba'zan o'ngda) ommaviy raqam beriladi; Atom raqami chap pastki qismida yozilgan. Agar ular neytral atomni emas, balki ionni belgilashni xohlasalar, ionning zaryadi yuqori o'ngga joylashtiriladi. Molekuladagi berilgan element atomlari soni pastki o'ng tomonda ko'rsatilgan. Misollar: ═≈ bir zaryadli xlor izotop ioni (atom raqami 17, massa raqami 35); ═≈ bir xil izotopning ikki atomli molekulasi. Argon va kaltsiyning izobarlari mos ravishda ═i bilan belgilanadi. Z. x jadvalida keltirilgan. xalqaro, lekin ular bilan bir qatorda, ayrim mamlakatlarda elementlarning milliy nomlaridan olingan belgilar qo'llaniladi. Masalan, Frantsiyada Z. x o'rniga. azot N, berilliy Be va volfram V Az (Azot), Gl (Glyutsin) va Tu (Volfram) olinadi. AQShda ko'pincha niobiy belgisi Nb o'rniga Cb (Kolumbiy) ishlatiladi. Atom raqamlari 102 va 103 ("nobelium" va "lawrencium") bo'lgan elementlarning nomlari va belgilari umuman qabul qilinmaydi. Tarixiy ma'lumotnoma. Kimyogarlar qadimgi dunyo va o'rta asrlarda moddalar, kimyoviy operatsiyalar va asboblarni belgilash uchun ramziy tasvirlar, harflarning qisqartmalari, shuningdek ikkalasining kombinatsiyasi ishlatilgan (qarang. guruch.). Antik davrning ettita metali ettita osmon jismining astronomik belgilari bilan tasvirlangan: Quyosh (oltin), Oy (kumush), Yupiter (qalay), Venera (mis), Saturn (qo'rg'oshin), Merkuriy (simob), Mars. (temir). 15-18-asrlarda kashf etilgan metallar - vismut, rux, kobalt - nomlarining birinchi harflari bilan belgilangan. Vino spirtining belgisi (lotincha spiritus vini) S va V harflaridan iborat. Kuchli aroq (lotincha aqua fortis, nitrat kislota) va oltin aroq (lotincha aqua regis, aqua regia, xlorid va azot aralashmasi) belgilari. kislotalar) suv Ñ va belgisidan tuzilgan Bosh harflar F, mos ravishda R. Shisha belgisi (lotincha vitrum) ikki V ≈ to'g'ri va teskari harflardan hosil bo'ladi. Qadimgi Z.ni tashkil etishga urinishlar x. 18-asr oxirigacha davom etdi. 19-asr boshlarida. Ingliz kimyogari J. Dalton kimyoviy elementlarning atomlarini doiralar bilan belgilashni taklif qildi, ularning ichida nuqtalar, chiziqlar, metallarning inglizcha nomlarining bosh harflari va boshqalar joylashtirilgan. Daltonlar Buyuk Britaniya va G'arbiy Evropada ma'lum darajada mashhur bo'ldi, lekin tez orada shved kimyogari I. Ya. Berzelius 1814 yilda taklif qilgan sof harflarga asoslangan kimyo bilan almashtirildi. Kimyoni yig'ish uchun u ifodalagan tamoyillar. shu kungacha o'z kuchlarini saqlab qolishdi; ular maqolaning boshida aytilgan. Rossiyada Z. x haqida birinchi bosma xabar. Berzelius 1824 yilda Moskva shifokori I. Ya. Zatsepin tomonidan yaratilgan. Kimyoviy elementlarning belgilari, nomlari, atom raqamlari va atom massalari Belgisi* Lotin nomi Ruscha nomi Atom raqami Atom massasi** Belgisi* Lotin nomi Ruscha nomi Atom raqami Atom massasi** Ac Actinium Actinium 89 [ 227] Mg Mgnesiom Magnesium 12 24.305 Ag Argentum Kumush 47 107,8680 Mn mangan marganets 25 54,9380 Al alyuminiy alyuminiy 13 26,98154 Mo Molebdaenum molibden 42 95,94 Am Ameritsiy 95 N Azot Azot Argonium Na4,91 Argon 709 Na4,9 um Natriy 11 22 .98977 Arsenik mishyak 33 74,9216 Nb Niobiy Niobiy 41 92,9064 Astatium Astatine 85 Nd Neodimiy Neodimiyum 60 144,24 Aurum Gold 79 196,9665 Ne Neonum Neon 10 20,179 B Borum Bor 5 10,810 Niccolum Nikel 27belium No1 barium (Barium No 2715) ) (Nobeliy) 102 Beriliy Beriliy bo'l 4 9.01218 Np Neptuniy Neptunium 93 237.0482 Bi-vismut vismut 83 208.9804 O kislorod kislorod 8 15.9994 Bk Berkelium Berkeley th 97 Os Osmiy Brom Brom P1902 P190. osfor Fosfor 15 30,97376 S Karboniy Uglerod 6 12,011 Pa Protaktiniy Protaktiniy 91 231,0359 Ca Kalsiy Kalsiy 20 40.08 Pb Plumbum qoʻrgʻoshin 82 207 .2 Cd kadmiy kadmiy 48 112 .40 Pd palladiy palladiy 46 106.4 Tse seriy seriy 58 140.12 Pm Prometiy prometiy 61 Cf. kalium 49 Chl 61 Cf kaliforniy kallorium 4 Chl 17 35.453 Pr Praseodymium Praseodymium 59 140.9077 Cm Curium Curium 96 Pt Platinum Platinum 78 195, 09 Co Cobaltum Cobalt 27 58,9332 Pu Plutonium Plutonium 94 Cr Cr Cr Chromium 24 51.996 Ra Radium Radium 88 226.0254 Csumbium Rubidium 88 226.0254 Csubium Rubidium Cs3105. 85,4678 Cu Cuprum mis 29 63,546 Re Renium Renium 75 186,2 Dy Disprosium Disprosium 66,162,50 Rh Rodium Rodium 45,102,9055 Er Erbium Erbium 68,167,26 Rn Radonum Radon 86 Es Einsteinium Einsteinium 99 Ruthenium Ruthenium 40,162,50 Europ, Europ. Oltingugurt 16 32,06 F Ftor Ftor 9 18,99840 Sb Stibium surma 51 121,75 Fe temir temir 26 55,847 Sk Skandiy Skandiy 21 44,9559 Fm Fermiyum Fermiyum 100 Selenyum Selen 34 78,96 Fr Frantsiy fransiy 87 Si kremniy kremniy 14 28,086 Ga Galiy Galliy 31 69,72 Sm Samarium, Samarium G51, Ga51, Ga51, 06. Sn Stannum qalay 50,118,69 Ge germaniy germaniy 32 72,59 Sr stronsiy stronsiy 38 87,62 H vodorod Vodorod 1 1,0079 Ta tantal tantal 73,180,949 He geliy geliy 2 4,00260 Tb terbiyum terbiy 65 158,9254 Hf gafniy gafniy 72 178,49 Tc technetium Technetium 64002 Hydrarag 6902. 0,59 Te Tellur Tellurium 52 127,60 Xo-golmiy Holmiy 6 7 164,9304 Th Toriy Toriy 90 232,0381 IODUM IOD 53 126,9045 TITANIUM Titan 22 47,90 Indium Hindiston 49 114,82 TLLIUM Taliy 81 204,37 IRIDIUM IRIDIM 77 192,22 TM Tulium Tulia 69 168,909 TM Tulium Uranium Uranium kalium 69 168,919 tl. 92,238,029 Kr Kripton Kripton 36 83,80 V Vanadiy Vanadiy 23 50,94 Ku Kurtschatovim Kurchatovim 104 Vt Volframium volfram 74,183,85 La lantan lantan 57 138,9055 Xe ksenonum ksenon 5 4,131,30 lityum lityum lityum 3 6,941 Y itriy itriy 39 88,9059 Ytterium (La1059 Yt) 173,04 Lu lutetiy lutetiy 71 174,97 Zn Sink rux 30 65,38 Md Mendeleviy Mendelev 101 Zr Zirkoniy Zirkonyum 40 91, 22 * Atom raqamlari 102 va 103 bo'lgan elementlarning umumiy bo'lmagan belgilari va nomlari qavs ichida berilgan. ** Atom massalari uglerod shkalasida berilgan (12C uglerod izotopining atom massasi aynan 12 ga teng) va 197-xalqaro jadvalga mos keladi.
- va.
- :
- Ilmiy intizom, moddalarni o'rganish, ularning tarkibi, tuzilishi, xususiyatlari va o'zaro o'zgarishlar.
- O'z ichiga olgan mavzu nazariy asos bu fandan.
- parchalanish Berilgan o'quv fanining mazmunini o'z ichiga olgan darslik.
- Ushbu fan va uning qonuniyatlarini ishlab chiqarishda, sanoatda va hokazolarda amaliy qo'llash.
- smth ning sifat tarkibi.
- parchalanish Ishlab chiqarishda va kundalik hayotda ishlatiladigan preparatlar, kimyoviy moddalar, eritmalar va boshqalar.
- parchalanish Tabiiy ingredientlarni deyarli o'z ichiga olmaydigan oziq-ovqat mahsulotlari.
- trans. parchalanish Perm.
- :
Radioaktiv elementlarning eng uzoq umr ko'radigan izotoplarining massa raqamlari kvadrat qavs ichida berilgan.
Lit.: Lomonosov M.V., Toʻliq. to'plam soch., 2-jild, M. ≈ L., 1951, b. 706≈709; Jua M., Kimyo tarixi, trans. Italiyadan, M., 1966; Crosland M. P., Kimyo tilidagi tarixiy tadqiqotlar, L., 196
Ushakov lug'ati
Kimyo
he miya, kimyo, pl. Yo'q, xotinlar (yunoncha kimyo). Tarkibi, tuzilishi, o'zgarishlari va o'zgarishlari, shuningdek, yangi sodda va murakkab moddalar. Kimyoni, deydi Engels, miqdoriy tarkibning o'zgarishi ta'sirida sodir bo'ladigan jismlarning sifat o'zgarishlari haqidagi fan deb atash mumkin. Organik kimyo. Noorganik kimyo. Amaliy kimyo. Nazariy kimyo. Kimyo kursi.
| nima. Biror narsaning kimyoviy xossalari ilmiy). Neft kimyosi.
ensiklopedik lug'at
Kimyo
(ehtimol, yunoncha Chemia - Chemiya, ulardan biri qadimgi ismlar Misr), moddalarning tarkibi va (yoki) tuzilishidagi o'zgarishlar bilan birga keladigan o'zgarishlarni o'rganadigan fan. Kimyoviy jarayonlar (rudalardan metallar olish, matolarni bo'yash, terini bo'yash va boshqalar) insoniyat tomonidan madaniy hayotining boshidayoq ishlatilgan. 3—4-asrlarda. Alkimyo paydo bo'ldi, uning vazifasi asosiy metallarni olijanob metallarga aylantirish edi. Uyg'onish davridan boshlab kimyoviy tadqiqotlar amaliy maqsadlarda (metallurgiya, shishasozlik, kulolchilik, bo'yoqlar ishlab chiqarish) tobora ko'proq foydalanilmoqda; Alkimyoning maxsus tibbiy tarmog'i - yatrokimyo ham paydo bo'ldi. 2-yarmda. 17-asr R.Boyl tushunchaning birinchi ilmiy ta’rifini berdi "kimyoviy element". 2-yarmida kimyoning haqiqiy fanga aylanishi davri tugadi. Kimyoviy reaksiyalarda massaning saqlanish qonuni shakllantirilgan 18-asr (yana q. M.V.Lomonosov, A.Lavuazye). Boshida. 19-asr J. Dalton kimyoviy atomizmga asos solgan, A. Avogardo tushunchasini kiritgan "molekula". Bu atom-molekulyar tushunchalar faqat 60-yillarda yaratilgan. 19-asr Shu bilan birga, A. M. Butlerov kimyoviy birikmalarning tuzilishi nazariyasini yaratdi, D. I. Mendeleev esa davriy qonunni kashf etdi (qarang. Davriy jadval Mendeleev elementlari). Oxiridan 19 - boshlanish 20-asrlar eng muhim yo'nalish Kimyo kimyoviy jarayonlarning qonuniyatlarini o'rganuvchi fan edi. Zamonaviy kimyoda uning alohida sohalari noorganik kimyo, organik kimyo, fizik kimyo, analitik kimyo, polimerlar kimyosi asosan mustaqil fanlarga aylandi. Kimyo va boshqa bilim sohalarining kesishmasida, masalan, biokimyo, agrokimyo va geokimyo paydo bo'ldi. Bu qonunlar kimyo qonunlariga asoslanadi Texnik fan, masalan, kimyoviy texnologiya, metallurgiya.
Ozhegov lug'ati
X VA IIV, Va, va.
1. Moddalarning tarkibi, tuzilishi, xossalari va ularning o'zgarishi haqidagi fan. Noorganik x. Organik x. Jismoniy x. (fizikaning umumiy tamoyillari asosida).
2. nima. Tarkibning o'zi, moddalarning xossalari va ularning o'zgarishi. X. uglevodlar. X. moy.
3. yig'ilgan Kimyoviy moddalar. Uy xo'jaligi x.
4. Biror kishiga ta'sir qilish usuli. kimyoviy moddalardan foydalanish (so'zlashuv tilida). Kimyo qiling (bunday vositalar yordamida kıvırma). Kimyo kursiga boring (ya'ni, bunday dorilar yordamida davolash kursi, kimyoterapiya). Kimyoviy moddalar bilan ishlov berilgan ko'chatlar (kimyoviy moddalar).
| adj. kimyoviy, oh, oh.
Efremova lug'ati
Kimyo
Brokxaus va Efron entsiklopediyasi
Kimyo
Bu so'zning asl ma'nosi va kelib chiqishi noma'lum; ehtimol bu Shimoliy Misrning oddiygina eski nomi bo‘lib, u holda kimyo fani Misr fani degan ma’noni anglatadi; ammo Chemi, Misrdan tashqari, qora rangni ham anglatardi va mélinos (qoralash) metallarning o'zgarishida muqarrar operatsiya hisoblanganligi sababli, thēnē tĮs chēmēías - bu Olympiodoring artefadoring moddasi bo'lishi mumkin. X. Kopp, "Geschichte der Chemie", II, 1844, 4 - 6 va M. Berthelot, "Kirish a l "é tude de la chimie des anciens et du moyen bge", 1889). "Ko'pchilik boshqa fanlardan X. taraqqiyotida uning maqsadi turli davrlarda turlicha tushunilganligi bilan ajralib turadi... Ma’naviy faoliyatning boshqa sohalarida boshqa davrlarda ularga qanday munosabatda bo‘lishidan qat’i nazar, maqsad doimo aniq e’tirof etilgan va u barqarorlik bilan saqlanib qolgan. aql, yilda Bu X tarixida umuman kuzatilmaydi. Bu fan nafaqat yordamchi vositalar va ilovalarni tanlashni, balki butun vazifani va uning mavjud bo'lish shartlarini o'zgartiradi (qarang. Alchemy, Iatrochemists, Phlogiston) ... Hozirgi vaqtda G. Kopp ("Geschichte der Chemie") davom etadi. ”, I , 1843, 5), X.ning vazifasi, oʻz-oʻzidan qabul qilingan (an und f ü r sich), birikmalarni ularning tarkibiy qismlariga parchalash va tarkibiy qismlardan yana birikmalar hosil qilishdir [Bu taʼrif sanalar. Orqaga 17-asr oʻrtalari jadval., Lemeri o'zining "Cours de Chymie" asarida "La Chymie est un art, qui enseigne a s é parer les differentes materials qui se rencontrent dans un mixte" (Corr. "Geschich.". II, 8) , va Chelik bunga "va tarkibiy qismlardan yana aralashmalar hosil qilish san'ati" qo'shdi (Corr, l. p.). Aralashmalarning tarkibiy qismlari tushunchasi o'zgardi; zamonaviy allaqachon Boyl tomonidan tasvirlangan, lekin odatda faqat Lavuazyedan keyin qabul qilingan (qarang: Lavuazye va Flogiston).]. Binobarin, vazifa barcha jismlarning tarkibini va ularning qanday shakllanganligi va qanday shakllanishi mumkinligini aniq bilishdan iborat.” D. I. Mendeleyev (“X. asoslari”, 6-nashr, 1895, 2) X.ni tabiiy deb belgilaydi. -toʻgʻridan-toʻgʻri predmeti “bir hil moddalar, ularning tarkibidan dunyoning barcha jismlari tashkil topgan, ularning oʻzgarishi va bunday oʻzgarishlar bilan birga boʻladigan hodisalarni oʻrganish” boʻlgan tarix fani.V.Ostvaldning fikricha, “Grundlinien der. anorg.Ch.”, 1900, 1), “bu oʻzgarishlarni mutlaqo alohida emas, balki ikkita katta guruhga boʻlish mumkin. Ba'zida transformatsiyalar o'rganilayotgan tananing faqat bir yoki bir nechta munosabatlari va xususiyatlariga taalluqlidir; ba'zan ular shunday bo'ladiki, o'rganilayotgan jism shunday yo'qoladi va uning o'rnida yangi xususiyatga ega bo'lgan yangi jismlar paydo bo'ladi. Birinchi turdagi hodisalar fizika sohasiga, ikkinchisi X. sohasiga kiradi va misol sifatida Ostvald oltingugurtning mexanik zarbalarga munosabatini ko'rib chiqadi (tananing nisbiy holati o'zgaradi, lekin rangi, vazni va hokazo, deb atalmish, oʻzgarmaydi. uning fizik xossalari), kuchsiz isitishga (harorat, solishtirma ogʻirlik va hajm oʻzgarishi, bugʻ bosimi, boshqa (?) xossalari oʻzgarishsiz qoladi), elektrifikatsiyaga va hodisalarni topadi. bunday turdagi jismoniy hisoblanishi kerak Lekin «agar biz olib kelsak (l. p., 2) oltingugurt bo'lagi olov bilan aloqa qilsa, u yonadi va ko'k olov bilan yonadi. Shu bilan birga, yonayotgan oltingugurtning taniqli hidi seziladi va yonish bir muncha vaqt davom etgandan so'ng, oltingugurt yo'qoladi: u yonib ketdi. Bu jarayon davomida oltingugurtning nafaqat individual xususiyatlari o'zgaradi, balki ... uning o'rniga boshqa narsa shakllangan; Biz buni hodisaning boshlanishi bilan bir vaqtda paydo bo'lgan, ammo ilgari sezilmagan hid bilan hukm qilishimiz mumkin. Bunda oltingugurt kimyoviy jarayonda ishtirok etgan... X. fanining oldiga ana shunday barcha oʻzgarishlarning qonuniyatlarini oʻrnatish vazifasi qoʻyilgan.” Boshqa darsliklarda fizikaviy oʻzgarishlar moddaning xossalari oʻzgarmagan holda qoladigan, uning asl holati tiklanganda; jarayon davomida Bundan tashqari, hech bo'lmaganda jismoniy jihatdan bir hil jismdan boshlasak, hech qanday mexanik usulda o'zgartiruvchi tizimning berilgan bir hil qismini heterojen qismlarga bo'lish mumkin emas; masalan. , muzning qizishi, uning erishi, qaynash paytida hosil bo'lgan suyuq suvning bug'ga aylanishi fizik jarayonlardir, chunki dastlabki harorat (va bosim) tiklanganda, muz unga xos bo'lgan barcha fizik xususiyatlar bilan bir xil miqdorda paydo bo'ladi. berilgan shartlar ostida. xususiyatlari; muzning erish haroratida biz bir vaqtning o'zida uchta holatda suv moddasiga ega bo'lishimiz mumkin - qattiq (muz), suyuq (suv) va gazsimon (bug ') va biz ularni mexanik ravishda ajratishimiz mumkin (masalan, muzni filtrlash mumkin). suyuq suv), lekin na muzni, na suvni, na bug'ni endi bizga ma'lum bo'lgan hech qanday mexanik vositalar bilan jismoniy jihatdan bir-biriga o'xshamaydigan moddalarga ajratib bo'lmaydi. Agar muz bug'lansa va hosil bo'lgan bug' 1500 ° - 2000 ° haroratgacha qizdirilsa, u holda mexanik jarayon bilan (diffuziya yordamida, Dissotsiatsiyaga qarang) haddan tashqari qizib ketgan bug'lar massasidan ulardan farqli gazni ajratib olish mumkin. xossalari (vodorodning kislorod bilan aralashmasi). Qayta sovutish orqali o'zgarmagan suvning o'zi muzga aylanadi va alohida yig'ilgan va tez sovutilgan gazsimon jism o'zining gazsimonligini saqlab qoladi; shuning uchun bu muzning kimyoviy o'zgarishiga misol bo'ladi. Darsliklarda ko'p narsalarni topish oson bo'lishiga qaramay shunga o'xshash misollar , va materiyaning fizik va kimyoviy o'zgarishlarga bo'linishi vaqt o'tishi bilan muqaddas bo'lganiga qaramay, bu, shubhasiz, keskin bir tomonlama va shuning uchun noto'g'ri. Ostvald noto'g'ri, chunki u o'z misolida mutlaqo beqiyos o'zgarishlarni taqqoslaydi. Oltingugurtning "pozitsiya energiyasi" o'zgarganda undagi xossalardagi o'zgarishlarni chetga surib qo'yish mumkin; nazariy jihatdan ular zarur, lekin, har holda, shunchalik ahamiyatsizki, ular nafaqat bizning his-tuyg'ularimiz yordamida, balki eng nozik zamonaviy asboblar yordamida murakkablashtirilgan hislar yordamida ham qiyin. Biz oltingugurtni zaif qizdirganimizda, biz quyidagi hodisalar bilan shug'ullanamiz. Ostvald oltingugurt deb ataydigan o'rganilayotgan tizimni ikkita mustaqil komponentdan iborat deb hisoblash kerak (bosqich qoidasiga qarang): oltingugurt va havo kislorodi [Azot va uning boshqa barcha gazsimon komponentlari transformatsiyada juda kam ishtirok etadi, bundan mustasno. namlik izlari - Aloqa hodisalariga qarang - va shuning uchun ularning mavjudligini e'tiborsiz qoldirish mumkin]; passiv qarshilik tufayli bu jismlar o'rtasidagi o'zaro ta'sir deyarli imkonsiz bo'lsa, yoki, agar u sodir bo'lsa, unda bunday arzimas tezlikda, nolga yaqin bo'lsa, biz uni butunlay ushlay olmaymiz. Shuning uchun biz butun tizimni Duhemning noto'g'ri muvozanat (soxta muvozanat) holatida, aks holda beqaror (qarang. A. Gorbov, "Fazalar qonuni", "Fizika-matematika yilnomasi" II), qodir deb hisoblashimiz mumkin. transformatsiyani yakunlash uchun muvozanat shartlarini o'zgartirish; oltingugurt, alohida ko'rib chiqiladi, ya'ni kislorod bilan cheksiz sekin reaktsiyasini e'tiborsiz qoldirib, biz bir muddatli monovariant tizim deb hisoblashimiz mumkin (ikkita tashqi muvozanat omili: harorat va bosim mavjud bo'lgan qattiq oltingugurt + bug ') va ma'lumki, Bunday tizim bo'ysunadigan qonunlar (qarang Faza qoidasi, l. p.) har qanday miqdordagi mustaqil atamalarga ega bo'lgan har qanday monovariant tizim bo'ysunadigan qonunlardan farq qilmaydi, CaO + CO 2 ni birlashtirish tizimi (yoki CaCO 3 ni ajratish), masalan. ; mexanik ma'noda, bug'lari bilan qattiq oltingugurt befarq barqaror tizimni hosil qiladi. Ammo oltingugurt + kislorodni taxminan 500 ° ga qizdiraylik; endi ularning o'zaro ta'siri kontakt yuzasi bo'ylab boshlanadi, yorug'lik va issiqlik paydo bo'lishi bilan birga keladi (tizim juda sovutilgan): oltingugurt, odatda, ular aytganidek, yonadi, lekin oltingugurt bug'lari bilan uchrashganda kislorod teng darajada yonadi; ikkala atama uchun ham o'zaro aloqada barqarorlik o'lchovi isitish orqali oshib ketadi va tizim beqaror bo'lib qoldi va oltingugurtning befarq barqaror holatini o'z + kislorodning beqaror holati bilan birlashtirish noqonuniy ekanligi aniq; va oltingugurt befarq barqaror holatda qolganda, biz yana bir bor takrorlaymiz, uning xususiyatlaridagi fizik o'zgarishlar CaO + CO 2 tizimidagi "kimyoviy" transformatsiya bilan bir xil qonunga bo'ysundi. Juda engil o'zgarish bilan, aytilgan narsa isitiladigan tizimga ham tegishli: muz, suyuq suv va uning bug'i. Muz va suyuq suvning o'zi qizdirilsa, tizimning ma'lum hajmi uchun (harorat va bosimning butun diapazonida) ikki fazaning birga yashashi mumkin: muz + bug ', muz + suyuq suv, suyuq suv + bug '; Bularning barchasi monovariant tizimlardir va shuning uchun bo'rning ajralishidan, hosil bo'lgan (ajraladigan) yod trixlorididan (qarang. Faza qoidasi, l.p.), ya'ni, odatda, ularning o'zgarishida sodir bo'ladigan narsa ularning o'zgarishi bilan bog'liq emas deb taxmin qilinadigan tizimlardan farq qilmaydi. fizik, ammo kimyoviy xususiyatga ega. Ammo biz maxsus texnika (diffuziya) yordamida suv bug'ini haddan tashqari qizdirdik [Shu tarzda tizimning muvozanat sharoitlariga yangi omil, ya'ni kapillyar taranglik kiritiladi va bu uning tabiatini o'zgartirishi mumkin. muvozanat (keyingi eslatmaga qarang).] biz bunday tizimning bir qismini ajratishga muvaffaq bo'ldik va biz taxmin qilamiz bug'ning qolgan, ajratilmagan massasi ajratilgan qismdan fizik xossalari bilan farq qilishini, oddiy bug'dan faqat boshqa, yuqori energiya tarkibi bilan farq qilishini; lekin, shubhasiz, bu faqat taxmin, garchi, ehtimol, eng oddiy va eng ehtimol; Haddan tashqari sovutilgan "portlovchi aralashma" ga kelsak, uni suv bilan taqqoslab bo'lmaydi, chunki bunday taqqoslash o'ta sovutilgan suvni bir xil haroratdagi muz bilan solishtirish kabi muvaffaqiyatsiz bo'ladi; bir tizim (juda sovutilgan suv) beqaror, passiv qarshilikka ega (Gibbsga ko'ra), ikkinchisi befarq barqaror, hech bo'lmaganda ikkita tashqi muvozanat omili mavjud bo'lganda: harorat va bosim [Biz Grove gaz batareyasini vodorod, kisloroddan quramiz. va suv, ya'ni biz unga bir nechta qo'shimcha muvozanat omillarini kiritamiz va u muvozanatga aylanadi va uning o'zgarishi oddiy haroratda ham qaytariladi.]. Oldingi taʼriflarni umumlashtirib, X.ning odatiy taʼriflari biroz tor, umumiyroq taʼrifi esa bu degan xulosaga kelamiz: X. materiya holatining oʻzgarishi qonuniyatlarini oʻrganuvchi aniq tabiiy-tarixiy fandir [Ot. shu bilan birga, bu masalaning birligi yoki murakkabligi masalasi umuman oldindan belgilanmagan.] ; u ularni "kimyoviy" birikmalar atrofida, ikkinchisi esa "elementlar" deb ataladigan maxsus, turg'un materiya navlari atrofida tasniflanadi ("kimyoviy birikma" va "element" iboralarining ma'nosi uchun quyida tarkibning doimiylik qonuniga qarang). Ushbu tadqiqotda materiya holatidagi qaytariladigan o'zgarishlarni fizik deb atash va ularni bizning sharoitimizda qaytarilmas va bir tomonlama davom etadigan "kimyoviy" o'zgarishlardan ajratish mumkin, ammo shuni yodda tutishimiz kerakki, yaqin vaqtgacha, va bu transformatsiyalar orasida ba'zilari, masalan, o'ta sovutilgan suyuqliklarning qattiq holatga o'tishi, o'ta to'yingan eritmalarning kristallanishi kabi jismoniy deb e'tirof etilgan [Agar bunday eritmalar mustaqil atamalar konsentratsiyasi nuqtai nazaridan qaralmasa, Ammo haroratning ularga ta'siri nuqtai nazaridan, muvozanatning tashqi omili sifatida ular ham o'ta sovutilgan tizimlar sifatida tan olinishi kerak.], garchi ular "kimyoviy" hodisalardan hech narsa bilan farq qilmaydi, masalan: suyuq vodorod peroksid, suyuq ozon, portlovchi aralashmaning portlashi (kislorod bilan vodorod, vodorod bilan xlor [Kuzatuvlar kislorod bilan vodorod aralashmasi ham yorug'lik ta'sirida ekanligini ko'rsatdi, transformatsiyani tezlashtiradi.]) va hokazo. Yuqoridagi nuqtai nazardan ko'rinib turibdiki, kimyoda ko'rsatilgan ma'lumotlar odatda bir tomonlama va parcha-parcha bo'lib, u odatda fizika kurslariga, kristallografiya kurslariga va hokazolarga kiritilgan ko'plab ma'lumotlar bilan to'ldirilishi kerak. va boshqalar, va ular yaqinda qo'llanmalar deb ataladigan qismga aylandi. fizik kimyo. Koʻzda tutilgan evolyutsiya nisbatan yaqinda boshlangan boʻlib, X. hajmini hatto yaqin kelajakda ham oldindan koʻra bilishning iloji yoʻq, lekin maʼlum darajada Maxning “zamonaviy davrda fizika va X. oʻrtasidagi koʻplab munosabatlari toʻgʻri keladi. kashf qilindi.X.ni amaliy fizika, xususan, amaliy mexanika deb hisoblash mumkinligi haqidagi eski fikr shundan yangi dalda oldi... Oldindan qarash boʻlmasa, kelajakdagi X. fizikani, va aksincha emas" ("Prinzipien der Wärmelehre", 1900, 5, 354); Moddaning holatidagi oʻzgarishlar, uning energiya taʼminotidagi oʻzgarishlarga qarab oʻrganiladigan barcha boʻlimlar fizikadan X ga oʻtkazilsa, ikkala fan ham bir jinslilikdan foyda olishiga shubha yoʻq.
Qonunlar va farazlar X. X.ning asosiy qonuniyatlarini umumiy sifat va umumiy miqdorga boʻlish mumkin. Sifat qonunlari.
I. Ularning orasiga oldingi planda joylashtirilishi kerak Gibbs faza qonuni; Bu allaqachon aytib o'tilgan (qarang: Bosqich qoidasi, l. p.) va bu erda biz o'zimizni eng ko'p ekanligini ko'rsatish bilan cheklashimiz mumkin. umumiy ifoda u erda:
v = n + e - r,
Qayerda v- tizim muvozanatining tashqi va ichki omillarining mustaqil o'zgarishlar soni yoki uning erkinlik darajalari soni; n- uning mustaqil shartlari soni (ichki muvozanat omillari) yoki kontsentratsiyasi mustaqil ravishda o'zgarishi mumkin bo'lgan jismlar soni; e- muvozanatning tashqi omillari soni (masalan: harorat, bosim, kapillyar taranglik, elektr qo'zg'alish kuchi, turli tortishish kuchlanishlari va boshqalar); r- fazalar soni, ya'ni materiyaning fizik jihatdan ajralib turadigan holatlari ajratilgan (r - 1) interfeyslar soni. Bu ibora Gibbsning o'zi maqolalaridan kelib chiqadi, lekin birinchi bo'lib Vald tomonidan ("Zeitschrift f. Ph. Ch." 18, 1895, 346) va shuning uchun so'z bilan (qarang. A. Gorbov, "Fazalar qonuni") yozilgan. ,” “Fiz. Mat. . Yillik.”, II), tizimga kiradigan har bir yangi jism va uning muvozanatining har bir yangi tashqi omili tizimning erkinlik darajasini bir marta oshiradi (mumkin bo'lgan fazalar soni, mumkin bo'lgan). haroratning, bosimning va boshqalarning mustaqil o'zgarishlari) va Har bir yangi faza yoki yangi hosil bo'lgan interfeys ushbu erkinlik darajasini 1 ga kamaytiradi. Fazalar qonuni materiya o'zgarishlarini o'rganishda baholanmagan yo'naltiruvchi ipdir.
II. O'zgartirish yo'nalishini belgilaydigan ikkinchi umumiy sifat qonuni Gibbs-Le Chatelier qonuni , unda aytilishicha, "muvozanatning har qanday omilidagi har bir o'zgarish tizimdagi o'zgarishlarni keltirib chiqaradi, bu esa ushbu omilda unga berilganga qarama-qarshi belgi o'zgarishiga olib keladi". Bu qonun avvalroq ham bayon qilingan (qarang Kimyoviy reaksiyalarning qaytarilishi).
Miqdor, vazn qonunlari.
I. Moddalar massasining saqlanish qonuni Lavoisier tomonidan apriori shaklda ifodalangan: "Biz aksioma sifatida qabul qilishimiz mumkin, - deydi u, - barcha o'zgarishlarda, ham sun'iy, ham tabiiy, hech narsa qayta yaratilmaydi: bir xil miqdordagi materiya tajribadan oldin va keyin mavjud [Debus (“U é ber einige Fundamentalsatze der Chemie va boshqalar”, 1894, 6) bu eʼtiqodning asoschisi Demokrit Abderalik deb hisoblaydi, u hech narsa faqat yoʻqdan kelib chiqmaydi va mavjud hech narsa hech narsaga aylanib boʻlmaydi, deb oʻrgatgan; Aristotel o'zining "Fizika" asarida keltirgan (I, 4)]. Ushbu printsipga har qanday kimyoviy eksperimentlar imkoniyati yotadi va shu tufayli biz doimo o'rganilayotgan jismlarning mohiyati va ulardan tahlil yo'li bilan ajratib olinadiganlar o'rtasidagi haqiqiy o'ziga xoslikni yoki tenglikni kutishga majbur bo'lamiz" (Lavoisier, “Oeuvres va boshqalar.” I , 101); Shubhasiz, bu pozitsiya Lavuazyedagi ko‘plab eksperimental kuzatishlar natijasi bo‘lgan (qarang: Phlogiston, Formulas and Kimyoviy nomenklatura). Er sharining ma'lum bir nuqtasi uchun har qanday jismlarning massalari ularning og'irliklariga qat'iy proportsional bo'lganligi sababli, Lavuazye qonuniga ko'ra aytishimiz mumkin: har qanday transformatsiya paytida o'zgaruvchan jismlarning og'irligi hosil bo'lgan jismlarning og'irligiga qat'iy teng bo'ladi. , va bu "kimyoviy" qonun materiyaning barcha harakatlari bo'ysunadigan boshqa, umumiyroq alohida holatni ifodalashini tushunish oson. Har safar ma'lum bir jismning massasi o'zgarganda (ko'payadi yoki kamayadi), keyin bir yoki bir nechta atrofdagi jismlarning massasi bir vaqtning o'zida kattaligi bo'yicha teng, lekin qarama-qarshi belgiga ega (kamayadi yoki ortadi) o'zgaradi.[Goutier va Charpi "Le ç ons de Chimie", 1900, 14] [Materiya massasining saqlanish qonuni fizikadagi energiyaning saqlanish qonuniga toʻliq parallel (qarang. V. Stevarta. P. G. Tait, "Koʻrinmas koinot". ", 1890).]. Stas kumush, yod va bromning to'xtatilgan miqdoridan kumush yodid va bromidni sintez qilganda, galogen birikmalarining og'irligi kumush va yod, kumush va bromdan bir oz kamroq bo'lib chiqdi, alohida tortilgan; bundan tashqari, L. Meyer ("Moderne Theorien d. Ch.", 1884, 135) bizning vaznli materiyamizning zarralari katta yoki kichikroq miqdordagi butunlay vaznsiz bo'lmagan yorug'lik efiri bilan bog'liq bo'lish ehtimolini ko'rsatdi, ularning miqdori, ehtimol, kimyoviy transformatsiyalar bilan o'zgarishlar; Shularni hisobga olib, birinchi Landolt va undan keyin Xaydveyler Lavuazye qonunini sinchkovlik bilan eksperimental sinovdan o'tkazdilar; ikkalasi ham muhrlangan shisha idishlarga o'ralgan turli tizimlar og'irligidagi o'zgarishlarni o'rgandilar. Landolt tizimning og'irligi: kumush sulfatning suvli eritmasi + sulfat kislota bilan kislotalangan temir sulfat eritmasi reaktsiyasi bilan kamayishini aniqladi:
Ag 2 SO 4 + 2FeSO 4 + H 2 SO 4 = 2Ag + Fe 2 (SO 4) 3 + H 2 O
0,130 mg da - 0,167 mg; bu pasayish tortish xatosidan 6 dan 12 baravar ko'pdir, lekin reaksiyaga kirishayotgan massalarga nisbatan nomutanosibdir, chunki u 171,3 g da = 0,130 mg va 114,2 g reaksiya tizimida 0,167 mg bo'lgan; yod kislotasi reaktsiyasida. sulfat kislota ishtirokida vodorod yodid bilan:
HJO 3 + 5H 2 SO 4 + 5KJ = 3J 2 + 5KHSO 4 + 3H 2 O
vaznning pasayishi ham kuzatildi, ammo farq (0,011 mg - 0,047 mg) eksperimental xato ichida edi; yod natriy oltingugurt tuzining suvli eritmasi bilan reaksiyaga kirishganda (o'zaro ta'sir ikki yo'nalishda borishi mumkin:
J 2 + 2Na 2 SO 3 = 2NaJ + Na 2 S 2 O 6
J 2 + Na 2 SO 3 + Η 2 L = 2HJ + Na 2 SO 4,
kaliy gidroksid bilan xloralgidrat
[CCl 3 .CH(OH) 2 + KOH = CCl 3 H + CHCO 2 + H 2 O]
va xloralgidrat suvda eritilganda, tajriba xatosi chegarasiga tushmaydigan og'irlikdagi o'zgarishlar kuzatilmadi. Heidweiler quyidagi o'zgarishlarni o'rgandi: misning temir bilan kislotali, asosli (?) va neytral yechimlar mis sulfat, mis sulfatni suvda eritish, kislotalangan mis sulfatni suvda va o'rta sulfatni sulfat kislotada eritish, mis sulfat eritmasidan mis oksidi gidratni kaliy gidroksid bilan cho'ktirish, ammiakning sirka kislotasi bilan o'zaro ta'siri va bariy xloridni cho'ktirish. kislota. Taxminan 200 g (160 - 280) ta'sir qiluvchi jismlarning umumiy soni va tortish xatosi 0,04 mg dan oshmagan holda, ikkita holatda u 0,014 va 0,019 og'irlikdagi o'sishni, qolgan 21 tasida esa og'irlikning pasayishini kuzatdi; 13 ta tajribada u mumkin bo'lgan xatolikdan kattaroq edi va bir marta 0,217 mg ga yetdi; pasayish, shubhasiz, misni kislotali va gidroksidi eritmada cho'ktirish paytida (lekin neytral eritmada emas), kislotalangan mis sulfatni suvda eritish paytida va mis oksidi gidratini cho'ktirish paytida aniqlandi [2 ta tajribada, ammo a juda ahamiyatsiz bo'lgan pasayish kuzatildi, ya'ni 0,037 va 0,032 mg]. Heidweiler vaznning o'zgarishi sababini aniqlay olmadi va bundan tashqari, vazn yo'qotish reaksiyaga kirishuvchi jismlarning massasiga mutanosib emas edi. Shunday qilib, ma'lum bo'lishicha, ma'lum transformatsiyalar paytida o'zgartirilgan moddaning massasi pasayganga o'xshaydi va bu pasayish tortish xatolaridan tashqarida joylashgan; Uni (Landolt) turli jismlarning teng massalariga nisbatan universal tortishishning turli kuchlanishi bilan izohlab bo‘lmaydi, chunki Besselning turli metallar va minerallardan yasalgan mayatniklar va Eötvös (E ötvö s) burilish balanslari bilan o‘tkazgan tajribalari shuni ko‘rsatdiki, farqni tushunish mumkin emas; boshqa tomondan, ko'rinib turganidek, chekinishlar reaksiyaga kirishayotgan massaga mutanosib emas va bu ba'zi tasodifiy xatolik ehtimolini keltirib chiqaradi; Lavuazye qonunini aniqlik doirasida ko'rib chiqishni davom ettirish mumkin ko'rinadi zamonaviy usullar kuzatishlar, to'liq aniq. Qanday bo'lmasin, yuqorida keltirilgan xatolarni oddiy tajribalarda hisobga olish mumkin emas [Temir bilan asosiy mis sulfat tizimi reaktsiyadan keyin 1 pud vazn yo'qotishi uchun, Heidweiler ma'lumotlariga ko'ra, shunday qilish kerak. eng qulay holatda 1 000 000 puddan bir oz ko'proq oling. aralashmalar. Yaqinda Heidweiler (Physikalische Zeitschiift, 1902) muhrlangan trubadagi radiyning og'irligi kuniga 0,02 mg ga kamayishini xabar qildi va buning natijasida potentsial energiyaning pasayishi diqqatga sazovordir. (= K×[(M Dt)/r 2 ]×r, Qayerda K tez., M yer massasi r- uning radiusi, Dt Yer tomonidan jalb qilingan jismning massasining o'zgarishi) = 0,02,600000000 mg sm = taxminan. 12.10 ergs, ya'ni Bekkerelning fikriga ko'ra, kuniga radiy tomonidan chiqarilgan energiya. Heidweilerning xabari dastlabki.]
II. Kimyoviy birikmalar tarkibining doimiylik qonuni bu shunday shakllantirilishi mumkin: Jismlar massasi, ularning ulanishi natijasida ma'lum bir jismoniy va ma'lum miqdorga ega bo'lgan yangi tanani hosil qiladi kimyoviy xossalari, bir-biriga va hosil bo'lgan tananing massasiga doimiy munosabatda bo'ladi, odatda kimyoning eng xarakterlisi hisoblanadi; hatto ba'zan faqat bir jinsli jismlarning tarkibi va o'zgarishini o'rganadigan fan sifatida ham ta'riflanadi, ya'ni tarkibining doimiyligi bilan tavsiflanadi, haqiqiy kimyoviy individlarni ifodalaydi va ma'lum kimyoviy birikmalar nomi bilan ataladi. mexanik aralashmalar va noaniq kimyoviy (?) birikmalardan farqli o'laroq (qarang: Tixvinskiy, "Zamonaviy kimyoning usuli va tizimi", Sankt-Peterburg, 1900, 3 va 6). Boshqa tomondan, bu qonun haqida sharhni topish mumkin (Gautier et Charpy, l. p., p. 14) "bu tavtologiyadan boshqa narsa emas. Aslida, "aniq" ning boshqa ta'rifiga ega bo'lishning iloji yo'q. birikma, bu qonun deb ataladigan narsadan tashqari. Jismoniy xususiyatlar ulanishni tavsiflash uchun etarli emas; Shunday qilib, biz ma'lum nisbatda (og'irlik bo'yicha) olingan suv va spirt aralashmasi uchun juda aniq xususiyatlarni kuzatamiz, garchi hech kim bu aralashmani birikma sifatida ko'rmaydi. Demak, bu erda haqiqiy qonun yo'q, lekin haqiqatning bayonoti, ammo juda ajoyib. Ya'ni, ko'pgina elementlar murakkab jismlarni faqat ma'lum nisbatlarda birlashtirib, murakkab jismni hosil qilishi mumkin, ular murakkab jismni olish usulidan qat'i nazar, o'zgarmasdir; elementlardan biri ortiqcha bo‘lsa, u holda birikma aktidan keyin ham shunday bo‘lib qoladi.” Vald yanada keskinroq aytadi (“Zeitsch. f. ph. Ch.”, 1897, 22, 256): “Qonuni kompozitsiyaning doimiyligi empirik qonun sifatida ko'rib chiqilishi kerak. Ammo bu ham mutlaqo to'g'ri emas. O'zingizdan so'rashingiz kerak, agar kimyoviy birikma deb hisoblangan ba'zi bir modda - va bu kamdan-kam hollarda bo'ladi - o'zgaruvchan sharoitlarda tarkibini o'zgartirsa, kimyogar nima qiladi? U qonunning to'g'riligiga shubha qiladimi? Shubhasiz; u faqat kimyoviy birikmalar ro‘yxatidan moddani kesib tashlaydi... Gap shundaki, moddani kimyoviy birikma deb tan oladigan boshqa belgilar yo‘q... Demak, tajriba shuni ko‘rsatdiki, ba’zi murakkab jismlar doimiy tarkibga ega. Bunday moddalarning barchasini va faqat ular faqat kimyoviy birikmalar deb hisoblanishi kerakligini tan olish o'zboshimchalikdir. Binobarin, kimyoviy birikmalar taʼrifi boʻyicha doimiy tarkibga ega boʻlib, taʼrifiga koʻra, bu shartni qoniqtirmaydigan jismlar kimyoviy birikmalar deb tan olinmaydi.” Yuqoridagilardan kelib chiqib, doimiylik qonunining qanday munosabatda ekanligini aniqlash qiziq tuyuladi. tarkibi haqida Lavuazye qonuni, uning kelib chiqish tarixi va biz hozirda mexanik aralashma, noaniq va aniq kimyoviy birikmalar deb hisoblashimiz kerak.Lavuazye qonuni reaksiyaga kirishuvchi jismlarning massasi hosil boʻlgan yangi jismning massasiga teng boʻlishini talab qiladi. Ulardan, lekin reaksiyaga kirishuvchi jismlarning miqdorini umuman oldindan belgilamaydi; ularning har qanday miqdori, agar ular noldan katta bo'lsa, ular uni qanoatlantiradi; Lavuazye qonuni jismlar son-sanoqsiz nisbatlarda reaksiyaga kirisha olmaydimi degan savolni oldindan belgilamaydi; Tarkibning doimiyligi qonuni reaksiya faqat reaksiyaga kirishayotgan massalarning ma'lum o'ziga xos nisbati bilan amalga oshirilishini aytadi, balki mumkin bo'lgan birikmalar soni bo'yicha ko'rsatmalar bermaydi. ular o'rgangan jismlarning tarkibi; tuzlar tarkibini aniqlashni quyidagilar amalga oshirganligini ko'rsatish kifoya: Bergman (1775-1784 yillar oralig'ida); Venzel (1777), Kirvan va Rixter (1790-1800); Lavuazye karbonat angidrid va suvning tarkibini aniqlab, tarkibni o'rganishga kirishdi organik birikmalar, u shu maqsadda yoqib yuborgan, hosil bo'lgan suv va karbonat angidridni to'plagan va ularning miqdoridan kelib chiqqan holda, yondirilgan moddadagi uglerod va vodorod miqdorini hisoblab chiqqan va hokazo; va agar u suv va karbonat angidridning tarkibi o'zgarishi mumkinligini tan olsa, bu mumkin emasligi aniq. Shunday qilib, murakkab jismlar tarkibining doimiyligiga bo'lgan ishonch uzoq vaqt davomida mavjud edi, aniqrog'i, hech kim boshqa narsaning mumkinligiga shubha qilmagan, ammo "qonun" ifoda etilmagan. Uning hal qiluvchi raqibi Bertolet ("Recherches sur les lois de l"afpnnt é", 1801 va 1802 va "Essai de statique chimique", 1803) edi. U tanalarni ba'zan har xil munosabatlarda, ba'zan ichki munosabatlarda birlashtirish mumkinligiga amin edi. ma'lum chegaralar; u bu cheklanishning sababini murakkab jismda tarkibiy qismlarni ushlab turadigan kuch reaksiyaga kirishuvchi jismlardan birining massasi ortishi bilan tushishi kerakligini ko'rdi (u to'yinganlik holatiga yaqinlashganda va boshqasining massasining nisbiy kamayishi), ikkinchidan, haroratning yopishqoqlikka va reaksiyaga kirishuvchi jismlarning tabiiy elastikligiga ta'sirida. ko'plab tarafdorlarni to'pladi, ayniqsa, o'sha paytda mavjud bo'lgan tahliliy ma'lumotlar ko'p jihatdan bunday qarashlarning to'g'riligini to'g'ridan-to'g'ri tasdig'i bo'lgan.Bertollet g'oyalariga muxolif Prust edi (tegishli maqolaga qarang) [Ushbu maqolada Prust g'oya bilan bog'liq. kimyoviy elementlarning bir asosiy moddadan, ya'ni vodoroddan kelib chiqishi haqida, ammo bu fikrni ingliz shifokori Prout (qarang) va Ves atomlari (qarang).]; bir qator ishlarda (1801-1808) u oksidlar, oltingugurt birikmalari va tuzlarning hosil bo'lishi, umuman olganda, ulardagi elementlarning massalari o'rtasidagi ma'lum va doimiy aloqalar bilan bog'liqligini ko'rsatdi, ammo bu faqat biz ko'rinadigan narsadir. mexanik va boshqa fizik va kimyoviy jihatdan farqlash heterojen aralashmalar kimyoviy birikmalardan. Ikkinchisi, ya'ni oksidlar tarkibining doimiylik qonunini 1801 yilda Proulx quyidagi so'zlar bilan ifodalagan (Korr, "Geschichte d. Ch.", II, 368): "Har doim o'zgarmas nisbatlar, bu doimiy atributlar xarakterlanadi. haqiqiy birikmalar, ham sun'iy, ham tabiiy, bir so'z bilan aytganda, Stahl tomonidan juda aniq ko'rinadigan bu pondus naturae; bularning barchasi, aytamanki, barcha birikmalar bo'ysunadigan tanlab olish qonunidan ko'ra kimyogarning kuchida emas. " "Aniq" birikmalar, Proulxga ko'ra, bir-biri bilan noaniq birikmalarda aralashtirilishi mumkin. munosabatlar, lekin bunday aralashtirish mahsuloti kimyoviy birikma emas, balki eritmadir. Bertolet (o'zining "Statik chimique" asarida) Proulxning qarashlari asossiz deb hisobladi va ular o'rtasida nizo kelib chiqdi va 1808 yilda, ko'pchilik zamondoshlari Proulxga moyil bo'lganda, ba'zi kimyoviy birikmalarni intensiv o'rganish boshlandi. Ayni paytda bu masalani yana bir bor ko'rib chiqish kerakligiga shubha yo'q. Zamonaviy nuqtai nazar haqida tasavvurga ega bo'lish uchun, keling, o'zaro aniq bog'lanish deb ataladigan narsa hosil qilmaydigan, lekin ma'lum sharoitlarda suyuq va bir hil jism hosil qilish qobiliyatiga ega bo'lgan ikkita jismning o'zaro ta'sirining eng oddiy holatiga to'xtalib o'tamiz. barcha yo'nalishdagi tizimlar. Ma'lumki (qarang. Faza qoidasi, qotishmalar, fraksiyalangan bug'lanish), tananing qo'shilishi IN tanaga A A, va tanani qo'shish A tanaga IN haroratning pasayishiga olib keladi. erituvchi tana IN, va shuning uchun, bu ikki jism tomonidan hosil bo'lgan barcha mumkin bo'lgan aralashmalarni harorat va kontsentratsiyalar diagrammasi bo'yicha qo'llaganda, biz erish nuqtasidan kelib chiqadigan evtektik nuqtada kesishgan ikkita egri chiziqni olamiz. A Va IN(rasmga qarang):
Diagrammani batafsil tekshirish quyidagilarni ko'rsatadi. Egri chiziqlar ustida SE Va ED bizda suyuq tizimlar hududi bor, odatda eritma deb ataladi IN V A (A ancha past eriydi B), lekin, aniqki, bu ham yechimdir A V IN. Nuqtadan boshlab gorizontal nuqta chiziq ustida D, har ikkala jism ham suyuqlik sifatida aralashadi (100% dan) A 100% gacha IN); bu chiziq va nuqtadan boshlanadigan gorizontal nuqta chiziq o'rtasida BILAN, tanasi A, bu sharoitda suyuqlik bir jinsliligini buzmagan holda eritmaga noma'lum miqdorda qo'shilishi va tana qo'shilishi mumkin. IN eruvchanlik egri chizig'i bilan cheklangan DE; Shu tufayli, yechim go'yo bir tomonlama. dan boshlanadigan gorizontal nuqta chiziq ostida BILAN, ikkalasi ham qattiq moddalar lekin bir-birini eritish qobiliyati cheklangan; yechim simmetrikdir. Nuqtali chiziq ostida ab har ikkala jism ham har qanday munosabatda bo'lishi mumkin, lekin ular bir-biriga ta'sir qilmaydi; ular haroratning yanada pasayishi bilan ham mutlaqo befarq va biz ularni bu sharoitda o'zaro ta'sirga keltira olmaymiz (tizim muvozanatining tashqi omillari harorat va bug 'bosimi deb hisoblanadi). A + B). Uchburchakda CaE qattiq holatda ortiqcha qattiq cho'kma A, u bilan to'yingan tana bilan aloqada va muvozanatda A, yechim; uchburchakda DbE tanasi qattiq holatda tushadi B, shuningdek, u bilan to'yingan eritma bilan aloqada va muvozanatda. To'rtburchakda nima yotadi AaBb odatda qo'ng'iroq qilamiz mexanik aralashma, garchi, aslida, bu yerda olingan jismlarning aralashuvi yo'q [Jismlarning aralashishini inkor etish bilan biz ularning bir-biriga nisbatan befarq munosabatini va ularning to'liq fazoviy izolyatsiyasini nazarda tutamiz. Shubhasiz, ba'zi bir evtektik metall konglomerati (q. Qotishmalar) mikroskop bilan oddiy ko'zga bir jinsli jism taassurotini beradi.]; ular xuddi alohida qurilmalarda bo'lgani kabi aralashtiriladi; shuning uchun bunday "mexanik" aralashmani B. Ruzboom (qarang Stereoizomerizm) bilan birgalikda konglomerat deb atash to'g'riroq; konglomeratning tarkibiy qismlarini bir-biridan turli usullar bilan va boshqa narsalar qatorida og'ir suyuqliklar yordamida ajratish mumkin (mineralogiyada cherkov va Tule usuli). Bunday konglomeratning tarkibi deyarli 100% dan farq qilishi mumkin. A 100% gacha B, lekin ma'lumki, har qanday aralashma uchun u bir qator harorat o'zgarishlarida doimiy bo'lib qoladi; va biz uni aniq birikma deb hisoblaymizmi yoki yo'qmi, tizimning turli nuqtalarida uning fizik heterojenligini isbotlashning ko'proq yoki kamroq osonligiga va evtektik nuqtaning bizga ko'proq yoki kamroq kirishiga bog'liq bo'ladi. E, yuqorida konglomeratning heterojenligi aniqroq namoyon bo'ladi (qattiq holatda ular tana bo'ladi. A yoki tana IN), agar uning konsentratsiyasi tasodifan evtektik nuqtaga to'g'ri kelmasa, qachon va undan yuqori bo'lsa, modda to'liq bir hil deb hisoblanadi, buning uchun evtektik harorat erish nuqtasi bo'ladi [Bunday konglomeratning evtektik haroratda bir hil suyuqlikka erishi isbotlangan. Gallokning (1888) tajribalari shuni ko'rsatdiki, tarkibida yog'och qotishmasiga mos keladigan kadmiy (1 qism), qalay (1 qism), qo'rg'oshin (2 qism) va vismut (4 qism) talaş konglomerati eriydi. suv hammomi (etarlicha uzoq isitish bilan), ya'ni 100 ° dan past bo'lsa, alohida metallar eriydi: Cd 320 °, Sn 32 °, Pb 320 ° va Bi 269,2 ° da; Shuningdek, u oddiy haroratda suyuqlik olish uchun kaliy (62,5° erish nuqtasi) va natriyni (erish nuqtasi 97,6°) yangi yuzalar bilan bir-biriga bosish kifoya ekanligini aniqladi. sur'at. va simobga o'xshash qotishma (eritma).]. Keyin jasadlar A Va IN, eritmaning qattiq shaklda tushishi ham o'zgarmas tarkibga ega bo'ladi, chunki ular parchalanmasdan (tarkibi o'zgarmagan holda) erishi mumkin deb taxmin qilinadi va qo'shimcha ravishda, bizda ularning o'zaro ta'siri bor, deb taxmin qilinadi. eritma, faqat ularning konsentratsiyasi birlik hajmiga o'zgaradi, lekin tarkibi emas [Aslida, bunday ideal holat aslida sodir bo'lmaydi: va tananing kristallari A, va tana kristallari IN tushadi, to'yingan eritma bilan namlanadi, uning tarkibi harorat bilan o'zgaradi va hatto kapillyarligi tufayli suyuqlikning qolgan qismidan tarkibida farq qilishi mumkin. Biroq, bunday yechimni olib tashlash nisbatan oson va bu matnda taqdim etilgan taqdimotning sababidir. "Zaif" suvli eritmalardan tushgan muz kristallari qattiq eritmalar emasligi Regnaultning bunday eritmalarning bug 'bosimi haqidagi ma'lumotlaridan va Ruedorffning pleoxroik tuzlarning zaif suvli eritmalari bo'yicha ba'zi kuzatishlaridan aniq.]. Nihoyat, agar uning tarkibi chiziqlar ustida joylashgan maydonga to'g'ri kelsa, eritma o'zgaruvchan konsentratsiyaga ega bo'ladi. SE Va E.D. va muvozanatning tashqi omillaridan biri, harorat (doimiy bosimda) yoki bosim (doimiy haroratda) ekan, tizim o'zgaradi; lekin chegaraviy egri chiziqlardan biriga mos keladigan yechim qanchalik tez bo'ladi G.E. yoki E.D. ya'ni ikkita mumkin bo'lgan monovariant tizimlardan biri va tizimning harorati yoki bosimining qiymati oldindan yoki yuqorida yotgan echimlar uchun imkon qadar tezroq beriladi. SE Va ED va devoriy tizimlarni ifodalovchi harorat va bosim qiymatlari o'zgarmasdir, shuning uchun bunday eritmalarning tarkibi to'liq o'zgarmas, aniqlangan bo'lib chiqadi va to'yingan eritmalarning tarkibi harorat va harorat bilan aniqlanishi uzoq vaqtdan beri ma'lum. ular bilan aloqada bo'lgan qattiq jismning tabiati va holati va ma'lum bir haroratda ma'lum bir bug 'bosimi, kerakli va mumkin bo'lgan solishtirma og'irlik, kerakli sinishi indeksiga ega bo'lgan ba'zi jismlarning to'yinmagan eritmasiga ega bo'lish uchun, va hokazo, bularning barchasi uchun reaksiyaga kirishuvchi jismlar qat'iy belgilangan "doimiy og'irlik nisbati" da olinishi kerak. Shunday qilib, biz barcha o'zgarmas (nonvariant) tizimlar ma'lum bir tarkibga ega degan xulosaga kelamiz [Matnda ikki tanali tizimga nisbatan qo'llaniladigan mulohazalarni har qanday murakkablikdagi tizimga osongina kengaytirish mumkin. Evtektik haroratdan pastda joylashgan konglomerat har doim ham sof jismlardan iborat bo'lmaydi A Va IN; oxirgi holat qachon sodir bo'ladi A Va IN ulanishlarni bering. Ammo yuqorida aytilganlarga amal qilgan holda va tegishli diagrammani bilib, bunday holatlarni tushunish qiyin emas; masalan, V. Ruzboom tomonidan berilgan Fe 2 Cl 4 ning eruvchanlik diagrammasiga qarang. Fraksiyalangan bug'lanish.]; Shuning uchun uning doimiyligi "aniq, kimyoviy" birikmalar imtiyozini anglatmaydi va shuning uchun zudlik bilan "ayrim, kimyoviy" birikmalarni topish kerak, ularning tavsifi hozirgacha X.ning deyarli butun tarkibini tashkil qiladi, ularni xarakterlash imkonini beradigan kompozitsiyaning doimiyligidan boshqa biron bir belgi. Bu belgini belgilagan Vald tomonidan berilgan monovariant tizimda o'zgarmas tarkibning fazasi sifatida doimiy kimyoviy birikma. Yuqorida muhokama qilingan holatda, bu fazalar qattiq moddalardir A Va IN ularning to'yingan eritmalari bilan aloqa qilishda: ikkinchisining haroratining oshishi bilan, ularning bosimining o'zgarishi bilan, eritmaning tarkibi doimiy ravishda o'zgaradi va qattiq faza, garchi u doimiy ravishda miqdori o'zgarib turadi [Butun tizimning massasi doimiy qabul qilinadi.], lekin o‘zgarmagan tarkibini, individualligini saqlab qoladi. Hech shubha yo'qki, Vald tomonidan ko'rsatilgan belgi kimyogarlarga uzoq vaqtdan beri ma'lum bo'lgan va ular doimo "doimiy, kimyoviy" birikmalarni kashf qilishda foydalanganlar, ammo Valddan oldin u hech kim tomonidan aniq shakllantirilmagan va "ta'rifi" Shuning uchun darsliklardagi kimyoviy” birikmalar to'liq bo'lmagan. Tajribada moddaning "bir hilligini" o'rnatish uchun uni har doim turli "erituvchilar" dan va har xil haroratlarda kristallash, ya'ni uni jism rolini o'ynashga majbur qilish kerak edi. IN bizning misolimiz; zarbani aniqlash kerak edi. uning bug'ining og'irligi va bug'ning tarkibini suyuqlik (qattiq) jismning tarkibi bilan solishtiring va hokazo. Nima tushuntiradi, yoki to'g'rirog'i, jismlar nima qiladi? A Va IN harorat va bosimning bir qator o'zgarishlari ostida o'z tarkibini o'zgarmagan holda saqlaydi? Gap shundaki, agar jismlar A Va IN ular ekzotermik bo'lib, biz ularni dissotsilanish reaktsiyalari boshlanishi mumkin bo'lgan haroratdan past haroratlarda o'rgansak, ular tarkibini saqlab qoladilar. A yoqilgan A 1 Va A 2, V yoqilgan b 1 Va b 2 ; agar A Va IN eksperimental sharoitda birikmalar endotermik bo'ladi, keyin biz ularni ma'lum bir chegara haroratidan yuqori o'zaro aloqaga keltirganimizdan keyin ular o'zlarining individualligini saqlab qoladilar, undan pastda ular qiyinchilik bilan mavjud bo'lishi mumkin, tarkibiy qismlariga parchalanishga tayyor [Bunday sharoitlarda, barcha "Endotermik" birikmalar odatda topiladi, ularning ba'zilari yuqorida sanab o'tilgan. Eslatib o'tamiz, vodorod periks, "endotermik birikma" portlovchi gaz alangasida hosil bo'ladi, Si 2 Cl 6 (Troost va Hautefeuille) SiCl 4 va Si dan 1300 ° dan yuqori hosil bo'ladi:
bu harorat ostida parchalana boshlaydi va allaqachon 800 ° da butunlay ajraladi. Ammo 1300° ga qizdirilgan gaz to'satdan sovutilsa, natijada suyuqlik, qaynab ketadi. 140 ° da va faqat 350 ° S atrofida parchalana boshlaydi; Pastda u passiv qarshiliklar tufayli saqlanib qolgan. Chorshanba. Fosfor - Tammanning o'ta sovutilgan (endotermik) tizimlarning o'zgarishi shartlari bo'yicha tadqiqotlari haqida.] Keyin biz ularni parchalanish reaktsiyalariga xos bo'lgan dissotsiatsiya bosimidan kattaroq bosimlarda o'zaro ta'sirga keltirganimizda, ular o'zlarining individualligini saqlab qoladilar; yoki, nihoyat, endotermik tizimlar bilan, biz ularni shunday super sovutish darajasida o'rgansak, ularda sodir bo'ladigan transformatsiya (agar bu sodir bo'lsa) biz uchun deyarli sezilmaydi. Binobarin, kompozitsiyaning doimiyligi tanlangan eksperimental sharoit bilan belgilanadi. Lekin nima uchun birikmalar barcha mumkin bo'lgan nisbatlarda emas, balki ularning ko'p qismi (qarang. Uglevodorodlar) juda cheklangan miqdorda hosil bo'ladi? Uold bunga qattiq jismlarning cheklangan o‘zaro eruvchanligini ko‘rsatib javob beradi [Buni tushunish uchun kaltsiy xlorid gidratlarining (qarang. Faza qoidasi l.c.) yoki temir xloridning (q. Fraksiyalangan bug‘lanish l.c.) eruvchanlik egri chiziqlarini o‘rganish kifoya. Qattiq holatda olingan galogen tuzlaridagi suvning eruvchanligi juda cheklangan miqdordagi nisbatlarga toʻgʻri kelishi aniq.] va hatto koʻp nisbatlar qonuni (pastga qarang) bu holatdan (pastga qarang) (l.s.) chiqaradi. Shubhasizki, bundan tashqari, cheklangan miqdordagi birikmalar ham jismlarning kimyoviy tabiati bilan bog'liq bo'lib, bu, masalan, kislorod bilan vodorodni bizning sharoitimizda yagona barqaror (ekzotermik) birikmaga aylantiradi. Bu faqat suvdir, qolgan tizimlar (H 2 O 2, H 2 O 4 ?), bizning harorat va bosimimizda ko'proq kislorodni o'z ichiga oladi, ular ozgina barqarordir (o'ta sovutilgan) va ularni saqlab qolish qiyin. qisqa vaqt. Keyin, hozirgina keltirilgan misollardan ko'rinib turibdiki, bu cheklash biz turli jismlarning o'zaro ta'sirini o'rganadigan tasodifiy cheklangan ("oddiy") sharoitlar tufayli aniq bo'ladi. Ammo agar cheklangan eruvchanlik holatlari kuzatilsa, unda teskari hodisani ham kutish kerak, ya'ni qattiq holatda jismlarning barcha mumkin bo'lgan jihatlari bo'yicha to'liq aralashishi holatlarini kutish kerak, aks holda odatiy holga ega bo'lgan bunday tizimlarning shakllanishini kutish kerak. "kimyoviy" birikmalarning xususiyatlari, ulardan tarkibining to'liq noaniqligi bilan farq qiladi. Bu bilan bog'liq hodisalarning ba'zilari odatda izomorf aralashmalar sifatida tavsiflanadi (tegishli maqolaga qarang), ba'zilari esa qattiq eritmalar nomi bilan tavsiflanadi (van "t Hoff, Mallard, Klein, Runne, Buxhoevden u. Tammann). jismlarning o'zaro ta'siridan yuqori A Va IN Fazalar qonuni nuqtai nazaridan biz bu jismlar elementlarni ifodalaydimi yoki ular "kimyoviy" murakkabmi degan savolni hal qilmadik. Gap shundaki, qonun elementlar va ularning birikmalari o'rtasida hech qanday farq qilmaydi va u kaltsiy xlorid gidratlarining suvda erishi hodisalariga ham (faza qoidasiga qarang) va ikkita elementning, xlor va yodning o'zaro ta'siriga teng darajada qo'llaniladi. (l. bilan.). Elementlar va murakkab jismlar o'rtasidagi shu paytgacha ma'lum bo'lgan yagona farq shundaki, ular teginish orqali ulardan farq qiladigan materiya shakllariga ajralmagan va shuning uchun biz hali ham Lavuazye ta'rifiga amal qilamiz (Kimyoviy nomenklaturaga qarang); Yagona farq shundaki, Dyulong va Petit qonuni (q. Issiqlik) va D.I.Mendeleyevning davriy qonuni (qarang Kimyoviy elementlarning davriy qonuni) ni hisobga olgan holda, biz yuqori ehtimollik bilan barcha zamonaviy elementlar, agar murakkab bo'lsa, deb aytishimiz mumkin. , ularning murakkabligi bir xil tartibda ["Biz har kuni materiyani har tomonlama o'zgartiramiz. Lekin shu bilan birga, biz bunday o'zgarishlar to'xtaydigan chegaralarni aniq belgilab oldik: ular hech qachon ... kimyoviy elementlardan uzoqroqqa o'tmagan. Bu chegara bizga hech qanday falsafiy nazariya tomonidan ko'rsatilmagan, bu haqiqiy to'siq bo'lib, biz tajribalar o'tkazish usullari bilan yengib chiqa olmagan edik... Biroq, bu biz aqliy jihatdan bu erda ko'rishimizni anglatadimi? Yo'q, shubhasiz, kimyogarlar bu chegaraga har doim inkor etib bo'lmaydigan haqiqat sifatida qarashgan, lekin har doim uni kesib o'tish umidida." M. Berthelot, "Les origines de l"Alchimie" (1885).] So'nggi paytlarda ko'pchilik bizning elementlarimizni soddalashtirishga erishilganiga ishonch bildirishgan; masalan, J. J. Tomson faqat bu taxminning o'zi kuzatilgan hodisalar bo'lishi mumkin deb hisoblaydi. siyrak gazlarda katod nurlarining o'tishi jarayonida quyidagicha izohlanadi: “Katod nurlari manfiy zaryad olib yurganligi uchun; elektrostatik kuchlar ta'sirida ular manfiy zaryadlangandek og'ishadi; magnit kuchning ta'siri xuddi shu nurlar yo'li bo'ylab harakatlanadigan manfiy zaryadlangan jismga xuddi shu kuch ta'sir qilgandek bo'lsa, men ular salbiyni ifodalaydi degan xulosadan qochishning hech qanday yo'lini ko'rmayapman. elektr zaryadlari materiya zarralari tomonidan olib o'tiladi. Savol shundaki, bu zarralar nima? Ular katta ajralish holatidagi atomlar, molekulalar yoki moddalarni ifodalaydimi? Bu holatga biroz oydinlik kiritish uchun men ushbu zarrachalar massasining ular olib yurgan zaryadga nisbatini bir qator o'lchovlar qildim; natijada ma'lum bo'ldiki, m/e (m- vazn, e- zaryad) gazning tabiatiga bog'liq emas va shu paytgacha ma'lum bo'lgan eng kichik o'xshash qiymatga nisbatan juda kichik (= 10 -7), ya'ni suvli kislota eritmalarini elektroliz qilish paytida vodorod ioniga to'g'ri keladigan 10 -4 , shuning uchun Tomson shunday xulosaga keldi: katod sharoitida "biz materiyaning yangi holati bilan shug'ullanamiz, uning bo'linishi gaz holatiga qaraganda ancha ilgarilab ketgan; moddaning har xil turlari, ya'ni. vodorod, kislorod va boshqalardan kelib chiqqanlar bir xil bo'ladi" va hokazo. Bu sohada ko'plab ishlarga qaramay, tajriba qiyinchiliklari tufayli savol nisbatan kam oldinga siljidi; Shuning uchun bu yerda faqat uning tavsifini keltirish va, darvoqe, Ostvaldning sharhini keltirish o‘rinlidir, unga ko‘ra “elektrolizning asosiy qonuni Faraday qonuni gazlarda tok o‘tkazuvchi moddalar yoki jismlarga mutlaqo tatbiq etilmaydi. Gazlarning o'tkazuvchanligi bo'yicha tadqiqotlar shunday shaklda ifodalanganki, ular vodorod molekulasidan bir necha yuz marta kichikroq (200 marta) moddiy zarralar mavjudligini isbotladilar, ammo bunday xulosaning faraziy tabiati aniq va butunlay boshqa qonunlarga amal qiladigan bu hodisalar uchun ionlarni nomlash noo'rin" (1901). Mavzuning keyingi eksperimental aniqlanishini kutishimiz kerak.
III. Ekvivalentlar qonuni (Qarang: Unitar tizim). Bergman allaqachon ikkita neytral tuzning eritmalarini aralashtirishda eritmaning neytralligi buzilmasligini payqagan, ammo u bu holatga etarlicha e'tibor bermagan. Ushbu hodisani birinchi bo'lib chuqur o'rganishni boshlagan Venzel (1740-43) bo'lib, u o'zining "Vorlesungen über die chemische Verwandtschaft der Körper" (1777) essesi bilan stexiometriyaga asos solgan. Bergmanning kuzatishlarining to'g'riligini tasdiqlab, Venzel ularga tushuntirish berdi, bu har xil miqdordagi turli ishqorlar va erlar, har qanday kislotaning bir xil miqdorini neytrallash, boshqa har qanday kislotalarning teng miqdorini neytrallashi kerakligidan iborat edi; Boshqacha qilib aytganda, ma'lum miqdordagi kislotani neytrallashtirgan ikkita er massalari orasidagi nisbat ular boshqa barcha kislotalarni zararsizlantirganda doimiy bo'lib qoladi va bu tahlillarni tekshirish va hatto hosil bo'lishi uchun zarur bo'lgan har qanday asos miqdorini hisoblash imkonini berdi. ma'lum bir kislota bilan o'rtacha tuz, agar bu maqsad uchun zarur bo'lgan faqat bitta asosning miqdori ma'lum bo'lsa; Venzelning o'zi esa bu holatga alohida ahamiyat bermadi va uning ishi o'sha vaqt uchun juda aniq bo'lsa ham, zamondoshlari tomonidan qadrlanmagan. Venzelning eng yaqin izdoshi Rixter bundan xursand emas edi. Rixter (1789-1802) kislotalarning asoslar bilan birikishida neytral tuzlar hosil qiladigan nisbiy og‘irlik miqdorlarini ketma-ket joylashtirishdan boshladi. U sulfat kislotaning 1000 qismini neytrallash uchun zarur bo'lgan asoslar miqdorini neytral asoslar qatori deb atadi; xuddi shu tarzda u turli xil asoslarning berilgan miqdorini neytrallash uchun zarur bo'lgan turli kislotalarning neytral qatorini aniqladi. Raqamlarining nisbatan past aniqligiga qaramay, Rixter asoslarning neytral qatorlari soni bir-biriga proportsional ekanligini va neytral kislotalar qatori uchun ham xuddi shunday ekanligini payqadi. Ushbu ishlar bilan bog'liq holda, Rixterning yana bir "kashfiyoti" mavjud, ya'ni u neytral tuzlardan metallar bir-birini siqib chiqaradigan miqdorlarni (qarang Ko'chirish) keng ko'lamli kuzatishlar, ya'ni ular bilan birikadigan miqdorlarni aniqlash. doimiy kislorod miqdori va metallar bitta kislota tuzlaridan siqib chiqarilganda va ular oksidlar shaklida doimiy miqdorda kislota angidrid bilan birikadigan miqdorlar [Buni aniq qilish uchun etarli. mis sulfatni sulfat angidrid bilan birikma mis oksidi holida tasavvur qilish va misning temir bilan siljishi tenglamasini yozing:
CuO.SO 3 + Fe = FeO.SO 3 + Cu;
u ko'rsatadi: 16 wt dan. birliklar kislorod birikmasi 63 wt. birliklar mis va 56 wt. birliklar temir (Cu = 63 va Fe = 56 dumaloq raqamlarda), va bu (63 + 16) wt. birliklar mis oksidi va (56 + 16) og'irligi. birliklar temir oksidi 80 wt bilan birlashtiriladi. birliklar sulfat angidrid (S = 32 dumaloq raqamlarda)]. Ilgari Bergman metallarning o'zaro siljishini o'rganib chiqdi va o'z kuzatuvlarini "Metallisda div e rsa phlogisti quantitate" maqolasida e'lon qildi. U kumushni nitrat tuzidan siqib chiqarish uchun aniq va doimiy miqdorda boshqa metallar kerakligini aniqladi; keyin metallarning boshqa tuzlardan oʻzaro siljishini oʻrgandi; Cho'kma metallar miqdorida katta farqlar kuzatildi, ammo ular doimiy qonunlarga bo'ysundi. Flogiston nazariyasi tarafdori sifatida Bergman o'z raqamlariga quyidagicha qaradi: har bir metall eritilganda "ohak" ga aylanadi, ya'ni o'z ichiga olgan flogistonni yo'qotadi (qarang); va boshqa metall bilan cho'kganda, u metall holatda cho'kma bo'lganligi sababli, hech qanday shubha yo'qki, u qayta tiklanadi, unga zarur bo'lgan flogiston miqdori bilan uni cho'ktiruvchi metall hisobiga qayta birlashadi va Bergman o'zining tajribalar natijasida turli metallar 1) har xil miqdordagi flogiston bilan bogʻlangan degan xulosaga keldi va 2) u olingan raqamlar teng miqdorda flogistonni oʻz ichiga olgan metallar miqdorini beradi. 20 dekabr 1783 yilda Lavuazye akademiyaga "Sur la precipitation des materials mé talliques les unes par les autres" ("Oeuvres va boshqalar", II, 528) memuarini taqdim etdi, u erda Bergmanning natijalariga ishora qilib, "uning fikricha, metallarda flogistonning yoʻqligi yoki boʻlishi taxmindan boshqa narsa emas. Haqiqatda esa uni qoʻldagi tarozi va oʻlchovlar bilan aniqlash mumkinki, metallni har qanday kalsinlashda, u quruq yoki hoʻl boʻladimi, havo yordamida suv yoki kislotalar, unga kislorod (princip e oxygè ne) qo'shilishi natijasida metall og'irligining ortishi kuzatiladi ... va shuning uchun agar 31 funt mis 100 funt cho'kma uchun etarli bo'lsa. kumush metall holatida [Haqiqiy ko'rsatkich 29,46 og'irlik birligini tashkil etadi. 100 og'irlik birlik kumushga mis; Bergmanning bu holatda tajribalari taxminan 4% ga xato edi.], ya'ni bu mis miqdori hamma bilan to'liq birlasha oladi. 100 funt kumush tarkibidagi kislorod... ohak holatida "; Bundan tashqari, Lavoisier hozirgina aytgan to'g'ri fikrni hisobga olmaydi va o'z hisob-kitoblarini Bergmanning noto'g'ri ma'lumotlariga asoslanib, butunlay noto'g'ri xulosalarga keladi. Bir necha yil o'tgach, Rixterning ishi aniqroq ma'lumotlar va Lavoisierning xotiralaridagi qarama-qarshiliklardan xoli tushuntirish bilan paydo bo'ladi. Rixter, tasodifan, simob va temir kislorod bilan bir nechta aniq birikmalar hosil qilishini aniqlaydi, lekin u o'z ishining natijalarini juda murakkab tilda taqdim etadi, bundan tashqari, ular Rixter o'zi ochgan deb o'ylagan bir qator xayoliy qonunlar bilan bog'liq ko'plab hisob-kitoblarni o'z ichiga oladi. Bu ishlarning deyarli barchasi e'tiborga olinmaydi va kislorod miqdorining tengligi keyinchalik Gey-Lyusak tomonidan (1808 yilda) va uning bahsi davomida Proulx tomonidan temir va simob oksidlarining turli xil doimiy kompozitsiyalari mavjudligi aniqlangan (tegishli sharhga qarang). maqola) Bertolet bilan. 1782 yilda Fisher Rixterning ishiga e'tibor qaratdi va uning neytral qatorlarning barcha jadvallarini ikkita qatordan iborat bittaga birlashtirish mumkinligini aniqladi: birida raqamlar bilan ifodalangan asoslar miqdori, ikkinchisi esa hosil bo'lishi uchun zarur bo'lgan kislotalar miqdorini o'z ichiga oladi. ko'rsatilgan asoslar soni bilan neytral tuzlar. Shunday qilib, bu raqamlar asoslar va kislotalar o'rtasidagi neytrallik munosabatlarini ifodaladi va ularni o'z ichiga olgan jadval kompozitsiyani aniq va qulay shaklda jamladi. katta miqdor Neytral tuzlar." Fisher tufayli Rixter ishining natijalari hammaga ma'lum bo'ldi, lekin baribir ularning ta'siri juda ahamiyatsiz edi va u topgan narsa keyinchalik qayta kashf qilindi. Shu bilan birga, Venzel va Rixter, agar ikkita jism uchdan bir qismi bilan birlashsa, haqiqatni aniqladilar. biroz hurmat A:B, keyin, bir xil nisbatda, ular murakkab jismlarning butun qatorida bir-birini almashtirishi mumkin va ma'lum bir holatda ular, natijada, bir xil nisbatda yoki uning ko'paytmasida (pastga qarang) bir-biri bilan bog'lanishi mumkin. Ushbu xarakterli raqamlarni Wollaston chaqirgan - ekvivalentlar; zamonaviyda darsliklar ekvivalentlarni (proporsional) deb belgilaydi. elementlar qanday og'irlikdagi miqdorlarda bir og'irlikda birlashtirilganligini ko'rsatadigan raqamlar. birliklar vodorod yoki uni almashtiring.
IV. Ko'paytmalar qonuni Daltonga tegishli; uning kelib chiqish tarixini endi aniqlik bilan qayta tiklash mumkin emas; Odatda, u quyidagicha shakllantiriladi: agar ikkita A va B jismlar bir necha nisbatda bog'langan bo'lsa, u holda A tanasining bir xil massasiga to'g'ri keladigan B tanasining massalari bir-biriga oddiy ko'p nisbatda va bir vaqtning o'zida B tanasining ekvivalenti bilan oddiy va ko'p nisbatda bo'ladi. ; umumiyroq formula Duhemga tegishli (Duhem, "Le mixte et la combinaison chimique", 1902, 73): C 1 , C 2 , C 3 ... turli elementlar bo'ladi; Ularning har biri uchun biz proportsional son ("atom" og'irlik) deb ataladigan bir qator xarakteristikani tanlashimiz mumkin va quyidagicha proportsional sonlar jadvalini ("atom" og'irliklari) olamiz: p 1, p 2, p 3 ... Agar tanalar C 1 , C 2 , C 3 ... bir-biri bilan bog'lang, keyin birlashtiruvchi jismlarning massalari munosabatda bo'ladi: lr l, mr m, nr n ... Qayerda λ, μ, ν butun sonlar... Dalton va uning zamondoshlari “butun sonlar” iborasi bilan kifoyalanmay, “butun sonlar” degan bo‘lardi. tub sonlar"; lekin kimyo paydo bo'lganida to'g'ri bo'lgan bu cheklov rivojlanib borgani sari kamroq va kamroq haqiqat bo'lib qoladi; xususan, organik kimyoning muvaffaqiyatlari ko'p hollarda butun sonlarni belgilashga majbur bo'ladi. λ, μ, ν... katta qiymatlar; dastlab ularga xos bo'lgan soddalik xarakteri shu tufayli yo'qoldi; Masalan, uni kerosin formulasida qanday topish mumkin, bu erda birlashgan uglerod va vodorodning massalari quyidagicha bog'liq. λ marta uglerodning proportsional ("atom") og'irligi va μ marta vodorodning proportsional og'irligi va qayerda λ Va μ ma'nolarga ega: λ = 27, μ = 56?" Haqiqatan ham, qonunning oddiy formulasi nafaqat parafinlarga tegishli emas (qarang), bu erda vodorod va uglerodning "mutanosib og'irliklari" formulalarida topilgan ko'rsatkichlar o'rtasidagi bog'liqlik kasr sifatida ifodalanadi. 2 + 2/n, balki umuman hamma uchun ham cheksiz seriyalar uglevodorodlar, asetilen qatoridan boshlab, chunki u doimiy ravishda quyidagilarga teng: 2 - 2/n, 2 - 4/n, 2 - 6/n va boshqalar, qayerda n- butun sonlar. Ammo shuni ta'kidlash kerakki, bunday taqqoslashda biz "qonun" ni u olingan misollarga mos kelmaydigan holatlarga nisbatan qo'llaymiz va uning kuzatish bilan kelishmovchiligi ajablanarli emas. Dalton tomonidan "qonun" botqoq gazini etilen bilan solishtirish va azot oksidlarini o'rganishda o'rnatildi va turli xil ketma-ketlikdagi va turli oksidlanish darajalaridagi birikmalar taqqoslanganligini ko'rish uchun ushbu birikmalarning zamonaviy formulalariga e'tibor qaratish kifoya. bir so'z bilan aytganda - har xil ekstremal, lekin doimiy ravishda ular tarkibidagi elementlardan birining massasi; va bu cheklov bilan "qonun" hali ham amal qiladi, buni hatto uglevodorodlar formulalarida ham ko'rish mumkin, bir-biri bilan taqqoslaganda, qatorlar: C 2 H 2, C 3 H 2, C 4 H 2 ... , CH 4, C 2 H 4, C 3 H 4 ..., C 2 H 6, C 3 H 6, C 4 H 6 ... va boshqalar; Ushbu taqqoslash orqali biz nisbatan oddiy butun sonlarni va qoidani topamiz "tana massalari IN, doimiy tana vazniga A, bir-biri bilan bir necha nisbatda bo'ladi", butun sonlar nisbati sifatida ifodalanadi; xuddi shu misollar Daltonning diqqatini o'ziga jalb qilgan va "kimyoviy" birikmalarning sakrashda paydo bo'lgan vaziyatni ham ko'rsatishi mumkin; haqiqatan ham H. 2 ning uglerod massasi 24, 36, 48 ga teng, H 4 da 12, 24, 36..., H 6 da 24, 36, 48 va boshqalar bor, yaʼni juda oz sonli sonlar takrorlanadi va u yerda. Bu uzluksizlik emas.Buni tushuntirish uchun Dalton o'zining "atom" gipotezasini taklif qildi [Qarang: "Alembic Club Reprints", No. 2, 1893, "Foundations of Atomic Theory" J. Dalton a. Vollaston (1802-1808) va Ostvald" s "Klassiker va boshqalar", № 3,1889: "Die Grundtagen der Atomthéorie" von J. Dalton u. V.H.Vollaston (1803—08). Chorshanba. qo'shimcha ravishda Art. Debus"a (l.c.) Dahem"a (l.c.) va A. Hannequin, "Essai tənqidi sur l"gipothese des atomes dans la Science Contemporaine" (P. 1899)]. Moddaning atom tuzilishi haqidagi tushuncha, shubhasiz, juda katta ahamiyatga ega. Qadimgi kelib chiqishi (qarang: Substansiya); Aftidan, Dalton shunday (Rosko a. Harden, “A New View of the Origin of Daltons Atomic Theory”, 1896; masalan, “Zeit. f. Ch.”, 1896) ostida ishlab chiqilgan. yorug'likning chiqishi haqidagi nazariyasini yaratish uchun atomlarga muhtoj bo'lgan Nyutonning ta'siri. Nyuton o'zining optikasini tugatuvchi masalalarda o'z nuqtai nazarini rivojlantirdi; Shunday qilib, XXXI savolida Nyuton shunday deb so'raydi: "Jismlarning eng kichik zarralari ma'lum xususiyatlarga, qobiliyatlarga yoki kuchlarga ega emaslarmi, ular nafaqat yorug'lik nurlarini aks ettirish, sindirish va chalg'itish uchun, balki ularni masofadan turib ta'sir qilish imkonini beradi. bir-biriga va shu yo'l bilan ko'pchilik tabiat hodisalariga sabab bo'ladi"? Ikki jism bir-biriga bog'langanda, Nyuton bu bog'lanishni ikkala jismning eng kichik zarralarini qisqa masofalarga o'zaro tortishish natijasi deb hisoblaydi. "Kaliy tarqalganda, uning zarralari va ularning ustida bug 'shaklida suzuvchi suv zarralari o'rtasidagi o'zaro tortishish tufayli emasmi? Va shuning uchun oddiy tuz, selitra, vitriol kaliyga qaraganda kamroq noaniq, chunki ular suv zarralariga nisbatan kamroq tortishish bor"? Dalton uchun atom qarashlarini qabul qilishning bevosita sababi, aftidan, azot oksidi havodagi kislorod bilan yoki 36 vol nisbatda to'liq reaksiyaga kirishishi mumkinligi haqidagi kuzatuv (xato, biz hozir bilamiz). YO'Q 100 aylanish tezligida havo, yoki 72 volga nisbatan. YO'Q bir xil 100 aylanish tezligida. havo va birinchi holda, azot kislotasi, ikkinchisida, nitrat kislota hosil bo'ladi; "Bu faktlar, - deydi u, - jarayonning nazariyasini aniq ko'rsatib turibdi: kislorod elementlari ma'lum miqdordagi azot oksidi bilan yoki ikki barobar ko'p bo'lishi mumkin, ammo oraliq miqdorsiz". U turli gazlarning suyuqliklarda eruvchanligini va aralashmalardagi gaz bosimini o‘rganish orqali atom qarashlariga olib keldi. Hech bo'lmaganda, biz ushbu tajribadan bir yil o'tgach (1803 yil 6 sentyabr) u "jismlarning yakuniy zarralari va ularning birikmasini kuzatish" va o'zining "Gazlarning suv bilan singishi to'g'risida" xabari bilan bandligini ko'ramiz. va boshqa suyuqliklar", 21 oktyabrda o'qilgan. 1803 yil (“Gazlarni suv va boshqa suyuqliklar bilan singdirish toʻgʻrisida”, Ostvalning “Klassiker” asarida qayta nashr etilgan”, yuqoriga qarang.) nisbiy ogʻirliklarning birinchi jadvali (juda notoʻgʻri) ilova qilingan: “Oxirgi zarrachalarning nisbiy ogʻirliklari jadvali. gaz eous va boshqa jismlar"; unda elementlar: vodorod, azot, uglerod, kislorod, fosfor, oltingugurt turli birikmalar bilan kesishgan holda sanab o'tilgan, ular orasida ba'zilar mavjud. organik moddalar, va har bir nom bilan yakuniy zarrachalarning nisbiy og'irligi muallif tomonidan qanday olinganligi tushuntirilmagan holda berilgan. 1804 yilda u o'z fikrlarini Manchesterga tashrif buyurgan prof. Tomson (Edinburgdan) va ikkinchisi ularni (Daltonning roziligi bilan) 1807 yilda nashr etilgan X. darsligining 3-jildida nashr etdi. Nihoyat, 1808 yilda Daltonning o'zi tomonidan "Kimyoviy falsafaning yangi tizimi" asarida bayon etilgan. ” (Qarang: Oslvaldning “Klassiker” l. p.). Quyidagi parchalar Dalton qarashlarining eng muhim nuqtalarini tavsiflaydi. haqida gapiramiz jismlarning uchta holatini kuzatish: gazsimon, suyuq va qattiq) barchani sezilarli o'lchamdagi jismlar, xoh suyuq, xoh qattiq, juda ko'p miqdordagi g'ayrioddiy kichik zarrachalar yoki materiya atomlaridan tashkil topganligi to'g'risida yashirin kelishuvga olib keldi. tortishish kuchi bilan, holatlarga qarab, ko'proq yoki kamroq ahamiyatga ega; biz uni zarrachalarning ajralishiga xalaqit berganida kogeziya deb ataymiz, yoki... afinite, ularni dispers holatdan yig'ishda (masalan, bug 'suvga aylanganda)... Juda muhim savol - yakuniy (oxirgi) ) berilgan moddaning zarralari, masalan. suvlar, bir xil, ya'ni bir xil bo'lgan ko'rinish, bir xil og'irlik va boshqalar. Biz bilgan narsalarga asoslanib, ular o'rtasida hech qanday farq borligini taxmin qilish uchun asosimiz yo'q;... bir xil bo'lmagan zarrachalar agregatlari shunchalik bir hil bo'lishi mumkinligini tasavvur qilish qiyin. Agar suvning ba'zi zarralari boshqalarga qaraganda og'irroq bo'lsa va tasodifan bu suyuqlikning bir qismi asosan ulardan (?) iborat bo'lsa, bu suvning kuzatilmagan solishtirma og'irligiga ta'sir qilishi kerak. Xuddi shu fikrlar boshqa organlarga ham tegishli. Shunday qilib, biz har qanday bir jinsli jismning yakuniy zarralari og'irligi, shakli va boshqalarga ko'ra bir-biriga mutlaqo o'xshash degan xulosaga kelishimiz kerak. Boshqacha qilib aytganda, suvning har bir zarrasi uning har bir boshqa zarrasi, har bir zarrasi bilan bir xil vodorod boshqa vodorod zarrasi bilan mutlaqo bir xildir va hokazo." "Ushbu ishning asosiy maqsadlaridan biri oddiy va murakkab jismlarning oxirgi zarralarining nisbiy og'irligini, oddiy jismlarning sonini aniqlashning ahamiyati va foydasini ko'rsatishdir. murakkab zarracha tarkibiga kiruvchi elementning zarralari ...Agar ikkita jism berilsa, A Va B, ulanishga moyil bo'lsa, eng oddiyidan boshlab quyidagi kombinatsiyalar mumkin, xususan:
1 tana atomi A+ 1 atom B= 1 atom BILAN, ikkilik
1 atom A+ 2 atom IN= 1 atom D, uchlik
2 atom A+ 1 atom B= 1 atom E, uchlik
1 atom A+ 3 atom IN= 1 atom F, to'rt barobar
3 atom A+ 1 atom IN= 1 atom G, to'rt barobar
va hokazo. Keyingi umumiy qoidalar kimyoviy sintez bilan bog'liq bo'lgan tadqiqotlarda etakchi tamoyillar sifatida qabul qilinishi mumkin. 1) Agar ikkita reaksiyaga kirishuvchi jismlar uchun faqat bitta birikma olish mumkin bo'lsa, u holda uni ikkilik deb hisoblash kerak, agar biron sababga ko'ra qarama-qarshi fikr bildirishga majbur bo'lmasa. 2) Agar ikkita birikma kuzatilsa (2 ta element uchun), unda ulardan biri ikkilik, ikkinchisi esa uchlik deb o'ylash kerak. 3) Agar uchta birikma ma'lum bo'lsa, ulardan biri ikkilik, ikkitasi uchlik bo'lishini kutishimiz kerak. 4) To'rtta birikma ma'lum bo'lsa, ulardan biri ikkilik, ikkitasi uchlik, biri to'rtlamchi va hokazo bo'lishini kutishimiz kerak. 5) Ikkilik birikma har doim ikkala tarkibiy jismning oddiy aralashmasidan maxsus og'irroq bo'lishi kerak. 6) Uch karrali birikma qoʻsh birikma va oddiy birikma aralashmasidan maxsus ogʻirroq boʻlishi kerak, ular birlashganda murakkab birikma hosil qilishi mumkin va hokazo. BILAN Va D, D Va E... Ushbu qoidalarni qo'llashdan quyidagi xulosalarga kelamiz: 1) suv vodorod va kislorodning ikkilik birikmasi bo'lib, ikkala elementar atomning nisbiy og'irliklari taxminan 1:7; 2) ammiak vodorod va azotning ikkilik birikmasi ekanligi va har ikkala elementar atomning nisbiy og‘irliklari bir-biriga taxminan 1:5 ga teng ekanligi; 3) azot oksidi azot va kislorodning ikkilik birikmasi boʻlib, ularning atomlarining ogʻirligi mos ravishda 5:7... Barcha hollarda ogʻirliklar har biri bittaga teng boʻlgan vodorod atomlarida ifodalanadi... Tufayli. Ushbu bobda ishlab chiqilgan g'oyalarning yangiligi, shuningdek, muhimligi uchun ba'zi oddiy holatlarda ulanish usulini ko'rsatadigan jadvallarni berish maqsadga muvofiq deb topildi ... Bunday jismlarning elementlari yoki atomlari. hozirda elementar hisoblangan, ba'zi an'anaviy belgilar bilan kichik doiralar bilan ko'rsatilgan (Formulalarga qarang); aloqa ikki yoki undan ortiq atomlarning yonma-yon kelishidan iborat "...Hozirgi vaqtda bu rahbar qoidalarning to‘liq o‘zboshimchaligi beixtiyor ko‘zni qamashtirmoqda. Shubhasiz, birikmaning tarkibi hech qanday sharoitda, biz bilamizmi yoki yo‘qmi, bog‘liq emas. yoki bir nechta birikmalarning 2 elementining hosil bo'lish shartlari va Dalton bilan bu boradagi kelishmovchiligimiz suvga H 2 O formulasini va ammiak uchun H 3 N formulasini berishimiz bilan eng yaxshi tasvirlangan, ya'ni biz birinchi emas deb hisoblaymiz. ikkilik, lekin uch tana, ikkinchisi - to'rtlamchi.U holda, nima uchun ikkita birikma mavjud bo'lsa, biri ikkilik, ikkinchisi uchlik bo'lishi kerakligi aniq emas; kislorodli vodorod uchun ikkita birikma aniq ma'lum, ammo Endi biz bir uchlik - H 2 O, ikkinchisi to'rtlamchi - H 2 O 2 (vodorod periks) deb hisoblaymiz. Shuningdek, 5-pozitsiya barcha "almashtirish" reaktsiyalari va, masalan, klassik reaktsiyalar bilan keskin kelishmovchilikda ekanligiga shubha yo'q. vodorod xlorid hosil bo'lish reaktsiyasi:
H 2 + Cl 2 = 2HCl,
qachon, ma'lumki, ud. vodorod va xlor aralashmasining og'irligi, kuzatish aniqligi doirasida, sp. vodorod xloridning ogʻirligi va boshqalar.Ayni paytda Dalton qarashlarining X. rivojlanishiga taʼsiri juda katta boʻlgan va hozirgacha davom etmoqda; Savol tug'iladi, materiyaning atom tuzilishi haqidagi g'oya Daltonga tegishli bo'lmaganida, bunga nima sabab bo'ldi? Xulosa qilish mumkinki, bu ta'sir quyidagi holatlarga bog'liq: 1) Bizni o'rab turgan materiyaning uzluksizligi, undagi davomiylikning yo'qligi bizga shunchalik ta'sir qiladiki, biz uni majoziy ma'noda uzluksiz deb tasavvur qila olmaymiz va bu boradagi barcha urinishlar. yo'nalish hozirgacha tushunish juda qiyin va samarasiz ekanligi isbotlangan; Ko'rinib turibdiki, xuddi shunday holatlar tufayli qadimgi odamlar orasida atom g'oyalari paydo bo'lgan. 2) Dalton kimyoviy injeneriyaga atom qarashlarining amaliy qo'llanilishini ko'rsatdi; turli elementlarning atomlari nisbiy ogʻirligi boʻyicha farqlanishini qabul qilib [Shu jihatdan u asosiy atomlar bir-biri bilan bir xil deb hisoblagan Xiggins (1790) fikriga qoʻshilmagan va materiyadagi barcha kuzatilgan farqlarni ularning katta yoki kichikroq klasterlari bilan bogʻlagan. Xigginsning qarashlari “a.ni avval Prau t tiriltirgan”, hozir esa J. J. Tomson]; u g'ayrioddiy sodda va oson kirish mumkin bo'lgan sxemani berdi, unga doimiy tarkibli birikmalarning ham, "ko'p nisbatlar" qonuniga bo'ysunadigan birikmalarning ham mavjudligi hayratlanarli darajada osonlik bilan mos keladi. Kimyogarlarning bir necha avlodlari nazarida sxemaning ravshanligi va qo'llanilishi hatto ushbu qonunlarning "tushuntirishi" bo'lib xizmat qildi va endigina "tarkibning doimiyligi" ilgari o'ylanganidan ko'ra tez-tez mumkin ekanligi ayon bo'ldi. Haligacha aniqlab bo'lmaydigan "tabiat" reaksiyaga kirishuvchi jismlar, tizimga ta'sir qiluvchi tashqi energiya turi va mavjud bo'lgan jismoniy heterojen komplekslar (fazalar) o'rtasidagi ma'lum munosabat uni aniqlaydi. "Ko'p nisbatlar" qonuniga kelsak, u hali ham umumiy qabul qilingan tushuntirishga ega emas; Valdning kristallografiyada ratsional parametrlar qonuni bilan taqqoslashi, uning aniqligi va asosiy qoidalarining aniqligi yo'qligi sababli qoniqarli emas; N. S. Kurnakov ham Valdning "Metal qotishmalarining erituvchanligi to'g'risida" gi Tabiat fanlarining XI Kongressi ma'ruzasidagi fikriga qo'shiladi. va vr. Sankt-Peterburgda 1901 yilda; ikkala pozitsiyaning parallelligiga shubha qilish qiyin; ammo, agar kristallografiyada atalgan qonun hatto sferik kristallarning mavjudligining mumkin emasligiga asoslangan matematik isbotga ega bo'lsa, X tomonidan qaysi parallel pozitsiyani qabul qilish kerakligi hali ham aniq emas. Boshqa tomondan, Dyuhem shunday deydi: "Ko'rinib turibdiki, (atom nazariyasining ko'p nisbatlar hodisalariga) javobi qoniqarli va hatto atom nazariyasining g'alabasi deb hisoblanishi mumkin, bu tushuntirishdan keyin yanada sezilarli g'alaba. ko'p nisbatlar qonuni keyinchalik o'zgartirilmadi, aksincha, u qonun bilan bir xil yosh va ehtimol uning kashf etilishidan oldin bo'lgan.Bu g'alaba yakuniymi?Bu shunday bo'lishi uchun nafaqat zarur atom nazariyasi tomonidan berilgan ko'p nisbatlarning tushuntirishi mumkin bo'lgan oqim bo'lishi mumkin, lekin ayni paytda yagona mumkin Lekin kim bu talqinning kafolatini o'z zimmasiga olishga jur'at etadi va boshqasini topish hech qachon mumkin emasligini ta'kidlashga qaror qiladi? Agar zamonaviy X.ning barcha tamoyillari nafaqat soʻz, balki atomlar haqidagi gʻoya ham qanday osonlik bilan, qanday ravshanlik bilan mos kelishini hisobga oladigan boʻlsak [Dyuhem u tomonidan berilgan taqdimotni anglatadi. iqtibos keltirgan asar («Le mixte et la comb. chim.», 1902).] va boshqa tomondan, agar biz ushbu tamoyillarni atom nuqtai nazaridan tushuntirishimiz bilanoq paydo bo'ladigan qarama-qarshiliklarga e'tibor qaratsak [M. . Stallo, "La Mati ère et la Physique moderne."], atom nazariyasining yagona muvaffaqiyati ertangi kunga kafolatlanmagan aniq g'alaba degan fikrdan himoya qilish qiyin; bu nazariya bizni ko'p nisbatlar qonunining haqiqiy, ob'ektiv sababi bilan tanishtirmaydi; bu sababni hali ham aniqlash kerakligi va nihoyat, zamonaviy X. Epikur taʼlimotini yoqlamasligini.” Kelajak qanday javob bermasin, hozircha gap shu: Dalton “koʻp munosabatlar” mavjudligini payqagan. va bu hodisalar atom g'oyalaridan kelib chiqadi deb hisobladik, chunki ular atomlarning mumkin bo'lgan eng oddiy birikmalariga to'g'ri keladi; biz endi Daltonning misolida bo'lgani kabi, nafaqat gazsimon va suyuq holatda ham, noaniq tarkibga ega bo'lgan juda ko'p sonli tizimlarni bilamiz. vaqt, balki qattiq moddada ham (Mitscherlixning izomorf aralashmalaridan qattiq Fan't Xoff eritmasigacha); Bu hodisalar to'g'ridan-to'g'ri materiyaning atom tuzilishiga ziddir, deb aytish mumkin emas, lekin ular nima uchun doimiy ravishda kuzatilmayotganini tushuntirishni talab qiladi va biz bu tushuntirishda endi "soddalik" ga to'xtalib bo'lmasligimiz aniq. 3) Nihoyat, ko'p nisbatlar qonuniga binoan, Dalton kimyogarlarga ular bitta alohida tana yoki tana bilan ishlayotganligini aniqlash uchun osonlikcha mavjud bo'lgan mezonni berdi. murakkab tizim, eksperimental sharoitda barqaror bo'lgan ikki yoki undan ortiq jismlarning o'zaro ta'siridan hosil bo'lgan. Mavzuning bu jihati zamondoshlar tomonidan aniq shakllantirilmagan, ammo qonunning o'zi ahamiyati ularning e'tiboridan chetda qolmadi va Tomson tez orada (1808 yil 14 yanvar) kislotali oksalat-kaliy tuzida deyarli ikki barobar ko'p miqdorda kislota borligini aniqladi. ga qaraganda o'rtacha tuz, va Wollaston (1808 yil 28 yanvar) ba'zi kislota, karbonat va oksalat kislota tuzlari uchun oddiy, ko'p munosabatlarni, so'ngra ta'riflar uchun kashf etdi. atom tarozilari Berzelius qabul qilinadi va ularga bir necha yillik doimiy va g'ayrioddiy puxta ish bag'ishlaydi [Cp. Ostvaldning, "Klassiker", № 35, "Versuch die bestimmten und einfachen Verhältnisse autzufinden, nach velchen die Bestandtheile der unorganischen Natur mit einander verbunden sind, von J. Berzelius" - 1818-19 yillarda bunga bir necha qo'shimcha ish berdi; Maqolalar.] Bu yerda kimyogarlar atom ogʻirliklarini oʻrnatishda duch kelgan qiyinchiliklar va Dalton qoidalarining asta-sekin yoʻq qilingani va Berzelius bunga qattiq elementlarning issiqlik sigʻimi qonunlari, Dyulong va Petit, Mitscherlix izomorfizmini keltirganligi haqida toʻxtalib oʻtmaydi. 1819); Keling, shuni ta'kidlash bilan cheklanamizki, bularning barchasi etarli emas edi va zamonaviy atom og'irliklari faqat "deb nomlangandan keyin o'rnatildi" molekulyar nazariya"Avogadro-Ampera.
Gey-Lyussakning hajm qonunlari. Lavuazye ("Oeuvres va boshqalar", I, 73 va 75) kislorodning vodorod bilan qo'shilib, suv hosil qilishi uchun har bir hajmga ikki baravar ko'p vodorod olish kerakligini ta'kidladi; Bu holat keyinchalik bahslashdi (masalan, Dalton vodorodning 185 qismi uchun 100 hajm kislorodga ega bo'lishi kerak deb o'ylardi) va shuning uchun A. F. Gumboldt va Gey-Lyussak o'sha vaqt uchun juda chuqur tajribalar o'tkazgan holda, aniqlanishi muhim edi. "Exp ériences sur les moyens endiométriques et sur la proportion des principes constituants de l"atmosphè re", 1805; qarang Ostvald, "Klassiker" № 42.] Lavoisier to'g'ri edi va bu, albatta, 200 ga yaqin. suv hosil bo'lishi uchun zarur bo'lgan vodorod 100 vol. kislorod. Bu vaqtda Proulx va Bertolet o'rtasida kimyoviy birikmalar tarkibining doimiyligi to'g'risida tortishuvlar mavjud edi, boshqa tomondan, Dalton o'zining "Kimyoviy falsafaning yangi tizimi" da "kimyoviy" ning o'zgarmas atom tarkibi foydasiga gapirdi. birikmalar va shuning uchun 1808 yilda Gey-Lyusak ("Sur la combinaison des moddalar gazeuses, les unes avec les autres" xotirasi [Qarang: Ostw. "Klas." No. 42.] turli gazlarning o'zaro ta'siri bo'yicha uzoq tadqiqot olib bordi; Natijalar Proulx va Daltonning qarashlari uchun ma'qul bo'ldi, ya'ni Gey-Lyussak "gazsimon jismlarning bir-biri bilan birikmalari har doim juda oddiy nisbatlarda sodir bo'ladi, shuning uchun bitta gazning bir hajmi bilan 1, 2 va ko'pi bilan, Boshqasining 3 ta hajmi birlashtiriladi.Bu hajm nisbatlari suyuq va qattiq jismlar uchun kuzatilmaydi, lekin shunga o'xshash, reaksiyaga kirishuvchi jismlarning og'irliklari uchun ham teng bo'lib, bu jismlar faqat gazsimon holatda bo'lishining yangi isbotidir. holatlar va to'g'ri qonunlarga bo'ysunadi. , va bu gaz holatiga ham xosdir." Odatda zamonaviy darsliklarda Gey-Lyussakning kuzatishlari ikkita qonun shaklida umumlashtiriladi: 1) Gaz va bug 'holatlarida reaksiyaga kirishuvchi jismlarning hajmlari teng yoki oddiy nisbatlarda bo'lib, oddiy kichik butun sonlar nisbati sifatida ifodalanadi. va 2) Olingan jismning gaz yoki bug 'holatdagi hajmi har doim hajmga oddiy nisbatda bo'ladi unga kiritilgan har bir tarkibiy qismning (gaz-bug'). Gay-Lyussakning tajribalari Bertolet va Proulx o'rtasidagi tortishuvga barham berdi. Bir qarashda g'alati tuyulmasin, Dalton ularga salbiy munosabatda bo'ldi, ya'ni o'zining "Kimyoviy falsafaning yangi tizimi" ga qo'shimcha ravishda u Gey-Lyussakning azot oksidi va kislorodning o'zaro ta'siri (haqiqatdan ham noto'g'ri) bo'yicha kuzatishlarini tanqid qiladi va qo'shimcha qiladi. : "Aslida, uning hajmlar haqida aytganlari mening atomlar haqida aytganlarimga o'xshaydi; va agar barcha gazlar (elastik suyuqliklar) teng hajmlarda teng miqdordagi atomlarni yoki 1, 2 ga bog'liq raqamlarni o'z ichiga olishi isbotlangan bo'lsa. , 3, va hokazo bo'lsa, ikkala gipoteza ham mos kelsa, meniki universal, uniki esa faqat gazlarga taalluqlidir.Gey-Lyussak bunday gipotezani men tomonidan ko'rib chiqilib, rad etilganini ko'rmay qola olmadi [Dalton [Dalton] u o'zining kitobidagi joyni nazarda tutadi, u erda u bir vaqtlar boshqa ko'plab gazlarda (oddiy va kimyoviy jihatdan murakkab) teng hajmdagi atomlar teng miqdordagi atomlar borligiga noaniq e'tiqodi borligini aytadi, lekin u uni tark etdilar, birinchidan, kislorodning azot oksidi bilan o'zaro ta'sirini kuzatishlar asosida, teng hajmdagi gazlar aralashmasi ba'zan ikki baravar kamayganida, bu yakuniy jismda boshlang'ichga qaraganda birlik hajmdagi atomlar kamroq ekanligini ko'rsatadi. (bu kuzatish noto'g'ri) , ikkinchidan, urish, chunki. suv bug'ining og'irligi urishdan kamroq. uni tashkil etuvchi kislorodning og'irligi, agar u 2 vodorod atomining (2 jild) 1 kislorod atomi (1 jild) bilan birikmasidan hosil bo'lsa, bu imkonsiz bo'lar edi.], lekin u bu fikrni tiriltirdi va men bir nechtasini qilaman. Garchi uning o'zi ham tez orada o'z qarashlarining nomuvofiqligini ko'rishiga shubham bo'lmasa-da." Dalton shunday tugatadi: "Haqiqat, men ishonamanki, gazlar hech qachon teng yoki oddiy... hajmlarda birikmaydi; Hech bir joyda matematik aniqlikka yaqinroq yaqinlik yo'q, masalan, kislorod bilan vodorod misolida, va shunga qaramay, mening tajribalarimning eng aniqligi shuni ko'rsatadi: bu erda 1,97 jildda. vodorod 1 jildni tashkil qiladi. kislorod." Endi bilamizki, Gey-Lyusak, shubhasiz, Daltonga qaraganda haqiqatga yaqinroq edi va Morli va Skott vodorod va kislorod misolida haqiqiy nisbat 2,002 ga 1 ekanligini ko'rsatdi.
Avogadroning pozitsiyasi. 1811-yil iyun oyida italyan fizigi A.Avogadro “Essai d”une mani ère de terminer les masses qarindoshlari des molecules élémentaires des corps, etles” sarlavhali maqolasida Daltonning qarashlarini Gey-Lyussakning kuzatishlari bilan uyg‘unlashtirish vazifasini o‘z zimmasiga oldi. proportions selon lesquelles elles entrent dans le s combinaison" [Ushbu maqolada Avogardo tomonidan ta'qib qilingan nomenklatura biznikidan farq qiladi; J. Uoker ta'kidlaganidek, uning molekulasi = atom, molekula (befarq), mol écule inté grante = molekula jismlari (asosan murakkab jismlar) , mol é cule constituante - elementar jismning molekulasi va mol écule élé mentaire - elementar jismning atomi, lekin maqoladagi o‘rinlardan biri mol écule inté grante atomni ham anglatadi, degan fikrni uyg‘otadi (qarang. Ostvald, "Klassiker", № 8).]. "Gey-Lyussak qiziqarli xotirasida ko'rsatdi, - deb yozadi Avogadro, - gazsimon jismlarning birikmalari har doim juda oddiy hajmli nisbatlarda sodir bo'ladi va gazsimon reaktsiya mahsuloti bo'lsa, uning hajmi ham hajmlarga oddiy nisbatlarda bo'ladi. reaksiyaga kirishuvchi jismlar.Ammo birikmaning tarkibiy qismlari massalari o‘rtasidagi munosabatlar faqat reaksiyaga kirishuvchi molekulalarning (va ularning massalarining) nisbiy soniga va hosil bo‘lgan murakkab molekulalar soniga bog‘liqdek tuyulishi mumkin.Bundan xulosa qilish kerakki, juda ko‘p gazsimon jismlarning hajmlari va ularni tashkil etuvchi molekulalar soni o'rtasidagi oddiy bog'lanishlar.Birinchi va aftidan, yagona qabul qilinadigan gipoteza har qanday gazlarning molekulalari soni teng hajmlarda bir xil bo'lishi yoki har doim proportsional bo'lishi haqiqati sifatida tan olinishi kerak. Haqiqatan ham, agar turli xil gazlar uchun teng hajmdagi molekulalar soni har xil bo'lsa, molekulalarning masofasini tartibga soluvchi qonun barcha holatlarda bitta gaz kabi oddiy bog'lanishga olib kelishini tushunish qiyin bo'lar edi. Yuqorida aytib o'tilgan, biz molekulalarning hajmi va soni o'rtasida tan olishga majburmiz ... Ushbu gipotezaga asoslanib, bizda osongina aniqlash vositasi bor. nisbiy massalar gazsimon holatda bo'lishga qodir bo'lgan jismlar uchun molekulalar, shuningdek, reaktsiya uchun zarur bo'lgan molekulalarning nisbiy soni; ya'ni, bu faraz bo'yicha molekulalar massalarining nisbati turli gazlarning solishtirma og'irliklari orasidagi nisbatlar bilan bir xil bo'ladi (teng harorat va bosimlarda) va reaksiyaga kirishuvchi molekulalarning nisbiy soni to'g'ridan-to'g'ri gazlarning hajmlari nisbati bilan beriladi. berilgan birikma hosil qiluvchi gazlar. Misol uchun, 1,10359 va 0,07321 raqamlari kislorod va vodorod gazlarining solishtirma og'irligini ifodalaganligi sababli (teng hajmdagi havoning og'irligi = birlik solishtirma og'irligi [Bu raqamlar noto'g'ri.], keyin ularning nisbati, aks holda, teng o'rtasidagi nisbat. Ikkala gazning hajm massalari, bizning farazimizga ko'ra, ularning molekulalarining massalari o'rtasidagi nisbatni ifodalaydi, shundan kelib chiqadiki, kislorod molekulasi vodorod molekulasidan deyarli 15 baravar og'irroq yoki aniqrog'i ular nisbatda. 15,074 dan 1... [Bu yerda berilgan nisbat noto‘g‘ri (Formulalar kimyosiga qarang). Avogadroning fikrini tushunish uchun kislorod molekulasining og‘irligini quyidagicha belgilaymiz. M, vodorod molekulasining og'irligi 1 ga teng bo'lsa, u holda ma'lum hajmdagi kislorodning og'irligi bo'ladi - xM, Qayerda x bu hajmdagi kislorod molekulalarining soni va bir xil hajmdagi vodorodning og'irligi = x 1(lavozim bo'yicha). Ma'lum zarbalar. ikkala gazning og'irligi rel. havoga, ya'ni miqdorlar: (xM)/s Va (x 1)/p, Qayerda R - teng hajmdagi havoning og'irligi; bu aniq [(xM)/p]:[(x 1)/p] = M/1, ya'ni kislorod va vodorod molekulalarining og'irliklari orasidagi nisbatga teng bo'lib, ulardan ikkinchisi an'anaviy o'lchov birligi sifatida qabul qilinadi.]. Boshqa tomondan, suvning hosil bo'lishi paytida vodorod va kislorod hajmlari orasidagi nisbat = 2: 1 ekanligini bilganimiz uchun, demak, suv har bir kislorod molekulasining ikkita vodorod molekulasi bilan o'zaro ta'siridan hosil bo'lishini bilamiz. .. Lekin bir mulohaza borki, u birinchi qarashda murakkab jismlar haqidagi farazimizning faraziga qarshi gapiradi. Oddiy jismlarning ikki yoki undan ortiq molekulalarining oʻzaro taʼsiridan hosil boʻlgan murakkab molekula massaga ega boʻlishi zarur koʻrinadi. miqdoriga teng bularning massasi; yoki xususan, 1 molning o'zaro ta'sirida murakkab jism olinganda. 2 yoki bir necha molli bitta tana. boshqa tana, shunday qilib, murakkab iskala soni. mol soniga teng bo'lib qoldi. birinchi tana. Bizning farazimiz tili bilan aytganda, bu gaz ikki yoki undan ortiq hajmdagi boshqa gaz bilan birlashganda, gaz holatidagi birikmaning hajmi birinchi gaz hajmiga teng bo'lishi kerakligiga tengdir. Ayni paytda, juda ko'p hollarda bu kuzatilmaydi. Masalan, gazsimon holatdagi suvning hajmi, Gey-Lyusak ko'rsatganidek, uni hosil qilish uchun sarflangan kislorod hajmidan ikki baravar ko'p yoki bir xil bo'lsa, vodorod hajmiga teng bo'lib, uning hajmiga teng emas. kisloroddan. Ammo bu faktlarni bizning farazimizga muvofiq talqin qilish usuli ham o'zini namoyon qiladi; ya'ni, biz faraz qilamiz: 1) har qanday elementar jismlarning molekulalari... alohida elementar molekulalar (atomlar) tomonidan hosil bo'lmaydi, balki ularning ma'lum sonidan iborat bo'lib, o'zaro tortishish bilan birlashadi va 2) qachonki boshqa jismning molekulalari birinchisining molekulalari bilan birlashib, murakkab molekula hosil qiladi, keyin hosil bo'lishi kerak bo'lgan integral molekula yarmidan, chorakdan va hokazolardan hosil bo'lgan ikki yoki undan ortiq qismlarga bo'linadi. ulanishga, yarmiga, ikkinchi tananing molekulalarining to'rtdan biriga bog'langan ..., shunday qilib, yakuniy molekulalar soni parchalanmagan holda bo'lishi bilan solishtirganda ikki barobar, to'rt barobar va hokazo bo'ladi. hosil bo'lgan gazning kuzatilgan hajm nisbati talab qiladi ["Shunday qilib, masalan, suvning yakuniy molekulasi bitta molekulaga bog'langan kislorodning yarim molekulasidan yoki ikkita yarim molekula vodoroddan iborat bo'lishi kerak" (taxminan. Avogadro). Ulanish akti 2 jild. vodorod bilan 1 vol. Avogadro kislorodni birikma sifatida tasavvur qiladi 2x ular aytishdi vodorod bilan 1 x ular aytishdi dastlab hosil bo'lishi bilan kislorod 1x murakkab ustunlar har birida 2 mol bo'lgan suv. vodorod va 1 mol. kislorod, lekin keyin parchalanadi 2x oddiyroq mol., uning massasi allaqachon teng
(2x mol. vodorod + x mol. kislota)/2x = (2 mol. vodorod)/2 + (mol. kislota)/2 = mol. vodorod + (mol kislotasi)/2;
suv bug'ining har bir hajmi teng hajmdagi kislorod gazidan 2 baravar kam kislorodni o'z ichiga oladi, ikkinchisi x ular aytishdi kislotali va teng hajmli bug 'o'z ichiga oladi
x mol. suv = x (mol. vodorod + mol. kislota./2).].
Turli, eng yaxshi o'rganilgan, gazsimon birikmalarni ko'rib chiqib, men faqat atamalardan birining hajmini ikki barobarga oshirish, boshqa jismning ikki yoki undan ortiq hajmlari bilan bog'lash misollarini topaman [Ifoda noto'g'ri, lekin, afsuski, tez-tez ishlatiladi. Shubhasiz, bu yerda hajmning ikki barobar ortishi kuzatilmayapti, aksincha, kamaymoqda; Avogadro ikki barobar ko'payishi haqida gapiradi, chunki uning taxminiga ko'ra, dastlab reaksiyaga kirishuvchi jismlarning hajmi bir hajmgacha kamayadi. Hozirgi kunda ko'proq narsani berish mumkin murakkab misollar va haroratda vodorod sulfidi hosil bo'lish tenglamasi. oltingugurtning qaynash nuqtasi:
S 8 + 8H 2 = 8SH 2
Avogadro dastlab murakkab molekula S 8 Η 16 ning hosil boʻlishini va keyinchalik uning hajmining oʻn sakkizga yetishini tushuntirishi kerak edi: S 8 H 16 = 8SH 2.]. Biz buni allaqachon suv uchun ko'rganmiz. Xuddi shunday, biz bilamizki, ammiak miqdori undagi (erkin) azot hajmidan ikki baravar ko'p. Ammo boshqa hollarda molekulalar 4, 8 va hokazolarga bo'linishi mumkin. Bunday bo'linish imkoniyatini apriori kutish kerak... Ikki gazsimon jismning haqiqiy birikmasi haqida o'zimiz uchun qanday haqiqiy fikrni shakllantirishimiz mumkin? teng hajmlarda o'zaro ta'sir qilish va uni o'zgartirmaslik, masalan, azot oksidi [Tarkibi va texnik xususiyatlari. azot oksidining og'irligi NO formulasida berilgan, uning azot va kisloroddan hosil bo'lishini faqat tenglama bilan ifodalash mumkin.
N 2 + O 2 = 2NO.
Aslida, bu reaktsiya hali amalga oshirilmagan. Quyidagi reaktsiyalar yaxshi misollar:
H 2 + Cl 2 = 2HCl,
H 2 + Br 2 = 2HBr,
hajmi o'zgarmasdan sodir bo'ladi.]. Molekulalarning bo'linuvchanligi haqidagi gipoteza bilan bog'lanish haqiqatda ikki turdagi molekulalarni bittaga aylantirishini va har bir murakkab molekula gazlardan kamida bittasining hajmini kamaytirishi kerakligini tushunish oson (qarang. yuqoridagi eslatma) tabiatan bir xil bo'lgan boshqa ikkitaga bo'linmadi... Dalton birikmalardagi molekulalarning (atomlarning) eng ehtimoliy soni haqidagi ixtiyoriy farazlarga asoslanib, oddiy jismlarning molekulalari o'rtasida munosabatlar o'rnatishga harakat qildi. Bizning farazimiz... uning ma’lumotlarini to‘g‘rilash imkonini beradi... Shunday qilib, masalan, Dalton suv vodorod va kislorod, molekula molekula (atom-atom) birikmasidan hosil bo‘ladi, deb taxmin qiladi. Bunga asoslanib va suv tarkibidagi ikkala jismning nisbiy og'irligidan kelib chiqqan holda, kislorod molekulasining massasi vodorod molekulasining massasiga taxminan 7½ dan 1 gacha yoki Daltonning o'z hisobiga ko'ra bog'liq bo'lishi kerak. , 6 dan 1 gacha. Bizning farazimizga ko'ra, bu nisbat ikki baravar katta, ya'ni = 15:1. Suv molekulasiga kelsak, u dumaloq sonlarda 15 + 2 = 17 ga teng bo'lishi kerak (vodorod molekulasini 1 deb hisoblaganda), agar u 2 ga bo'linmasa; ammo bu bo'linish tufayli u yarim o'lchamga aylanadi, ya'ni 8½ yoki, aniqrog'i, 8,537 ga to'g'ridan-to'g'ri zarbani bo'lish orqali topish mumkin. suv bug'ining og'irligi, ya'ni solishtirma og'irlik uchun 0,625 (Gey-Lyussak; havoga nisbatan solishtirma og'irlik berilgan). vodorodning og'irligi 0,0732 ga teng. Bu massa Dalton tomonidan suv molekulasiga tegishli bo‘lgan 7 dan farq qiladi, faqat Dalton tomonidan suv tarkibi uchun qabul qilingan raqamlardagi farq tufayli” va hokazo. ular bilan qo'shilaman, chunki u Gey-Lyussak kuzatuvlarining to'g'riligiga umuman shubha qilar edi, bundan tashqari, Avogadroning qarashlari uning atomlarning bo'linmasligi haqidagi e'tiqodlariga zid edi; Avogadroning maqolasi keyinchalik butunlay unutilganligi va hozir ham bu borada ko'plab tushunmovchiliklar mavjudligi g'alati. Avogadroning: “Teng harorat va bosimdagi har qanday gazlarning teng hajmlari teng miqdordagi molekulalarni o'z ichiga oladi” yoki aksincha: “Teng hajmlar teng miqdordagi molekulalarga to'g'ri keladi” degan pozitsiyasini aniq ko'rish kerak. Teng harorat va bosimlarda olingan gazlar toʻgʻrisida” degani, qatʼiy aytganda, “gipoteza” emas, balki sof shartli taʼrif va boshqa hech narsa emas [Ostvald oʻzining “Grundlinien” asarida buni Avogadro postulati deb ataydi.]; Uni qabul qilib, biz birikmalarimizni ularning reaksiyalari Gey-Lyusak qonunlariga bo'ysunadigan tarzda ifodalashga rozi bo'lamiz, ya'ni. ya'ni har bir formula normal sharoitda qandaydir an'anaviy normal hajmga gazsimon holatda to'g'ri keladi va X. ko'rib chiqadigan barcha o'zgarishlarni shunday ifodalashimiz aniq, chunki ularning barchasi gaz holatida sodir bo'lishini tasavvur qilish mumkin. ; Bizning formulalarimiz nafaqat harorat va eksperimental bosimda, balki boshqalarda ham haqiqatga yaqinlashishi Boyl-Mariotte va Charlz-Gey-Lyussak qonunlarining nisbatan keng qo'llanilishidan kelib chiqadi (qarang: Gazlar). Beatga oid eksperimental ma'lumotlar qachon paydo bo'ldi. berilgan bug'ning og'irliklari biz kutgan formulaga mos kelmasa, biz odatda bunday kelishuv kuzatiladigan harorat va bosimni qidiramiz yoki tajriba ma'lumotlarini butunlay e'tiborsiz qoldirib, mos kelmaydigan "molekulyar" formulalarni yozamiz. Avogadroning "qonuni"; Shunday qilib, har qanday organik X.da sirka kislota molekulasini topish mumkin. quyidagi formulaga ega: C 2 H 3 O (OH), sirka kislotasida suvli qoldiq shaklida emas, balki 3 ta vodorod atomining mavjudligi, kislotaga xlor bilan ta'sir qilganda, biz shuni ko'rsatadiki, ketma-ket 1/3, 2/3 va nihoyat 3/3 ni almashtiring, ya'ni barcha vodorod xlordir; va shu bilan birga, tempda hech qanday shubha yo'q. qaynayotganda, sirka kislotasi bug'ining formulasi chambarchas mos keladi - C 4 H 8 O 4 va monoxloroasetik kislota formulasi C 2 H 3 ClO 2 ga qaraganda C 4 H 6 Cl 2 O 4 ga yaqinroq. Bunday misollarni yana ko'p keltirish mumkin, ammo keltirilgani biz "Avogadro qonuni" bilan emas, ya'ni ob'ektiv bo'lgan va bizning o'zboshimchaligimizga bog'liq bo'lmagan raqamli nisbat bilan emas, balki bir usul bilan ishlayotganimizni aniq ko'rsatib turibdi. eksperimental ma'lumotlarni ifodalash, hisoblash. Har qanday gazning ma'lum hajmida mavjud bo'lgan molekulalarning haqiqiy soni (agar molekulalar bizning tasavvurimizni aks ettirmasa) Avogadro taklifi bilan belgilangan molekulalar soniga hech qanday aloqasi yo'q va ikkita gazning teng hajmlarida ( teng harorat va bosimlarda) aslida ularning butunlay boshqacha sonidan iborat [Boyl va Charlz qonunidan beri - PV = RT matematik jihatdan to'g'ri emas, u holda Avogadro pozitsiyasini haqiqatga to'g'ri kelishini hisobga olsak ham, ikkita gazning teng hajmlaridagi molekulalarning matematik tengligi faqat ma'lum bir harorat nuqtasida va ma'lum bir bosimda (yoki ma'lum va gazlar massalari va ular egallagan hajmlar orasidagi sun'iy nisbatlar).]; Eksperimental ravishda topilgan va materiyaning tuzilishi haqidagi g'oyalarimizdan mutlaqo mustaqil bo'lgan Gey-Lyussak qonunlariga bunday taxmin umuman ta'sir qilmaydi: ular o'zlari ifodalagan "ko'plik qonuni" kabi tushunarsiz bo'lib qoladilar. gazsimon jismlar uchun tushunarsizdir. Bu juda achinarli, chunki X.ning baʼzi darsliklarida “qonun”ning toʻgʻriligining matematik isbotini, qolaversa, Maksvell tashabbusi bilan berilgan isbotni ham uchratish mumkin (“Theory of Heat”, L., 1894, 325). ; "Gey-Lyussak qonuni"). "Ikki gaz issiqlik muvozanatida bo'lgan holatni ko'rib chiqaylik, - deydi u. Biz allaqachon ko'rsatgan edik, agar Μ 1 va M 2 bu gazlarning alohida molekulalarining massalarini ifodalaydi, a V 1, va V 2 ta mos keladigan qo'zg'alish tezligi, issiqlik muvozanatida (1) tenglamaga muvofiq bo'lishi kerak
M 1 V 1 2 = M 2 V 2 2.
Agar ikkala gazning bosimi bo'lsa p 1 va p 2 va birlik hajmdagi molekulalar soni N 1 va N 2, keyin (2) tenglamaga muvofiq
p 1 = 1/3 M 1 N 1 V 1 2
R 2 = 1/3 M 2 N 2 V 2 2;
agar bosimlar teng bo'lsa, u holda
M 1 N 1 V 1 2 = M 2 N 2 V 2 2,
va agar haroratlar teng bo'lsa, u holda
L 1 V 1 2 = L 2 V 2 2;
Oxirgi ikkita tenglamani hadga bo'lib, biz buni topamiz Ν 1 = N 2(6) yoki ikkita gaz bir xil haroratda va bir xil bosimda bo'lsa, hajm birligiga to'g'ri keladigan molekulalar soni ikkala gaz uchun ham bir xil bo'ladi." Yozuvchiga ravshan ko'rinadiki, hatto ikki xil gazning bosimi bo'lsa ham. teng , harorat muvozanatida bo'lish, uchun ifodalar R 1 Va R 2 bu ikkala gazning teng hajmlarini nazarda tutishi kerakligi isbotlanmaguncha tenglashtirib bo'lmaydi; Bu Maksvell tomonidan taxmin qilinadi, chunki N 1 va N 2 ular "hajm birliklari" ga ishora qiladilar, ammo bunday taxminga bo'lgan ehtiyojni aniq deb hisoblash mumkin emas, chunki gazning bosimi bir marta o'rnatilgandan so'ng, gaz egallagan hajmga hech qanday aloqasi yo'q. Ushbu ixtiyoriy tanlov tufayli noaniq muammoning o'zi aniq echimga ega bo'ldi. Klauzius (1857) bu borada ancha ehtiyotkor edi; u gazlarning teng hajmlari teng miqdordagi molekulalarni o'z ichiga oladi deb faraz qildi va bundan u gazlarning kinetik nazariyasidan foydalanib, ularning tirik kuchlari teng bo'lishi kerak degan xulosaga keldi. Shunday qilib, biz Avogadro pozitsiyasini isbotlay olmaymiz, lekin uning ta'rifini qabul qilgandan so'ng, biz molekulalarning nisbiy og'irliklarini (teng hajmdagi gazlarning nisbiy og'irliklarini) osongina o'rnatishimiz mumkinligiga shubha yo'q; hamma narsa urishning ikkita ta'rifiga tushadi. solishtirilgan gazlarning og'irliklari va yuqorida ko'rganimizdek, zarbalar qaysi gazga nisbatan aniqlanishi mutlaqo befarq. vazn. Avogadro vodorod molekulasini molekulyar og'irlikning birligi deb hisobladi (yuqoriga qarang); Endi ko'pincha bunday birlik vodorod atomi hisoblanadi. Keyingi savol, uning molekulasida qancha vodorod atomi borligi va Avogadro terminologiyasidan keyin "atom" so'ziga qanday ta'rif berilishi mumkinligi. Tajriba orqali aniqlanganki, qachon kimyoviy o'zaro ta'sir gazsimon jismlar, ko'pincha transformatsiyadan keyin ulardan biri kattaroq hajm tajribadan oldingiga qaraganda; shuning uchun, masalan, yuqorida ko'rsatilgandek, suv bug'i ko'rinishidagi kislorodning berilgan massasi bir xil harorat va bosim sharoitida olingan bir xil toza kislorod massasidan ikki baravar ko'p hajmni egallaydi; Avogadro bilan birgalikda biz buni suv hosil bo'lishida kislorod molekulasi ikkita mutlaqo bir xil yarmiga bo'linganligini va shuning uchun kimyoviy reaktsiyalar molekulalarning bo'linishi bilan birga bo'lishi mumkinligini tan olamiz; tajriba shuni ko'rsatadiki, bu bo'linish ko'pincha shu qadar uzoqqa boradiki, u bizga boshqa yo'l bilan etib bo'lmaydi; Shunday qilib, masalan, agar biz yuqorida aytib o'tilgan misolda qoladigan bo'lsak, suv bug'ini kislorod bilan qanchalik yuqori haroratda solishtirmasak ham, ma'lum hajmdagi kislorod gazida har doim uning og'irligi bo'yicha ikki baravar ko'p bo'ladi. teng hajmdagi suv bug'lari. Boshqa tomondan, gr so'zidan kelib chiqqan "atom" so'zi. sl. Timos - bo'linmas, bizni u bilan shunday materiya massasini belgilashga majbur qiladi, biz bo'linish orqali yanada soddalashtirishga qodir emasmiz. Atomning zamonaviy ta'rifi shundan kelib chiqadi: bu - kimyoviy jihatdan murakkab molekulalarga kiritilgan elementning eng kichik massasi; ya'ni, bu elementdan tashqari, kamida bitta boshqa element mavjud bo'lgan bunday jismlarning molekulalari. Yuqorida qo'yilgan savolni hal qilish uchun, keyin urishni aniqlash kerak. turli vodorod birikmalarining vodorod og'irliklari, bu urishlarning qancha qismini tahlil qilish orqali aniqlang. vodorod molekulalarida ifodalangan og'irliklar vodorodga tushadi va eng kichiki uning atomi sifatida qabul qilinadi; Gey-Lyussak qonuniga ko'ra, topilgan massa va vodorod molekulasining massasi o'rtasidagi munosabat oddiy, ya'ni nisbatan kichik butun son sifatida ifodalanishi kerak. Siz buni boshqacha qilishingiz mumkin; siz gazsimon birikmalarning hajmlarini ulardagi vodorod hajmi bilan solishtirishingiz mumkin; eng katta butun son bilan ifodalangan nisbat bizga vodorod molekulasining bo'linuvchanlik o'lchovini beradi. Aniqlik uchun vodorod birikmalarini misol qilib olaylik: botqoq gazi (uglerod va vodorod birikmasi), ammiak (azot va vodorod birikmasi), suv (kislorod va vodorod birikmasi) va vodorod xlorid (elementar tarkibi). ismning o'zi bilan berilgan); urish birinchisining vodorod og'irligi = 8, ya'ni og'irlik x ular aytishdi botqoq gazi: og'irlik x ular aytishdi vodorod = 8, bu erdan mol. botqoq gazi = og'irligi bo'yicha 8 mol. vodorod; tahlil shuni ko'rsatadiki, bu miqdorning ¼ qismi vodorod, iz., mol. botqoq gazi uglerod (og'irligi 6 mol. vodorod) va 2 moldan iborat. vodorod; urish ammiakning og'irligi = 8½ va 1½, wt. birliklar bu miqdor vodorod; keyingi, oldingi usulda fikr yuritib, biz 1 mol degan xulosaga kelamiz. ammiak azotdan (og'irligi 7 mol. vodorod) va 1½ = 3/2 moldan iborat. vodorod; suv molekulasining tarkibi - kislorod (miqdorda = 8 mol. vodorod) va 1 mol. vodorod; nihoyat, urish. vodorod xloridning og'irligi = 18,25, shundan faqat 0,5 vodorod; keyin vodorod xlorid molekulasi xlor (= 17,75 mol. vodorod) va ½ moldan iborat. vodorod; oxirgi qiymat biz topgan eng kichigi; Shuning uchun biz vodorod molekulasining yarmiga bo'linishini taxmin qilishimiz mumkin va bu yarmini vaqtincha vodorodning "atom og'irligi" sifatida olish mumkin. Shubhasiz, bu birikmalarni ularning hajmli tarkibi nuqtai nazaridan ko'rib chiqish bir xil xulosaga keladi; Yuqorida keltirilgan raqamlar aynan 1 jildni bildiradi. botqoq gazi ½ vol.ga teng. uning tarkibidagi vodorod, 1 vol. ammiak = 2/3 vol. uning tarkibidagi vodorod, 1 vol. suv bug'i = 1 vol. uning tarkibidagi vodorod va nihoyat, 1 vol. vodorod xlorid uning tarkibidagi vodorod hajmidan ikki baravar ko'p; eng katta o'sish vodorod xloridning hosil bo'lishida sodir bo'ldi va Avogadroga ko'ra, biz vodorod molekulasi ikkiga bo'linishini tan olishimiz kerak. Turli xil birikmalarning tarkibini ko'plab aniqlashlar molekulasida vodorod molekulasining yarmidan kam bo'lgan kimyoviy murakkab birikmalar yo'qligini ko'rsatdi; Shunday qilib, biz nihoyat, bu miqdorni vodorod atomi deb atashimiz mumkin [Ammo J. J. Tomson tajribalari.] va uni harf bilan belgilashimiz mumkin. H, H 2 vodorod molekulasini yozing. Ud topish uchun. vodorodga nisbatan gazning og'irligi, biz ta'rifi bo'yicha teng miqdordagi molekulalarni o'z ichiga olgan gaz va vodorodning teng hajmlari (ma'lum bir harorat va bosimda) og'irliklari orasidagi nisbatni olishimiz kerak va shuning uchun bu urish. vazn
D = (xM)/(xH 2),
Qayerda x- ikkala gazning molekulalarining soni bizga noma'lum, M- berilgan gaz molekulasining og'irligi va H 2 - vodorod molekulasining og'irligi yoki so'z bilan aytganda: gazning molekulyar og'irligi D vodorodning molekulyar og'irligidan marta; uni vodorod atomlarida (yarim vodorod molekulasida) ifodalaganimizda, u ga teng bo'ladi 2D marta vodorodning atom og'irligi. Odatda ikkinchisi o'lchov birligi sifatida olinadi; Keyin
M = 2D,
lekin shuni esda tutish kerakki, bu iborada D bu mavhum raqam bo'lib, 2 nomlanadi, chunki u 2 vodorod atomi o'rniga turadi va allaqachon aytib o'tilgan (Formulalarga qarang), agar biz kislorod = 16 deb hisoblasak, u holda vodorodning atom og'irligi = 1,008, va hokazo, keyin
M" = 2·1,008D,
Qayerda M" barcha atom og'irliklari O = 16 ga tayinlangan formulani ifodalaydi, a D urish bug'ning (gazning) vodorod bilan og'irligi. H 2 = 2 va O 2 = 32 da gramm molekulalarining hajmi uchun Kimyoviy formulalarga qarang. Xulosa sifatida shuni ta'kidlash kerakki, Avogadrodan tashqari, xuddi shu masala bo'yicha quyidagilar ham yozgan: Amper ("Ann. de chim." 90, 1814, nemischa tarjimasi, Ostvaldning "Klassik.", No 8). , Godin (Gandin, "Ann. chim. phys.", 35, 1833: "Recherches sur la structure intime dos corps inorganiques d é finis etc." [Maqola hayratlanarli ravshanlik bilan yozilgan, ammo zamondoshlar tomonidan tushunilmagan va keyin unutilgan; Aytgancha, Gaudin teng kvadratlarda teng hajmdagi gazlarni tasvirlagan - keyinchalik Goffman tomonidan kiritilgan mnemonik qurilma.], Jerar (Unitar tizimga qarang) va ayniqsa, Kannizzaro (Sankt Kannizzaro, "Nuovo Cimento", 7, 1858: "Sunto di un corso di filosofi a chimica fatto nella Reale Universita di Genova"; nemis tilida Ostvaldning "Klassiker" asarida, № 30), Avogadroni qayta kashf etgan. Hatto barcha e'tirozlarni sanab bo'lmaydi. Bu erda "qonun, Avogadro".. Tushunmovchiliklarga misol sifatida ammiak bug'ining vodorodga nisbatan solishtirma og'irligi formulaning yarmiga emas, balki to'rtdan biriga teng bo'lganligini ko'rsatish kifoya. ya'ni
NH 4 Cl/4 = NH 4 Cl/2H 2,
shundan kelib chiqadiki, vodorod molekulasi mos keladi
NH 4 Cl/2 = N/2 + H 4 /2 + Cl/2;
chunki NH 4 Cl bug'lanishi sharoitida azot va xlor "atomlari" ning bo'linishiga, ya'ni bu elementlarning o'zgarishiga yo'l qo'yib bo'lmaydi, G. Sen-Kler Devil NH 4 Cl bug'ining g'ayritabiiy zichligini ko'rib chiqdi. "Avogadro qonuni" ning noto'g'riligiga dalil bo'ladi. S. Kannizzaro birinchi [Chor. E. Mitscherlich, "Ueber das Verh ältniss des spec. Gewichts de r Gasarten zu den chem. Proportionen", "Ann. Ch. Ph.", 12, 1834 va "Gesamm. Abhandl.".] kelishmovchilikni tushuntirish mumkinligini ko'rsatdi. NH 4 Cl ning NH 3 va HCl ga parchalanishi bilan, ular 2 ta vodorod "molekulalari" hajmini egallashi kerak. Pebalning bevosita tajribasi keyinchalik bu fikrni tasdiqladi. Shuni ta'kidlash kerakki, ko'p hollarda g'ayritabiiy urish. bug'ning og'irligi hosil bo'lgan mahsulotlarni eksperimental o'rganish hali ham mavjud emas va shuning uchun endi qabul qilingan talqin keyinchalik noto'g'ri bo'lib chiqishi mumkin. Shunday qilib, masalan, harorat oshishi bilan urish haroratining pasayishi. C 4 H 8 O 4 / 2 H 2 ga yetadigan sirka kislotasi bug'ining og'irligi odatda quyidagi ifoda bilan izohlanadi:
ammo quyidagi reaktsiya ham mumkin:
(sirka angidrid) + H 2 O, va hokazo. Barcha zamonaviy atom og'irliklari Avogadroning ta'rifiga muvofiq olinadi va shuning uchun barcha zamonaviy kimyoviy. ek. (ayniqsa gazsimon jismlar uchun) Gey-Lyussakning hajm qonunlarining illyustratsiyasi sifatida xizmat qilishi mumkin.
Molekulalar, atomlar va ekvivalentlarning og'irliklarini aniqlashga xizmat qiluvchi boshqa qonunlar. Hamma birikmalar va elementlar ham aylana olmaydi gazsimon holat. Biz bunday hollarda molekulaning nisbiy og'irligini urish orqali aniqlash imkoniyatidan mahrum bo'lamiz. bug'ning og'irligi (qarang Bug 'zichligini aniqlash) va shuning uchun biz ushbu jismlarning molekulalariga ma'lum bir element kiritilgan atomik (eng kichik) og'irlikni to'g'ridan-to'g'ri aniqlay olmaymiz. Oxirgi qiymat, shu bilan birga, bunday hollarda bilvosita, eritmalarning ba'zi xususiyatlaridan foydalangan holda (qarang: Eritmalar, Krioskopiya va Ebulioskopiya) yoki izomorfizm asosida (qarang); Atom og'irligining qiymatini Dyulong va Petit qonuni yoki D.I.Mendeleevning davriy qonuni yordamida aniqlashimiz mumkin (qarang. Davriy qonun va atomlarning og'irligi); Nihoyat, ekvivalent qiymat Faradayning elektrolitik qonuni yordamida aniqlanishi mumkin (qarang: Elektroliz va Elektrolitik dissotsiatsiya). - Kimyoviy o'zgarishlarni tartibga soluvchi miqdoriy qonunlar, massalar ta'siri qonuni va Hoff qonuni haqida - qarang: Kimyoviy yaqinlik, Kimyoviy muvozanat, Kimyoviy reaktsiyalarning qaytarilishi.
Kimyoviy qarashlarning rivojlanish tarixi, ushbu maqoladan tashqari, ushbu lug'atda ko'p marta to'xtalib o'tgan. Qarang: Alkimyo, Materiya, Havo, Atom og'irliklari, Glikollar, Glitserin, Dualizm, O'rinbosarlik, Izomeriya, Kislotalar, Metallar va Metalloidlar, Sut kislotasi., Kimyoviy qaytuvchanlik. reaksiyalar, Parafinlar, Kimyoviy elementlarning davriyligi, To'yingan organik kislotalar, Pseudomerizm, Radikallar, Tuz, Stereokimyo, Termokimyo, Sirka kislotasi. (tuzilishi), Unitar sistema, Flogiston, Kimyoviy formulalar, Kimyoviy nomenklatura, Kimyoviy tuzilishi, Kimyoviy yaqinlik, Kimyoviy turlari nazariya, Elektrokimyo, Elektroliz, Elektrolitik dissotsilanish, Etil, Eteren nazariyasi, Yadro nazariyasi va barcha taniqli kimyogarlarning tarjimai holi. Tarixiy elementlar va eng muhimlari haqida ma'lumot kimyoviy birikmalar- ularga bag'ishlangan maxsus maqolalarga qarang.
A. I. Gorbov. Δ.