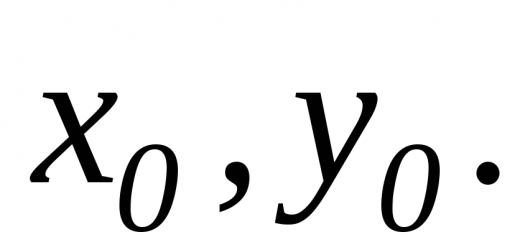6-sonli ma’ruza
Molekula energiyasi
Atom Kimyoviy elementning kimyoviy xossalariga ega bo'lgan eng kichik zarrachasi deyiladi.
Atom musbat zaryadlangan yadro va uning maydonida harakatlanuvchi elektronlardan iborat. Yadroning zaryadi barcha elektronlarning zaryadiga teng. Ion berilgan atomning elektr zaryadli zarrasi atomlar elektronlarni yo'qotganda yoki olganida hosil bo'ladi.
Molekula asosiy kimyoviy xossalarga ega bo'lgan bir hil moddaning eng kichik zarrasi.
Molekulalar bir-biriga atomlararo kimyoviy bog'lar orqali bog'langan bir xil yoki turli atomlardan iborat.
Elektr neytral atomlarning barqaror molekula hosil qilish sabablarini tushunish uchun biz ikkita bir xil yoki turli atomlardan tashkil topgan eng oddiy diatomik molekulalarni ko'rib chiqish bilan cheklanamiz.
Molekulada atomni ushlab turadigan kuchlar tashqi elektronlarning o'zaro ta'siridan kelib chiqadi. Atomlar molekulaga birlashganda, ichki qobiqlarning elektronlari oldingi holatida qoladi.
Agar atomlar bir-biridan katta masofada joylashgan bo'lsa, ular bir-biri bilan o'zaro ta'sir qilmaydi. Atomlar bir-biriga yaqinlashganda, ularning o'zaro tortishish kuchlari ortadi. Atomlarning o'lchamlari bilan taqqoslanadigan masofalarda o'zaro itarish kuchlari paydo bo'ladi, ular bir atomning elektronlarini boshqa atomning elektron qobiqlariga juda chuqur kirib borishiga imkon bermaydi.
Repulsiv kuchlar jozibador kuchlardan ko'ra ko'proq "qisqa masofa" dir. Bu shuni anglatadiki, atomlar orasidagi masofa oshgani sayin, itaruvchi kuchlar tortishish kuchlariga qaraganda tezroq kamayadi.
Jozibali kuch, itaruvchi kuch va natijada atomlar orasidagi o'zaro ta'sir kuchining masofaga bog'liqligi grafigi quyidagicha ko'rinadi:
Molekuladagi elektronlarning o'zaro ta'sir energiyasi atom yadrolarining o'zaro joylashishi bilan belgilanadi va masofaning funktsiyasidir, ya'ni
Butun molekulaning umumiy energiyasiga harakatlanuvchi yadrolarning kinetik energiyasi ham kiradi.
Demak,
![]() .
.
Bu yadrolar orasidagi o'zaro ta'sirning potentsial energiyasi ekanligini anglatadi.
Keyin diatomik molekuladagi atomlar orasidagi o'zaro ta'sir kuchini ifodalaydi.
Shunga ko'ra, molekuladagi atomlarning o'zaro ta'sirining potentsial energiyasining atomlar orasidagi masofaga bog'liqligi grafigi quyidagicha ko'rinishga ega:

Molekuladagi muvozanat atomlararo masofa deyiladi ulanish uzunligi. D miqdori deyiladi molekulyar dissotsiatsiya energiyasi yoki bog'lanish energiyasi. Bu atomlarning kimyoviy bog'larini molekulalarga ajratish va ularni atomlararo kuchlar ta'siridan tashqarida olib tashlash uchun bajarilishi kerak bo'lgan ishga son jihatdan tengdir. Dissotsilanish energiyasi molekulaning hosil bo'lishida ajralib chiqadigan energiyaga teng, lekin ishorasi bo'yicha qarama-qarshidir. Dissotsilanish energiyasi manfiy, molekula hosil bo'lganda ajralib chiqadigan energiya esa ijobiydir.
Molekulaning energiyasi yadrolar harakatining tabiatiga bog'liq. Ushbu harakatni translyatsion, aylanish va tebranishlarga bo'lish mumkin. Molekuladagi atomlar orasidagi kichik masofada va molekulalarga ta'minlangan idishning etarlicha katta hajmida, oldinga energiya uzluksiz spektrga ega va uning o'rtacha qiymati ga teng, ya'ni.
Aylanma energiya diskret spektrga ega va qiymatlarni qabul qila oladi
![]() ,
,
bu yerda I aylanma kvant soni;
J - molekulaning inersiya momenti.
Vibratsiyali harakat energiyasi shuningdek, diskret spektrga ega va qiymatlarni qabul qilishi mumkin
![]() ,
,
tebranish kvant soni qayerda;
– bu turdagi tebranishlarning tabiiy chastotasi.
Eng past tebranish darajasi nol energiyaga ega bo'lganda
 Aylanma va translatsiya harakati energiyasi energiyaning kinetik shakliga, tebranish harakatining energiyasi potentsial shaklga mos keladi. Binobarin, diatomik molekulaning tebranish harakatining energiya bosqichlarini grafikda tasvirlash mumkin.
Aylanma va translatsiya harakati energiyasi energiyaning kinetik shakliga, tebranish harakatining energiyasi potentsial shaklga mos keladi. Binobarin, diatomik molekulaning tebranish harakatining energiya bosqichlarini grafikda tasvirlash mumkin.
Ikki atomli molekulaning aylanish harakatining energiya bosqichlari xuddi shunday tarzda joylashgan, faqat ular orasidagi masofa tebranish harakatining bir xil bosqichlariga qaraganda ancha kichikdir.
Atomlararo aloqalarning asosiy turlari
Atom aloqalarining ikki turi mavjud: ion (yoki geteropolyar) va kovalent (yoki gomeopolar).
Ion aloqasi molekuladagi elektronlar shunday joylashganki, yadrolardan birining yonida ortiqcha, ikkinchisining yonida esa kamlik hosil bo'ladigan hollarda yuzaga keladi. Shunday qilib, molekula bir-biriga tortilgan, qarama-qarshi belgilarning ikkita ionidan iborat ko'rinadi. Ion bog'langan molekulalarga misollar NaCl, KCl, RbF, CsJ va hokazo. elementlarning atomlarini birlashtirish natijasida hosil bo'ladi I-oh va VII-Mendeleyev davriy sistemasining ikkinchi guruhi. Bunda o'ziga bir yoki bir nechta elektron qo'shgan atom manfiy zaryadga ega bo'lib manfiy ionga aylanadi va elektronlarning tegishli sonini bergan atom musbat ionga aylanadi. Ionlarning musbat va manfiy zaryadlarining umumiy yig'indisi nolga teng. Shuning uchun ion molekulalari elektr jihatdan neytraldir. Molekulaning barqarorligini ta'minlovchi kuchlar tabiatda elektrdir.
Ion bog'lanish sodir bo'lishi uchun elektronni olib tashlash energiyasi, ya'ni musbat ion hosil qilish ishi manfiy ionlar hosil bo'lganda ajralib chiqadigan energiya va ularning o'zaro energiyasi yig'indisidan kam bo'lishi kerak. diqqatga sazovor joy.
Ko'rinib turibdiki, neytral atomdan musbat ion hosil bo'lishi elektron qobiqda joylashgan elektronlar paydo bo'lganda, eng kam ishni talab qiladi.
Boshqa tomondan, elektron qobiqni to'ldirishdan oldin bitta elektronga ega bo'lmagan halogen atomlariga elektron biriktirilganda eng katta energiya chiqariladi. Shuning uchun elektronlarning o'tkazilishi natijasida ionli bog'lanish hosil bo'ladi, bu esa hosil bo'lgan ionlarda to'ldirilgan elektron qobiqlarning paydo bo'lishiga olib keladi.
Boshqa ulanish turi - kovalent bog'lanish.
Bir xil atomlardan tashkil topgan molekulalar hosil bo'lganda, qarama-qarshi zaryadlangan ionlarning hosil bo'lishi mumkin emas. Shuning uchun ionli bog'lanish mumkin emas. Ammo tabiatda molekulalari bir xil atomlardan hosil bo'lgan moddalar mavjud H 2, O 2, N 2 va hokazo. Ushbu turdagi moddalardagi bog'lanish deyiladi kovalent yoki gomeopolar(homeo - har xil [yunoncha]). Bundan tashqari, turli atomlarga ega bo'lgan molekulalarda kovalent bog'lanishlar ham kuzatiladi: vodorod ftorid HF, azot oksidi YO'Q, metan CH 4 va hokazo.
Kovalent bog'lanishlarning tabiatini faqat kvant mexanikasi asosida tushuntirish mumkin. Kvant mexanik tushuntirish elektronning to'lqin tabiatiga asoslanadi. Atomning tashqi elektronlarining to'lqin funksiyasi atom markazidan masofa oshgani sayin birdan to'xtamaydi, balki asta-sekin kamayadi. Atomlar bir-biriga yaqinlashganda, tashqi elektronlarning loyqa elektron bulutlari qisman bir-biriga yopishib, ularning deformatsiyasiga olib keladi. Elektronlar holatining o'zgarishini aniq hisoblash o'zaro ta'sirda ishtirok etuvchi barcha zarralar tizimi uchun Shredinger to'lqin tenglamasini echishni talab qiladi. Bu yo'lning murakkabligi va mashaqqatliligi bizni bu erda faqat hodisalarni sifatli ko'rib chiqish bilan cheklanishga majbur qiladi.
 Eng oddiy holatda s- elektronning holati, elektron bulut ma'lum radiusli shardir. Agar kovalent molekuladagi ikkala elektron o'zaro almashsa, avval yadroga tegishli bo'lgan elektron 1 " A", yadroga tegishli bo'lgan elektron 2 joyiga o'tadi" b", va elektron 2 teskari o'tishni amalga oshiradi, keyin kovalent molekula holatida hech narsa o'zgarmaydi.
Eng oddiy holatda s- elektronning holati, elektron bulut ma'lum radiusli shardir. Agar kovalent molekuladagi ikkala elektron o'zaro almashsa, avval yadroga tegishli bo'lgan elektron 1 " A", yadroga tegishli bo'lgan elektron 2 joyiga o'tadi" b", va elektron 2 teskari o'tishni amalga oshiradi, keyin kovalent molekula holatida hech narsa o'zgarmaydi.
Pauli printsipi qarama-qarshi spinli ikkita elektronning bir xil holatda bo'lishiga imkon beradi. Ikkala elektron joylashishi mumkin bo'lgan hududlarning birlashishi ular orasida maxsus kvant mexanikasining paydo bo'lishini anglatadi almashinuv o'zaro ta'siri. Bunda molekuladagi elektronlarning har biri navbatma-navbat u yoki bu yadroga tegishli bo'lishi mumkin.
Hisob-kitoblar shuni ko'rsatadiki, agar o'zaro ta'sir qiluvchi elektronlarning spinlari parallel bo'lsa, molekulaning almashinuv energiyasi ijobiy, parallel bo'lmasa manfiy bo'ladi.
Shunday qilib, kovalent bog'lanish turi qarama-qarshi spinli elektronlar bilan ta'minlanadi. Agar ion bog'lanishda biz elektronlarni bir atomdan ikkinchisiga o'tkazish haqida gapirgan bo'lsak, bu erda ulanish elektronlarni umumlashtirish va ularning harakati uchun umumiy maydon yaratish orqali amalga oshiriladi.
Molekulyar spektrlar
Molekulyar spektrlar atom spektrlaridan juda farq qiladi. Atom spektrlari alohida chiziqlardan iborat bo'lsa, molekulyar spektrlar bir uchi o'tkir, ikkinchisi xiralashgan chiziqlardan iborat. Shuning uchun molekulyar spektrlar ham deyiladi chiziqli spektrlar.
Molekulyar spektrlardagi chiziqlar elektromagnit to'lqinlarning infraqizil, ko'rinadigan va ultrabinafsha chastota diapazonlarida kuzatiladi. Bunday holda, chiziqlar ma'lum bir ketma-ketlikda joylashgan bo'lib, bir qator chiziqlar hosil qiladi. Spektrda bir qator seriyalar mavjud.
Kvant mexanikasi molekulyar spektrlarning tabiatini tushuntirib beradi. Ko'p atomli molekulalarning spektrlarini nazariy talqin qilish juda murakkab. Biz faqat ikki atomli molekulalarni ko'rib chiqish bilan cheklanamiz.
Ilgari biz molekula energiyasi atom yadrolari harakatining tabiatiga bog'liqligini ta'kidladik va bu energiyaning uch turini aniqladik: translatsiya, aylanish va tebranish. Bundan tashqari, molekula energiyasi ham elektronlar harakatining tabiati bilan belgilanadi. Ushbu turdagi energiya deyiladi elektron energiya va molekulaning umumiy energiyasining tarkibiy qismidir.
Shunday qilib, molekulaning umumiy energiyasi:
Translatsiya energiyasining o'zgarishi molekulyar spektrda spektral chiziqning paydo bo'lishiga olib kelishi mumkin emas, shuning uchun biz molekulyar spektrlarni ko'rib chiqishda ushbu turdagi energiyani istisno qilamiz. Keyin
Bor chastotasi qoidasiga ko'ra ( III- Bor postulati) molekula energiya holati o'zgarganda chiqaradigan kvant chastotasi ga teng.
![]() .
.
Tajriba va nazariy tadqiqotlar shuni ko‘rsatdi
Shuning uchun, kuchsiz qo'zg'alishlar bilan u faqat o'zgaradi, kuchliroqlari bilan - hatto kuchliroqlari bilan -. Keling, molekulyar spektrlarning har xil turlarini batafsilroq ko'rib chiqaylik.
Molekulalarning aylanish spektri
Keling, energiyaning kichik qismlari bilan elektromagnit to'lqinlarning yutilishini o'rganishni boshlaylik. Energiya kvantining qiymati eng yaqin ikki daraja orasidagi masofaga teng bo'lmaguncha, molekula yutmaydi. Asta-sekin chastotani oshirib, biz molekulani bir aylanish bosqichidan ikkinchisiga ko'tarishga qodir kvantlarga erishamiz. Bu 0,1-1 mm gacha bo'lgan infraqizil to'lqinlar hududida sodir bo'ladi.
![]() ,
,
bu erda va --chi va --chi energiya darajalaridagi aylanish kvant sonining qiymatlari.
Aylanadigan kvant raqamlari va qiymatlarga ega bo'lishi mumkin, ya'ni. ularning mumkin bo'lgan o'zgarishlari tanlov qoidasi bilan cheklanadi
Kvantning molekula tomonidan yutilishi uni bir aylanish energiya darajasidan ikkinchisiga, yuqoriroq darajaga o'tkazadi va aylanish yutilish spektrida spektral chiziq paydo bo'lishiga olib keladi. To'lqin uzunligi pasayganda (ya'ni, raqam o'zgaradi), bu mintaqada yutilish spektrining tobora ko'proq yangi chiziqlari paydo bo'ladi. Barcha chiziqlarning yig'indisi molekulaning aylanish energiya holatlarini taqsimlash haqida fikr beradi.
Biz hozirgacha molekulaning yutilish spektrini ko'rib chiqdik. Molekulaning emissiya spektri ham mumkin. Aylanma emissiya spektridagi chiziqlarning ko'rinishi molekulaning yuqori aylanish energiyasi darajasidan pastki darajaga o'tishi bilan bog'liq.
Aylanma spektrlar oddiy molekulalarda atomlararo masofalarni katta aniqlik bilan aniqlash imkonini beradi. Atomlarning inersiya momentini va massasini bilib, atomlar orasidagi masofani aniqlash mumkin. Ikki atomli molekula uchun
Molekulalarning tebranish-aylanish spektri
To'lqin uzunligi mikron bo'lgan infraqizil mintaqadagi moddaning elektromagnit to'lqinlarining yutilishi tebranish energiya darajalari o'rtasida o'tishni keltirib chiqaradi va molekulaning tebranish spektrining paydo bo'lishiga olib keladi. Biroq, molekulaning tebranish energiya darajalari o'zgarganda, uning aylanish energiya holatlari bir vaqtning o'zida o'zgaradi. Ikki tebranish energiya darajasi o'rtasidagi o'tish aylanish energiya holatlaridagi o'zgarishlar bilan birga keladi. Bunda molekulaning tebranish-aylanish spektri paydo bo'ladi.
Agar molekula bir vaqtning o'zida tebransa va aylansa, uning energiyasi ikkita kvant soni bilan aniqlanadi va:
![]() .
.
Ikkala kvant sonini tanlash qoidalarini hisobga olgan holda, biz tebranish-aylanish spektrining chastotalari uchun quyidagi formulani olamiz (oldingi formula / h va oldingi energiya darajasini, ya'ni qavs ichidagi atamalarni olib tashlang):
![]() .
.
Bunday holda, (+) belgisi pastroqdan yuqoriroq aylanish darajasiga o'tishlarga mos keladi va (-) belgisi qarama-qarshi pozitsiyaga mos keladi. Chastotaning tebranish qismi tarmoqli joylashgan spektral hududni aniqlaydi; aylanish qismi chiziqning nozik tuzilishini aniqlaydi, ya'ni. individual spektral chiziqlarning bo'linishi.
Klassik tushunchalarga ko'ra, ikki atomli molekulaning aylanishi yoki tebranishi, agar molekula nolga teng bo'lmagan dipol momentga ega bo'lsa, elektromagnit to'lqinlarning tarqalishiga olib kelishi mumkin. Bu shart faqat ikki xil atom tomonidan hosil qilingan molekulalar uchun qondiriladi, ya'ni. assimetrik molekulalar uchun.
Bir xil atomlar hosil qilgan simmetrik molekula nol dipol momentga ega. Shuning uchun klassik elektrodinamikaga ko'ra, bunday molekulaning tebranishi va aylanishi nurlanishni keltirib chiqara olmaydi. Kvant nazariyasi shunga o'xshash natijalarga olib keladi.
Molekulalarning elektron tebranish spektri
Ko'rinadigan va ultrabinafsha diapazonda elektromagnit to'lqinlarning yutilishi molekulaning turli elektron energiya darajalari o'rtasida o'tishlariga olib keladi, ya'ni. molekulaning elektron spektrining paydo bo'lishiga. Har bir elektron energiya darajasi elektronlarning ma'lum bir fazoviy taqsimotiga yoki ular aytganidek, diskret energiyaga ega elektronlarning ma'lum bir konfiguratsiyasiga mos keladi. Elektronlarning har bir konfiguratsiyasi ko'plab tebranish energiya darajalariga mos keladi.
Ikki elektron daraja o'rtasidagi o'tish tebranish darajalari orasidagi ko'plab o'tishlar bilan birga keladi. Molekulaning elektron tebranish spektri shunday paydo bo'ladi, u yaqin chiziqlar guruhlaridan iborat.
Har bir tebranish energiya holatiga aylanish darajalari tizimi o'rnatiladi. Shuning uchun elektron-vibratsiyali o'tish paytida fotonning chastotasi har uch turdagi energiyaning o'zgarishi bilan aniqlanadi:
![]() .
.
Chastota - spektrning o'rnini aniqlaydi.
Butun elektron tebranish spektri ko'pincha bir-birining ustiga chiqadigan va keng diapazonni tashkil etuvchi bir necha guruh guruhlari tizimidir.
Molekulyar spektrlarni o'rganish va talqin qilish molekulalarning batafsil tuzilishini tushunishga imkon beradi va kimyoviy tahlil uchun keng qo'llaniladi.
Ramanning tarqalishi
Bu hodisa shundaki, yorug'lik gazlar, suyuqliklar yoki shaffof kristall jismlar orqali o'tganda paydo bo'ladigan tarqalish spektrida yorug'likning doimiy chastotali tarqalishi bilan bir qatorda, chastotalarga mos keladigan bir qator yuqori yoki past chastotalar paydo bo'ladi. tarqaladigan molekulalarning tebranish yoki aylanish o'tishlari.
Ramanning tarqalishi hodisasi oddiy kvant mexanik tushuntirishga ega. Yorug'likning molekulalar tomonidan tarqalish jarayonini fotonlarning molekulalar bilan noelastik to'qnashuvi deb hisoblash mumkin. To'qnashuv paytida foton molekuladan faqat ikki energiya darajasi o'rtasidagi farqga teng bo'lgan energiya miqdorini berishi yoki olishi mumkin. Agar molekula foton bilan to'qnashganda energiyasi past bo'lgan holatdan yuqori energiyali holatga o'tsa, u energiyasini yo'qotadi va chastotasi kamayadi. Bu molekula spektrida asosiyga nisbatan uzunroq to'lqin uzunliklariga siljigan chiziq hosil qiladi. Agar foton bilan to'qnashgandan so'ng, molekula yuqori energiyali holatdan past energiyali holatga o'tsa, spektrda asosiyga nisbatan qisqaroq to'lqin uzunliklariga siljigan chiziq hosil bo'ladi.
Ramanning tarqalishini o'rganish molekulalarning tuzilishi haqida ma'lumot beradi. Bu usul yordamida molekulalarning tabiiy tebranish chastotalari oson va tez aniqlanadi. Shuningdek, u bizga molekula simmetriyasining tabiatini hukm qilish imkonini beradi.
Luminesans
Agar moddaning molekulalarini o'rtacha kinetik energiyasini oshirmasdan qo'zg'aluvchan holatga keltirish mumkin bo'lsa, ya'ni. isitishsiz, keyin bu jismlarning porlashi yoki luminesans paydo bo'ladi.
Luminesansning ikki turi mavjud: floresans Va fosforessensiya.
Floresans lyuminesans qo'zg'atuvchining harakati tugagandan so'ng darhol to'xtaydigan luminesans deb ataladi.
Floresansiya bilan molekulalarning qo'zg'aluvchan holatdan pastki darajaga o'z-o'zidan o'tishi sodir bo'ladi. Ushbu turdagi porlash juda qisqa davom etadi (taxminan 10 -7 soniya).
Fosforessensiya luminesans qo'zg'atuvchining ta'siridan keyin uzoq vaqt davomida o'zining yorqinligini saqlaydigan luminesans deb ataladi.
Fosforessensiya jarayonida molekula qo'zg'aluvchan holatdan metastabil darajaga o'tadi. Metastabil Bu pastroq darajaga o'tish mumkin bo'lmagan daraja. Emissiya, agar molekula yana hayajonlangan darajaga qaytsa, paydo bo'lishi mumkin.
Metastabil holatdan qo'zg'aluvchan holatga o'tish faqat qo'shimcha qo'zg'alish mavjud bo'lganda mumkin. Bunday qo'shimcha patogen moddaning harorati bo'lishi mumkin. Yuqori haroratlarda bu o'tish tez sodir bo'ladi, past haroratlarda u asta-sekin sodir bo'ladi.
Yuqorida aytib o'tganimizdek, yorug'lik ta'sirida luminesans deyiladi fotoluminesans, elektron bombardimon ta'siri ostida - katodolyuminesans, elektr maydoni ta'sirida - elektroluminesans, kimyoviy transformatsiyalar ta'siri ostida - kimyoluminesans.
Kvant kuchaytirgichlari va radiatsiya generatorlari
Asrimizning 50-yillari o'rtalarida kvant elektronikasining jadal rivojlanishi boshlandi. 1954 yilda SSSRda akademiklar N.G.Basov va A.M.ning asarlari paydo boʻldi. Proxorov, unda santimetr diapazonidagi ultra qisqa radioto'lqinlarning kvant generatori chaqirildi. maser(rag'batlantirilgan nurlanish emissiyasi orqali mikrodasturlarni kuchaytirish). 60-yillarda paydo bo'lgan ko'rinadigan va infraqizil hududlarda yorug'lik generatorlari va kuchaytirgichlari seriyasi deb nomlangan. optik kvant generatorlari yoki lazerlar(rag'batlantirilgan nurlanish emissiyasi orqali yorug'likni kuchaytirish).
Ikkala turdagi qurilmalar ham rag'batlantirilgan yoki ogohlantirilgan nurlanish ta'siriga asoslangan holda ishlaydi.
Keling, ushbu turdagi nurlanishni batafsil ko'rib chiqaylik.
Ushbu turdagi nurlanish elektromagnit to'lqinning to'lqin o'tadigan moddaning atomlari bilan o'zaro ta'siri natijasidir.
Atomlarda yuqori energiya darajasidan quyi darajaga o'tish o'z-o'zidan (yoki o'z-o'zidan) sodir bo'ladi. Biroq, hodisa nurlanishining ta'siri ostida, bunday o'tishlar ham oldinga, ham teskari yo'nalishda mumkin. Bunday o'tishlar deyiladi majbur yoki qo'zg'atilgan. Hayajonlangan darajalardan biridan past energiya darajasiga majburiy o'tish paytida atom o'tish sodir bo'lgan fotonga qo'shimcha bo'lgan foton chiqaradi.
Bunday holda, ushbu fotonning tarqalish yo'nalishi va shunga mos ravishda barcha stimulyatsiya qilingan nurlanish o'tishga sabab bo'lgan tashqi nurlanishning tarqalish yo'nalishiga to'g'ri keladi, ya'ni. rag'batlantirilgan emissiya harakatlantiruvchi emissiya bilan qat'iy muvofiqdir.
Shunday qilib, stimulyatsiya qilingan emissiya natijasida paydo bo'lgan yangi foton muhitdan o'tadigan yorug'likni kuchaytiradi. Biroq, induksiyalangan emissiya bilan bir vaqtda, yorug'likni yutish jarayoni sodir bo'ladi, chunki Harakatlanuvchi foton past energiya darajasida joylashgan atom tomonidan so'riladi va atom yuqori energiya darajasiga o'tadi. Va
Atrof muhitni teskari holatga o'tkazish jarayoni deyiladi pompalanadi muhitni yaxshilash. Qattiq muhitni pompalashning ko'plab usullari mavjud. Ulardan eng oddiyi muhitning optik pompalanishi bo'lib, unda atomlar shunday chastotali yorug'lik nurlanishi orqali quyi darajadan yuqori qo'zg'aluvchan darajaga o'tkaziladi.
Teskari holatga ega bo'lgan muhitda stimulyatsiya qilingan emissiya atomlar tomonidan yorug'likning yutilishidan oshadi, buning natijasida tushayotgan yorug'lik nuri kuchayadi.
Keling, optik diapazonda to'lqin generatori sifatida ishlatiladigan bunday vositadan foydalanadigan qurilmani ko'rib chiqaylik lazer.
 Uning asosiy qismi alyuminiy oksidi bo'lgan sun'iy yoqut kristalli bo'lib, unda ba'zi alyuminiy atomlari xrom atomlari bilan almashtiriladi. Yaqut kristalli to'lqin uzunligi 5600 yorug'lik bilan nurlantirilganda, xrom ionlari yuqori energiya darajasiga o'tadi.
Uning asosiy qismi alyuminiy oksidi bo'lgan sun'iy yoqut kristalli bo'lib, unda ba'zi alyuminiy atomlari xrom atomlari bilan almashtiriladi. Yaqut kristalli to'lqin uzunligi 5600 yorug'lik bilan nurlantirilganda, xrom ionlari yuqori energiya darajasiga o'tadi.
Asosiy holatga qaytish ikki bosqichda sodir bo'ladi. Birinchi bosqichda hayajonlangan ionlar energiyaning bir qismini kristall panjaraga beradi va metastabil holatga kiradi. Ionlar bu darajada yuqori darajaga qaraganda uzoqroq vaqt qoladi. Natijada, metastabil darajadagi teskari holatga erishiladi.
 |
Ionlarning asosiy holatga qaytishi ikkita qizil chiziqning chiqishi bilan birga keladi: va . Bu qaytish bir xil to'lqin uzunligidagi fotonlarning ta'siri ostida ko'chki kabi sodir bo'ladi, ya'ni. rag'batlantirilgan emissiya bilan. Bu qaytish o'z-o'zidan emissiyaga qaraganda ancha tezroq sodir bo'ladi, shuning uchun yorug'lik kuchayadi.
Lazerda ishlatiladigan yoqut diametri 0,5 sm va uzunligi 4-5 sm bo'lgan novda shaklida bo'ladi.Ushbu tayoqning tekis uchlari silliqlangan va kumushlangan bo'lib, ular bir-biriga qaragan ikkita ko'zgu hosil qiladi. ularning shaffofligi. Butun yoqut novda impulsli elektron trubkasi yonida joylashgan bo'lib, u vositani optik ravishda pompalash uchun ishlatiladi. Harakat yo'nalishlari yoqut o'qi bilan kichik burchaklarni tashkil etuvchi fotonlar uning uchlaridan bir nechta aks ettirishni boshdan kechiradilar.
Shuning uchun ularning kristalldagi yo'li juda uzun bo'ladi va bu yo'nalishdagi fotonlar kaskadlari eng katta rivojlanishni oladi.
Boshqa yo'nalishlarda o'z-o'zidan chiqarilgan fotonlar kristallning yon yuzasi orqali keyingi nurlanishni keltirib chiqarmasdan chiqib ketadi.
Eksenel nur etarlicha kuchli bo'lganda, uning bir qismi kristallning shaffof uchi orqali tashqariga chiqadi.
Kristal ichida katta miqdorda issiqlik hosil bo'ladi. Shuning uchun uni intensiv sovutish kerak.
Lazer nurlanishi bir qator xususiyatlarga ega. U quyidagilar bilan tavsiflanadi:
1. vaqt va fazoviy muvofiqlik;
2. qat'iy monoxromatik;
3. yuqori quvvat;
4. nurning torligi.
Radiatsiyaning yuqori kogerentliligi lazerlarni radioaloqa uchun, xususan, koinotdagi yoʻnalishli radioaloqa uchun qoʻllash uchun keng istiqbollarni ochadi. Agar yorug'likni modulyatsiya qilish va demodulyatsiya qilish usuli topilsa, juda katta hajmdagi ma'lumotlarni uzatish mumkin bo'ladi. Shunday qilib, uzatiladigan axborot hajmi bo'yicha bitta lazer Qo'shma Shtatlarning sharqiy va g'arbiy qirg'oqlari o'rtasidagi butun aloqa tizimini almashtirishi mumkin edi.
Lazer nurlarining burchak kengligi shunchalik kichikki, teleskopik fokuslash yordamida oy yuzasida diametri 3 km bo'lgan yorug'lik nuqtasini olish mumkin. Nurning yuqori quvvati va torligi linzalardan foydalangan holda fokuslashda quyosh nuriga qaratilishi mumkin bo'lgan energiya oqimining zichligidan 1000 baravar yuqori energiya oqimining zichligini olish imkonini beradi. Bunday yorug'lik nurlari ishlov berish va payvandlashda, kimyoviy reaktsiyalarning borishiga ta'sir qilishda va hokazolarda ishlatilishi mumkin.
Yuqoridagilar lazerning barcha imkoniyatlarini tugatmaydi. Bu butunlay yangi turdagi yorug'lik manbai va uni qo'llashning barcha mumkin bo'lgan sohalarini tasavvur qilish hali ham qiyin.
MOLEKULAR SPEKTRA, elektromagnit emissiya va yutilish spektrlari. radiatsiya va kombinatsiya erkin yoki kuchsiz bog'langan molekulalarga tegishli yorug'likning tarqalishi. Ular spektrning rentgen, UV, ko'rinadigan, IQ va radio to'lqinlari (shu jumladan, mikroto'lqinli) hududlarida chiziqlar (chiziqlar) to'plamiga o'xshaydi. Emissiya spektrlari (emissiya molekulyar spektrlari) va yutilish (yutilish molekulyar spektrlari)dagi chiziqlar (chiziqlar) holati v chastotalar (to'lqin uzunliklari l = c/v, bu erda c - yorug'lik tezligi) va to'lqin raqamlari = 1 bilan tavsiflanadi. /l; u E" va E energiyalari orasidagi farq bilan aniqlanadi: molekulaning kvant o'tish sodir bo'lgan holatlari:
![]()
(h-Plank doimiysi). Kombinatsiya bilan Tarqalishda hv qiymati hodisa va tarqoq fotonlarning energiyalari farqiga teng. Bantlar (chiziqlar) intensivligi ma'lum turdagi molekulalarning soni (kontsentratsiyasi), E" va E energiya darajalari populyatsiyasi: va mos keladigan o'tish ehtimoli bilan bog'liq.
Radiatsiyaning emissiyasi yoki yutilishi bilan o'tish ehtimoli birinchi navbatda elektr matritsa elementining kvadrati bilan belgilanadi. o'tish dipol momenti va aniqroq hisobga olgan holda - magnit matritsa elementlarining kvadratlari bilan. va elektr molekulaning kvadrupol momentlari (qarang Kvant oʻtishlari). Kombinatsiya bilan Yorug'likning tarqalishida o'tish ehtimoli molekulaning induksiyalangan o'tish dipol momentining matritsa elementi bilan bog'liq, ya'ni. molekulaning qutblanish qobiliyatining matritsa elementi bilan.
Shartlar aytadi. O'zaro o'tishlari ma'lum molekulyar spektrlar shaklida namoyon bo'ladigan tizimlar boshqa tabiatga ega va energiya jihatidan juda farq qiladi. Muayyan turdagi energiya darajalari bir-biridan uzoqda joylashganki, o'tish paytida molekula yuqori chastotali nurlanishni yutadi yoki chiqaradi. Boshqa tabiatning darajalari orasidagi masofa kichik va ba'zi hollarda tashqi bo'lmaganda. maydon darajalari birlashadi (degeneratsiya). Kichik energiya farqlarida past chastotali mintaqada o'tishlar kuzatiladi. Masalan, ayrim elementlar atomlarining yadrolari o'ziga xos xususiyatlarga ega. mag. moment va elektr spin bilan bog'liq bo'lgan to'rt kutupli moment. Elektronlar ham magnitga ega ularning aylanishi bilan bog'liq moment. Tashqi yo'qligida magnit orientatsiya maydonlari momentlar o'zboshimchalik bilan, ya'ni. ular kvantlangan emas va tegishli energiyalar. davlatlar degeneratsiyaga uchragan. Tashqi qo'llashda doimiy magnit maydon, degeneratsiya ko'tariladi va energiya darajalari orasidagi o'tishlar mumkin, spektrning radiochastota hududida kuzatiladi. Shunday qilib, NMR va EPR spektrlari paydo bo'ladi (qarang: Yadro magnit rezonansi, Elektron paramagnit rezonansi).
Kinetik taqsimot mol chiqaradigan elektronlarning energiyalari. tizimlar rentgen nurlari yoki qattiq UV nurlari bilan nurlanish natijasida rentgen nurlarini beradispektroskopiya va fotoelektron spektroskopiya. Qo'shimcha iskaladagi jarayonlar Dastlabki qo'zg'alishdan kelib chiqqan tizim boshqa spektrlarning paydo bo'lishiga olib keladi. Shunday qilib, Auger spektrlari bo'shashish natijasida paydo bo'ladi. elektronni tashqi tomondan tortib olish k.-l ning qobiqlari. bo'sh bo'lgan ichki uchun atom qobiq va chiqarilgan energiya o'zgaradi. kinetikda boshqa elektronning energiyasi ext. atom tomonidan chiqarilgan qobiq. Bunda neytral molekulaning ma'lum holatidan mol holatiga kvant o'tish sodir bo'ladi. ion (qarang Auger spektroskopiyasi).
An'anaga ko'ra, faqat optik spektrlar bilan bog'liq spektrlar tegishli molekulyar spektrlar sifatida tasniflanadi. uchta asosiy bilan bog'liq bo'lgan molekulaning elektron-vibratsiyali-aylanuvchi, energiya darajalari o'rtasidagi o'tishlar. energiya turlari molekula darajalari - elektron E el, tebranish E soni va aylanish E bp, ichki uch turdagi mos keladi. molekulada harakat. Berilgan elektron holatdagi molekulaning muvozanat konfiguratsiyasining energiyasi Eel sifatida qabul qilinadi. Molekulaning mumkin bo'lgan elektron holatlari to'plami uning elektron qobig'i va simmetriyasining xususiyatlari bilan belgilanadi. Tebranish molekuladagi yadrolarning har bir elektron holatdagi muvozanat holatiga nisbatan harakatlari bir necha tebranishlar uchun kvantlanadi. erkinlik darajalari, murakkab tebranishlar tizimi hosil bo'ladi. energiya darajalari E hisoblanadi. Molekulaning bir butun sifatida bog'langan yadrolarning qattiq tizimi sifatida aylanishi aylanish bilan tavsiflanadi. aylanishni hosil qiluvchi kvantlangan harakat miqdori momenti. holatlar (aylanish energiya darajalari) E vaqt. Odatda, elektron o'tishlarning energiyasi bir necha tartibda bo'ladi. eV, tebranish - 10 -2 ... 10 -1 eV, aylanish - 10 -5 ... 10 -3 eV.
Emissiya, yutilish yoki kombinatsiyalar bilan qaysi energiya darajalariga o'tish sodir bo'lishiga qarab. elektromagnit tarqalish radiatsiya - elektron, tebranish. yoki aylanish, elektron, tebranishlar mavjud. va aylanma molekulyar spektrlar. Elektron spektrlar, Tebranish spektrlari, Aylanma spektrlar maqolalarida molekulalarning tegishli holatlari, kvant oʻtishlarini tanlash qoidalari, mol. spektroskopiya, shuningdek molekulalarning qanday xususiyatlaridan foydalanish mumkin. molekulyar spektrlardan olingan: elektron holatlarning xossalari va simmetriyasi, tebranishlar. konstantalar, dissotsilanish energiyasi, molekulaning simmetriyasi, aylanish. konstantalar, inersiya momentlari, geom. parametrlar, elektr dipol momentlari, strukturaviy ma'lumotlar va ichki kuch maydonlari va boshqalar. Ko'rinadigan va UV hududlaridagi elektron yutilish va luminesans spektrlari taqsimot haqida ma'lumot beradi.
Spektr atomlar va molekulalarning bir energetik holatdan ikkinchisiga oʻtishida modda tomonidan soʻrilgan, chiqarilgan, sochilgan yoki aks ettirilgan elektromagnit nurlanishning energiya kvantlarining ketma-ketligi.
Yorug'likning materiya bilan o'zaro ta'sir qilish xususiyatiga ko'ra spektrlarni yutilish spektrlariga bo'lish mumkin; emissiya (emissiya); tarqalish va aks ettirish.
O'rganilayotgan ob'ektlar uchun optik spektroskopiya, ya'ni. 10 -3 ÷10 -8 to'lqin uzunligi oralig'ida spektroskopiya m atomik va molekulyarga bo'linadi.
Atom spektri o'rni elektronning bir darajadan ikkinchi darajaga o'tish energiyasi bilan belgilanadigan chiziqlar ketma-ketligidir.
Atom energiyasi Translatsiya harakati va elektron energiyaning kinetik energiyasi yig'indisi sifatida ifodalanishi mumkin:
qaerda chastota, to'lqin uzunligi, to'lqin raqami, yorug'lik tezligi, Plank doimiysi.
Atomdagi elektronning energiyasi bosh kvant sonining kvadratiga teskari proportsional bo'lganligi sababli, atom spektridagi chiziq uchun tenglama yozilishi mumkin:
 . .
| (4.12) |
Bu yerga  - yuqori va quyi darajadagi elektron energiyalari; - Ridberg doimiysi;
- yuqori va quyi darajadagi elektron energiyalari; - Ridberg doimiysi;  - to'lqin sonlari birliklarida ifodalangan spektral atamalar (m -1, sm -1).
- to'lqin sonlari birliklarida ifodalangan spektral atamalar (m -1, sm -1).
Atom spektrining barcha chiziqlari qisqa to'lqinli mintaqada atomning ionlanish energiyasi bilan belgilanadigan chegaraga yaqinlashadi, shundan so'ng uzluksiz spektr mavjud.
Molekula energiyasi Birinchi taxminga ko'ra, u tarjima, aylanish, tebranish va elektron energiyalarning yig'indisi sifatida ko'rib chiqilishi mumkin:
 | (4.15) |
Ko'pgina molekulalar uchun bu shart qondiriladi. Masalan, 291 K da H 2 uchun jami energiyaning alohida komponentlari kattalik yoki undan ko'p tartib bilan farqlanadi:
309,5 kJ/mol,
 =25,9 kJ/mol,
=25,9 kJ/mol,
2,5 kJ/mol,
 =3,8 kJ/mol.
=3,8 kJ/mol.
Spektrning turli mintaqalaridagi kvantlarning energiya qiymatlari 4.2-jadvalda taqqoslanadi.
4.2-jadval - Molekulalarning optik spektrining turli mintaqalarining so'rilgan kvantlarining energiyasi
"Yadrolarning tebranishlari" va "molekulalarning aylanishi" tushunchalari nisbiydir. Haqiqatda, bunday harakat turlari kosmosda yadrolarning tarqalishi haqidagi g'oyalarni faqat taxminan etkazadi, bu elektronlarning tarqalishi bilan bir xil ehtimollik xususiyatiga ega.
Ikki atomli molekula holatidagi energiya darajalarining sxematik tizimi 4.1-rasmda keltirilgan.
Aylanma energiya darajalari orasidagi o'tish uzoq-IR va mikroto'lqinli hududlarda aylanish spektrlarining paydo bo'lishiga olib keladi. Xuddi shu elektron darajadagi tebranish darajalari o'rtasidagi o'tishlar IR yaqinidagi mintaqada tebranish-aylanish spektrlarini beradi, chunki tebranish kvant sonining o'zgarishi muqarrar ravishda aylanma kvant sonining o'zgarishiga olib keladi. Nihoyat, elektron darajalar orasidagi o'tishlar ko'rinadigan va UV hududlarida elektron-vibratsiyali-aylanma spektrlarning paydo bo'lishiga olib keladi.
Umumiy holatda, o'tishlar soni juda katta bo'lishi mumkin, lekin aslida ularning hammasi ham spektrlarda ko'rinmaydi. O'tishlar soni cheklangan tanlash qoidalari .
Molekulyar spektrlar juda ko'p ma'lumot beradi. Ulardan foydalanish mumkin:
Sifatli tahlilda moddalarni aniqlash uchun, chunki har bir moddaning o'ziga xos spektri bor;
Miqdoriy tahlil uchun;
Strukturaviy guruh tahlili uchun, chunki >C=O, _ NH 2, _ OH va boshqalar kabi ayrim guruhlar spektrlarda xarakterli chiziqlar beradi;
Molekulalarning energiya holatlari va molekulyar xarakteristikalarini (yadrolararo masofa, inersiya momenti, tabiiy tebranish chastotalari, dissotsilanish energiyalari) aniqlash; molekulyar spektrlarni har tomonlama o'rganish molekulalarning fazoviy tuzilishi haqida xulosa chiqarish imkonini beradi;
Kinetik tadqiqotlarda, shu jumladan juda tez reaktsiyalarni o'rganish uchun.

 - elektron darajalarning energiyasi;
- elektron darajalarning energiyasi;
Vibratsiya darajasining energiyasi;
Aylanish darajalarining energiyalari
4.1-rasm – Ikki atomli molekulaning energiya darajalarining sxematik joylashuvi
Bouger-Lambert-Beer qonuni
Molekulyar spektroskopiya yordamida miqdoriy molekulyar tahlilning asosi Bouger-Lambert-Beer qonuni , tushayotgan va o'tadigan yorug'lik intensivligini yutuvchi qatlamning kontsentratsiyasi va qalinligi bilan bog'lash (4.2-rasm):
yoki mutanosiblik omili bilan:
Integratsiya natijasi:
 | (4.19) |
 . .
| (4.20) |
Qachonki, tushayotgan yorug'likning intensivligi kattalik tartibida kamayadi
 . .
| (4.21) |
Agar =1 mol/l bo'lsa, u holda, ya'ni. Yutish koeffitsienti qatlamning o'zaro qalinligiga teng bo'lib, unda 1 ga teng konsentratsiyada tushayotgan yorug'likning intensivligi kattalik tartibida kamayadi.
Yutish koeffitsientlari va to'lqin uzunligiga bog'liq. Ushbu bog'liqlik turi molekulalarning o'ziga xos "barmoq izi" bo'lib, u moddani aniqlash uchun sifat tahlilida qo'llaniladi. Bu bog'liqlik ma'lum bir modda uchun xarakterli va individualdir va molekulaga kiritilgan xarakterli guruhlar va bog'lanishlarni aks ettiradi.
Optik zichlik D
% sifatida ifodalangan
4.2.3 Qattiq rotator yaqinlashuvida ikki atomli molekulaning aylanish energiyasi. Molekulalarning aylanish spektrlari va ularning molekulyar xarakteristikalarni aniqlashda qo‘llanilishi
Aylanma spektrlarning ko'rinishi molekulaning aylanish energiyasi kvantlanganligi bilan bog'liq, ya'ni.
| 0 |
| A |
Nuqtaidan beri O molekulaning og'irlik markazi bo'lsa, u holda:
Qisqartirilgan massa belgilarini joriy qilish:
 | (4.34) |
tenglamaga olib keladi
 . .
| (4.35) |
Shunday qilib, ikki atomli molekula (4.7-rasm). A), o'q atrofida aylanadigan yoki og'irlik markazidan o'tib, nuqta atrofida radiusli doirani tasvirlab, massali zarracha sifatida ko'rib chiqilishi uchun soddalashtirilishi mumkin. O(4.7-rasm b).
Molekulaning o'q atrofida aylanishi amalda nolga teng bo'lgan inersiya momentini beradi, chunki atomlarning radiuslari yadrolararo masofadan ancha kichikdir. Molekulaning bog'lanish chizig'iga o'zaro perpendikulyar yoki o'qlari atrofida aylanish teng kattalikdagi inersiya momentlariga olib keladi:
bu yerda faqat butun qiymatlarni qabul qiluvchi aylanma kvant soni
0, 1, 2…. Ga muvofiq aylanish spektri uchun tanlash qoidasi diatomik molekulaning energiya kvantini yutishda aylanma kvant sonining o'zgarishi faqat bitta tomonidan mumkin, ya'ni.
(4.37) tenglamani quyidagi shaklga aylantiradi:
 20
20  12
12  6
6  2
2  |
dan o'tish paytida kvantning yutilishiga mos keladigan aylanish spektridagi chiziqning to'lqin raqami j har bir daraja uchun energiya darajasi j+1, tenglama yordamida hisoblanishi mumkin:
Shunday qilib, qattiq rotator modelining yaqinlashuvidagi aylanish spektri bir-biridan bir xil masofada joylashgan chiziqlar tizimidir (4.5b-rasm). Qattiq rotator modelida hisoblangan diatomik molekulalarning aylanish spektrlariga misollar 4.6-rasmda keltirilgan.
| A b |


4.6-rasm – Aylanma spektrlar HF (A) Va CO(b)
Vodorod galogenid molekulalari uchun bu spektr spektrning uzoq IQ mintaqasiga, og'irroq molekulalar uchun - mikroto'lqinli pechga o'tkaziladi.
Ikki atomli molekulaning aylanish spektrining paydo bo'lishining olingan naqshlariga asoslanib, amalda birinchi navbatda spektrdagi qo'shni chiziqlar orasidagi masofa aniqlanadi, keyin ular topiladi va tenglamalar yordamida:
 , ,
| (4.45) |
Qaerda - markazdan qochma buzilish konstantasi
, aylanish konstantasi bilan taxminiy munosabat bilan bog'langan  . Tuzatish faqat juda katta uchun hisobga olinishi kerak j.
. Tuzatish faqat juda katta uchun hisobga olinishi kerak j.
Ko'p atomli molekulalar uchun, odatda, uch xil inertsiya momenti mumkin  . Agar molekulada simmetriya elementlari mavjud bo'lsa, inersiya momentlari mos kelishi yoki hatto nolga teng bo'lishi mumkin. Masalan, chiziqli ko'p atomli molekulalar uchun(CO 2, OCS, HCN va boshqalar)
. Agar molekulada simmetriya elementlari mavjud bo'lsa, inersiya momentlari mos kelishi yoki hatto nolga teng bo'lishi mumkin. Masalan, chiziqli ko'p atomli molekulalar uchun(CO 2, OCS, HCN va boshqalar)
Qayerda  - aylanma o'tishga mos keladigan chiziqning pozitsiyasi
- aylanma o'tishga mos keladigan chiziqning pozitsiyasi  izotopik almashtirilgan molekulada.
izotopik almashtirilgan molekulada.
Chiziqning izotopik siljishining kattaligini hisoblash uchun izotopning atom massasining o'zgarishini, inersiya momentini, aylanish doimiyligini va pozitsiyasini hisobga olgan holda izotopik almashtirilgan molekulaning kamaytirilgan massasini ketma-ket hisoblash kerak. mos ravishda (4.34), (4.35), (4.39) va (4.43) tenglamalar bo'yicha molekula spektridagi chiziq chizig'ini yoki izotopik almashtirilgan va bo'lmagan bir xil o'tishga mos keladigan chiziqlar to'lqin raqamlarining nisbatini baholang. -izotopik almashtirilgan molekulalar, so'ngra (4.50) tenglama yordamida izotop siljishining yo'nalishi va kattaligini aniqlang. Agar yadrolararo masofa taxminan doimiy hisoblansa  , u holda to'lqin raqamlarining nisbati kamaytirilgan massalarning teskari nisbatiga to'g'ri keladi:
, u holda to'lqin raqamlarining nisbati kamaytirilgan massalarning teskari nisbatiga to'g'ri keladi:
bu yerda zarrachalarning umumiy soni, boshiga zarrachalar soni i- haroratdagi energiya darajasi T, k- Boltsman doimiysi, - statistik ve kuch degeneratsiya darajasi i-bu energiya darajasining, ma'lum darajada zarrachalarni topish ehtimolini tavsiflaydi.
Aylanish holati uchun aholi darajasi odatda zarrachalar sonining nisbati bilan tavsiflanadi j- energiya darajasi nol darajadagi zarrachalar soniga:
 , ,
| (4.53) |
Qayerda  - statistik og'irlik j-aylanma energiya darajasi, aylanuvchi molekula impulsining o'z o'qiga - molekulaning aloqa chizig'iga proyeksiyalari soniga to'g'ri keladi;
- statistik og'irlik j-aylanma energiya darajasi, aylanuvchi molekula impulsining o'z o'qiga - molekulaning aloqa chizig'iga proyeksiyalari soniga to'g'ri keladi;  , nol aylanish darajasidagi energiya
, nol aylanish darajasidagi energiya  . Funktsiya oshgani sayin maksimaldan o'tadi j, misol sifatida CO molekulasi yordamida 4.7-rasmda ko'rsatilgan.
. Funktsiya oshgani sayin maksimaldan o'tadi j, misol sifatida CO molekulasi yordamida 4.7-rasmda ko'rsatilgan.
Funktsiyaning ekstremumi maksimal nisbiy populyatsiyaga ega darajaga to'g'ri keladi, uning kvant sonining qiymati funktsiyaning ekstremumdagi hosilasini aniqlagandan so'ng olingan tenglama yordamida hisoblanishi mumkin:
 . .
| (4.54) |


Shakl 4.7 - Aylanma energiya darajalarining nisbiy populyatsiyasi
molekulalar CO 298 va 1000 K haroratlarda
Misol. HI aylanish spektrida qo'shni chiziqlar orasidagi masofa aniqlanadi  sm -1. Molekuladagi aylanish konstantasini, inersiya momentini va yadrolararo muvozanat masofasini hisoblang.
sm -1. Molekuladagi aylanish konstantasini, inersiya momentini va yadrolararo muvozanat masofasini hisoblang.
Yechim
Qattiq rotator modelining yaqinlashuvida (4.45) tenglamaga muvofiq, biz aylanish konstantasini aniqlaymiz:
 sm -1.
sm -1.
Molekulaning inersiya momenti (4.46) tenglama yordamida aylanish konstantasining qiymatidan hisoblanadi:
 kg . m 2.
kg . m 2.
Muvozanat yadrolararo masofani aniqlash uchun vodorod yadrolarining massalarini hisobga olgan holda (4.47) tenglamadan foydalanamiz.  va yod
va yod  kg da ifodalangan:
kg da ifodalangan:
Misol. 1 H 35 Cl spektrining uzoq IQ mintaqasida to'lqin raqamlari bo'lgan chiziqlar aniqlandi:
Molekulaning inertsiya momenti va yadrolararo masofasining o'rtacha qiymatlarini aniqlang. Spektrdagi kuzatilgan chiziqlarni aylanma o'tishlarga bog'lang.
Yechim
Qattiq rotator modeliga ko'ra, aylanish spektrining qo'shni chiziqlaridagi to'lqin raqamlaridagi farq doimiy va 2 ga teng. Spektrdagi qo'shni chiziqlar orasidagi masofalarning o'rtacha qiymatidan aylanish konstantasini aniqlaymiz:
![]() sm -1,
sm -1,
 sm -1
sm -1
Molekulaning inersiya momentini topamiz ((4.46) tenglama):
Biz vodorod yadrolarining massalarini hisobga olib, yadrolararo muvozanat masofasini hisoblaymiz ((4.47) tenglama).  va xlor
va xlor  (kg bilan ifodalangan):
(kg bilan ifodalangan):
(4.43) tenglamadan foydalanib, biz 1 H 35 Cl aylanish spektridagi chiziqlar o'rnini baholaymiz:
Keling, chiziqlarning to'lqin raqamlarining hisoblangan qiymatlarini eksperimental qiymatlar bilan taqqoslaylik. Ma'lum bo'lishicha, 1 H 35 Cl aylanish spektrida kuzatilgan chiziqlar o'tishlarga mos keladi:
| N qator | |||||||
| , sm -1 | 85.384 | 106.730 | 128.076 | 149.422 | 170.768 | 192.114 | 213.466 |
 | 3 4 | 4 5 | 5 6 | 6 7 | 7 8 | 8 9 | 9 10 |
Misol. bilan o'tishga mos keladigan yutilish chizig'ining izotopik siljishining kattaligi va yo'nalishini aniqlang.  xlor atomi 37 Cl izotopi bilan almashtirilganda 1 H 35 Cl molekulasining aylanish spektridagi energiya darajasi. 1 H 35 Cl va 1 H 37 Cl molekulalaridagi yadrolararo masofa bir xil deb hisoblanadi.
xlor atomi 37 Cl izotopi bilan almashtirilganda 1 H 35 Cl molekulasining aylanish spektridagi energiya darajasi. 1 H 35 Cl va 1 H 37 Cl molekulalaridagi yadrolararo masofa bir xil deb hisoblanadi.
Yechim
O'tishga mos keladigan chiziqning izotopik siljishining kattaligini aniqlash  , biz 1 H 37 Cl molekulasining kamaytirilgan massasini 37 Cl atom massasining o'zgarishini hisobga olgan holda hisoblaymiz:
, biz 1 H 37 Cl molekulasining kamaytirilgan massasini 37 Cl atom massasining o'zgarishini hisobga olgan holda hisoblaymiz:
Keyin biz inersiya momentini, aylanish doimiyligini va chiziqning holatini hisoblaymiz  1 H 37 Cl molekulasining spektrida va mos ravishda (4.35), (4.39), (4.43) va (4.50) tenglamalarga muvofiq izotop siljish qiymati.
1 H 37 Cl molekulasining spektrida va mos ravishda (4.35), (4.39), (4.43) va (4.50) tenglamalarga muvofiq izotop siljish qiymati.
Aks holda, izotopik siljish molekulalardagi bir xil o'tishga mos keladigan chiziqlarning to'lqin raqamlari nisbati (yadrolararo masofani doimiy deb hisoblaymiz) va keyin (4.51) tenglamadan foydalanib, chiziqning spektrdagi holatidan baholanishi mumkin.
1 H 35 Cl va 1 H 37 Cl molekulalari uchun ma'lum bir o'tishning to'lqin raqamlarining nisbati quyidagilarga teng:

Izotopik almashtirilgan molekula chizig'ining to'lqin raqamini aniqlash uchun biz oldingi misolda topilgan o'tish to'lqini sonining qiymatini almashtiramiz. j → j+1 (3→4):
Biz xulosa qilamiz: past chastotali yoki uzun to'lqinli mintaqaga izotopik siljish
85,384-83,049=2,335 sm -1.
Misol. 1 H 35 Cl molekulasining aylanish spektrining eng qizg'in spektral chizig'ining to'lqin raqami va to'lqin uzunligini hisoblang. Chiziqni mos keladigan aylanish o'tish bilan moslang.
Yechim
Molekulaning aylanish spektridagi eng qizg'in chiziq aylanish energiyasi darajasining maksimal nisbiy populyatsiyasi bilan bog'liq.
Oldingi misolda topilgan aylanish konstantasining qiymatini 1 H 35 Cl ga almashtirish (  sm -1) tenglamaga (4.54) ushbu energiya darajasining sonini hisoblash imkonini beradi:
sm -1) tenglamaga (4.54) ushbu energiya darajasining sonini hisoblash imkonini beradi:
 .
.
Ushbu darajadan aylanma o'tishning to'lqin raqami (4.43) tenglama yordamida hisoblanadi:
(4.11) tenglamadan o'tish to'lqin uzunligini quyidagilarga nisbatan o'zgartirilgan holda topamiz:
4.2.4 Ko'p o'lchovli topshiriq No 11 "Ikki atomli molekulalarning aylanish spektrlari"
1. Qattiq aylantiruvchi sifatida ikki atomli molekulaning aylanish harakati energiyasini hisoblash uchun kvant mexanik tenglamasini yozing.
2. Ikki atomli molekulaning qo'shni, yuqori kvant darajasiga o'tishida qattiq rotator sifatidagi aylanish energiyasining o'zgarishini hisoblash uchun tenglamani tuzing.  .
.
3. Ikki atomli molekulaning yutilish spektridagi aylanish chiziqlarining to’lqin sonining aylanma kvant soniga bog’liqligi tenglamasini tuzing.
4. Ikki atomli molekulaning aylanish yutilish spektridagi qo'shni chiziqlarning to'lqinlar sonlari farqini hisoblash uchun tenglamani tuzing.
5. Ikki atomli molekulaning aylanish konstantasini (sm -1 va m -1 da) hisoblang. A molekulaning aylanish yutilish spektrining uzun to'lqinli infraqizil hududida joylashgan ikkita qo'shni chiziqning to'lqin raqamlari bo'yicha (4.3-jadvalga qarang).
6. Molekulaning aylanish energiyasini aniqlang A dastlabki besh kvant aylanish darajasida (J).
7. Ikki atomli molekulaning qattiq rotator sifatidagi aylanish harakatining energiya darajalarini sxematik tarzda chizing.
8. Ushbu diagrammada qattiq rotator bo'lmagan molekulaning aylanish kvant darajalarini nuqta chiziq bilan chizing.
9. Aylanma yutilish spektridagi qo'shni chiziqlarning to'lqinlar sonlari farqi asosida muvozanat yadrolararo masofani hisoblash uchun tenglamani tuzing.
10. Ikki atomli molekulaning inersiya momentini (kg. m2) aniqlang. A.
11. Molekulaning kamaytirilgan massasini (kg) hisoblang A.
12. Molekulaning yadrolararo muvozanat masofasini () hisoblang A. Olingan qiymatni mos yozuvlar ma'lumotlari bilan solishtiring.
13. Molekulaning aylanish spektridagi kuzatilgan chiziqlarni belgilang A aylanma o'tishlarga.
14. Darajadan aylanish o'tishiga mos keladigan spektral chiziqning to'lqin raqamini hisoblang j molekula uchun A(4.3-jadvalga qarang).
15. Izotopik almashtirilgan molekulaning kamaytirilgan massasini (kg) hisoblang. B.
16. Darajadan aylanma o'tish bilan bog'liq bo'lgan spektral chiziqning to'lqin sonini hisoblang j molekula uchun B(4.3-jadvalga qarang). Molekulalardagi yadrolararo masofalar A Va B teng deb hisoblang.
17. Molekulalarning aylanish spektrlarida izotop siljishining kattaligi va yo‘nalishini aniqlang. A Va B aylanish darajasiga o'tishga mos keladigan spektral chiziq uchun j.
18. Molekulaning aylanish energiyasi ortishi bilan yutilish chiziqlari intensivligining monoton bo‘lmagan o‘zgarishi sababini tushuntiring.
19. Eng yuqori nisbiy populyatsiyaga mos keladigan aylanish darajasining kvant sonini aniqlang. Molekulalarning aylanish spektrlarining eng qizg'in spektral chiziqlarining to'lqin uzunliklarini hisoblang A Va B.
Alohida atomlarning nurlanishiga mos keladigan spektrlardan tashqari, butun molekulalar chiqaradigan spektrlar ham kuzatiladi (§ 61). Molekulyar spektrlar tuzilishi jihatidan atom spektrlariga qaraganda ancha xilma-xil va murakkabroqdir. Bu erda atomlarning spektral qatoriga o'xshash, lekin boshqa chastota qonuniga ega bo'lgan va ular uzluksiz bandlarga birikadigan juda yaqin joylashgan chiziqlar bilan siqilgan chiziqlar ketma-ketligi kuzatiladi (279-rasm). Ushbu spektrlarning o'ziga xos xususiyati tufayli ular chiziqli deb ataladi.
Guruch. 279. Chiziqli spektr
Shu bilan birga, bir qarashda, har qanday naqshlarni o'rnatish qiyin bo'lgan, bir xil masofada joylashgan spektral chiziqlar ketma-ketligi va nihoyat, ko'p chiziqli spektrlar kuzatiladi (280-rasm). Shuni ta'kidlash kerakki, vodorod spektrini o'rganishda biz doimo atom spektrida Ha molekulyar spektrining superpozitsiyasiga ega bo'lamiz va alohida vodorod atomlari chiqaradigan chiziqlarning intensivligini oshirish uchun maxsus choralar ko'rish kerak.

Guruch. 280. Vodorodning molekulyar spektri
Kvant nuqtai nazaridan, atom spektrlarida bo'lgani kabi, molekula bir turg'un energiya darajasidan ikkinchisiga o'tganda molekulyar spektrning har bir chizig'i chiqariladi. Ammo molekula holatida statsionar holatning energiyasi bog'liq bo'lgan yana ko'p omillar mavjud.
Ikki atomli molekulaning eng oddiy holatida energiya uch qismdan iborat: 1) molekulaning elektron qobig'ining energiyasi; 2) molekulani tashkil etuvchi atomlar yadrolarining ularni tutashtiruvchi to‘g‘ri chiziq bo‘ylab tebranish energiyasi; 3) yadrolarning umumiy massa markazi atrofida aylanish energiyasi. Har uch turdagi energiya kvantlangan, ya'ni ular faqat diskret qiymatlar qatorini qabul qilishi mumkin. Molekulaning elektron qobig'i molekulani tashkil etuvchi atomlarning elektron qobiqlarining birlashishi natijasida hosil bo'ladi. Cheklovchi holat sifatida molekulalarning energiya elektron holatlarini ko'rish mumkin
molekulani tashkil etuvchi atomlarning atomlararo o'zaro ta'siridan kelib chiqqan juda kuchli Stark effekti. Atomlarni molekulalarga bog'laydigan kuchlar sof elektrostatik xususiyatga ega bo'lsa-da, kimyoviy bog'lanishni to'g'ri tushunish faqat zamonaviy to'lqin-mexanik kvant nazariyasi doirasida mumkin bo'ldi.
Ikki xil molekula mavjud: gomeopolar va geteropolyar. Yadrolar orasidagi masofa ortishi bilan gomeopolyar molekulalar neytral qismlarga parchalanadi. Gemopolyar molekulalarga molekulalar kiradi.Geteropolyar molekulalar yadrolar orasidagi masofa ortishi bilan musbat va manfiy ionlarga parchalanadi. Geteropolyar molekulalarning tipik misoli tuzlar molekulalari, masalan, va hokazo (I jild, § 121, 130, 1959; oldingi nashrda, § 115 va 124, va hokazo. II, 19, 22, 1959; yilda); oldingi tahriri § 21 va 24).
Gomeopolyar molekula elektron bulutining energiya holatlari ko'p darajada elektronlarning to'lqin xususiyatlari bilan belgilanadi.
Keling, eng oddiy molekulaning (bir-biridan yaqin masofada joylashgan va "to'siq" bilan ajratilgan ikkita potentsial "teshik" ni ifodalovchi ionlangan vodorod molekulasi) juda qo'pol modelini ko'rib chiqaylik (281-rasm).

Guruch. 281. Ikki potentsial teshik.

Guruch. 282. Uzoq “quduqlar” holatida elektronning to‘lqin funksiyalari.
"Teshiklar" ning har biri molekulani tashkil etuvchi atomlardan birini ifodalaydi. Atomlar orasidagi masofa katta bo'lganligi sababli, ularning har biridagi elektron "quduqlar" ning har biridagi doimiy elektron to'lqinlariga mos keladigan kvantlangan energiya qiymatlariga ega (§ 63). Shaklda. 282, a va b, ajratilgan atomlarda joylashgan elektronlarning holatini tavsiflovchi ikkita bir xil to'lqin funktsiyasi tasvirlangan. Ushbu to'lqin funktsiyalari bir xil energiya darajasiga mos keladi.
Atomlar molekula hosil qilish uchun birlashganda, "teshiklar" orasidagi "to'siq" "shaffof" bo'ladi (§ 63), chunki uning kengligi elektron to'lqin uzunligiga mutanosib bo'ladi. Buning natijasida mavjud
atomlar o'rtasida "to'siq" orqali elektron almashinuvi va elektronning u yoki bu atomga tegishliligi haqida gapirishning ma'nosi yo'q.
To'lqin funksiyasi endi ikkita ko'rinishga ega bo'lishi mumkin: c va d (283-rasm). c holatni taxminan a va b egri chiziqlarni qo'shish natijasi sifatida ko'rish mumkin (282-rasm), holatni a va b o'rtasidagi farq sifatida, lekin c va d holatlarga mos keladigan energiyalar endi bir-biriga to'liq teng emas. Holatning energiyasi holat energiyasidan bir oz kichikdir.Shunday qilib, har bir atom sathidan ikkita molekulyar elektron daraja paydo bo'ladi.

Guruch. 283. Yaqin «quduqlar» holatida elektronning to'lqin funktsiyalari.
Hozirgacha biz bitta elektronga ega bo'lgan vodorod molekulasining ioni haqida gapirdik. Neytral vodorod molekulasi ikkita elektronga ega, bu ularning spinlarining nisbiy pozitsiyalarini hisobga olish zarurligiga olib keladi. Pauli printsipiga ko'ra, parallel spinli elektronlar bir-biridan "qochadi", shuning uchun har bir elektronni topish ehtimoli zichligi shaklga muvofiq taqsimlanadi. 284, a, ya'ni elektronlar ko'pincha yadrolar orasidagi bo'shliqdan tashqarida joylashgan. Shuning uchun parallel spinlar bilan barqaror molekula hosil bo'lmaydi. Aksincha, antiparallel spinlar yadrolar orasidagi bo'shliq ichida har ikkala elektronni topishning eng yuqori ehtimoliga to'g'ri keladi (294-rasm, b). Bunday holda, manfiy elektron zaryad ham musbat yadrolarni o'ziga tortadi va butun tizim bir butun sifatida barqaror molekula hosil qiladi.
Geteropolyar molekulalarda elektron zaryad zichligini taqsimlash sxemasi ancha klassikdir. Elektronlarning ortiqcha qismi yadrolardan birining yonida guruhlangan bo'lsa, ikkinchisining yonida, aksincha, elektronlar etishmasligi mavjud. Shunday qilib, molekulada bir-biriga tortiladigan musbat va manfiy ikkita ion hosil bo'ladi: masalan, va
Molekulalarning elektron holatlarining ramziyligi atom simvolizmi bilan juda ko'p o'xshashliklarga ega. Tabiiyki, molekulada asosiy rolni yadrolarni bog'laydigan o'qning yo'nalishi o'ynaydi. Bu erda atomdagi I ga o'xshash A kvant raqami kiritiladi. Kvant soni molekulaning elektron bulutining hosil bo'lgan orbital impulsining molekula o'qiga proyeksiyasining mutlaq qiymatini tavsiflaydi.
Molekulyar elektron holatlarning qiymatlari va belgilari o'rtasida atomlardagiga o'xshash moslik mavjud (§ 67):

Elektron bulutining hosil bo'lgan spinining molekula o'qiga proyeksiyasining mutlaq qiymati 2 kvant raqami bilan, elektron qobiqning umumiy aylanish momentining proyeksiyasi esa kvant soni bilan tavsiflanadi.
Kvant soni atomning ichki kvant soniga o'xshaydi (§59 va 67).

Guruch. 284. Molekulaning turli nuqtalarida elektronni topish ehtimoli zichligi.
Xuddi atomlar singari, molekulalar hosil bo'lgan orbital impulsga nisbatan hosil bo'lgan spinning turli yo'nalishlari tufayli ko'plikni namoyon qiladi.
Ushbu holatlarni hisobga olgan holda, molekulalarning elektron holatlari quyidagicha yoziladi:
bu erda 5 - hosil bo'lgan spinning qiymati va A kvant sonining turli qiymatlariga mos keladigan belgilardan birini yoki A ni bildiradi. Masalan, vodorod molekulasining normal holati 2 ga, gidroksilning normal holatiga teng. molekula - kislorod molekulasining normal holati. Turli elektron holatlar o'rtasida o'tish paytida quyidagi tanlov qoidalari qo'llaniladi: .
Yadrolarning tebranishlari bilan bog'liq bo'lgan molekulaning tebranish energiyasi yadrolarning to'lqin xususiyatlarini hisobga olgan holda kvantlanadi. Molekuladagi yadrolar kvazelastik kuch bilan bog'langan deb faraz qilsak (zarraning potentsial energiyasi siljish kvadratiga proportsionaldir, § 63), biz Shredinger tenglamasidan tebranishning quyidagi ruxsat etilgan qiymatlarini olamiz. Ushbu tizimning energiyasi (harmonik
osilator):
![]()
bu erda odatdagidek aniqlanadigan yadrolarning tabiiy tebranishlarining chastotasi (I jildi, 1959 yil 57-§; oldingi nashrda § 67):
![]()
yadrolarning kamaytirilgan massasi qayerda; ikkala yadroning massalari; molekulaning kvazelastik konstantasi; ga teng kvant soni Katta massa tufayli chastota spektrning infraqizil hududida yotadi.

Guruch. 285. Molekulaning tebranish energiyasining darajalari.
Kvazielastik konstanta elektron qobiqning konfiguratsiyasiga bog'liq va shuning uchun molekulaning turli elektron holatlari uchun har xil bo'ladi. Bu doimiy kattaroq bo'lsa, molekula qanchalik kuchli bo'lsa, ya'ni kimyoviy bog'lanish kuchliroq bo'ladi.
Formula (3) teng oraliqdagi energiya darajalari tizimiga to'g'ri keladi, ularning orasidagi masofa Aslida, yadro tebranishlarining katta amplitudalarida tiklovchi kuchning Guk qonunidan chetga chiqishi allaqachon ta'sir qila boshlaydi. Natijada energiya darajalari bir-biriga yaqinlashadi (285-rasm). Etarlicha katta amplitudalarda molekula qismlarga ajraladi.
Garmonik osilator uchun faqat chastotadagi yorug'likning emissiyasi yoki yutilishiga to'g'ri keladigan o'tishlarga ruxsat beriladi.
Chastotalar uchun kvant shartiga ko'ra (§ 58), bu holda molekulalarning spektrlarida kuzatiladigan ohanglar paydo bo'lishi kerak.
Tebranish energiyasi molekulaning elektron bulutining energiyasiga nisbatan kichik qo'shimcha hisoblanadi. Yadrolarning tebranishlari har bir elektron sathning tebranish energiyasining turli qiymatlariga mos keladigan yaqin darajalar tizimiga aylanishiga olib keladi (286-rasm). Bu molekulaning energiya darajalari tizimining murakkabligini tugatmaydi.

Guruch. 286. Molekulaning tebranish va elektron energiyasining qo'shilishi.
Shuningdek, molekulyar energiyaning eng kichik komponenti - aylanish energiyasini hisobga olish kerak. Aylanish energiyasining ruxsat etilgan qiymatlari to'lqin mexanikasiga ko'ra, momentni kvantlash printsipiga asoslangan holda aniqlanadi.
To'lqin mexanikasiga ko'ra, har qanday kvantlangan tizimning momenti (§ 59) ga teng
![]()
Bunday holda, o'rnini bosadi va 0, 1, 2, 3 va boshqalarga teng bo'ladi.
Oldingi aylanuvchi jismning kinetik energiyasi. ed. § 42) bo'ladi
![]()
bu erda inersiya momenti, co - aylanishning burchak tezligi.
Ammo, boshqa tomondan, moment teng bo'ladi, shuning uchun biz quyidagilarni olamiz:
yoki (5) ifodasini almashtirib, nihoyat topamiz:
![]()
Shaklda. 287 molekulaning aylanish darajalarini ko'rsatadi; tebranish va atom darajalaridan farqli o'laroq, aylanish darajalari orasidagi masofa aylanish darajalari orasidagi o'tishning ortishi bilan ortadi va chastotali chiziqlar chiqariladi.
![]()
Bu erda Evrash mos keladi
Formula (9) chastotalar uchun berilgan

Guruch. 287. Molekulaning aylanish energiyasining darajalari.
Biz spektrning uzoq infraqizil qismida yotadigan teng masofali spektral chiziqlarni olamiz. Bu chiziqlarning chastotalarini o'lchash molekulaning inersiya momentini aniqlash imkonini beradi.Ma'lum bo'lishicha, molekulalarning inersiya momentlari kattalik tartibida bo'ladi.Shuni ta'kidlash kerakki, inersiya momenti I ning o'zi harakat
markazdan qochma kuchlar molekulaning aylanish tezligi oshishi bilan ortadi. Aylanishlarning mavjudligi har bir tebranish energiyasi darajasining aylanish energiyasining turli qiymatlariga mos keladigan bir qator yaqin pastki darajalarga bo'linishiga olib keladi.
Molekula bir energetik holatdan ikkinchisiga o'tganda molekulaning har uch turdagi energiyasi bir vaqtning o'zida o'zgarishi mumkin (288-rasm). Natijada, elektron-vibratsiyali o'tish paytida chiqariladigan har bir spektral chiziq nozik aylanish strukturasiga ega bo'ladi va tipik molekulyar tarmoqqa aylanadi.

Guruch. 288. Molekulaning har uch turdagi energiyasining bir vaqtda o'zgarishi
Teng oraliqdagi chiziqlarning bunday chiziqlari bug 'va suvda kuzatiladi va spektrning uzoq infraqizil qismida yotadi. Ular bu bug'larning emissiya spektrida emas, balki ularning yutilish spektrida kuzatiladi, chunki molekulalarning tabiiy chastotalariga mos keladigan chastotalar boshqalarga qaraganda kuchliroq so'riladi. Shaklda. 289 yaqin infraqizil mintaqadagi bug 'yutilish spektridagi chiziqni ko'rsatadi. Bu tarmoqli nafaqat aylanish energiyasida, balki tebranish energiyasida ham (elektron qobiqlarning doimiy energiyasida) farq qiluvchi energiya holatlari orasidagi o'tishlarga mos keladi. Bu holda, va va Ekol bir vaqtning o'zida o'zgaradi, bu energiyaning katta o'zgarishiga olib keladi, ya'ni spektral chiziqlar birinchi ko'rib chiqilgan holatdan ko'ra yuqori chastotaga ega.
Shunga ko'ra, yaqin infraqizil mintaqada joylashgan spektrda 1-rasmda ko'rsatilganlarga o'xshash chiziqlar paydo bo'ladi. 289.

Guruch. 289. Yutish zonasi.
Bandning markazi ( doimiy EURdagi o'tishga to'g'ri keladi; tanlash qoidasiga ko'ra, bunday chastotalar molekula tomonidan chiqarilmaydi. Yuqori chastotali chiziqlar - qisqaroq to'lqin uzunliklari - EUR o'zgarishi qo'shilgan o'tishlarga mos keladi. Pastki chastotali chiziqlar (o'ng tomon) teskari munosabatga mos keladi: aylanish energiyasining o'zgarishi qarama-qarshi belgiga ega.
Bunday chiziqlar bilan bir qatorda inersiya momentining o'zgarishi bilan o'tishlarga mos keladigan chiziqlar kuzatiladi, ammo bu holda (9) formulaga muvofiq, chiziqlar chastotalari bog'liq bo'lishi kerak va chiziqlar orasidagi masofalar teng bo'lmaydi. Har bir chiziq bir chetiga to'g'ri keladigan bir qator chiziqlardan iborat,
bu chiziqning boshi deb ataladi. Tasmaga kiritilgan individual spektral chiziqning chastotasi uchun Delander 1885 yilda quyidagi shakldagi empirik formulani berdi:
butun son qayerda.
Delandre formulasi bevosita yuqoridagi fikrlardan kelib chiqadi. Delandr formulasini bir o'q bo'ylab, ikkinchisi bo'ylab chizsak, grafik tasvirlash mumkin (290-rasm).

Guruch. 290. Delandr formulasining grafik tasviri.
Quyida biz ko'rib turganimizdek, odatiy chiziqni tashkil etuvchi mos keladigan chiziqlar mavjud. Molekulyar spektrning tuzilishi molekula inertsiya momentiga kuchli bog'liq bo'lganligi sababli molekulyar spektrlarni o'rganish bu qiymatni aniqlashning ishonchli usullaridan biridir. Molekulaning tuzilishidagi eng kichik o'zgarishlarni uning spektrini o'rganish orqali aniqlash mumkin. Eng qizig'i shundaki, bir xil elementning turli xil izotoplarini (§ 86) o'z ichiga olgan molekulalarning spektrida ushbu izotoplarning turli massalariga mos keladigan turli xil chiziqlar bo'lishi kerak. Bundan kelib chiqadiki, atomlarning massalari ularning molekuladagi tebranish chastotasini ham, uning inersiya momentini ham aniqlaydi. Haqiqatan ham, mis xlorid tarmoqli chiziqlari 63 va 65 mis izotoplarining 35 va 37 xlor izotoplari bilan to'rtta birikmasiga mos keladigan to'rtta komponentdan iborat:
Oddiy vodoroddagi izotop kontsentratsiyasi teng bo'lishiga qaramay, vodorodning og'ir izotopi bo'lgan molekulalarga mos keladigan chiziqlar ham topildi.
Yadrolarning massasidan tashqari, yadrolarning boshqa xossalari ham molekulyar spektrlarning tuzilishiga ta'sir qiladi. Xususan, yadrolarning aylanish momentlari (spinlari) juda muhim rol o'ynaydi. Agar bir xil atomlardan tashkil topgan molekulada yadrolarning aylanish momentlari nolga teng bo'lsa, aylanish chizig'ining har ikkinchi chizig'i tushib ketadi.Bu ta'sir, masalan, molekulada kuzatiladi.
Agar yadrolarning aylanish momentlari nolga teng bo'lmasa, ular aylanish zonasida intensivliklarning almashinishiga, zaif chiziqlar kuchli bilan almashinishiga olib kelishi mumkin.)
Nihoyat, radiospektroskopiya usullaridan foydalanib, yadrolarning to'rt kutupli elektr momenti bilan bog'liq bo'lgan molekulyar spektrlarning o'ta nozik tuzilishini aniqlash va aniq o'lchash mumkin bo'ldi.
To'rt kutupli elektr momenti yadro shaklining sferikdan og'ishi natijasida paydo bo'ladi. Yadro cho'zilgan yoki inqilobli ellipsoid shakliga ega bo'lishi mumkin. Bunday zaryadlangan ellipsoidni endi yadro markazida joylashgan nuqtaviy zaryad bilan almashtirib bo'lmaydi.

Guruch. 291. “Atom” soatlari uchun yutuvchi qurilma: 1 - ikki tomondan gaz o‘tkazmaydigan parda 7 bilan yopilgan va past bosimda ammiak bilan to‘ldirilgan uzunlikdagi ko‘ndalang kesimli to‘rtburchak to‘lqin o‘tkazgich;
2 - unga berilgan yuqori chastotali kuchlanishning harmonikasini yaratadigan kristall diod; 3 - chiqish kristalli diyot; 4 - chastotali modulyatsiyalangan yuqori chastotali kuchlanish generatori; 5 - vakuum pompasi va ammiak gaz ushlagichiga quvur liniyasi; 6 - impuls kuchaytirgichiga chiqish; 7 - to'siqlar; I - kristall diodli oqim ko'rsatkichi; B - vakuum o'lchagich.
Kulon kuchidan tashqari, yadro maydonida masofaning to'rtinchi kuchiga teskari proportsional va yadro simmetriya o'qi yo'nalishi bilan burchakka bog'liq bo'lgan qo'shimcha kuch paydo bo'ladi. Qo'shimcha kuchning paydo bo'lishi yadroda to'rt kutupli moment mavjudligi bilan bog'liq.
Birinchi marta yadroda to'rt kutupli moment mavjudligi atom chiziqlarining o'ta nozik tuzilishining ba'zi tafsilotlaridan foydalangan holda an'anaviy spektroskopiya orqali aniqlandi. Ammo bu usullar momentning kattaligini aniq aniqlashga imkon bermadi.
Radiospektroskopik usulda toʻlqin oʻtkazgich oʻrganilayotgan molekulyar gaz bilan toʻldiriladi va radiotoʻlqinlarning gazdagi yutilishi oʻlchanadi. Radioto'lqinlarni hosil qilish uchun klistronlardan foydalanish yuqori darajadagi monoxromatiklikka ega bo'lgan tebranishlarni olish imkonini beradi, keyinchalik ular modulyatsiyalanadi. Santimetrli to'lqin hududida ammiakning yutilish spektri alohida batafsil o'rganildi.Ushbu spektrda o'ta nozik struktura topildi, bu yadroning kvadrupol momenti bilan molekulaning o'zi elektr maydoni o'rtasida bog'liqlik mavjudligi bilan izohlanadi.
Radiospektroskopiyaning asosiy afzalligi radiochastotalarga mos keladigan fotonlarning past energiyasidir. Buning yordamida radiochastotalarning yutilishi atomlar va molekulalarning juda yaqin energiya darajalari o'rtasidagi o'tishlarni aniqlay oladi. Yadro effektlaridan tashqari, radiospektroskopiya usuli kuchsiz elektrda molekulyar chiziqlarning Stark effekti orqali butun molekulaning elektr dipol momentlarini aniqlash uchun juda qulaydir.
dalalar. So'nggi yillarda turli xil molekulalarning tuzilishini o'rganishning radiospektroskopik usuliga bag'ishlangan juda ko'p ishlar paydo bo'ldi.Ammiakdagi radioto'lqinlarning yutilishi o'ta aniq "atomik" soatlarni yaratishda qo'llanildi (1-rasm). 291).
Astronomik kunning davomiyligi asta-sekin o'sib boradi va qo'shimcha ravishda chegaralar ichida o'zgarib turadi.Bir xil tezlikda soatlarni qurish maqsadga muvofiqdir. "Atom" soati ammiakda hosil bo'lgan to'lqinlarning yutilishi bilan boshqariladigan chastotali radio to'lqinlarining kvarts generatoridir. 1,25 sm to'lqin uzunligida ammiak molekulasining tabiiy chastotasi bilan rezonans paydo bo'ladi, bu juda o'tkir assimilyatsiya chizig'iga to'g'ri keladi. Jeneratör to'lqin uzunligining bu qiymatdan eng kichik og'ishi rezonansni buzadi va radio emissiyasi uchun gazning shaffofligini kuchli o'sishiga olib keladi, bu tegishli asbob-uskunalar tomonidan qayd etiladi va generatorning chastotasini tiklaydigan avtomatlashtirishni faollashtiradi. "Atom" soatlari allaqachon Yerning aylanishiga qaraganda bir xilda harakat qilgan. Kunning bir qismi tartibining aniqligiga erishish mumkin bo'ladi, deb taxmin qilinadi.

molekulyar spektrlar, optik emissiya va yutilish spektrlari, shuningdek Ramanning tarqalishi, erkin yoki erkin bog'langanlarga tegishli molekulalar. Xonim. murakkab tuzilishga ega. Odatdagi M. s. - chiziqli, ular ultrabinafsha, ko'rinadigan va yaqin infraqizil hududlarda ko'proq yoki kamroq tor chiziqlar to'plami shaklida emissiya va yutilishda va Ramanning tarqalishida kuzatiladi, ular spektral asboblarning etarli ajratish kuchi bilan parchalanadi. bir-biriga yaqin joylashgan chiziqlar to'plami. M. ning oʻziga xos tuzilishi. turli molekulalar uchun har xil bo'ladi va umuman olganda, molekuladagi atomlar soni ortishi bilan murakkablashadi. Juda murakkab molekulalar uchun ko'rinadigan va ultrabinafsha spektrlar bir necha keng uzluksiz chiziqlardan iborat; bunday molekulalarning spektrlari bir-biriga o'xshash.
Xonim. qachon paydo bo'ladi kvant o'tishlari orasida energiya darajalari E' Va E'' molekulalari nisbatiga ko'ra
h n= E‘ - E‘’, (1)
Qayerda h n - emissiya qilingan energiya foton chastota n ( h -Plank doimiysi ). Ramanning tarqalishi bilan h n hodisaning energiyalari va tarqoq fotonlar orasidagi farqga teng. Xonim. atomlarga qaraganda molekuladagi ichki harakatlarning kattaroq murakkabligi bilan belgilanadigan chiziqli atom spektrlariga qaraganda ancha murakkab. Molekulalardagi ikki yoki undan ortiq yadrolarga nisbatan elektronlarning harakati bilan bir qatorda yadrolarning tebranish harakati (ularni oʻrab turgan ichki elektronlar bilan birgalikda) molekulaning butun molekuladagi muvozanat pozitsiyalari va aylanish harakati atrofida sodir boʻladi. Harakatning bu uch turi - elektron, tebranish va aylanish - energiya darajasining uch turiga va spektrlarning uch turiga mos keladi.
Kvant mexanikasiga ko'ra, molekuladagi barcha turdagi harakatlarning energiyasi faqat ma'lum qiymatlarni qabul qilishi mumkin, ya'ni u kvantlangan. Molekulaning umumiy energiyasi E Taxminan uch turdagi harakatning kvantlangan energiya qiymatlari yig'indisi sifatida ifodalanishi mumkin:
E = E elektron pochta + E+ hisoblang E aylantiring (2)
Kattalik tartibi bo'yicha
Qayerda m elektronning massasi va kattaligi M molekuladagi atom yadrolarining massa tartibiga ega, ya'ni. m/M~ 10 -3 -10 -5, shuning uchun:
E elektron pochta >> E hisoblash >> E aylantiring (4)
Odatda E el haqida bir necha ev(bir necha yuz kJ/mol), E hisoblash ~ 10 -2 -10 -1 eV, E aylanish ~ 10 -5 -10 -3 ev.
(4) ga muvofiq molekulaning energiya darajalari tizimi bir-biridan uzoqda joylashgan elektron darajalar to'plami bilan tavsiflanadi (turli qiymatlar). E el at E hisoblash = E aylanish = 0), tebranish darajalari bir-biriga yaqinroq joylashgan (turli qiymatlar). E berilganda hisoblash E l va E aylanish = 0) va undan ham yaqinroq joylashgan aylanish darajalari (turli qiymatlar E berilgan vaqtda aylanish E el va E hisoblash).
Elektron energiya darajalari ( E(2) dagi el molekulaning muvozanat konfiguratsiyasiga mos keladi (muvozanat qiymati bilan tavsiflangan ikki atomli molekula holatida) r 0 yadrolararo masofa r. Har bir elektron holat ma'lum bir muvozanat konfiguratsiyasiga va ma'lum bir qiymatga mos keladi E el; eng past qiymat asosiy energiya darajasiga to'g'ri keladi.
Molekulaning elektron holatlari to'plami uning elektron qobig'ining xususiyatlari bilan belgilanadi. Printsipial jihatdan qadriyatlar E el usullari yordamida hisoblash mumkin kvant kimyosi, ammo bu muammoni faqat taxminiy usullar yordamida va nisbatan oddiy molekulalar uchun hal qilish mumkin. Kimyoviy tuzilishi bilan belgilanadigan molekulaning elektron darajalari (elektron energiya darajalarining joylashuvi va ularning xarakteristikalari) haqidagi eng muhim ma'lumotlar uning molekulyar tuzilishini o'rganish orqali olinadi.
Berilgan elektron energiya darajasining juda muhim xarakteristikasi bu qiymatdir kvant soni S, molekulaning barcha elektronlarining umumiy spin momentining mutlaq qiymatini tavsiflovchi. Kimyoviy barqaror molekulalar odatda juft elektronlar soniga ega va ular uchun S= 0, 1, 2... (asosiy elektron daraja uchun odatiy qiymat S= 0 va hayajonlanganlar uchun - S= 0 va S= 1). Bilan darajalar S= 0 singl deb ataladi, bilan S= 1 - triplet (chunki molekuladagi o'zaro ta'sir ularning c = 2 ga bo'linishiga olib keladi. S+ 1 = 3 pastki daraja) . BILAN erkin radikallar ular uchun, qoida tariqasida, toq elektronlar soni bor S= 1/2, 3/2, ... va qiymat asosiy va hayajonlangan darajalar uchun xosdir S= 1/2 (ikki darajali darajalar c = 2 pastki darajaga bo'linadi).
Muvozanat konfiguratsiyasi simmetriyaga ega bo'lgan molekulalar uchun elektron darajalarni qo'shimcha ravishda tasniflash mumkin. Simmetriya o'qiga (cheksiz tartibli) ega bo'lgan diatomik va chiziqli triatomik molekulalar barcha atomlarning yadrolari orqali o'tadi. , elektron darajalar l kvant sonining qiymatlari bilan tavsiflanadi, bu barcha elektronlarning umumiy orbital momentumning molekula o'qiga proyeksiyasining mutlaq qiymatini belgilaydi. L = 0, 1, 2, ... bo'lgan darajalar mos ravishda S, P, D... deb belgilanadi va c qiymati yuqori chapdagi indeks bilan ko'rsatiladi (masalan, 3 S, 2 p, ...). Simmetriya markazi bo'lgan molekulalar uchun, masalan, CO 2 va C 6 H 6 , barcha elektron darajalar indekslar bilan belgilanadigan juft va toq darajalarga bo'linadi g Va u(simmetriya markazida teskari aylantirilganda to'lqin funksiyasi o'z belgisini saqlab qolishi yoki uni o'zgartirishiga qarab).
Vibratsiyali energiya darajalari (qiymatlari E hisoblash) taxminan garmonik hisoblangan tebranish harakatini kvantlash orqali topish mumkin. Ikki atomli molekulaning eng oddiy holatida (yadrolararo masofaning o'zgarishiga mos keladigan bir erkinlik darajasi r) garmonik deb hisoblanadi osilator; uning kvantlanishi teng oraliqdagi energiya darajalarini beradi:
E hisoblash = h n e (u +1/2), (5)
Bu erda n e - molekulaning garmonik tebranishlarining asosiy chastotasi, u - 0, 1, 2, ... qiymatlarini qabul qiluvchi tebranish kvant soni. N atomlar ( N³ 3) va ega f tebranish erkinlik darajalari ( f = 3N- 5 va f = 3N- mos ravishda chiziqli va chiziqli bo'lmagan molekulalar uchun 6), bu chiqadi f deb atalmish chastotalar bilan normal tebranishlar n i ( i = 1, 2, 3, ..., f) va tebranish darajalarining murakkab tizimi:
![]()
Qayerda u i = 0, 1, 2, ... mos keladigan tebranish kvant sonlari. Erning elektron holatidagi normal tebranishlar chastotalari to'plami kimyoviy tuzilishiga qarab molekula uchun juda muhim xususiyatdir. Molekula atomlarining hammasi yoki bir qismi ma'lum bir normal tebranishda ishtirok etadi; atomlar bir xil chastotali garmonik tebranishlarni amalga oshiradi v i, lekin tebranish shaklini aniqlaydigan turli amplitudalar bilan. Oddiy tebranishlar shakliga ko'ra cho'zilish (bog'lanish chiziqlarining uzunligi o'zgaradi) va egilish (kimyoviy bog'lanishlar orasidagi burchaklar - bog'lanish burchaklari - o'zgaradi) ga bo'linadi. Past simmetriyali molekulalar uchun (2 dan yuqori tartibli simmetriya o'qlari bo'lmagan) turli xil tebranish chastotalari soni 2 ga teng va barcha tebranishlar degenerativ emas, nosimmetrik molekulalar uchun ikki va uch marta degenerativ tebranishlar (juft va uchlik) mavjud. chastotaga mos keladigan tebranishlar). Masalan, chiziqli bo'lmagan triatomik molekulada H 2 O f= 3 va uchta degenerativ bo'lmagan tebranishlar mumkin (ikkita cho'zish va bitta egilish). Ko'proq simmetrik chiziqli triatomik CO 2 molekulasi mavjud f= 4 - ikkita degenerativ bo'lmagan tebranish (cho'zish) va bitta ikki marta degeneratsiya (deformatsiya). Yassi yuqori nosimmetrik molekula uchun C 6 H 6 chiqadi f= 30 - o'nta degenerativ bo'lmagan va 10 ta ikki marta buziladigan tebranishlar; shundan 14 ta tebranish molekula tekisligida (8 ta cho'zilish va 6 ta egilish) va 6 tasi tekislikdan tashqari egilish tebranishlari - bu tekislikka perpendikulyar. Bundan ham nosimmetrik tetraedral CH 4 molekulasi mavjud f = 9 - bitta degenerativ bo'lmagan tebranish (cho'zish), bitta ikki marta degeneratsiya (deformatsiya) va ikkita uch marta degeneratsiya (bir cho'zish va bitta deformatsiya).
Aylanma energiya darajalarini molekulaning aylanish harakatini kvantlash, uni qattiq modda sifatida ko'rib chiqish orqali topish mumkin. inersiya momentlari. Ikki atomli yoki chiziqli ko'p atomli molekulaning eng oddiy holatida uning aylanish energiyasi
![]()
Qayerda I molekula o'qiga perpendikulyar bo'lgan o'qqa nisbatan molekulaning inersiya momenti va M- impulsning aylanish momenti. Kvantlash qoidalariga ko'ra,
![]()
aylanma kvant soni qayerda J= 0, 1, 2, ..., va shuning uchun uchun E aylanish qabul qilindi:
bu erda aylanish konstantasi energiya darajalari orasidagi masofalar masshtabini belgilaydi, bu yadro massalari va yadrolararo masofalarning ortishi bilan kamayadi.
M.larning har xil turlari. molekulalarning energiya darajalari o'rtasidagi o'tishning har xil turlarida paydo bo'ladi. (1) va (2) ga muvofiq
D E = E‘ - E'' = D E el + D E hisoblash + D E aylantirish, (8)
qaerda o'zgaradi D E el, D E hisoblash va D E elektron, tebranish va aylanish energiyalarining aylanishi shartni qondiradi:
D E el >> D E hisoblash >> D E aylantirish (9)
[darajalar orasidagi masofalar energiyaning o'zlari bilan bir xil tartibda E el, E ol va E aylanish, qanoatlantiruvchi shart (4)].
D da E el ¹ 0, ko'rinadigan va ultrabinafsha (UV) hududlarda kuzatiladigan elektron mikroskop olinadi. Odatda D E el ¹ 0 bir vaqtning o'zida D E 0 va D raqamlari E aylanish ¹ 0; turli D E berilgan D uchun hisoblash E el turli tebranish zonalariga mos keladi va turli D E berilgan D da aylanish E el va d E hisoblash - bu chiziq parchalanadigan alohida aylanish chiziqlari; xarakterli chiziqli struktura olinadi.
![]()
N 2 molekulasining 3805 elektron tebranish zonasining aylanish bo'linishi
Berilgan D bilan chiziqlar to'plami E el (chastotali sof elektron o'tishga to'g'ri keladi v el = D E email/ h) chiziqli tizim deb ataladi; individual bantlar o'tishlarning nisbiy ehtimoliga qarab turli intensivlikka ega bo'lib, ular taxminan kvant mexanik usullari bilan hisoblanishi mumkin. Murakkab molekulalar uchun ma'lum elektron o'tishga mos keladigan bitta tizimning chiziqlari odatda bitta keng uzluksiz tarmoqqa birlashadi; bir nechta bunday keng diapazonlar bir-birining ustiga chiqishi mumkin. Organik birikmalarning muzlatilgan eritmalarida kuzatiladigan xarakterli diskret elektron spektrlar . Elektron (aniqrog'i, elektron-vibratsiyali-aylanuvchi) spektrlar shisha (ko'rinadigan hudud uchun) va kvarts (UV mintaqasi uchun) optikasi bo'lgan spektrograflar va spektrometrlar yordamida eksperimental ravishda o'rganiladi, ularda yorug'likni parchalash uchun prizma yoki difraksion panjara ishlatiladi. spektr .
D da E el = 0 va D E soni ¹ 0, tebranish magnit rezonanslari olinadi, yaqin masofada kuzatiladi (bir nechagacha mkm) va o'rtada (bir necha o'ntagacha mkm) infraqizil (IR) mintaqa, odatda yutilishda, shuningdek, yorug'likning Raman tarqalishida. Qoida tariqasida, bir vaqtning o'zida D E aylanish ¹ 0 va berilganda E Natijada alohida aylanma chiziqlarga bo'linadigan tebranish tasmasi paydo bo'ladi. Ular tebranuvchi M.larda eng kuchli. D ga mos keladigan chiziqlar u = u’ - u'' = 1 (ko'p atomli molekulalar uchun - D u i = u men' - u i ''= 1 da D u k = u k ' - u k '' = 0, bu erda k¹i).
Sof garmonik tebranishlar uchun tanlash qoidalari, boshqa o'tishlarni taqiqlash qat'iy amalga oshiriladi; angarmonik tebranishlar uchun D. uchun chiziqlar paydo bo'ladi u> 1 (ohanglar); ularning intensivligi odatda past boʻladi va D ortishi bilan kamayadi u.
Tebranish (aniqrog'i, tebranish-aylanish) spektrlari infraqizil nurlanish uchun shaffof prizma yoki diffraktsiya panjarali IQ spektrometrlari, shuningdek Furye spektrometrlari va Raman tarqalishida yuqori diafragmali diafragma yordamida yutilishda IQ mintaqasida eksperimental ravishda o'rganiladi. ko'rinadigan hudud) lazer qo'zg'alishi yordamida.
D da E el = 0 va D E count = 0, alohida chiziqlardan iborat sof aylanadigan magnit tizimlar olinadi. Ular uzoq masofada yutilishda kuzatiladi (yuzlab mkm)IR mintaqasi va ayniqsa mikroto'lqinli mintaqada, shuningdek Raman spektrlarida. Ikki atomli va chiziqli ko'p atomli molekulalar uchun (shuningdek, etarlicha simmetrik chiziqli bo'lmagan ko'p atomli molekulalar uchun) bu chiziqlar bir-biridan Dn = 2 oraliqlar bilan teng masofada joylashgan (chastota shkalasida). B yutilish spektrlarida va Dn = 4 B Raman spektrlarida.
Sof aylanish spektrlari yutilishda uzoq IQ mintaqasida maxsus diffraktsiya panjaralari (echelette) va Furye spektrometrlari bo'lgan IQ spektrometrlari, mikroto'lqinli mintaqada mikroto'lqinli (mikroto'lqinli) spektrometrlar yordamida o'rganiladi. , shuningdek, yuqori diafragmali spektrograflar yordamida Ramanning tarqalishida.
Mikroorganizmlarni o'rganishga asoslangan molekulyar spektroskopiya usullari kimyo, biologiya va boshqa fanlarning turli masalalarini hal qilish imkonini beradi (masalan, neft mahsulotlari, polimer moddalari va boshqalar tarkibini aniqlash). MS bo'yicha kimyoda. molekulalarning tuzilishini o'rganish. Elektron M. s. molekulalarning elektron qobiqlari haqida ma'lumot olish, qo'zg'alish darajalari va ularning xususiyatlarini aniqlash, molekulalarning dissotsilanish energiyalarini topish (molekulaning tebranish darajalarining dissotsiatsiya chegaralariga yaqinlashishi orqali) imkonini beradi. Tebranish M.larini oʻrganish. molekuladagi ma'lum turdagi kimyoviy bog'lanishlarga (masalan, oddiy qo'sh va uch C-C aloqalari, organik molekulalar uchun C-H, N-H, O-H aloqalari), atomlarning turli guruhlariga (masalan, CH 2) mos keladigan xarakterli tebranish chastotalarini topishga imkon beradi. , CH 3, NH 2), molekulalarning fazoviy tuzilishini aniqlang, sis- va trans-izomerlarni farqlang. Buning uchun infraqizil yutilish spektrlari (IR) va Raman spektrlari (RSS) qo'llaniladi. IQ usuli molekulalarning tuzilishini o'rganishning eng samarali optik usullaridan biri sifatida ayniqsa keng tarqaldi. U SKR usuli bilan birgalikda eng to'liq ma'lumotni taqdim etadi. Aylanadigan magnit rezonanslarni, shuningdek elektron va tebranish spektrlarining aylanish tuzilishini o'rganish molekulalarning inersiya momentlarining eksperimental ravishda topilgan qiymatlaridan foydalanishga imkon beradi [aylanish konstantalari qiymatlaridan olinadi, qarang. (7)] molekulaning muvozanat konfiguratsiyasi parametrlarini katta aniqlik bilan topish (oddiyroq molekulalar uchun, masalan, H 2 O) - bog'lanish uzunligi va bog'lanish burchaklari. Aniqlangan parametrlar sonini ko'paytirish uchun muvozanat konfiguratsiyasining parametrlari bir xil, ammo inertsiya momentlari har xil bo'lgan izotopik molekulalarning spektrlari (xususan, vodorod deyteriy bilan almashtiriladi) o'rganiladi.
M. lardan foydalanishga misol sifatida. Molekulalarning kimyoviy tuzilishini aniqlash uchun benzol molekulasi C 6 H 6 ni ko'rib chiqing. Uni o'rganish M. s. modelning to'g'riligini tasdiqlaydi, unga ko'ra molekula tekis va benzol halqasidagi barcha 6 C-C bog'lari ekvivalent bo'lib, molekulaning simmetriya markazidan unga perpendikulyar o'tadigan oltinchi tartibli simmetriya o'qi bilan muntazam olti burchak hosil qiladi. samolyot. Elektron M. s. yutilish zonasi C 6 H 6 yerning juft singl sathidan qo'zg'aluvchan toq darajalarga o'tishga mos keladigan bir nechta bantlar tizimidan iborat bo'lib, ulardan birinchisi uchlik, yuqorilari esa singldir. Chiziqlar tizimi 1840-yillarda eng kuchli. E 5 - E 1 = 7,0 ev), bantlar tizimi 3400 mintaqasida eng zaifdir ( E 2 - E 1 = 3,8ev), umumiy aylanish uchun taxminiy tanlash qoidalari bilan taqiqlangan singlet-triplet o'tishga mos keladi. O'tishlar deb ataladigan qo'zg'alishga mos keladi. p elektronlar benzol halqasi bo'ylab delokalizatsiyalangan ; Elektron molekulyar spektrlardan olingan daraja diagrammasi taxminiy kvant mexanik hisoblari bilan mos keladi. Tebranuvchi M. s. C 6 H 6 molekulada simmetriya markazining mavjudligiga mos keladi - IRSda paydo bo'ladigan (faol) tebranish chastotalari SRSda yo'q (faol emas) va aksincha (muqobil taqiq deb ataladi). C 6 H 6 ning 20 ta normal tebranishlaridan 4 tasi ICSda va 7 tasi SCRda faol, qolgan 11 tasi ham ICS, ham SCRda faol emas. O'lchangan chastota qiymatlari (in sm -1): 673, 1038, 1486, 3080 (ICSda) va 607, 850, 992, 1178, 1596, 3047, 3062 (TFRda). 673 va 850 chastotalar tekis bo'lmagan tebranishlarga, qolgan barcha chastotalar tekis tebranishlarga mos keladi. Planar tebranishlar uchun 992 chastotasi (benzol halqasining davriy siqilishi va cho'zilishidan iborat bo'lgan C-C bog'larining cho'zilgan tebranishiga mos keladi), 3062 va 3080 (chastotali tebranishlarning cho'zilishiga to'g'ri keladi) va C-H bog'lanishlarining chastotasi 67 ga xosdir. benzol halqasining egilish tebranishiga). C 6 H 6 ning kuzatilgan tebranish spektrlari (va shunga o'xshash C 6 D 6 tebranish spektrlari) nazariy hisob-kitoblar bilan juda yaxshi mos keladi, bu esa ushbu spektrlarni to'liq izohlash va barcha normal tebranishlarning shakllarini topish imkonini berdi.
Xuddi shu tarzda, siz M. s dan foydalanishingiz mumkin. turli sinf organik va noorganik molekulalarning tuzilishini aniqlang, polimer molekulalari kabi juda murakkab.
Ma’ruza 12. Yadro fizikasi. Atom yadrosining tuzilishi.
Yadro- bu atomning markaziy massiv qismi bo'lib, uning atrofida elektronlar kvant orbitalarida aylanadi. Yadroning massasi atom tarkibiga kirgan barcha elektronlarning massasidan taxminan 4·10 3 marta katta. Yadro hajmi juda kichik (10 -12 -10 -13 sm), bu butun atomning diametridan taxminan 10 5 marta kichikdir. Elektr zaryadi ijobiy va mutlaq qiymatda atom elektronlarining zaryadlari yig'indisiga teng (chunki butun atom elektr neytraldir).
Yadro E. Rezerford (1911) tomonidan alfa zarrachalarning materiyadan oʻtayotganda sochilishi boʻyicha tajribalar natijasida kashf etilgan. Rezerford a-zarralar kutilganidan ko'ra tez-tez katta burchak ostida tarqalib ketishini aniqlab, atomning musbat zaryadi kichik yadroda to'planishini taklif qildi (bundan oldin J. Tomson g'oyalari ustunlik qilgan, unga ko'ra musbat zaryad atom butun hajmida bir xil taqsimlangan deb hisoblangan). Rezerfordning g‘oyasi zamondoshlari tomonidan darhol qabul qilinmadi (asosiy to‘siq yadro atrofida orbita bo‘ylab harakatlanayotganda elektromagnit nurlanish energiyasini yo‘qotishi natijasida atom elektronlarining yadroga muqarrar tushishiga ishonish edi). Uning tan olinishida atomning kvant nazariyasiga asos solgan N. Borning (1913) mashhur asari katta rol o‘ynadi. Bor orbitalarning barqarorligini atom elektronlari harakatini kvantlashning boshlang'ich printsipi deb hisobladi va shundan so'ng keng empirik materialni (Balmer seriyasi va boshqalar) tushuntiruvchi chiziqli optik spektrlar qonunlarini keltirib chiqardi. Biroz vaqt o'tgach (1913 yil oxirida) Rezerford shogirdi G. Mozili eksperimental tarzda ko'rsatdiki, elementlar davriy sistemasidagi elementning atom raqami Z o'zgarganda atomlarning chiziqli rentgen spektrlarining qisqa to'lqinli chegarasining siljishi. Bor nazariyasiga mos keladi, agar yadroning elektr zaryadini (elektron zaryad birliklarida) Z ga teng deb hisoblasak.Bu kashfiyot ishonchsizlik to‘sig‘ini butunlay buzib tashladi: yangi jismoniy ob’ekt – yadro mustahkam bog‘langan bo‘lib chiqdi. Hozirgi vaqtda yagona va jismoniy shaffof tushuntirishga ega bo'lgan bir qator heterojen hodisalar bilan. Mozelining ishidan keyin fizikada atom yadrosining mavjudligi haqiqati nihoyat aniqlandi.
Yadro tarkibi. Yadro kashf etilganda faqat ikkita elementar zarracha - proton va elektron ma'lum edi. Shunga ko'ra, yadro ulardan iborat bo'lishi ehtimoli bor deb hisoblangan. Biroq, 20-yillarning oxirida. 20-asr Proton-elektron gipotezasi "azot falokati" deb nomlangan jiddiy qiyinchilikka duch keldi: proton-elektron gipotezasiga ko'ra, azot yadrosida 21 ta zarracha (14 proton va 7 elektron) bo'lishi kerak, ularning har biri 1/2 spinga ega edi. . Azot yadrosining spini yarim butun son bo'lishi kerak edi, ammo optik molekulyar spektrlarni o'lchash ma'lumotlariga ko'ra, spin 1 ga teng bo'lib chiqdi.
Yadro tarkibi J.Chedvik (1932) tomonidan kashf etilgandan keyin aniqlangan. neytron. Neytronning massasi, Chadvikning birinchi tajribalaridan ma'lum bo'lishicha, protonning massasiga yaqin va spin 1/2 ga teng (keyinchalik aniqlangan). Yadro proton va neytronlardan iborat degan fikrni birinchi marta bosma nashrlarda D. D. Ivanenko (1932) ifodalagan va shundan so‘ng darhol V. Geyzenberg (1932) tomonidan ishlab chiqilgan. Yadroning proton-neytron tarkibi haqidagi taxmin keyinchalik eksperimental tarzda to'liq tasdiqlandi. Zamonaviy yadro fizikasida proton (p) va neytron (n) odatda nuklon nomi ostida birlashtiriladi. Yadrodagi nuklonlarning umumiy soni massa soni deb ataladi A, protonlar soni yadro zaryadiga Z (elektron zaryad birliklarida), neytronlar soniga teng. N = A - Z. U izotoplar bir xil Z, lekin boshqacha A Va N, yadrolari bir xil izobarlarga ega A va turli Z va N.
Nuklonlardan og'irroq yangi zarralarning kashf etilishi munosabati bilan. nuklon izobarlari, ular ham yadroning bir qismi bo'lishi kerakligi ma'lum bo'ldi (bir-biri bilan to'qnashgan yadro ichidagi nuklonlar nuklon izobarlariga aylanishi mumkin). Eng oddiy yadroda - deytron , bitta proton va bitta neytrondan iborat bo'lgan nuklonlar vaqtning ~ 1% nuklon izobarlari shaklida qolishi kerak. Bir qator kuzatilgan hodisalar yadrolarda bunday izobar holatlar mavjudligidan dalolat beradi. Nuklonlar va nuklon izobarlaridan tashqari, yadrolarda davriy ravishda qisqa vaqt ichida (10 -23 -10 -24) sek) paydo bo'ladi mezonlar , shu jumladan, eng engillari - p-mezonlar. Nuklonlarning o'zaro ta'siri nuklonlardan biri tomonidan mezonning ko'p chiqishi va boshqasi tomonidan yutilishi bilan bog'liq. Rivojlanayotgan, ya'ni. almashinuv mezon oqimlari, xususan, yadrolarning elektromagnit xususiyatlariga ta'sir qiladi. Mezon almashinish oqimlarining eng aniq namoyon bo'lishi deytronning yuqori energiyali elektronlar va g-kvantlar tomonidan bo'linishi reaktsiyasida topilgan.
Nuklonlarning o'zaro ta'siri. Yadroda nuklonlarni ushlab turuvchi kuchlar deyiladi yadroviy . Bu fizikada ma'lum bo'lgan eng kuchli o'zaro ta'sirlar. Yadrodagi ikkita nuklon o'rtasida ta'sir qiluvchi yadro kuchlari protonlar orasidagi elektrostatik o'zaro ta'sirdan yuz baravar kuchliroqdir. Yadro kuchlarining muhim xususiyati ularningdir. nuklonlarning zaryad holatidan mustaqilligi: ikkita proton, ikkita neytron yoki neytron va protonning yadroviy o'zaro ta'siri, agar bu juft zarralarning nisbiy harakat holatlari bir xil bo'lsa, bir xil bo'ladi. Yadro kuchlarining kattaligi nuklonlar orasidagi masofaga, ularning spinlarining o'zaro orientatsiyasiga, spinlarning orbital burchak momentiga va bir zarrachadan ikkinchisiga tortilgan radius vektoriga nisbatan orientatsiyasiga bog'liq. Yadro kuchlari ma'lum bir ta'sir doirasi bilan tavsiflanadi: bu kuchlarning potentsiali masofaga qarab kamayadi r dan tezroq zarralar orasidagi r-2, va kuchlarning o'zlari tezroq r-3. Yadro kuchlarining fizik tabiatini hisobga oladigan bo'lsak, ular masofaga qarab eksponent ravishda kamayishi kerak. Yadro kuchlarining ta'sir radiusi deb ataladigan narsa bilan belgilanadi. Kompton to'lqin uzunligi O'zaro ta'sir davomida nuklonlar o'rtasida almashinadigan r 0 mezon:
bu erda m, mezon massasi, Plank doimiysi, Bilan- vakuumdagi yorug'lik tezligi. P-mezonlarning almashinuvi natijasida yuzaga keladigan kuchlar eng katta ta'sir radiusiga ega. Ular uchun r 0 = 1,41 f (1 f = 10 -13 sm). Yadrolardagi nuklonlararo masofalar aynan shunday kattalik tartibiga ega, ammo og'irroq mezonlarning (m-, r-, w-mezonlar va boshqalar) almashinuvi ham yadro kuchlariga yordam beradi. Ikki nuklon orasidagi yadro kuchlarining masofaga va yadro kuchlarining har xil turdagi mezonlar almashinuvi natijasidagi hissasiga aniq bog'liqligi aniq belgilanmagan. Ko'p yadroli yadrolarda faqat juft nuklonlarning o'zaro ta'siriga kamaymaydigan kuchlar mumkin. Bularning roli yadrolarning tuzilishidagi ko'p zarrali kuchlar noaniqligicha qolmoqda.
Yadro o'lchamlari ulardagi nuklonlar soniga bog'liq. Yadrodagi nuklonlar sonining p sonining o'rtacha zichligi (ularning birlik hajmdagi soni) barcha ko'p yadroli yadrolar uchun (A > 0) deyarli bir xil. Demak, yadro hajmi nuklonlar soniga proporsionaldir A, va uning chiziqli o'lchami ~A 1/3. Samarali yadro radiusi R munosabat bilan belgilanadi:
R = a A 1/3 , (2)
doimiysi qayerda A ga yaqin Hz, lekin undan farq qiladi va u qanday jismoniy hodisalarda o'lchanganiga bog'liq R. Yadroning zaryad radiusi deb ataladigan holatda, elektronlarning yadrolarga tarqalishi yoki energiya darajasining m- pozitsiyasi bilan o'lchanadi. mezoatomlar : a = 1,12 f. O'zaro ta'sir jarayonlaridan aniqlangan samarali radius hadronlar (nuklonlar, mezonlar, a-zarralar va boshqalar) yadrolari zaryaddan bir oz kattaroq: 1,2 dan. f 1,4 gacha f.
Yadro moddasining zichligi oddiy moddalarning zichligiga nisbatan hayratlanarli darajada yuqori: u taxminan 10 14 ni tashkil qiladi. G/sm 3. Yadroda r markaziy qismda deyarli doimiy bo'lib, periferiya tomon eksponent ravishda kamayadi. Empirik ma'lumotlarning taxminiy tavsifi uchun r ning yadro markazidan r masofasiga quyidagi bog'liqligi ba'zan qabul qilinadi:
![]() .
.
Samarali yadro radiusi R ga teng R 0 + b. b qiymati yadro chegarasining xiralashishini tavsiflaydi, u barcha yadrolar uchun deyarli bir xil (» 0,5) f). Parametr r 0 - yadroning "chegarasidagi" ikki tomonlama zichlik, normalizatsiya shartidan (p ning hajmli integralining nuklonlar soniga tengligi) A). (2) dan kelib chiqadiki, yadrolarning o'lchamlari 10 dan 13 gacha bo'lgan kattaliklarga qarab o'zgaradi. sm 10-12 gacha sm og'ir yadrolar uchun (atom hajmi ~ 10 -8 sm). Biroq, formula (2) nuklonlar sonining ko'payishi bilan yadrolarning chiziqli o'lchamlarini faqat taxminan, sezilarli darajada o'sishi bilan tavsiflaydi. A. Unga bir yoki ikkita nuklon qo'shilgan taqdirda yadro hajmining o'zgarishi yadro tuzilishining tafsilotlariga bog'liq va tartibsiz bo'lishi mumkin. Xususan (atom energiyasi sathining izotopik siljishi o'lchovlari bilan ko'rsatilgandek), ba'zida ikkita neytron qo'shilganda yadro radiusi ham kamayadi.