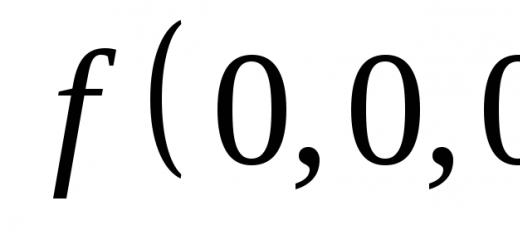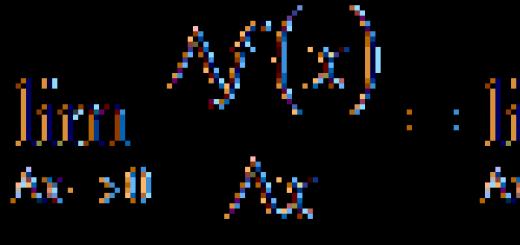Muammo 325.
A + B ⇒ AB reaksiya tezligi konstantasining qiymatini toping, agar A va B moddalarning konsentrasiyalari mos ravishda 0,05 va 0,01 mol/l ga teng bo‘lsa, reaksiya tezligi 5 ga teng bo‘lsa. .
10 -5 mol/(l. min).
Yechim:
Tezlikkimyoviy reaksiya tenglama bilan ifodalanadi:
v- ,k- reaksiya tezligi konstantasi

Javob: 0,1/mol. min.
Muammo 326.
2A + B ⇒ A 2 B reaksiya tezligi A moddaning konsentratsiyasini 2 marta, B moddaning konsentratsiyasini 2 marta kamaytirsa, necha marta o'zgaradi?
Yechim:
v- ,k- reaksiya tezligi konstantasi, [A] va [B] - boshlang'ich moddalarning konsentratsiyasi.
A moddasining konsentratsiyasining 2 marta oshishi va B moddasining konsentratsiyasining 2 marta kamayishi tufayli reaktsiya tezligi tenglama bilan ifodalanadi:
![]()
v va v" ifodalarini solishtirsak, reaksiya tezligi 2 marta oshganligini aniqlaymiz.
Javob: 2 barobarga oshdi.
Muammo 327.
Tizimdagi B 2 moddasining konsentratsiyasini necha marta oshirish kerak?
2A 2(g) + B 2(g) = 2A 2 B, shuning uchun A moddaning konsentratsiyasi 4 marta kamayganda, to'g'ridan-to'g'ri reaksiya tezligi o'zgarmaydi?
Yechim:
A moddasining kontsentratsiyasi 4 marta kamaydi. B modda konsentratsiyasining o'zgarishini quyidagicha belgilaymiz x. Keyin, A moddasining konsentratsiyasi o'zgarishidan oldin, reaktsiya tezligini tenglama bilan ifodalash mumkin:
![]()
v- ,k- reaksiya tezligi konstantasi, [A] va [B] - boshlang'ich moddalarning konsentratsiyasi.
A 2 moddasining kontsentratsiyasini o'zgartirgandan so'ng, reaktsiya tezligi tenglama bilan ifodalanadi:
![]()
Masala shartlariga ko'ra, v = v" yoki

Shunday qilib, 2A 2 (g) + B 2 (g) = 2A 2 B sistemada B 2 moddaning konsentratsiyasini 16 marta oshirish kerak, shuning uchun A 2 moddaning konsentratsiyasi 4 marta kamayganda, to'g'ridan-to'g'ri reaktsiya tezligi o'zgarmaydi.
Javob: 16 marta.
Muammo 328.
Bir xil sig'imdagi ikkita idish kiritiladi: birinchisiga - 1 mol gaz A va 2 mol gaz B, ikkinchisiga - 2 mol A va 1 mol gaz B. Har ikkala idishdagi harorat bir xil. Bu idishlardagi A va B gazlari orasidagi reaksiya tezligi farqlanadimi, agar reaksiya tezligi quyidagicha ifodalansa: a) tenglama b) tenglama
Yechim:
a) Agar reaksiya tezligi tenglama bilan ifodalansa, u holda idishlardagi A va B moddalarning kontsentratsiyasini hisobga olgan holda, tomirlar uchun reaksiya tezligining ifodalarini yozamiz:
Shunday qilib,
b) Agar reaksiya tezligi tenglama bilan ifodalangan bo'lsa, u holda idishlardagi A va B moddalarning konsentratsiyasini hisobga olgan holda, tomirlar uchun reaktsiya tezligining ifodalarini yozamiz:
Shunday qilib, ![]()
Javob: a) yo'q, b) ha.
Muammo 329.
3A+B ⇒ reaksiya boshlanganidan bir oz vaqt o'tgach 2C+D moddalarning konsentratsiyasi: [A] = 0,03 mol/l; [B] =0,01 mol/l; [C] = 0,008 mol/l. A va B moddalarning dastlabki konsentratsiyasi qanday?
Yechim:
A va B moddalarning konsentrasiyalarini topish uchun reaksiya tenglamasiga ko'ra 3 mol A va 1 mol B moddadan 1 mol C modda hosil bo'lishini hisobga olamiz.Chunki shartga ko'ra muammo, tizimning har bir litrida 0,008 mol C moddasi hosil bo'lgan, keyin unga 0,012 mol A moddasi (3/2) sarflangan. .
0,008 = 0,012) va 0,004 mol B moddasi (1/2) .
0,008 = 0,004). Shunday qilib, A va B moddalarining dastlabki kontsentratsiyasi teng bo'ladi:
[A] 0 = 0,03 + 0,012 = 0,042 mol/l;
[B] 0 = 0,01 + 0,004 = 0,014 mol / l.
Javob:[A] 0 = 0,042 mol/l; [B] 0 = 0,014 mol/l.
Muammo 330.
CO + C1 2 = COC1 2 tizimida konsentratsiya 0,03 dan 0,12 mol / l gacha, xlor konsentratsiyasi esa 0,02 dan 0,06 mol / l gacha oshirildi. Oldinga reaktsiya tezligi necha marta oshdi?
Yechim:
Konsentratsiya o'zgarishidan oldin reaktsiya tezligini tenglama bilan ifodalash mumkin:
![]()
v - reaksiya tezligi, k - reaksiya tezligi konstantasi, [CO] va boshlang'ich moddalarning konsentratsiyasi.
Reaktivlar kontsentratsiyasini oshirgandan so'ng, reaksiya tezligi:
Reaksiya tezligi necha marta oshganini hisoblab chiqamiz:
![]()
Javob: 12 marta.
10-DARS 10-sinf(o'qishning birinchi yili)
Kimyoviy kinetika asoslari. Kimyoviy muvozanat holati rejasi
1. Kimyoviy kinetika va uni o'rganish sohasi.
2. Gomogen va geterogen reaksiyalar tezligi.
3. Reaksiya tezligining turli omillarga bog'liqligi: reaksiyaga kirishuvchi moddalarning tabiati, reaktivlarning konsentratsiyasi (massalar ta'siri qonuni), harorat (van't-Xoff qoidasi), katalizator.
4. Qaytariladigan va qaytmas kimyoviy reaksiyalar.
5. Kimyoviy muvozanat va uning siljishi shartlari. Le Chatelier printsipi.
Kimyoviy reaksiyalarning tezligi va mexanizmlarini o‘rganuvchi kimyo bo‘limiga kimyoviy kinetika deyiladi. Bu bo'limdagi asosiy tushunchalardan biri kimyoviy reaksiya tezligi tushunchasidir. Ba'zi kimyoviy reaktsiyalar deyarli bir zumda sodir bo'ladi (masalan, eritmadagi neytrallanish reaktsiyasi), boshqalari ming yillar davom etadi (masalan, tog' jinslarining parchalanishi paytida grafitning loyga aylanishi).
Tezlik bir hil reaktsiya- tizimning birlik hajmida reaksiyaga kirishadigan yoki reaksiya natijasida hosil bo'lgan moddaning miqdori:

Boshqacha qilib aytganda, bir jinsli reaksiya tezligi reaktivlardan har qandayining molyar konsentratsiyasining vaqt birligidagi o'zgarishiga teng. Reaktsiya tezligi ijobiy miqdordir, shuning uchun uni reaktsiya mahsuloti konsentratsiyasining o'zgarishi orqali ifodalashda "+" belgisi, reagent konsentratsiyasi o'zgarganda esa "-" belgisi beriladi.
Geterogen reaksiya tezligi - fazaning birlik yuzasiga birlik vaqt ichida reaksiyaga kirishadigan yoki reaktsiya natijasida hosil bo'lgan moddaning miqdori:
![]()
Kimyoviy reaksiya tezligiga ta'sir qiluvchi eng muhim omillar reagentlarning tabiati va konsentratsiyasi, harorat va katalizator mavjudligidir.
Ta'sir qilish reaktivlarning tabiati bir xil sharoitda turli moddalar bir-biri bilan turli tezliklarda o'zaro ta'sir qilishida o'zini namoyon qiladi, masalan:

Ko'payganda reaktiv kontsentratsiyasi zarralar orasidagi to'qnashuvlar soni ortadi, bu esa reaktsiya tezligining oshishiga olib keladi. Reaksiya tezligining reaktivlar konsentratsiyasiga miqdoriy bog’liqligi samarali massa qonuni bilan ifodalanadi (K.M.Guldberg va P.Vaage, 1867; N.I.Beketov, 1865). Doimiy haroratda bir hil kimyoviy reaksiya tezligi reaksiyaga kirishuvchi moddalarning stexiometrik koeffitsientlariga (kontsentratsiya) teng quvvatdagi kontsentratsiyasi mahsulotiga to'g'ridan-to'g'ri proportsionaldir. qattiq moddalar hisobga olinmaydi), masalan:

Bu erda A va B gazlar yoki suyuqliklar, k - reaksiya tezligi konstantasi 1 mol/l reaktiv konsentratsiyasidagi reaksiya tezligiga teng. Doimiy k reaksiyaga kirishuvchi moddalarning xossalariga va haroratga bog'liq, lekin moddalarning konsentratsiyasiga bog'liq emas.
Reaktsiya tezligining bog'liqligi harorat Van t-Goffning (1884) eksperimental qoidasi bilan tavsiflanadi. Harorat 10 ° ga ko'tarilganda, ko'pgina kimyoviy reaktsiyalarning tezligi 2-4 marta oshadi:
harorat koeffitsienti qayerda.
Katalizator kimyoviy reaksiya tezligini o'zgartiruvchi, lekin bu reaksiya natijasida iste'mol qilinmaydigan moddadir. Ijobiy katalizatorlar (maxsus va universal), salbiy (ingibitorlar) va biologik (fermentlar yoki fermentlar) mavjud. Katalizatorlar ishtirokida reaksiya tezligining o'zgarishi deyiladi kataliz. Bir jinsli va geterogen kataliz mavjud. Agar reaktivlar va katalizator bir xil agregatsiya holatida bo'lsa, kataliz bir hil bo'ladi; turlicha - heterojen.
Gomogen kataliz:
heterojen kataliz:
Katalizatorlarning ta'sir qilish mexanizmi juda murakkab va to'liq tushunilmagan. Reagent va katalizator o'rtasida oraliq birikmalar hosil bo'lishi haqida gipoteza mavjud:
A + mushuk. ,
B AB + mushuk.
Promotorlar katalizatorlar ta'sirini kuchaytirish uchun ishlatiladi; Katalizatorlarning ta'sirini susaytiradigan katalitik zaharlar ham mavjud.
Geterogen reaksiya tezligiga ta'sir qiladi interfaziya maydoni(moddani maydalash darajasi) va reagentlarni etkazib berish tezligi va reaktsiya mahsulotlarini faza interfeysidan olib tashlash.
Barcha kimyoviy reaktsiyalar ikki turga bo'linadi: qaytarilmas va qaytmas.
Faqat bir yoʻnalishda kechadigan kimyoviy reaksiyalar qaytarilmas deyiladi., ya'ni. bu reaksiyalar maxsulotlari bir-biri bilan o'zaro ta'sirlashib, boshlang'ich moddalarni hosil qilmaydi. Reaksiyaning qaytarilmasligi uchun shartlar cho'kma, gaz yoki kuchsiz elektrolit hosil bo'lishidir. Masalan:
BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl,
K 2 S + 2HCl = 2KCl + H 2 S,
HCl + NaOH = NaCl + H 2 O.
Qaytariladigan reaktsiyalar bir vaqtning o'zida oldinga va teskari yo'nalishda sodir bo'ladigan reaktsiyalardir., Masalan:
![]()
Qaytariladigan kimyoviy reaksiya sodir bo'lganda, to'g'ridan-to'g'ri reaktsiya tezligi dastlab maksimal qiymatga ega bo'ladi, keyin esa boshlang'ich moddalar kontsentratsiyasining pasayishi tufayli kamayadi. Teskari reaktsiya, aksincha, vaqtning boshlang'ich momentida asta-sekin o'sib boruvchi minimal tezlikka ega. Shunday qilib, ma'lum bir vaqtning o'zida keladi davlat kimyoviy muvozanat , bunda oldinga boradigan reaksiya tezligi teskari reaksiya tezligiga teng. Kimyoviy muvozanat holati dinamikdir - to'g'ri va teskari reaktsiyalar davom etadi, lekin ularning tezligi teng bo'lganligi sababli, reaktsiya tizimidagi barcha moddalarning konsentratsiyasi o'zgarmaydi. Bu konsentratsiyalar muvozanat deyiladi.

To'g'ridan-to'g'ri va teskari reaktsiyalar tezligi konstantalarining nisbati doimiy qiymat bo'lib, muvozanat konstantasi deb ataladi ( TO R ) . Qattiq qattiq konsentratsiyalar muvozanat konstantasi ifodasiga kiritilmagan. Reaksiyaning muvozanat konstantasi harorat va bosimga bog'liq, lekin reaktivlarning konsentratsiyasiga va katalizator mavjudligiga bog'liq emas, bu ham oldinga, ham teskari reaktsiyalarning borishini tezlashtiradi. Ko'proq TO p, qanchalik baland amaliy yechim reaksiya mahsulotlari. Agar TO p > 1, keyin tizimda reaktsiya mahsulotlari ustunlik qiladi; Agar TO R< 1, в системе преобладают реагенты.
Kimyoviy muvozanat mobil, ya'ni. tashqi sharoitlar o'zgarganda, oldinga yoki teskari reaktsiya tezligi oshishi mumkin. Muvozanatning siljish yo‘nalishi 1884-yilda fransuz olimi Le Shatelye tomonidan ishlab chiqilgan prinsip bilan belgilanadi.Agar muvozanat sistemasiga tashqi ta’sir o‘tkazilsa, u holda muvozanat bu ta’sirga qarshi turuvchi reaksiya tomon siljiydi. Muvozanatning siljishi reaksiyaga kirishuvchi moddalar kontsentratsiyasi, harorat va bosimning o‘zgarishiga ta’sir qiladi.
Reagentlar kontsentratsiyasining ortishi va mahsulotlarni olib tashlash muvozanatning to'g'ridan-to'g'ri reaktsiyaga siljishiga olib keladi.
Tizim qizdirilganda muvozanat endotermik reaksiyaga, sovutilganda esa ekzotermik reaksiyaga siljiydi.
Gazsimon moddalar ishtirokidagi reaksiyalar uchun bosimning oshishi muvozanatni gaz molekulalari sonining kamayishi bilan yuzaga keladigan reaksiya tomon siljitadi. Agar reaksiya gazsimon moddalar molekulalari sonini o'zgartirmasdan davom etsa, bosimning o'zgarishi hech qanday holatda muvozanatning siljishiga ta'sir qilmaydi.
1. Idishda moddasi miqdori 4,5 mol bo'lgan A gazi va 3 mol miqdoridagi B gazi aralashtirildi. A va B gazlari A + B = C tenglamasiga muvofiq reaksiyaga kirishadi. Bir muncha vaqt o'tgach, tizimda 2 mol modda miqdori bilan gaz C hosil bo'ldi. Tizimda reaksiyaga kirishmagan A va B gazlarning qancha miqdori qoladi?
Reaksiya tenglamasidan quyidagicha xulosa chiqariladi:
Dn(A) = Dn(B) = Dn(C) = 2 mol,
bu yerda Dn - reaksiya jarayonida modda miqdorining o'zgarishi.
Shunday qilib, idishda nima qoladi:
n 2 (A) = n 1 (A) - Dn (A); n 2 (A) = (4,5 - 2) mol = 2,5 mol;
n 2 (B) = n 1 (B) - Dn (B); n 2 (B) = (3 - 2) mol = 1 mol.
2. Reaksiya tenglama bo‘yicha boradi: 2A + B ⇄ C va A moddada ikkinchi tartib va B moddada birinchi tartib. Vaqtning dastlabki momentida reaksiya tezligi 15 mol/l × s ni tashkil qiladi. B moddaning 50% reaksiyaga kirishgan momentdagi tezlik konstantasini va to'g'ridan-to'g'ri reaksiya tezligini hisoblang, agar dastlabki konsentratsiyalar: C(A) = 10 mol/l; C(B) = 5 mol/l. Kimyoviy reaksiya tezligi qanday o'zgaradi?

Reaksiyaga kirgan C(B) ga teng:
C (B) = 0,5 5 = 2,5 mol/l.
Shunga ko'ra, reaksiyaga kirgan C(A) ga teng:
2 mol/l A - 1 mol/l B
C(A) - 2,5 mol/l B
![]()
Reaksiyadan keyin C(A) va C(B):
C(A) = 10 - 5 = 5 mol/l,
C (B) = 5 - 2,5 = 2,5 mol / l.
Oldinga reaktsiya tezligi quyidagilarga teng bo'ladi:
Kimyoviy reaktsiya tezligi o'zgaradi:

ya'ni 8 barobarga kamayadi.
3. A va B moddalar orasidagi reaksiya tenglama bilan ifodalanadi: A + 2B = C va birinchi tartib A modda uchun, ikkinchisi B modda uchun. Moddalarning dastlabki konsentrasiyalari: C(A) = 2 mol. /l; C(B) = 4 mol/l; tezlik konstantasi 1,0 ga teng. A moddaning konsentratsiyasi 0,3 mol/l ga kamayganda, reaksiyaning dastlabki tezligini va ma’lum vaqtdan keyingi tezligini toping.
Ommaviy harakat qonuniga ko'ra:
Agar A moddaning konsentratsiyasi 0,3 mol/l ga kamaysa, B moddaning konsentratsiyasi 0,3 × 2 = 0,6 mol/l ga kamayadi. Reaktsiya sodir bo'lgandan keyin kontsentratsiyalar:
4. Yopiq idishda sodir bo'ladigan to'g'ridan-to'g'ri va teskari gaz fazali reaktsiyalarning tezligi tenglamalar bilan ifodalanadi:
![]()
![]()
Massalar ta'siri qonuniga ko'ra, dastlabki sharoitlarda to'g'ri va teskari reaktsiyalarning tezligi tengdir:
Gazsimon tizimlar uchun bosimning 3 baravar oshishi gaz aralashmasi hajmining 3 baravar kamayishiga olib keladi, barcha uchta gazning kontsentratsiyasi bir xil miqdorda oshadi va ikkala reaktsiyaning tezligi mos ravishda teng bo'ladi:
Reaktsiya tezligi nisbati:


Shunday qilib, to'g'ridan-to'g'ri reaktsiya tezligi 27 marta, teskari reaktsiya 9 marta ortadi.
5. Reaksiya 50 0 S haroratda 2 minut 15 sekund davom etadi. 70 0 S haroratda bu reaksiya qancha vaqt ichida tugaydi, agar bu harorat oralig'ida g tezligining harorat koeffitsienti 3 bo'lsa?
Harorat 50 dan 70 0 C gacha ko'tarilganda, reaksiya tezligi Van't-Xoff qoidasiga muvofiq ortadi:
Qayerda = 70 0 S, = 50 0 C, a va berilgan haroratlarda reaksiya tezligi.
Biz olamiz:

bular. reaksiya tezligi 9 marta ortadi.
Ta'rifga ko'ra, reaktsiya vaqti reaktsiya tezligiga teskari proportsionaldir, shuning uchun:
haroratlarda reaksiya vaqti qayerda va Va .
Bu erdan biz olamiz:

= 135 s (2 min 15 s) ekanligini hisobga olib, haroratdagi reaksiya vaqtini aniqlaymiz :
![]()
6. dan harorat ortganda kimyoviy reaksiya tezligi necha marta ortadi = 10 0 C gacha = 80 0 S , g tezlikning harorat koeffitsienti 2 bo'lsa?
Van't-Xoff qoidasidan:

Reaksiya tezligi 128 marta ortadi.
7. Dorining bemor organizmidan chiqarilish kinetikasini o‘rganayotganda, 3 soatdan keyin bemorning tanasida preparatning dastlabki miqdorining 50% qolishi aniqlandi. Agar bu birinchi tartibli reaksiya ekanligi ma'lum bo'lsa, preparatni inson tanasidan olib tashlash reaktsiyasining yarimparchalanish davri va tezligi konstantasini aniqlang.
Belgilangan vaqt davomida preparatning 50% tanadan chiqarilganligi sababli, keyin t 1/2 = 3 soat. Tenglamadan reaksiya tezligi konstantasini hisoblaymiz:

8. Laboratoriya tekshiruvlari vaqtida suvli eritmalar preparatning gidrolizlanishi tufayli preparatning konsentratsiyasi sutkada 0,05 mol/l dan 0,03 mol/l gacha kamayganligi aniqlandi. Dori gidroliz reaksiyasining yarim yemirilish davrini hisoblang.
Gidroliz reaktsiyalari odatda suvning sezilarli darajada ko'pligi bilan sodir bo'lganligi sababli, uning konsentratsiyasi doimiy bo'lishi mumkin. Binobarin, reaksiya jarayonida faqat preparatning konsentratsiyasi o'zgaradi va gidroliz reaktsiyasini birinchi tartibli reaksiya deb hisoblash mumkin.
Reaksiya tezligi konstantasining qiymatini tenglamadan topamiz:

9. Preparatning bemor tanasidan yarim yemirilish davri (birinchi tartibli reaksiya) 5 soat. Preparatning 75% tanadan chiqariladigan vaqtni aniqlang.
Preparatning 75% tanadan chiqarilganda C/C 0 nisbati 0,25 ni tashkil qiladi. Bunday holda formuladan foydalanish qulay:


![]() ,
,
10. Saxaroza gidroliz reaksiyasi tezligi konstantasi 2,31×10 - 3 soat - 1 ga teng. Hisoblash:
1) reaksiyaning yarim yemirilish davri;
2) saxarozaning 20% gidrolizga uchragan vaqt;
3) glyukozaning qaysi qismi 5 kundan keyin gidrolizga uchraydi.
1. Yarim yemirilish davri quyidagilarga teng:

2. 20% saxaroza gidrolizga uchragach, C/C 0 nisbati 0,8 ni tashkil qiladi. Demak:
3. 5 kundan keyin (120 soat) C/C 0 nisbati:

Natijada, glyukozaning 24% gidrolizlangan.
11. Ma'lum bir birinchi tartibli reaksiya jarayonida 30 daqiqada moddaning dastlabki miqdorining 60% i transformatsiyaga uchraydi. 1 soatdan keyin moddaning qaysi qismi qolishini aniqlang.
1. 30 daqiqadan so'ng qolgan moddaning miqdori:
C 1 = C 0 - 0,6 C 0 = 0,4 × C 0.
ya'ni C 0 / C 1 nisbati 2,5 ga teng.
2. Reaksiya tezligi konstantasi topilsin:
3. 1 soatdan keyin qolgan C2 moddaning miqdori quyidagi formula bilan aniqlanadi:
Shunday qilib, 1 soatdan keyin asl moddaning 16% qoladi.
O'z-o'zini nazorat qilish uchun savollar
1. Kimyoviy reaksiya tezligi nima deyiladi?
2. Gomogen reaksiyaning haqiqiy tezligi nimaga teng?
3. Gomogen reaksiya tezligi qanday o'lchamga ega?
4. Geterogen reaksiya tezligi nima deyiladi?
5. Geterogen reaksiya tezligi qanday o'lchamga ega?
6. Reaksiya tezligiga ta’sir etuvchi omillarni sanab bering.
7. Massalar ta’siri qonunini tuzing.
8. Nima jismoniy ma'no reaksiya tezligi konstantalari? Reaksiya tezligi konstantasi nimaga bog'liq va nimaga bog'liq emas?
9. Reaksiyaning borish tartibi qanday? Nol, birinchi, ikkinchi va uchinchi tartibli reaksiya tenglamalariga misollar keltiring.
10. Reaksiya tezligi konstantasining o‘lchami reaksiya tartibiga bog‘liqmi?
11. Reaksiyaning molekulyarligi nima deyiladi?
13. Oddiy va aniqlang murakkab reaktsiyalar. Murakkab reaksiyalarning tasnifini keltiring.
14. Vant-Xoff qoidasini tuzing. Olib keling matematik ifoda Van't Xoff qoidalari.
15. Reaksiya tezligi aktivlanish energiyasiga qanday bog’liq? Arrenius tenglamasini yozing.
16. Faollashgan kompleks nima? Nima uchun reaksiyalar faollashgan komplekslarning hosil bo'lish bosqichlari orqali o'tadi?
17. Katalizator nima? Gomogen va geterogen kataliz. Nima uchun reaksiyalar katalizatorlar ishtirokida tezroq boradi?
18. Fermentativ kataliz nima? Michaelis-Menten tenglamasini yozing.
Mustaqil hal qilish uchun vazifalar variantlari
Variant №1
1. A va B moddalar orasidagi reaksiya 2A + B = C tenglama bilan ifodalanadi va A modda uchun ikkinchi tartib va B modda uchun birinchi tartibdir. Moddalarning dastlabki konsentrasiyalari: C 0 (A) = 0,4 mol/l. ; C 0 (B) = 0,8 mol/l; k = 0,6. A moddaning konsentratsiyasi 0,2 mol/l ga kamayganda, reaksiyaning dastlabki tezligini va ma’lum vaqtdan keyingi tezligini toping.
2. Reaksiya tezligi 64 marta oshishi uchun haroratni necha darajaga oshirish kerak? Reaksiya tezligining harorat koeffitsienti g 2 ga teng.
a) tizimdagi bosim ikki baravar oshganda?
b) gazlar hajmi ikki barobar ortganda?
Variant № 2
1. Reaksiya tenglama bo‘yicha boradi: A + B = C va A moddada va B moddada birinchi tartibli. A ning konsentratsiyasi 2 dan 8 mol/l ga, B ning konsentratsiyasi esa 3 dan oshdi. 9 mol/l. Oldinga reaktsiya tezligi necha marta oshdi?
2. 150 0 S da reaksiya 10 daqiqada tugaydi. Harorat koeffitsienti g ni 2 ga teng qilib, 170 0 S da reaksiya necha daqiqadan keyin tugashini hisoblang.
3. Reaksiya tezligi tenglama bilan ifodalanadi: ![]() Boshlang'ich moddalar konsentratsiyasi 3 marta oshganda reaksiya tezligi necha marta o'zgaradi?
Boshlang'ich moddalar konsentratsiyasi 3 marta oshganda reaksiya tezligi necha marta o'zgaradi?
Variant №3
1. Reaksiya tenglama bilan ifodalanadi: A + B = C va A va B moddalarida birinchi tartib bor. Dastlabki konsentratsiyalarda C 0 (A) = 3 mol/l va C 0 (B) = 5 mol/l. , bevosita reaksiya tezligi 0,3 mol/l×s ga teng. A ning konsentratsiyasi 2 mol/l ga kamayganda ma’lum vaqtdan keyin tezlik konstantasini va reaksiya tezligini aniqlang.
2. Harorat 10 dan 70 0 S gacha ko’tarilganda kimyoviy reaksiya tezligi g tezligining harorat koeffitsienti 2 ga teng bo’lsa, uning tezligi necha marta ortadi?
3. Reaksiya tezligi A (s) + 2B (gaz) = C (s) tenglama bilan ifodalanadi: ![]() Agar B konsentratsiyasi ikki baravar oshirilsa, reaksiya tezligi qanday o'zgaradi?
Agar B konsentratsiyasi ikki baravar oshirilsa, reaksiya tezligi qanday o'zgaradi?
Variant № 4
1. Reaksiya quyidagi tenglama bo‘yicha boradi: 2A + B = 2C va A modda uchun ikkinchi, B modda uchun birinchi tartib bor. B moddaning 40% reaksiyaga kirishgan momentdagi to‘g‘ridan-to‘g‘ri reaksiya tezligini hisoblang, agar dastlabki konsentratsiyalar: C 0 (A) = 8 mol/l; C 0 (B) = 4 mol/l; k = 0,4.
2. 100 0 S da ba’zi reaksiya 5 daqiqada tugaydi. Tezlik g harorat koeffitsienti 3 bo'lsa, u 80 0 S da qancha vaqt tugaydi?
3. 3A + B = C reaksiya tezligi tenglama bilan ifodalanadi: ![]() Oldinga reaktsiya tezligi necha marta o'zgaradi:
Oldinga reaktsiya tezligi necha marta o'zgaradi:
a) A moddaning konsentratsiyasi ikki baravar oshganda?
b) boshlang'ich moddalar konsentratsiyasining bir vaqtning o'zida 2 marta kamayishi bilan?
Variant №5
1. Harorat 40 dan 70 0 S gacha ko’tarilganda ma’lum reaksiya tezligi 8 marta oshdi. g qiymatini aniqlang.
2. Reaksiya tenglama bo‘yicha boradi: A + 3B = 2C va A moddada birinchi, B moddada ikkinchi. Moddalarning boshlang‘ich konsentrasiyalari: C 0 (A) = 2 mol/l; C 0 (B) = 6 mol/l; k = 1. To'g'ridan-to'g'ri reaktsiyaning boshlang'ich tezligini va A moddaning konsentratsiyasi 1 mol/l ga kamaygan momentdagi tezligini hisoblang. Kimyoviy reaksiya tezligi qanday o'zgaradi?
3. Gaz fazasida sodir bo'ladigan va tenglamalarga bo'ysunadigan to'g'ri va teskari reaksiyalar tezligi qanday o'zgaradi?
Variant №6
1. Yopiq idishda 1 mol A va 3 mol B dan iborat gazlar aralashmasi mavjud bo'lib, u tenglama bo'yicha reaksiyaga kirishadi: A + 3B = 2C. To'g'ridan-to'g'ri reaktsiya tezligi tenglama bilan tavsiflanadi ![]() 0,5 mol A reaksiyasidan keyin oldinga siljish tezligi necha marta kamayadi?
0,5 mol A reaksiyasidan keyin oldinga siljish tezligi necha marta kamayadi?
2. Reaksiya tezligi 9 marta oshishi uchun haroratni necha darajaga oshirish kerak, agar g tezligining harorat koeffitsienti 3 bo'lsa?
3. To'g'ridan-to'g'ri gaz fazasi reaktsiyasining tezligi qanday o'zgaradi: 2A = B, tartibi 0,5 deb baholanadi, tizimdagi bosimning izotermik pasayishi bilan 3 marta?
Variant № 7
1. A va B moddalar orasidagi reaksiya tenglama bo‘yicha boradi: A + 2B = C va A va B moddalarida birinchi tartibli. Reaksiyaga kiruvchi moddalarning dastlabki konsentrasiyalari: C 0 (A) = 1,5 mol/ l; C 0 (B) = 3 mol/l; k = 0,4. A ning 75% reaksiyaga kirishganda, vaqtning dastlabki momentida va ma'lum vaqtdan keyin kimyoviy reaksiya tezligini hisoblang.
2. Haroratning 30 0 S ga ortishi bilan reaksiya tezligi 27 marta ortasa, g tezligining harorat koeffitsienti nimaga teng?
3. Gaz fazasida sodir bo'ladigan va tenglamalarga bo'ysunadigan to'g'ri va teskari reaksiyalar tezligi qanday o'zgaradi?
bosimning 2 marta izotermik ortishi bilan?
Variant № 8
1. 1 mol A va 2 mol B moddadan iborat 1 litrli eritmada quyidagi reaksiya sodir bo'ladi: A + 3B = 2C + D. To'g'ridan-to'g'ri reaktsiya A moddada birinchi, B moddada ikkinchi tartibli. 0,65 mol A moddasi reaksiyaga kirishgandan so'ng to'g'ridan-to'g'ri reaksiya tezligi necha marta kamayadi?
2. Harorat -5 dan +5 0 S gacha ko'tarilganda bakterial gidroliz tezligi (fermentativ jarayon) 4 marta ortadi. Reaksiya tezligi g harorat koeffitsientining qiymatini toping.
3. 2A (gaz) = B (gaz) + C (qattiq) sistemada A moddaning konsentratsiyasini necha marta oshirish kerak, shunda ikkinchi tartibli reaktsiya bo'lgan to'g'ridan-to'g'ri reaksiya tezligi oshadi. 4 marta?
Variant № 9
1. Reaksiya tenglama bo‘yicha boradi: 2A + B = 2C va A moddada ikkinchi, B moddada birinchi tartib. To‘g‘ridan-to‘g‘ri reaksiya tezligi 8 mol/l×s. B moddaning 30% reaksiyaga kirishgan momentdagi tezlik konstantasini va to'g'ridan-to'g'ri reaksiya tezligini hisoblang, agar dastlabki konsentratsiyalar: C 0 (A) = 2 mol/l; C 0 (B) = 1 mol/l. Kimyoviy reaksiya tezligi qanday o'zgaradi?
2. Harorat 10 dan 50 0 S gacha ko`tarilganda reaksiya tezligi 16 marta oshdi. Tezlik g harorat koeffitsientini aniqlang.
3. Reaksiya tenglama bo‘yicha boradi: A + B = C + D + E va A moddada birinchi tartib, B moddada nolga teng. Reaksiyaga kirishuvchi aralashmani 3 marta suyultirilgandan keyin to‘g‘ridan-to‘g‘ri reaksiya tezligi qanday o‘zgaradi?
Variant № 10
1. Reaksiya tenglama bo‘yicha boradi: A + 2B = AB 2 va A moddada birinchi, B moddada ikkinchi. Reaksiya tezligi konstantasi 0,01. Dastlabki konsentratsiyalarda reaksiya tezligini hisoblang: C 0 (A) = 0,8 mol/l; C 0 (B) = 0,8 mol/l va 0,2 mol/l AB 2 moddasi hosil bo`lish vaqtidagi reaksiya tezligi.
2. Harorat 30 dan 60 0 S gacha ko’tarilganda kimyoviy reaksiya tezligi g tezligining harorat koeffitsienti 3 ga teng bo’lsa, uning tezligi necha marta ortadi?
3. Bemorning tanasidan preparatning yarim yemirilish davri (birinchi tartibli reaksiya) 6 soat. Inson tanasida preparatning tarkibini 8 marta kamaytirish uchun qancha vaqt kerakligini aniqlang.
Variant № 11
1. Reaksiya tenglama bo'yicha boradi: A + B = 2C va A va B moddalarida birinchi tartibli. Moddalarning boshlang'ich konsentratsiyasi: C 0 (A) = 0,3 mol/l; C 0 (B) = 0,5 mol/l; k = 0,1. A ning konsentratsiyasi 0,1 mol/l ga kamayganda, bir muncha vaqt o'tgach, dastlabki reaksiya tezligini va reaksiya tezligini toping.
2. 100 0 S da ba’zi reaksiyalar 16 daqiqada tugaydi. g tezligining harorat koeffitsientini 2 ga teng qilib, bir xil reaksiya 140 0 C da necha daqiqadan keyin tugashini hisoblang?
3. Bemorning tanasidan preparatning yarimparchalanish davri (birinchi tartibli reaksiya) 2 soat. Preparatning 99% tanadan chiqariladigan vaqtni aniqlang.
Variant № 12
1. Reaksiya tenglama bo‘yicha boradi: A + 2B = C va A moddada birinchi, B moddada ikkinchi. Moddalarning boshlang‘ich konsentrasiyalari: C 0 (A) = 0,9 mol/l; C 0 (B) = 1,5 mol/l; k = 0,6. Reaksiyaning boshlang‘ich tezligini va ma’lum vaqtdan keyin, ya’ni A moddaning 50% sarflangandagi tezligini toping.
2. Kimyoviy reaksiya tezligining harorat koeffitsienti nimaga teng? , agar harorat 30 0 S ga oshishi bilan tezlik 27 marta oshadi?
3. Ma’lum bir birinchi tartibli reaksiyaning yarim yemirilish davri 30 minut. Dastlabki miqdorning qaysi qismi 1 soatdan keyin qolishini hisoblang.
Variant № 13
1. Reaksiya tenglama bo‘yicha boradi: 2A + B = 2C va A moddada ikkinchi, B moddada birinchi tartib. Reaksiya tezligi konstantasi 5 × 10 - 2. Reaksiya tezligini dastlabki konsentratsiyalarda hisoblang C 0 (A) = 0,4 mol/l; C 0 (B) = 0,9 mol/l va 0,1 mol S modda hosil bo`lish vaqtidagi reaksiya tezligi.
2. 10 0 S haroratda reaksiya 80 daqiqada boradi. Agar g tezligining harorat koeffitsienti 2 bo'lsa, reaksiya 20 daqiqada qanday haroratda tugaydi?
3. davomida laboratoriya tadqiqotlari 24 soat ichida bemorning tanasida preparatning konsentratsiyasi 0,1 mol / l dan 0,02 mol / l gacha kamayganligi aniqlandi. Bu birinchi darajali reaksiya deb faraz qilib, preparatning yarim yemirilish davrini hisoblang.
Variant № 14
1. Hajmi 1 litr bo'lgan yopiq idishda 1 mol gaz A va 3 mol gaz B dan iborat gazlar aralashmasi mavjud bo'lib, u tenglama bo'yicha reaksiyaga kirishadi: A + 3B = 2C. To'g'ridan-to'g'ri reaktsiya A moddaga nisbatan birinchi tartibli va B moddaga nisbatan ikkinchi tartibli. 0,5 mol gaz A reaksiyaga kirishgandan so'ng oldinga reaktsiya tezligi qanday o'zgaradi?
2. Tizimning harorati 10 dan 50 0 S gacha ko'tarilganda kimyoviy reaksiya tezligi 16 marta oshdi. Reaksiya tezligi g harorat koeffitsientini aniqlang .
3. Baxtsiz hodisa paytida Chernobil atom elektr stantsiyasi(1986) Cs-137 radionuklidi chiqarildi, uning yarimparchalanish davri 30 yil. Hozirgi vaqtda tanaga kirgan radionuklidning qaysi qismi qolganligini hisoblang.
Variant № 15
1. Reaksiya tenglama bo'yicha boradi: A + B = C A moddada va B moddada birinchi darajaga ega. Moddalarning dastlabki konsentrasiyalarida C 0 (A) = 0,6 mol/l; C 0 (B) = 0,8 mol/l, reaksiya tezligi 0,03 mol/l×s. A moddaning konsentratsiyasi 0,3 mol/l ga pasayganda ma’lum vaqtdan keyin tezlik konstantasini va reaksiya tezligini aniqlang.
2. 0 0 C da reaksiya tezligi 1 mol/l×s. Reaksiya tezligining harorat koeffitsienti 3 ga teng bo'lsa, 30 0 C da bu reaksiya tezligini hisoblang.
3. 25 0 S da pestitsidlar gidrolizlanish tezligi konstantasi 0,32 s - 1 ga teng. Namunadagi pestitsidning dastlabki konsentratsiyasi 2,5 mol/l ni tashkil etdi. Pestitsid konsentratsiyasi 0,01 mol/l gacha kamayishi uchun qancha vaqt ketishini hisoblang.
Variant № 16
1. Parchalanish reaksiyasi tenglama bo’yicha boradi: 2A = 2B + C va A moddada ikkinchi tartibli. Bu reaksiyaning 200 0 S da tezlik konstantasi 0,05 ga teng. Dastlabki kontsentratsiya C(A) = 2 mol/l. A moddaning 80% parchalangan boshlang'ich moment va momentdagi ko'rsatilgan haroratdagi reaktsiya tezligini aniqlang.
2. To'g'ridan-to'g'ri reaksiya tezligi qanday o'zgaradi: 2A (qattiq) + 3B (gaz) = 2C (solv), A moddada nol tartibli va B moddada uchinchi tartib, agar tizimdagi bosim bo'lsa 3 marta ko'paydi?
3. Ma’lum bir birinchi tartibli reaksiya jarayonida 45 daqiqada moddaning dastlabki miqdorining 20% i transformatsiyaga uchraydi. 1,5 soatdan keyin moddaning qaysi qismi qolishini aniqlang.
Variant № 17
1. Gazlarning o'zaro ta'siri tenglama bo'yicha boradi: A + 2B = 2C va A moddada birinchi, B moddada ikkinchi. Gazlarning boshlang'ich konsentrasiyalari teng: C 0 (A) = 2 mol/ l; C 0 (B) = 4 mol/l; k = 0,02. A moddasining 50% reaksiyaga kirishgandan so‘ng, boshlang‘ich vaqtda va ma’lum vaqtdan keyin to‘g‘ridan-to‘g‘ri reaksiya tezligini hisoblang.
2. 20 0 S da reaksiya 2 daqiqada sodir bo'ladi. Agar g = 2 bo'lsa, 0 0 C da bir xil reaksiya qancha vaqt davomida sodir bo'ladi?
3. Chumoli kislota oltin yuzasida uglerod oksidi (IV) va vodorodga parchalanadi. Bu reaksiyaning 140 0 S da tezlik konstantasi 5,5 × 10 - 4 min –1 ga, 185 0 C da esa 9,2 × 10 - 3 min –1 ga teng. Bu reaksiyaning aktivlanish energiyasini aniqlang.
Variant № 18
1. Reaksiya tenglama bo‘yicha boradi: 2A + B = 2C va A va B moddalarida birinchi tartibli. Reaksiya tezligi 0,5 mol/l×s. Moddalarning dastlabki konsentrasiyalari: C(A) = 6 mol/l; C(B) = 3 mol/l. Bu reaksiyaning tezlik konstantasini va B moddaning konsentratsiyasi 1 mol/l ga pasayganda ma’lum vaqtdan keyin reaksiya tezligini aniqlang.
2. 20 0 S da reaksiya 2 daqiqada sodir bo'ladi. Agar g = 2 bo'lsa, 50 0 C da bir xil reaksiya qancha vaqt davomida sodir bo'ladi?
3. Qamish shakarining 25 0 S da inversiya reaktsiyasi tezligi konstantasi 9,67 × 10 - 3 min - 1 ga, 40 0 ° C da esa 73,4 × 10 - 3 min - 1 ga teng. Belgilangan harorat oralig'ida ushbu reaksiyaning faollashuv energiyasini aniqlang.
Qaytarib bo'lmaydigan reaktsiyalar
1. 2A + B ® A 2 B reaksiya tezligi A moddaning konsentratsiyasini 2 marta, B moddaning konsentratsiyasini 2 marta kamaytirsa, qanday o'zgaradi?
2. 2A 2 (g) + B 2 (g) ® 2A 2 B (g) sistemada B 2 moddaning konsentratsiyasini necha marta oshirish kerakki, A moddaning konsentratsiyasi 4 marta kamayganda, tezligi to'g'ridan-to'g'ri reaktsiyaning o'zgarmaydi?
3. CO + C1 2 ® COC1 2 tizimida CO ning konsentratsiyasi 0,03 dan 0,12 mol/l gacha, C1 2 konsentratsiyasi esa 0,02 dan 0,06 mol/l gacha oshirildi. Oldinga reaktsiya tezligi necha marta oshdi?
4. N 2 (g) + 3H (g) ® 2 NH 3 to'g'ridan-to'g'ri reaksiya tezligi qanday o'zgaradi, agar a) tizimdagi bosim 3 marta oshirilsa; b) tovushni 2 marta kamaytirish; v) N 2 ning konsentratsiyasini 4 marta oshiradi?
5. 2NO + O 2 ® 2 NO 2 reaksiyasi natijasida NO 2 hosil bo'lish tezligi 1000 marta oshishi uchun bosimni necha marta oshirish kerak?
6. Uglerod oksidi (II) va xlor o'rtasidagi reaksiya CO + C1 2 ® COC1 2 tenglamasi bo'yicha boradi. a) CO kontsentratsiyasi 2 marta oshganda reaksiya tezligi qanday o'zgaradi; b) konsentratsiyasi C1 2 2 marta; v) ikkala moddaning konsentratsiyasi 2 marta?
7. Reaksiya gaz fazasida boradi. Reaksiyada ikkita A va B moddalar ishtirok etadi.Ma’lumki, A komponentining konsentratsiyasi ikki barobar oshganda tezlik 2 marta, B komponentning konsentratsiyasi ikki barobar oshganda esa tezlik 4 marta ortadi. Hodisa sodir bo'ladigan reaksiya tenglamasini yozing. Umumiy bosim 3 marta oshganda reaksiya tezligi qanday o'zgaradi?
8. A, B va D moddalarning o'zaro ta'sir qilish reaksiya tezligi o'rganiladi.B va D ning doimiy konsentratsiyasida A moddaning konsentratsiyasining 4 marta ortishi tezlikning 16 marta oshishiga olib keladi. Agar A va D moddalarning doimiy konsentratsiyasida B moddasining konsentratsiyasi 2 marta oshsa, u holda tezlik faqat 2 marta oshadi. A va B ning doimiy konsentratsiyasida D moddasining kontsentratsiyasini ikki baravar oshirish tezlikning 4 barobar oshishiga olib keladi. Reaksiya tenglamasini yozing.
9. Reaksiya tezligi konstantasi 2 × 10 -1 l × mol -1 × s bo'lsa, A(g) + B(g) ® AB(g) kimyoviy reaksiya tezligini va A va moddalarning konsentratsiyasini aniqlang. B mos ravishda 0,025 va 0,01 mol/l. Bosim 3 marta oshganda reaksiya tezligini hisoblang.
10. A + 2B ® AB 2 reaksiya tezligi konstantasining qiymatini toping, agar A va B moddalarning konsentrasiyalarida mos ravishda 0,1 va 0,05 mol/l ga teng bo‘lsa, reaksiya tezligi 7 × 10 -5 mol/ bo‘lsa. (l×s) .
11. 2 litr hajmli idishda 4,5 mol miqdoridagi A gazi va 3 mol miqdoridagi B gazi aralashtiriladi. Gazlar A + B = C tenglamasiga muvofiq reaksiyaga kirishadi. 20 soniyadan so'ng tizimda 2 mol modda miqdori bilan gaz C hosil bo'ldi. Aniqlash o'rtacha tezlik reaktsiyalar. Qanday miqdordagi A va B moddalar reaksiyaga kirishmagan?
12. A va B moddalar orasidagi reaksiya A + B ® C tenglamasi bilan ifodalanadi. Dastlabki konsentratsiyalar [A] O = 0,03 mol/l, [B] O = 0,05 mol/l. Reaksiya tezligi konstantasi 0,4 ga teng. Hosil bo‘lgan S moddaning konsentratsiyasi 0,01 mol/l ga teng bo‘lganda, bir muncha vaqt o‘tgach, dastlabki reaksiya tezligini va reaksiya tezligini toping.
13. orasidagi reaksiya gazsimon moddalar A va B tenglama bilan ifodalanadi A + B ® C. Moddalarning dastlabki kontsentratsiyasi [A] 0 = 0,03 mol / l, [B] 0 = 0,03 mol / l. Reaksiya tezligi konstantasi 0,1 ga teng. Bir muncha vaqt o'tgach, A moddasining konsentratsiyasi 0,015 mol/l ga kamaydi. Kimyoviy reaksiya tezligi dastlabki tezlikka teng bo'lishi uchun umumiy bosimni necha marta oshirish kerak?
14. Reaksiya tezligi 27 marta oshishi uchun haroratni necha darajaga oshirish kerak? Reaksiya tezligining harorat koeffitsienti 3 ga teng.
15. 20 o C da reaksiya 2 daqiqada boradi. Bu reaksiya a) 50 o C da, b) 0 o C da qancha vaqt ichida sodir bo ladi? Reaksiya tezligining harorat koeffitsienti 2 ga teng.
16. 30 o S haroratda reaksiya 25 minutda, 50 o S da 4 minutda boradi. Reaksiya tezligining harorat koeffitsientini hisoblang.
17. 0 o C da reaksiya tezligi 1 mol/l×s. Tezlikning harorat koeffitsienti 3 ga teng bo'lsa, bu reaksiyaning 30 o C da tezligini hisoblang.
18. Haroratning 50 o S ga oshishi bilan reaksiya tezligi 32 marta oshdi. Kimyoviy reaksiya tezligining harorat koeffitsientini hisoblang.
19. 25 o S da bir xil tezlikda ikkita reaksiya sodir bo ladi. Birinchi reaksiya tezligining harorat koeffitsienti 2,0 ga, ikkinchisi esa 2,5 ga teng. 95 o C da bu reaksiyalar tezligi nisbatini toping.
20. Haroratning 290 dan 300 K gacha oshishi bilan reaksiya tezligi 2 marta oshsa, reaksiyaning faollanish energiyasi nimaga teng?
21. Agar katalizatordan foydalanish natijasida aktivlanish energiyasini 4 kJ/mol ga kamaytirish mumkin bo'lsa, 298 K da sodir bo'ladigan reaksiya tezligi necha marta ortadi?
22. 300 K da tezligi 280 K dan 10 marta katta bo lgan reaksiyaning aktivlanish energiyasining qiymati nimaga teng.
23. O 3 (g) +NO(g) ® O 2 (g) +NO 2 (g) reaksiyasining faollanish energiyasi 40 kJ/mol. Harorat 27 dan 37 o C gacha ko'tarilganda reaksiya tezligi necha marta o'zgaradi?
24. Bir katalizator 300 K da aktivlanish energiyasini 20 kJ/molga, ikkinchisi esa 40 kJ/mol ga kamaytiradi. Qaysi katalizator samaraliroq? Muayyan katalizatordan foydalanganda reaksiya tezligi nisbatini hisoblab javobni asoslang.
25. 150 o C da ba'zi reaksiyalar 16 daqiqada tugaydi. Reaksiya tezligining harorat koeffitsientini 2,5 ga teng qilib, a) 200 o C da, b) 80 o C da amalga oshirilsa, bu reaksiya qaysi vaqtdan keyin tugashini hisoblang.
26. Harorat 10 o C ga oshganda kimyoviy reaksiya tezligi ikki barobar ortadi. 20 o C da 0,04 mol/(l×s) ga teng. a) 40 o C, b) 0 o C da bu reaksiya tezligi qanday bo ladi?
27. 20 o C da kimyoviy reaksiya tezligi 0,04 mol/(l×s) ga teng. Agar aktivlanish energiyasi 70 kJ/mol ekanligi ma'lum bo'lsa, 70 o C da bu reaksiya tezligini hisoblang.
28. Agar 120 o C da bu reaksiyaning tezlik konstantasi 5,88 × 10 -4, 170 o C da - 6,7 × 10 -2 ga teng bo lsa, g reaksiyaning harorat koeffitsientini hisoblang.
29. Harorat koeffitsienti g = 2 bo'lsa, harorat 300 K dan 400 K gacha ko'tarilganda kimyoviy reaksiya tezligi necha marta o'zgaradi? Bu reaksiyaning aktivlanish energiyasi qanday?
30. Tizimdagi bosim 4 martaga va harorat bir vaqtning o'zida 40 o C ga ko'tarilganda kimyoviy reaksiya A + 2B ® C tezligi necha marta ortadi. Reaktivlar gazlardir. Reaksiyaning harorat koeffitsienti 2 ga teng.
31. 2A(g) + B(g) ® 2C(g) kimyoviy reaksiya tezligi sistemadagi barcha moddalarning bosimi 3 marta va sistemaning harorati bir vaqtda 30 ga pasayganda necha marta kamayadi. o C? Reaksiya tezligi g harorat koeffitsienti 2 ga teng.
32. A va B gazsimon moddalar orasidagi reaksiya A + B ® C tenglamasi bilan ifodalanadi. Moddalarning dastlabki konsentrasiyalari [A] 0 = 0,05 mol/l va [B] 0 = 0,05 mol/l. Biroz vaqt o'tgach, moddalarning konsentratsiyasi ikki baravar kamaydi. Reaksiya tezligi dastlabki tezlikka teng bo'lishi uchun haroratni qanday o'zgartirish kerakligini aniqlang, agar a) reaksiyaning harorat koeffitsienti 2, b) faollanish energiyasi 70 kJ, reaksiya harorati 27 o C bo'lsa?
33. Ma'lumki, harorat 290 dan 300 K gacha ko'tarilganda kimyoviy reaksiya tezligi ikki barobar ortadi. Faollashtirish energiyasini hisoblang. Agar tizimga ushbu reaksiyaning faollashuv energiyasini 10 kJ/mol ga kamaytiruvchi katalizator kiritilsa, bu reaksiya tezligi 310 K da qanday o zgaradi?
Kimyoviy muvozanat
1. Muayyan haroratda 2NO 2 «2NO+O 2 sistemasida muvozanat = 0,4 mol/l, = 0,2 mol/l, = 0,1 mol/l konsentratsiyalarda o`rnatildi. Kislorodning dastlabki konsentratsiyasi nolga teng bo‘lsa, muvozanat konstantasini va NO 2 ning boshlang‘ich konsentratsiyasini toping. To'g'ridan-to'g'ri reaktsiya endotermik bo'lsa, qanday shartlar muvozanatning NO hosil bo'lishiga qarab siljishiga yordam beradi?
2. A+B«C+D sistemaning muvozanat konstantasi birlikka teng. 3 mol A va 5 mol B moddani aralashtirsa, A moddaning necha foizi aylanadi? To'g'ridan-to'g'ri reaktsiya ekzotermik bo'lsa, qanday shartlar muvozanatning B hosil bo'lishiga qarab siljishiga yordam beradi?
3. Tizim uchun
CO (G) + H 2 O (G) “CO 2 (G) + H 2 (G)
0 = 0 =0,03 mol/l, 0 = 0 =0. Muvozanat konsentratsiyasi bo'lsa, muvozanat konstantasini hisoblang karbonat angidrid 0,01 mol/l ga teng. To'g'ridan-to'g'ri reaktsiya endotermik bo'lsa, muvozanatning CO ning hosil bo'lishiga qarab siljishiga qanday shartlar yordam beradi?
4. Tizim uchun
2NO (G) +Cl 2 (G) “2NOCl (G)
0 =0,5 mol/l, 0 =0,2 mol/l, 0 =0 mol/l. Muvozanat konstantasini toping, agar uning boshlanishi vaqtida 20% azot oksidi reaksiyaga kirsa. To'g'ridan-to'g'ri reaktsiya ekzotermik bo'lsa, muvozanatning NOCl hosil bo'lishiga qarab siljishiga qanday shartlar yordam beradi?
H 2(G) + I 2(G) «2HI (G) ,
agar 1 mol yod va 2 mol vodorod sig'imi 10 litr bo'lgan idishga joylashtirilsa (KC = 50). To'g'ridan-to'g'ri reaktsiya ekzotermik bo'lsa, muvozanatning yod hosil bo'lishiga qarab siljishiga qanday sharoitlar yordam beradi?
6. CO (G) + H 2 O (G) sistemasi uchun “CO 2 (G) + H 2 (G), 0 = 0 =1 mol/l, 0 = 0 =0. Agar muvozanat konstantasi K C = 1 bo'lsa, muvozanat aralashmasining tarkibini (% hajm) hisoblang. Agar teskari reaksiya ekzotermik bo'lsa, muvozanatning vodorod hosil bo'lishiga qarab siljishiga qanday shartlar yordam beradi?
7. Yopiq idishda AB (G) “A (G) + B (G) reaksiyasi boradi. Muvozanat konstantasi K C =0,04. AB ning muvozanat konsentratsiyasi 0,02 mol/l bo'lsa, AB ning boshlang'ich konsentratsiyasini toping. Agar teskari reaksiya ekzotermik bo'lsa, muvozanatning A hosil bo'lishiga qarab siljishiga qanday shartlar yordam beradi?
8. 800˚C haroratda 10 litr hajmli yopiq idishda CaCO 3 (T) “CaO (T) + CO 2 (G) muvozanati o'rnatildi. Muvozanat konstantasi K P =300 kPa. CaCO 3 ning qanday massasi parchalanadi? To'g'ridan-to'g'ri reaktsiya endotermik bo'lsa, muvozanatning karbonat angidrid hosil bo'lishiga qanday sharoitlar yordam beradi?
9. Muayyan haroratda yopiq idishda Fe (T) + H 2 O (G) “FeO (T) + H 2 (G) muvozanati o'rnatildi. K P = 1 va vodorodning dastlabki parsial bosimi nolga teng bo'lsa, reaksiyaga kirishgan suvning ulushini aniqlang. Agar teskari reaksiya ekzotermik bo'lsa, muvozanatning vodorod hosil bo'lishiga qarab siljishiga qanday shartlar yordam beradi?
10. Vodorodning 2HI (G) “H 2 (G) + I 2 (G) sistemasidagi muvozanat konsentratsiyasini aniqlang, agar HI ning dastlabki konsentratsiyasi 0,05 mol/l va muvozanat konstantasi K C = 0,02 bo lsa. To'g'ridan-to'g'ri reaktsiya endotermik bo'lsa, muvozanatning HI hosil bo'lishiga qarab siljishiga qanday shartlar yordam beradi?
Kimyoviy reaksiyalar tezligi Kimyoviy reaksiyalarning tezligi va mexanizmini o'rganuvchi kimyo bo'limiga kimyoviy kinetika deyiladi. Kimyoviy reaksiya tezligi - reaksiya fazosining bir birligidagi vaqt birligidagi elementar o'zaro ta'sirlar soni. Bu ta'rif ham bir jinsli, ham heterojen jarayonlar uchun amal qiladi. Birinchi holda, reaksiya maydoni reaksiya idishining hajmi, ikkinchisida esa reaktsiya sodir bo'lgan sirtdir. O'zaro ta'sir vaqt birligida reagentlar yoki reaktsiya mahsulotlarining kontsentratsiyasini o'zgartirganligi sababli. Bunday holda, reaktsiyada ishtirok etuvchi barcha moddalar kontsentratsiyasining o'zgarishini kuzatishning hojati yo'q, chunki uning stexiometrik tenglamasi reaktivlarning kontsentratsiyasi o'rtasidagi munosabatni o'rnatadi. Reaktivlarning kontsentratsiyasi ko'pincha 1 litr (mol / L) dagi mollar soni sifatida ifodalanadi. Kimyoviy reaksiya tezligi reaksiyaga kirishuvchi moddalarning tabiatiga, konsentratsiyasiga, haroratiga, moddalarning aloqa yuzasining kattaligiga, katalizatorlar mavjudligiga va boshqalarga bog'liq. , va monomolekulyar reaksiya haqida gapiring; elementar aktda ikki xil molekulalarning to'qnashuvi sodir bo'lganda, bog'liqlik quyidagi ko'rinishga ega bo'ladi: u - k[A][B] va ular bimolekulyar reaksiya haqida gapiradi; elementar aktda uch molekulaning to'qnashuvi sodir bo'lganda, tezlikning konsentratsiyaga bog'liqligi to'g'ri bo'ladi: v - k [A] [B] [C] va ular trimolekulyar reaktsiya haqida gapiradi. Barcha tahlil qilingan bog'liqliklarda: v - reaktsiya tezligi; [A], [B], [C] - reaksiyaga kirishuvchi moddalar konsentratsiyasi; k - mutanosiblik koeffitsienti; reaksiya tezligi konstantasi deb ataladi. v = k, reaksiyaga kirishuvchi moddalar yoki ularning mahsuloti konsentratsiyalari birlikka teng bo'lganda. Tezlik konstantasi reaktivlarning tabiatiga va haroratga bog'liq. Oddiy reaksiyalar tezligining (ya’ni bir elementar harakat orqali sodir bo‘ladigan reaksiyalar) konsentratsiyaga bog‘liqligi 1867 yilda K.Guldberg va P.Veyj tomonidan o‘rnatilgan massalar ta’siri qonuni bilan tavsiflanadi: kimyoviy reaksiya tezligi to‘g‘ridan-to‘g‘ri proporsionaldir. reaksiyaga kirishuvchi moddalar kontsentratsiyasining mahsuloti ularning stexiometrik koeffitsientlarini quvvatga ko'taradi. Masalan, reaksiya uchun 2NO + 02 = 2N02; v - k2 va uch marta ortadi Toping: Yechish: 1) Reaksiya tenglamasini yozing: 2SO + 02 = 2S02. Massalar ta'siri qonuniga ko'ra v - k[C0]2. 2) [CO] = a ni belgilaymiz; = b, keyin: v = k a2 b. 3) Boshlang'ich moddalarning konsentratsiyasi 3 marta oshganda, biz quyidagilarga erishamiz: [CO] = 3a, a = 3b. 4) u1 reaksiya tezligini hisoblang: - k9a23b - k27a% a agar k27 D2b 27 v k a2b Javob: 27 marta. 3-misol Agar reaksiya tezligining harorat koeffitsienti 3 ga teng bo'lsa, harorat 40 °C ga oshganda kimyoviy reaksiya tezligi necha marta ortadi? Berilgan: = 40 °C da Y - 3 Toping: 2 Yechish: 1) Van't-Xoff qoidasiga ko'ra: h-U vt2 = vh y 10, 40 va, - vt > 3 10 - vt -81. 2 1 1 Javob: 81 marta. a 4-misol A va B moddalar orasidagi reaksiya 2A + B * "C sxema bo'yicha boradi. A moddaning konsentratsiyasi 10 mol/l, B moddasi esa 6 mol/l. Reaksiya tezligi konstantasi 0,8 l2 4 mol"2 sek"1. Kimyoviy reaksiyaning dastlabki momentdagi, shuningdek, reaksiya aralashmasida B moddasining 60% qolgan momentdagi tezligini hisoblang. Berilgan: k - 0,8 l2 mol"2 sek"1 [A] = 10 mol/l. [B] = 6 mol/l Toping: "boshlang! ^ Yechish: 1) Dastlabki momentdagi reaksiya tezligini toping: v - k[A]2 [B], r> = 0,8 102 b - 480 mol - l sek. "1. boshi 2) Bir muncha vaqt o'tgach, reaksiya aralashmasida B moddasining 60% qoladi.Keyin: Demak, [B] ga kamaygan: 6 - 3,6 = 2,4 mol/l. 3) Reaksiya tenglamasidan kelib chiqadiki, A va B moddalar bir-biri bilan 2:1 nisbatda o'zaro ta'sir qiladi, shuning uchun [A] 4,8 mol/l ga kamaygan va teng bo'lgan: [A] = 10 - 4,8 = 5,2 mol. /l. 4) Hisoblang, agar: d) = 0,8 * 5,22 3,6 = 77,9 mol l "1 * sek"1. Javob: g>boshlash ~ 480 mol l sek"1, g/ = 77,9 mol l-1 sek"1. 5-misol 30 °C haroratdagi reaksiya 2 daqiqada davom etadi. Agar bu harorat oralig'ida reaksiya tezligining harorat koeffitsienti 2 ga teng bo'lsa, bu reaksiya 60 ° C haroratda qancha vaqt ichida tugaydi? Berilgan: t1 = 30 °C t2 = 60 °C 7 = 2 t = 2 min = 120 sek Toping: h Yechish: 1) Van't Hoff qoidasiga muvofiq: vt - = y 1 vt - = 23 = 8 .Vt 2) Reaksiya tezligi reaksiya vaqtiga teskari proporsional, shuning uchun: Javob: t = 15 sek. Mustaqil yechish uchun savol va topshiriqlar 1. Reaksiya tezligini aniqlang. Turli tezliklarda sodir bo'ladigan reaksiyalarga misollar keltiring. 2. Tizimning doimiy hajmida sodir bo'ladigan kimyoviy reaksiyaning haqiqiy tezligining ifodasi quyidagicha yoziladi: dC v = ±--. d t iboraning o'ng tomonida qaysi hollarda ijobiy va qaysi hollarda salbiy belgi kerakligini ko'rsating. 3. Kimyoviy reaksiya tezligi qanday omillarga bog'liq? 4. Aktivatsiya energiyasi deb nimaga aytiladi? Kimyoviy reaksiya tezligiga qaysi omil ta'sir qiladi? 5. Harorat oshishi bilan reaksiya tezligining kuchli ortishi nima bilan izohlanadi? 6. Kimyoviy kinetikaning asosiy qonuni - massalar ta'siri qonunini aniqlang. Kim va qachon tuzilgan? 7. Kimyoviy reaksiyaning tezlik konstantasi nima deb ataladi va u qanday omillarga bog'liq? 8. Katalizator nima va u kimyoviy reaksiya tezligiga qanday ta'sir qiladi? 9. Inhibitorlar qo’llaniladigan jarayonlarga misollar keltiring. 10. Promouterlar nima va ular qayerda ishlatiladi? 11. Qanday moddalar “katalitik zaharlar” deb ataladi? Bunday moddalarga misollar keltiring. 12. Gomogen va geterogen kataliz nima? Ularning katalitik jarayonlaridan foydalangan holda jarayonlarga misollar keltiring. 13. Gaz aralashmasining hajmi 2 marta kamaytirilsa, 2S0 + 02 = 2S02 reaksiya tezligi qanday o'zgaradi? 14. Harorat 10 °C ga ko'tarilganda reaksiya tezligi 2 marta oshishi ma'lum bo'lsa, harorat 10 ° C dan 40 ° C gacha ko'tarilganda kimyoviy reaksiya tezligi necha marta ortadi? 15. Har 10 °C harorat oshishi bilan A + B = C reaksiya tezligi uch marta ortadi. Harorat 50 °C ga oshganda reaksiya tezligi necha marta ortadi? 16. Vodorod va brom o'rtasidagi reaksiya tezligi boshlang'ich moddalarning konsentratsiyasini 4 marta oshirsa, necha marta ortadi? 17. Harorat 40 °C (y = 2) ga oshganda reaksiya tezligi necha marta ortadi? 18. Agar sistemadagi bosim ikki barobar oshirilsa, 2NO + 02 ^ 2N02 reaksiya tezligi qanday o'zgaradi? 19. Reaksiya tezligi 125 marta oshishi uchun N2 + 3H2^2NH3 sistemada vodorod konsentratsiyasini necha marta oshirish kerak? 20. Azot oksidi (II) va xlor o'rtasidagi reaksiya 2NO + C12 2NOC1 tenglama bo'yicha boradi; Quyidagi hollarda reaksiya tezligi qanday o'zgaradi: a) azot oksidi kontsentratsiyasi ikki barobar oshganda; b) xlor kontsentratsiyasi ikki baravar ortdi; v) ikkala moddaning konsentratsiyasi ikki barobar ortadi? . 21. 150 °C da ba'zi reaktsiyalar 16 daqiqada tugaydi. Harorat koeffitsientini 2,5 ga teng qilib, xuddi shu reaktsiya 80 ° C da tugaydigan vaqtni hisoblang. 22. Reaksiya tezligi 32 marta oshishi uchun haroratni necha darajaga oshirish kerak? Reaksiya tezligining harorat koeffitsienti 2. 23. 30 °C da reaksiya 3 daqiqada sodir bo'ladi. Reaksiya tezligining harorat koeffitsienti 3 ga teng bo'lsa, 50 °C da bir xil reaksiya qancha vaqt davom etadi. 24. 40 ° C haroratda reaktsiya 36 daqiqada, 60 ° C da 4 daqiqada davom etadi. . Reaksiya tezligining harorat koeffitsientini hisoblang. 25. 10 °C da reaksiya tezligi 2 mol/l. Reaksiya tezligining harorat koeffitsienti 2 ga teng bo'lsa, bu reaksiyaning tezligini 50 °C da hisoblang.