A kémiai egyensúly egy ilyen visszafordítható állapot kémiai reakció
aA+ b B= c C+ d D,
amelyben a reakcióelegyben lévő reagensek koncentrációja az idő múlásával nem változik. A kémiai egyensúly állapotát jellemzik állandó Kémiai egyensúly :
Ahol C i- az összetevők koncentrációja egyensúlyi a tökéletes keverék.
Az egyensúlyi állandó kifejezhető egyensúlyi móltörtekkel is X i alkatrészek:
A gázfázisban végbemenő reakcióknál célszerű az egyensúlyi állandót az egyensúlyi parciális nyomásokkal kifejezni. P i alkatrészek:
Mert ideális gázok P i = C i RTÉs P i = X és P, Ahol P tehát a teljes nyomás K P, K CÉs K X a következő kapcsolattal függnek össze:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Az egyensúlyi állandó összefügg r G o kémiai reakció:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
változás r G vagy r F kémiai reakcióban adott (nem feltétlenül egyensúlyi) parciális nyomáson P i vagy koncentrációk C i komponensek kiszámíthatók az egyenlet segítségével kémiai reakció izotermák (van't Hoff izotermák):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Alapján Le Chatelier elve, ha egy egyensúlyban lévő rendszerre külső hatást fejtenek ki, akkor az egyensúly úgy tolódik el, hogy a külső hatás hatása csökkenjen. Így a nyomás növekedése az egyensúlyt a gázmolekulák számának csökkenése felé tolja el. Bármely reakciókomponens hozzáadása egy egyensúlyi keverékhez az egyensúlyt ennek a komponensnek a mennyiségének csökkenése felé tolja el. A hőmérséklet növekedése (vagy csökkenése) az egyensúlyt egy olyan reakció felé tolja el, amely a hő elnyelésével (kibocsátásával) megy végbe.
Az egyensúlyi állandó hőmérséklettől való mennyiségi függését az egyenlet írja le kémiai reakció izobárok (van't Hoff izobárok)
![]() (9.9)
(9.9)
És kémiai reakció izohorjai (van't Hoff isochores)
![]() . (9.10)
. (9.10)
A (9.9) egyenlet integrálása azzal a feltételezéssel, hogy r H a reakció nem függ a hőmérséklettől (ami szűk hőmérsékleti tartományokban igaz), a következőket adja:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Ahol C – integrációs állandó. Így a függőség ln K P 1-től /T lineárisnak kell lennie, és az egyenes lejtése: r H/R.
Integráció belül K 1 , K 2, és T 1, T 2 ad:
 (9.13)
(9.13)
 (9.14)
(9.14)
Ezzel az egyenlettel, ismerve az egyensúlyi állandókat két különböző hőmérsékleten, kiszámíthatjuk r H reakciók. Ennek megfelelően tudva r H reakciót és az egyensúlyi állandót egy hőmérsékleten, akkor kiszámíthatja az egyensúlyi állandót egy másik hőmérsékleten.
PÉLDÁK
CO(g) + 2H 2 (g) = CH3OH(g)
500 K-nál. f G o CO(g) és CH 3 OH(g) esetén 500 K hőmérsékleten –155,41 kJ. mol –1 és –134,20 kJ. mol –1 ill.
Megoldás. G o reakciók:
r G o= f G o(CH3OH) – f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Példa 9-2. A reakció egyensúlyi állandója
egyenlő K P = 1,64 10 –4 400 o C-on. Milyen össznyomást kell kifejteni N 2 és H 2 ekvimoláris keverékére, hogy a N 2 10%-a NH 3 -dá alakuljon? A gázokat ideálisnak tekintik.
Megoldás. Hagyja, hogy egy mól N 2 reagáljon. Akkor
| N 2 (g) | + | 3H 2 (g) | = | 2NH3 (g) | |
| Eredeti mennyiség | 1 | 1 | |||
| Egyensúlyi mennyiség | 1– | 1–3 | 2 (összesen: 2–2) | ||
| Egyensúlyi móltört: |
Ennélfogva, K X =  És K P = K X . P –2
=
És K P = K X . P –2
=  .
.
Ha a kapott képletbe behelyettesítjük a = 0,1-et, megkapjuk
1.64 10 –4 = , ahol P= 51,2 atm.
, ahol P= 51,2 atm.
Példa 9-3. A reakció egyensúlyi állandója
CO(g) + 2H 2 (g) = CH3OH(g)
500 K-en egyenlő K P = 6,09 10 –3 . Egy 1 mol CO-ból, 2 mol H 2-ből és 1 mol inert gázból (N2) álló reakcióelegyet 500 K hőmérsékletre és 100 atm össznyomásra melegítenek. Számítsa ki az egyensúlyi keverék összetételét!
Megoldás. Hagyja, hogy egy mól CO reagáljon. Akkor
| Patkószeg) | + | 2H 2 (g) | = | CH3OH (g) | |
| Eredeti mennyiség: | 1 | 2 | 0 | ||
| Egyensúlyi mennyiség: | 1– | 2–2 | |||
| Összesen egyensúlyi keverékben: | 3-2 mol komponens + 1 mol N 2 = 4-2 mol | ||||
| Egyensúlyi móltört | |||||
Ennélfogva, K X =  És K P = K X . P–2 =
És K P = K X . P–2 = ![]() .
.
Így 6,09 10 –3 = ![]() .
.
Ezt az egyenletet megoldva = 0,732 kapunk. Ennek megfelelően az egyensúlyi keverékben lévő anyagok móltörtjei egyenlők: = 0,288, = 0,106, = 0,212 és = 0,394.
Példa 9-4. A reakcióhoz
N 2 (g) + 3H 2 (g) = 2NH3 (g)
298 K-nál K P = 6,0 10 5, a f H o(NH 3) = –46,1 kJ. mol –1 . Becsülje meg az egyensúlyi állandó értékét 500 K-en.
Megoldás. A reakció standard moláris entalpiája a
r H o= 2f H o(NH 3) = –92,2 kJ. mol –1 .
A (9.14) egyenlet szerint 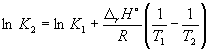 =
=
Ln (6,0 10 5) + ![]() = –1,73, honnan K 2 =
0.18.
= –1,73, honnan K 2 =
0.18.
Figyeljük meg, hogy az exoterm reakció egyensúlyi állandója a hőmérséklet emelkedésével csökken, ami megfelel Le Chatelier elvének.
FELADATOK
- 1273 K-en és 30 atm össznyomáson egyensúlyi keverékben
- 2000 o C-on és 1 atm össznyomáson a víz 2%-a hidrogénné és oxigénné disszociál. Számítsa ki a reakció egyensúlyi állandóját!
- A reakció egyensúlyi állandója
- A reakció egyensúlyi állandója
- Egy 3 literes, 1,79 10 –2 mol I 2 -t tartalmazó edényt 973 K-re melegítettünk. A nyomás az edényben egyensúlyi állapotban 0,49 atm. Feltételezve, hogy a gázok ideálisak, számítsuk ki a reakció egyensúlyi állandóját 973 K-en
- A reakcióhoz
- A reakcióhoz
- Egy 0,341 mol PCl 5-öt és 0,233 mol N 2 -t tartalmazó 1 literes edényt 250 o C-ra melegítettünk. A teljes nyomás egyensúlyi állapotban 29,33 atm volt. Feltéve, hogy minden gáz ideális, számítsa ki az edényben lezajló reakció egyensúlyi állandóját 250 o C-on
- A reakció egyensúlyi állandója
- 25 o C-on f G o(NH 3) = –16,5 kJ. mol –1 . Kiszámítja r G az NH 3 képződési reakciói 3 atm, 1 atm és 4 atm parciális N 2, H 2 és NH 3 parciális nyomáson. Milyen irányban megy végbe spontán módon a reakció ilyen körülmények között?
- Exoterm reakció
- A borneol (C 10 H 17 OH) izoborneollá történő izomerizációjának gázfázisú reakciójának egyensúlyi állandója 503 K-on 0,106. 7,5 g borneol és 14,0 g izoborneol keverékét egy 5 literes edénybe helyeztük és tartottuk. 503 K-en az egyensúly eléréséig. Számítsa ki a borneol és az izoborneol móltörtjeit és tömegeit az egyensúlyi keverékben!
- Egyensúly a reakcióban
- Számítsa ki azt a teljes nyomást, amelyet 3 rész H 2 és 1 rész N 2 keverékére kell kifejteni, hogy 400 o C-on 10 térfogat% NH 3-t tartalmazó egyensúlyi keveréket kapjunk. A reakció egyensúlyi állandója
- 250 o C-on és 1 atm össznyomáson a reakció során a PCl 5 80%-ban disszociál
- 2000 o C-on a reakcióhoz
- Számítsd ki annak a reakciónak a standard entalpiáját, amelynek egyensúlyi állandója!
a) 2-szeresére nő, b) 2-szeresére csökken, ha a hőmérséklet 298 K-ról 308 K-ra változik. - A 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) reakció egyensúlyi állandójának a 300 K és 600 K közötti hőmérséklettől való függését az egyenlet írja le
CO 2 (g) + C (tv) = 2CO (g)
17 térfogat% CO 2 -t tartalmaz. Hány százalékos CO 2 lesz a gázban 20 atm össznyomás mellett? Milyen nyomáson lesz a gáz 25% CO 2 -t tartalmaz?
H 2O (g) = H2 (g) + 1/2O 2 (g) ilyen körülmények között.
CO (g) + H 2 O (g) = CO 2 (g) + H 2 (g)
500 o C-on egyenlő Kp= 5,5. 1 mol CO-ból és 5 mol vízből álló keveréket erre a hőmérsékletre melegítettük. Számítsa ki a H 2 O mólhányadát az egyensúlyi keverékben!
N 2 O 4 (g) = 2NO 2 (g)
25 o C-on egyenlő Kp= 0,143. Számítsa ki azt a nyomást, amely egy 1 literes edényben alakul ki, amelybe 1 g N 2 O 4 került ezen a hőmérsékleten!
I 2 (g) = 21 (g).
250 o C-on r G o = –2508 J mol –1. Mekkora össznyomáson lesz a PCl 5 PCl 3 és Cl 2 átalakulási foka 250 o C-on 30%?
2HI (g) = H 2 (g) + I 2 (g)
egyensúlyi állandó K P = 1,83 10 –2 698,6 K-en. Hány gramm HI keletkezik, ha 10 g I 2 -t és 0,2 g H 2 -t erre a hőmérsékletre melegítünk egy háromliteres edényben? Mekkora a H 2, I 2 és HI parciális nyomása?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(g) + 2H 2 (g) = CH3OH(g)
500 K-en egyenlő K P = 6,09 10 –3 . Számítsa ki a metanol 90%-os termeléséhez szükséges össznyomást, ha a CO-t és a H2-t 1:2 arányban vesszük.
CO(g) + 2H 2 (g) = CH3OH(g)
egyensúlyban van 500 K és 10 bar nyomáson. Ha a gázok ideálisak, hogyan befolyásolják a következő tényezők a metanol hozamát: a) növekszik T; b) előléptetés P; c) inert gáz hozzáadása at V= const; d) inert gáz hozzáadása at P= const; e) H2 hozzáadása at P= const?
2NOCl(g) = 2NO(g) + Cl 2 (g)
227 o C-ra és 1,0 bar össznyomásra állítjuk be, amikor a NOCl parciális nyomása 0,64 bar (kezdetben csak NOCl volt jelen). Kiszámítja r G o reakcióhoz. Milyen össznyomáson lesz a Cl 2 parciális nyomása 0,10 bar?
N 2 (g) + 3H 2 (g) = 2NH3 (g)
400 o C-on egyenlő K = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
Mekkora lesz a PCl 5 disszociációja, ha N 2 -t adunk a rendszerhez úgy, hogy a nitrogén parciális nyomása 0,9 atm? A teljes nyomást 1 atm értéken tartják.
N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 –3 . N 2, O 2, NO és inert gáz egyensúlyi keveréke 1 bar össznyomáson 80 térfogat% N 2 -t és 16 % O 2 -t tartalmaz. Hány térfogatszázalék a NEM? Mekkora az inert gáz parciális nyomása?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
1885-ben a francia fizikus és kémikus Le Chatelier fejlesztette ki, 1887-ben pedig Braun német fizikus támasztotta alá a kémiai egyensúly törvényét és a kémiai egyensúlyi állandót, valamint vizsgálta ezek függését a különböző külső tényezők hatásától.
A kémiai egyensúly lényege
Az egyensúly egy állapot, ami azt jelenti, hogy a dolgok mindig mozognak. A termékeket reagensekre bontják, és a reagenseket termékekké egyesítik. A dolgok mozognak, de a koncentráció ugyanaz marad. A reakciót kettős nyíllal írják egyenlőségjel helyett, jelezve, hogy megfordítható.

Klasszikus minták
A múlt században a vegyészek felfedeztek bizonyos mintákat, amelyek lehetővé teszik a reakció irányának megváltoztatását ugyanabban a tartályban. A kémiai reakciók végbemenetelének ismerete hihetetlenül fontos, mindkettő számára laboratóriumi kutatásés az ipari termelés. Ahol nagyon fontos képes irányítani ezeket a jelenségeket. Az emberi természetből fakad, hogy sok természetes folyamatba, különösen a visszafordíthatóba beavatkozik, hogy azokat később saját hasznára fordítsa. A kémiai reakciók ismerete hasznosabb lesz, ha elsajátítja a karokat, hogy tökéletesen irányítsa őket.
A vegyészek a kémiában a tömeghatás törvényét használják a reakciók sebességének helyes kiszámítására. Egyértelművé teszi, hogy egyik sem fog befejeződni, ha zárt rendszerben zajlik. A keletkező anyagok molekulái állandó és véletlenszerű mozgásban vannak, és hamarosan bekövetkezhet egy fordított reakció, amelyben a kiindulási anyag molekulái helyreállnak.
Leggyakrabban az iparban használják nyílt rendszerek. Az edények, készülékek és egyéb tartályok, ahol kémiai reakciók játszódnak le, zárva maradnak. Erre azért van szükség, hogy ezen eljárások során ki lehessen vonni a kívánt terméket és megszabadulni a haszontalan reakciótermékektől. Például a szenet nyitott kemencében elégetik, a cementet nyitott kemencében állítják elő, a kohók állandó levegőellátással működnek, és az ammónia szintetizálása úgy történik, hogy magát az ammóniát folyamatosan eltávolítják.

Reverzibilis és irreverzibilis kémiai reakciók
Az elnevezés alapján megadhatjuk a megfelelő definíciókat: a reakciókat akkor tekintjük visszafordíthatatlannak, ha befejeződnek, nem változtatják meg irányukat és egy adott úton haladnak, függetlenül a nyomáseséstől és a hőmérséklet-ingadozástól. Az övék jellegzetes tulajdonsága az, hogy egyes termékek elhagyhatják a reakcióteret. Így például elő lehet állítani gázt (CaCO 3 = CaO + CO 2), csapadékot (Cu(NO 3) 2 + H 2 S = CuS + 2HNO 3) vagy másokat. ha a folyamat során felszabadul nagyszámú hőenergia, például: 4P + 5O 2 = 2P 2 O 5 + Q.
A természetben előforduló reakciók szinte mindegyike visszafordítható. Függetlenül az olyan külső körülményektől, mint a nyomás és a hőmérséklet, szinte minden folyamat egyidejűleg, különböző irányban lejátszódhat. Ahogy a kémiai tömeghatás törvénye kimondja, az elnyelt hő mennyisége megegyezik a felszabaduló mennyiséggel, ami azt jelenti, hogy ha az egyik reakció exoterm volt, akkor a második (fordított) endoterm lesz.
Kémiai egyensúly: kémiai egyensúlyi állandó
A reakciók a kémia „igéi” – a kémikusok által tanulmányozott tevékenységek. Sok reakció előrehalad a befejezésig, majd leáll, ami azt jelenti, hogy a reagensek teljesen átalakulnak termékekké anélkül, hogy vissza tudnának térni eredeti állapotukba. Egyes esetekben a reakció valóban visszafordíthatatlan, például ha az égés során mind fizikai, mind kémiai változások következnek be, de sok más körülmény is van, amikor ez nem csak lehetséges, hanem folyamatos is, mivel az első reakció termékei a második reakcióban reagensekké válnak. .
Egyensúlynak nevezzük azt a dinamikus állapotot, amelyben a reagensek és a termékek koncentrációja állandó marad. Lehetőség van az anyagok viselkedésének előrejelzésére bizonyos, az egyes vegyi anyagok előállításának költségeit csökkenteni kívánó iparágakra vonatkozó törvények segítségével. A kémiai egyensúly fogalma hasznos az emberi egészséget fenntartó vagy potenciálisan veszélyeztető folyamatok megértésében is. A kémiai egyensúlyi állandó egy reakciótényező érték, amely az ionerősségtől és a hőmérséklettől függ, és független az oldatban lévő reaktánsok és termékek koncentrációjától.

Az egyensúlyi állandó számítása
Ez a mennyiség dimenzió nélküli, vagyis nincs meghatározott számú egysége. Bár a számítást általában két reagensre és két termékre írják, bármennyi reakcióban résztvevőre működik. Az egyensúlyi állandó számítása és értelmezése attól függ, hogy a kémiai reakció homogén vagy heterogén egyensúlyt foglal magában. Ez azt jelenti, hogy minden reagáló komponens lehet tiszta folyadék vagy gáz. A heterogén egyensúlyt elérő reakciók esetében általában nem egy fázis van, hanem legalább kettő. Például folyadékok és gázok, vagy mindkettő folyadék.

Egyensúlyi állandó érték
Egy adott hőmérséklethez csak egy értéke van az egyensúlyi állandónak, amely csak akkor változik, ha a reakció végbemenetelének hőmérséklete egyik vagy másik irányba változik. Lehetséges bizonyos előrejelzéseket tenni egy kémiai reakcióra az alapján, hogy az egyensúlyi állandó nagy vagy kicsi. Ha az érték nagyon nagy, akkor az egyensúly kedvez a jobb reakciónak, és több termék keletkezik, mint amennyi reagens volt. A reakció ebben az esetben „teljesnek” vagy „mennyiséginek” nevezhető.
Ha az egyensúlyi állandó értéke kicsi, akkor ez egy bal oldali reakciót kedvez, ahol a reaktánsok száma nagyobb volt, mint a keletkezett termékek. Ha ez az érték nullára hajlik, akkor feltételezhetjük, hogy a reakció nem megy végbe. Ha az előre és fordított reakciók egyensúlyi állandójának értékei közel azonosak, akkor a reaktánsok és a termékek mennyisége is közel azonos lesz. Ez a fajta reakció reverzibilisnek tekinthető.

Tekintsünk egy konkrét reverzibilis reakciót
Vegyünk ebből kettőt kémiai elem, mint a jód és a hidrogén, amelyek összekeverve új anyagot adnak - hidrogén-jodidot.
Legyen v 1 az előrehaladó reakció sebessége, v 2 a fordított reakció sebessége, k az egyensúlyi állandó. A tömeghatás törvényét felhasználva a következő kifejezést kapjuk:
v 1 = k 1 * c(H 2) * c (I 2),
v 2 = k 2 * c 2 (HI).
Ha a jód (I 2) és a hidrogén (H 2) molekuláit összekeverjük, kölcsönhatásuk megkezdődik. A kezdeti szakaszban ezen elemek koncentrációja maximális, de a reakció végére az új vegyület - a hidrogén-jodid (HI) - koncentrációja maximális lesz. Ennek megfelelően a reakciósebesség eltérő lesz. A legelején maximálisak lesznek. Idővel eljön az a pillanat, amikor ezek az értékek egyenlőek, és ezt az állapotot kémiai egyensúlynak nevezik.
A kémiai egyensúlyi állandó kifejezését általában szögletes zárójelekkel jelöljük: , , . Mivel egyensúlyban a sebességek egyenlőek, akkor:
k 1 = k 2 2 ,
Ez megadja a kémiai egyensúlyi állandó egyenletét:
k 1 /k 2 = 2 / = K.

Le Chatelier-Brown elv
A következő minta létezik: ha egy egyensúlyban lévő rendszeren bizonyos hatást fejtenek ki (például hőmérséklet vagy nyomás változtatásával megváltoztatjuk a kémiai egyensúly feltételeit), akkor az egyensúly eltolódik, hogy részben ellensúlyozza a változás hatását. Ez az elv a kémia mellett többre is vonatkozik különböző formák a farmakológia és a közgazdaságtan területére.

Kémiai egyensúlyi állandó és kifejezési módok
Az egyensúlyi kifejezés a termékek és a reagensek koncentrációjával fejezhető ki. Csak vegyi anyagok a vizes és gázfázisban az egyensúlyi képletben szerepel, mivel a folyadékok és szilárd anyagok koncentrációja nem változik. Milyen tényezők befolyásolják a kémiai egyensúlyt? Ha tiszta folyadékról, ill szilárd, úgy tekintjük, hogy K = 1, és ennek megfelelően nem veszik figyelembe, kivéve az erősen koncentrált oldatokat. Például a tiszta víz aktivitása 1.
Egy másik példa a szilárd szén, amely két szén-monoxid molekula reakciójával képződik szén-dioxidés szén. Az egyensúlyt befolyásoló tényezők közé tartozik egy reagens vagy termék hozzáadása (a koncentráció változása befolyásolja az egyensúlyt). A reagens hozzáadása egyensúlyhoz vezethet a jobb oldalon kémiai egyenlet, ahol a termék több formája is megjelenik. A termék hozzáadása a bal oldalon egyensúlyba hozható, amint a reaktánsok több formája válik elérhetővé.

Egyensúly akkor jön létre, ha egy mindkét irányban lezajló reakcióban állandó a termékek és a reagensek aránya. Általában a kémiai egyensúly statikus, mivel a termékek és a reaktánsok mennyiségi aránya állandó. Közelebbről megvizsgálva azonban kiderül, hogy az egyensúlyi folyamat valójában nagyon dinamikus folyamat, mivel a reakció mindkét irányba azonos ütemben halad.
A dinamikus egyensúly egy példa az állandósult állapotú függvényre. Egy állandósult állapotú rendszer esetében a jelenleg megfigyelt viselkedés a jövőben is folytatódik. Ezért, ha a reakció eléri az egyensúlyt, a termék és a reagens koncentrációjának aránya változatlan marad, bár a reakció folytatódik.

Hogyan beszéljünk egyszerűen bonyolult dolgokról?
Az olyan fogalmakat, mint a kémiai egyensúly és a kémiai egyensúlyi állandó, meglehetősen nehéz megérteni. Vegyünk egy példát az életből. Előfordult már, hogy elakadt egy hídon két város között, és azt vette észre, hogy a másik irányba zökkenőmentes és szabályos a forgalom, miközben Ön reménytelenül elakad a forgalomban? Ez nem jó.
Mi lenne, ha az autók mindkét oldalon egyenletesen és azonos sebességgel haladnának? Az autók száma mindkét városban változatlan marad? Ha mindkét városba való be- és kilépés sebessége azonos, és az egyes városokban lévő autók száma időben stabil, ez azt jelenti, hogy az egész folyamat dinamikus egyensúlyban van.
PÉLDA
Számítsa ki a reverzibilis kémiai egyensúlyi állandóját! homogén reakció, CO + H 2 O = CO 2 + H 2, azon a tényen alapulva, hogy az anyagok egyensúlyi koncentrációja:
[CO]p = 0,045 mol/l,
[H2O] p = 0,064 mol/l,
[CO 2] p = 0,18 mol/l.
Adott:
[CO]p = 0,045 mol/l
[H20] p = 0,064 mol/l
[CO 2] p = 0,18 mol/l
Megoldás:
A reakciótermékek mólaránya tehát 1:1
[CO 2 ] p = [H 2 ] p = 0,18 mol/l.
A (2.1) kifejezés alapján kiszámítjuk a kémiai egyensúlyi állandó értékét:
Az x.r. = [CO 2 ] p [H 2 ] p / [CO 2 ] p [H 2 O] p = 0,18 0,18/0,045 0,064
Válasz: 11,25.
2. Az egyensúlyi koncentrációk kiszámítása a reaktánsok kezdeti koncentrációiból és fordítva
1. példa
A reverzibilis gázreakció a következő egyenlet szerint megy végbe:
CO + CI 2 = COCI 2.
A reagensek kezdeti koncentrációi:
[CO]0 = 0,03 mol/l;
0 = 0,02 mol/l.
Az egyensúly elérése után a szén-monoxid koncentrációja:
[CO]p = 0,021 mol/l.
Számítsa ki a megmaradt anyagok egyensúlyi koncentrációit és a kémiai egyensúlyi állandó értékét!
Adott:
[CO]0 = 0,03 mol/l
[C1 2] 0 = 0,02 mol/l
[CO]p = 0,021 mol/l
P , p , K x . p – ?
Megoldás:
Az egyensúlyi állapotra a CO-koncentráció változása:
∆[CO] = [CO] 0 – [CO] p = 0,03 – 0,021 = 0,009 mol/l.
Mivel a reakcióban részt vevő anyagok mólaránya 1:1:1, az összes anyag koncentrációjának változása azonos:
[C1 2 ] p = [C1 2 ] 0 – ∆[C1 2 ] = 0,02 – 0,009 = 0,011 mol/l,
[SOS1 2 ] p = 0,009 mol/l,
K x р = [ССО1 2 ] Р / [СО] Р [С1 2 ] р = 0,009/0,021 · 0,011 = 39.
A számítások eredményeit beírjuk a táblázatba, ahol a „+” és „–” jelek az anyag koncentrációjának növekedését, illetve csökkenését jelentik.
Válasz:[C1 2] p = 0,011 mol/l; [SOC12] p = 0,009 mol/l; K x p = 39.
2. példa
A 2NO + O 2 = 2NO 2 reverzibilis reakcióban részt vevő anyagok egyensúlyi koncentrációi a következők (mol/l):
P=0,056;
[O 2] = 0,028;
Adott:
P = 0,056 mol/l
P = 0,028 mol/l
P = 0,044 mol/l
0 , [О 2 ] 0 – ?
Megoldás:
A nitrogén-monoxid (IV) kezdeti koncentrációja 0 = 0, változása az egyensúlyi pillanatban ∆ = 0,044 mol/l.
Az NO és NO 2 mólaránya a reakcióban 2:2 (1:1), ezért a NO kezdeti koncentrációja:
0 = p + 0,044 = 0,056 + 0,044 = 0,1 mol/l.
Az O 2 és NO 2 mólaránya 1:2, így az O 2 kezdeti koncentrációja:
[O 2 ] 0 = [O 2 ] p + 0,044/2 = 0,028 + 0,022 = 0,05 mol/l.
A számítási eredményeket a táblázat tartalmazza
Válasz: 0 = 0,1 mol/l; [O 2] 0 = 0,05 mol/l.
3. példa
Az ammónia szintézis reakciója a ZN 2 + N 2 = 2NH 3 egyenlet szerint megy végbe. A kiindulási anyagok kezdeti koncentrációja egyenlő (mol/l): hidrogén – 0,05; nitrogén – 0,04: a reakciósebesség állandója 0,3. Számítsa ki: a) a kezdeti reakciósebességet; b) a reakció sebessége, amikor az ammóniakoncentráció 0,02 mol/l lett.
Adott:
a) [H2]0 = 0,05 mol/l
0 = 0,04 mol/l
b) = 0,02 mol/l
Megoldás:
a) A tömeghatás törvényének megfelelően megkapjuk a kezdeti reakciósebességet:
υ 0 = k 0 3 0 = 3 10 –1 3 = 1,5 10 –6 mol/l s.
b) A reakcióegyenlet alapján a hidrogén és az ammónia mólaránya 3:2. Az ammóniakoncentráció 0,02 mol/l-es növekedése a hidrogénkoncentráció 0,03 mol/l-es csökkenését okozza (0,02 – 3/2 = 0,03).
Így mire az ammóniakoncentráció 0,02 mol/l-rel nőtt, a hidrogénkoncentráció 0,02 mol/l-re csökkent (0,05 – 0,03 = 0,02). A nitrogén és az ammónia mólaránya 1:2. A nitrogénkoncentráció 0,01 mol (0,02 – 1/2 = 0,01) csökken, és 0,03 mol/l (0,04 – 0,01 = 0,03) lesz. A reakciósebesség is csökken a reagensek koncentrációjának csökkenésével:
υ = k 3 = 3 10 –1 3 = 7,2 10 –8 mol/l s.
Válasz: a) 1,5 10 –6 mol/l s; b) 7,2 10 –8 mol/l s.
4. példa
A reakció a 2NO + O 2 = 2NO 2 egyenlet szerint megy végbe, valamivel a reakció megindulása után a reakcióban részt vevő összes anyag koncentrációja: = 0,04 mol/l; [O 2] = 0,01 mol/l; = 0,02 mol/l. Számítsa ki a kiindulási anyagok kezdeti koncentrációit és a kezdeti reakciósebességet, ha a reakciósebesség állandó k = 1.
Adott:
0,04 mol/l
[O 2 ] = 0,01 mol/l
0,02 mol/l
0 , 0 , x 0 – ?
Megoldás:
A reakcióegyenlet szerint az NO és az NO 2 mólaránya 2:2 (1:1).
A reakciótermék NO 2 koncentrációjának 0,02 mol/l-re való növelése az NO koncentráció 0,02 mol/l-es csökkenését okozta. Ezért a nitrogén-monoxid (II) kezdeti koncentrációja a következő volt:
0 = +0,02 = 0,04 + 0,02 = 0,06 mol/l.
Az O 2 és az NO 2 mólaránya 1:2, így a NO 2 koncentráció 0,02 mol-ra történő emelése 0,01 mol (0,02 1/2 = 0,01) oxigénkoncentráció csökkenést okozott. Ennek eredményeként a kezdeti oxigénkoncentráció a következő volt:
[O 2 ] 0 = [O 2 ] + 0,01 = 0,01 + 0,01 = 0,02 mol/l.
Kezdeti reakciósebesség
υ 0 = k 0 2 0 = 1 2 = 7,2 · 10 –5 mol/l·s.
Válasz: 0 = 0,06 mol/l; [O 2] 0 = 0,02 mol/l;
x 0 = 7,2 10 –5 mol/l s.
A legtöbb kémiai reakció reverzibilis, pl. egyszerre áramlik ellentétes irányba. Azokban az esetekben, amikor az előre és fordított reakciók azonos sebességgel mennek végbe, kémiai egyensúly áll be. Például egy reverzibilis homogén reakcióban: H 2 (g) + I 2 (g) ↔ 2HI (g) az előre és fordított reakciók sebességének aránya a tömeghatás törvénye szerint a koncentrációk arányától függ. a reaktánsok közül, nevezetesen: az előrehaladó reakció sebessége: υ 1 = k 1 [H 2 ]. Fordított reakciósebesség: υ 2 = k 2 2.
Ha H 2 és I 2 kiindulási anyag, akkor az első pillanatban az előrehaladó reakció sebességét azok kezdeti koncentrációja határozza meg, a fordított reakció sebessége pedig nulla. Ahogy a H 2 és I 2 elfogy, és HI képződik, az előrehaladó reakció sebessége csökken, a fordított reakció sebessége pedig nő. Egy idő után mindkét sebesség kiegyenlítődik, és a rendszerben létrejön a kémiai egyensúly, azaz. az egységnyi idő alatt előállított és elfogyasztott HI molekulák száma azonos lesz.
Mivel kémiai egyensúly esetén az előre és a fordított reakció sebessége egyenlő V 1 = V 2, akkor k 1 = k 2 2.
Mivel k 1 és k 2 egy adott hőmérsékleten állandó, arányuk állandó lesz. Ha K-vel jelöljük, a következőt kapjuk:

K-t kémiai egyensúlyi állandónak, a fenti egyenletet pedig a tömeghatás törvényének (Guldberg - Waale) nevezzük.
BAN BEN általános eset az aA+bB+…↔dD+eE+… formájú reakciónál az egyensúlyi állandó egyenlő ![]() . közötti interakcióhoz gáznemű anyagok gyakran használják azt a kifejezést, amelyben a reagenseket egyensúlyi parciális nyomások képviselik p. Az említett reakcióhoz
. közötti interakcióhoz gáznemű anyagok gyakran használják azt a kifejezést, amelyben a reagenseket egyensúlyi parciális nyomások képviselik p. Az említett reakcióhoz  .
.
Az egyensúlyi állapot azt a határt jellemzi, amelyig adott körülmények között a reakció spontán lezajlik (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
Az egyensúlyi koncentrációk közötti kapcsolat nem függ attól, hogy mely anyagokat vegyük kiindulási anyagnak (például H 2 és I 2 vagy HI), pl. az egyensúlyi állapot mindkét oldalról megközelíthető.
A kémiai egyensúlyi állandó a reagensek természetétől és a hőmérséklettől függ; Az egyensúlyi állandó nem függ a nyomástól (ha túl magas) vagy a reagensek koncentrációjától.
A hőmérséklet, az entalpia és az entrópia tényezők egyensúlyi állandójára gyakorolt hatás. Az egyensúlyi állandó a ∆G o kémiai reakció standard izobár-izoterm potenciáljának változásához kapcsolódik a ∆G o =-RT ln K egyszerű egyenlettel.
Ez azt mutatja, hogy a ∆G o nagy negatív értékei (∆G o<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), akkor az egyensúlyi keverékben a kiindulási anyagok vannak túlsúlyban. Ez az egyenlet lehetővé teszi a K kiszámítását a ∆G o értékéből, majd a reagensek egyensúlyi koncentrációiból (parciális nyomásaiból). Ha figyelembe vesszük, hogy ∆G o =∆Н o -Т∆S o, akkor némi transzformáció után azt kapjuk, hogy ![]() . Ebből az egyenletből kitűnik, hogy az egyensúlyi állandó nagyon érzékeny a hőmérséklet változásaira. A reagensek természetének az egyensúlyi állandóra gyakorolt hatása meghatározza annak entalpia- és entrópiatényezőktől való függését.
. Ebből az egyenletből kitűnik, hogy az egyensúlyi állandó nagyon érzékeny a hőmérséklet változásaira. A reagensek természetének az egyensúlyi állandóra gyakorolt hatása meghatározza annak entalpia- és entrópiatényezőktől való függését.
Le Chatelier elve
A kémiai egyensúly állapota adott állandó körülmények között bármikor megmarad. A feltételek megváltozásakor az egyensúlyi állapot felborul, mivel ebben az esetben az ellentétes folyamatok sebessége változó mértékben változik. Egy idő után azonban a rendszer ismét egyensúlyi állapotba kerül, de ezúttal az új megváltozott feltételeknek megfelelően.
Az egyensúlynak a körülmények változásától függő eltolódását általában Le Chatelier elve (vagy a mozgó egyensúly elve) határozza meg: Ha egy egyensúlyban lévő rendszert kívülről befolyásolunk az egyensúlyi helyzetet meghatározó feltételek bármelyikének megváltoztatásával, akkor az a folyamat irányába tolódik el, aminek lefolyása gyengíti a kiváltott hatás hatását.
Így a hőmérséklet emelkedése egyensúlyi eltolódást okoz azoknak a folyamatoknak az irányába, amelyek lefolyását hőfelvétel kíséri, a hőmérséklet csökkenése pedig ezzel ellentétes irányba hat. Hasonlóképpen a nyomásnövekedés egy olyan folyamat irányába tolja el az egyensúlyt, amelyet térfogatcsökkenés kísér, a nyomáscsökkenés pedig az ellenkező irányba hat. Például a 3H 2 +N 2 2H 3 N egyensúlyi rendszerben, ∆H o = -46,2 kJ, a hőmérséklet emelkedése fokozza a H 3 N bomlását hidrogénre és nitrogénre, mivel ez a folyamat endoterm. A nyomásnövekedés a H 3 N képződése felé tolja el az egyensúlyt, mert ezzel egyidejűleg a térfogat is csökken.
Ha a reakcióban részt vevő anyagok közül egy bizonyos mennyiséget hozzáadunk egy egyensúlyi állapotú rendszerhez (vagy éppen ellenkezőleg, eltávolítjuk a rendszerből), akkor az előre- és a visszirányú reakciók sebessége megváltozik, de fokozatosan ismét kiegyenlítődik. Más szavakkal, a rendszer visszatér a kémiai egyensúly állapotába. Ebben az új állapotban a rendszerben lévő összes anyag egyensúlyi koncentrációja el fog térni az eredeti egyensúlyi koncentrációktól, de a köztük lévő arány változatlan marad. Így egy egyensúlyi rendszerben lehetetlen az egyik anyag koncentrációját megváltoztatni anélkül, hogy az összes többi koncentrációja megváltozna.
Le Chatelier elvének megfelelően a reagens további mennyiségeinek egyensúlyi rendszerbe bevitele az egyensúly eltolódását okozza abba az irányba, amelyben ennek az anyagnak a koncentrációja csökken, és ennek megfelelően a kölcsönhatás termékeinek koncentrációja nő.
A kémiai egyensúly vizsgálata nagy jelentőséggel bír mind az elméleti kutatás, mind a gyakorlati problémák megoldása szempontjából. A különböző hőmérsékletek és nyomások egyensúlyi helyzetének meghatározásával lehetőség nyílik a kémiai folyamat legkedvezőbb feltételeinek kiválasztására. A folyamatfeltételek végső megválasztásakor figyelembe veszik azok hatását a folyamat sebességére is.
1. példa Egy reakció egyensúlyi állandójának kiszámítása a reagensek egyensúlyi koncentrációiból.
Számítsa ki az A + B 2C reakció egyensúlyi állandóját, ha az egyensúlyi koncentrációk [A] = 0,3 mol∙l -1; [V]=1,1 mol∙l-1; [C]=2,1 mol∙l -1.
Megoldás. Ennek a reakciónak az egyensúlyi állandójának kifejezése a következő: . Helyettesítsük itt a problémafelvetésben jelzett egyensúlyi koncentrációkat: =5,79.
2. példa. A reagáló anyagok egyensúlyi koncentrációinak számítása. A reakció az A + 2B C egyenlet szerint megy végbe.
Határozza meg a reagáló anyagok egyensúlyi koncentrációit, ha az A és B anyagok kezdeti koncentrációja 0,5 és 0,7 mol∙l -1, és a reakció egyensúlyi állandója K p = 50.
Megoldás. Minden mól A és B anyagra 2 mól C anyag képződik. Ha az A és B anyagok koncentrációjának csökkenését X mol-lal jelöljük, akkor az anyag koncentrációjának növekedése 2X mol. A reaktánsok egyensúlyi koncentrációi a következők:
CA = (kb. 5-x)mol∙l-1; C B = (0,7-x) mol∙l-1; C C =2x mol∙l -1
x 1 = 0,86; x 2 =0,44
A feladat feltételei szerint x 2 érték érvényes. Ezért a reaktánsok egyensúlyi koncentrációi:
CA = 0,5-0,44 = 0,06 mol∙l -1; C B = 0,7-0,44 = 0,26 mol∙l -1; C C = 0,44∙2 = 0,88 mol∙l -1.
3. példa Egy reakció Gibbs-energia ∆G o változásának meghatározása a K r egyensúlyi állandó értékével. Számítsa ki a Gibbs-energiát, és határozza meg a CO + Cl 2 = COCl 2 reakció lehetőségét 700 K-en, ha az egyensúlyi állandó Kp = 1,0685∙10 -4. Az összes reagáló anyag parciális nyomása azonos és 101325 Pa.
Megoldás.∆G 700 =2,303∙RT ![]() .
.
Ehhez a folyamathoz:
Mivel ∆Go<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
4. példa. Változás a kémiai egyensúlyban. Milyen irányba tolódik el az egyensúly az N 2 +3H 2 2NH 3 -22kcal rendszerben:
a) növekvő N 2 koncentrációval;
b) növekvő H2 koncentrációval;
c) növekvő hőmérséklettel;
d) amikor a nyomás csökken?
Megoldás. A reakcióegyenlet bal oldalán lévő anyagok koncentrációjának növekedése Le Chatelier szabálya szerint olyan folyamatot kell, hogy okozzon, amely gyengíti a hatást és a koncentráció csökkenéséhez vezet, pl. az egyensúly jobbra tolódik el (a és b eset).
Az ammónia szintézis reakciója exoterm. A hőmérséklet emelkedése egyensúlyi eltolódást okoz balra - endoterm reakció felé, gyengíti a hatást (c eset).
A nyomáscsökkenés (d eset) kedvez a rendszer térfogatának növekedéséhez vezető reakciónak, pl. N 2 és H 2 képződése felé.
5. példa. Hányszorosára változik az előre- és visszafelé irányuló reakció sebessége a 2SO 2 (g) + O 2 (g) 2SO 3 (r) rendszerben, ha a gázelegy térfogata háromszorosára csökken? Milyen irányba tolódik el a rendszer egyensúlya?
Megoldás. Jelöljük a reaktánsok koncentrációit: = A, =b,=Val vel. A tömeghatás törvénye szerint a térfogatváltozás előtti előre és fordított reakció sebessége egyenlő
v pr = Ka 2 b, v arr = K 1 s 2
Miután egy homogén rendszer térfogatát háromszorosára csökkentjük, mindegyik reaktáns koncentrációja háromszorosára nő: = 3a,[O 2] = 3b; = 3s.Új koncentrációknál az előre- és hátrameneti reakció sebessége v" np:
v" np = K(3a) 2 (3b) = 27 Ka 2 b; v o 6 p = K 1 (3c) 2 = 9K 1 c 2.
![]() ;
; ![]()
Következésképpen az előre irányuló reakció sebessége 27-szeresére, a fordított reakcióé pedig csak kilencszeresére nőtt. A rendszer egyensúlya a SO 3 képződése felé tolódott el.
6. példa. Számítsa ki, hogy a gázfázisban lezajló reakció sebessége hányszorosára nő, ha a hőmérséklet 30-ról 70 0 C-ra emelkedik, ha a reakció hőmérsékleti együtthatója 2!
Megoldás. A kémiai reakció sebességének hőmérséklettől való függését az empirikus Van't Hoff-szabály határozza meg a képlet szerint
Következésképpen a reakciósebesség 70 °C-on 16-szor nagyobb, mint a 30 °C-on.
7. példa. Egy homogén rendszer egyensúlyi állandója
CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) 850°C-on egyenlő 1-gyel. Számítsa ki az összes anyag koncentrációját egyensúlyban, ha a kezdeti koncentrációk: [CO] ISH = 3 mol/l, [H 2 O] RI = 2 mol/l.
Megoldás. Egyensúlyi állapotban az előre- és a visszirányú reakció sebessége egyenlő, ezen sebességek állandóinak aránya állandó, és az adott rendszer egyensúlyi állandójának nevezzük:
V np = K 1[CO][H20]; V o b p = NAK NEK 2 [CO2][H2];
![]()
A problémafelvetésben a kezdeti koncentrációk megadva, míg a kifejezésben K r csak a rendszer összes anyagának egyensúlyi koncentrációját tartalmazza. Tegyük fel, hogy az egyensúlyi pillanatban a koncentráció [CO 2 ] P = x mol/l. A rendszer egyenlete szerint a képződött hidrogén móljainak száma is lesz x mol/l. Ugyanannyi anyajegyre (X mol/l) CO és H 2 O keletkezik x mol CO 2 és H 2. Ezért mind a négy anyag egyensúlyi koncentrációja (mol/l):
[CO 2 ] P = [H 2 ] P = X;[CO] P = (3 – x); P =(2x).
Az egyensúlyi állandó ismeretében megtaláljuk az értéket X, majd az összes anyag kezdeti koncentrációja:
![]() ; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
Minden kémiai reakció felosztható megfordíthatóÉs visszafordíthatatlan. A reverzibilis reakciók közé tartoznak azok a reakciók, amelyek egy bizonyos hőmérsékleten két ellentétes irányban - előre és hátra - észrevehető sebességgel mennek végbe. A reverzibilis reakciók nem mennek végbe, a reagensek egyike sem fogy el teljesen. Példa erre a reakció
Egy bizonyos hőmérséklet-tartományban ez a reakció reverzibilis. jele " » a visszafordíthatóság jele.
Irreverzibilis reakciók azok a reakciók, amelyek csak egy irányba haladnak a befejezésig, azaz. amíg az egyik reaktáns teljesen el nem fogy. Az irreverzibilis reakcióra példa a kálium-klorát bomlási reakciója:
A kálium-klorát képződése kálium-kloridból és oxigénből normál körülmények között lehetetlen.
Kémiai egyensúlyi állapot. Kémiai egyensúlyi állandó
Írjuk fel valamilyen reverzibilis reakció egyenletét általános formában:
Mire a reakció elkezdődött, az A és B kiindulási anyagok koncentrációja a maximumon volt. A reakció során elfogynak és koncentrációjuk csökken. Sőt, a tömeghatás törvényének megfelelően a közvetlen reakció sebessége
csökkenni fog. (Itt és lent a felső nyíl jelzi a folyamat irányát.) A kezdeti pillanatban a D és E reakciótermékek koncentrációja nulla volt. A reakció során ezek növekednek, a fordított reakció sebessége nulláról nő az egyenlet szerint:
ábrán. 4.5 mutatja az előre- és hátrameneti sebesség változását
reakciók az idő múlásával. t idő után ezek a sebességek egyenlővé válnak --» 
Rizs. 4.5. Az előre (1) és a fordított (2) reakciók sebességének változása az idő függvényében: - katalizátor hiányában: .......... - katalizátor jelenlétében
Ezt az állapotot kémiai egyensúlynak nevezzük. A kémiai egyensúly a spontán folyamatok legstabilabb, korlátozó állapota. Korlátlan ideig tarthat, ha a külső körülmények nem változnak. Az egyensúlyi állapotban lévő izolált rendszerekben a rendszer entrópiája eléri a maximumot és állandó marad, i.e. dS = 0. Izobár-izoterm körülmények között a folyamat hajtóereje, a Gibbs-energia egyensúlyi állapotban minimális értéket vesz fel, és nem változik tovább, azaz. dG = 0.
A reakcióban résztvevők koncentrációját egyensúlyi állapotban nevezzük egyensúlynak.Általában a megfelelő anyagok képleteivel jelöljük, szögletes zárójelben, például az ammónia egyensúlyi koncentrációját a kezdeti, nem egyensúlyi C^NH^ koncentrációval ellentétben jelöljük.
Mivel egyensúlyban a közvetlen és a fordított folyamatok sebessége egyenlő, a (4.44) egyenlet jobb oldalát egyenlővé tesszük, ill.
- -^ én-
- (4.45), a koncentráció jelölés helyébe: A: [A]"”[B]" = ?[D] /; )










