Kemijska ravnoteža je takvo stanje reverzibilnog kemijska reakcija
aA+ b B= c C+ d D,
kod kojih nema promjena koncentracija reaktanata u reakcijskoj smjesi tijekom vremena. Karakterizira se stanje kemijske ravnoteže konstantno kemijska ravnoteža :
Gdje C i– koncentracija komponenti u ravnoteža savršena mješavina.
Konstanta ravnoteže također se može izraziti u obliku ravnotežnih molnih udjela X i komponente:
Za reakcije koje se odvijaju u plinovitoj fazi, prikladno je izraziti konstantu ravnoteže u smislu ravnotežnih parcijalnih tlakova P i komponente:
Za idealni plinovi P i = C i RT I P i = X i P, Gdje P je ukupni pritisak, dakle K P, K C I K X povezani su sljedećim odnosom:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Konstanta ravnoteže povezana je s r G o kemijska reakcija:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Promijeniti r G ili r F u kemijskoj reakciji pri zadanim (ne nužno ravnotežnim) parcijalnim tlakovima P i odnosno koncentracije C i komponente se mogu izračunati pomoću jednadžbe izoterme kemijske reakcije (van't Hoffove izoterme):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Prema Le Chatelierov princip, ako se vanjski utjecaj izvrši na sustav koji je u ravnoteži, tada će se ravnoteža pomaknuti tako da se smanji učinak vanjskog utjecaja. Dakle, povećanje tlaka pomiče ravnotežu prema smanjenju broja molekula plina. Dodavanje bilo koje reakcijske komponente u ravnotežnu smjesu pomiče ravnotežu prema smanjenju količine te komponente. Povećanje (ili smanjenje) temperature pomiče ravnotežu prema reakciji koja se događa s apsorpcijom (oslobađanjem) topline.
Kvantitativna ovisnost konstante ravnoteže o temperaturi opisana je jednadžbom izobare kemijske reakcije (van't Hoffove izobare)
![]() (9.9)
(9.9)
I izohore kemijske reakcije (van't Hoffove izohore)
![]() . (9.10)
. (9.10)
Integriranje jednadžbe (9.9) pod pretpostavkom da r H reakcija ne ovisi o temperaturi (što vrijedi u uskim temperaturnim područjima), daje:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Gdje C – integracijska konstanta. Dakle, ovisnost ln K P od 1 /T mora biti linearan, a nagib ravne linije je – r H/R.
Integracija unutar K 1 , K 2, i T 1, T 2 daje:
 (9.13)
(9.13)
 (9.14)
(9.14)
Pomoću ove jednadžbe, poznavajući konstante ravnoteže na dvije različite temperature, možemo izračunati r H reakcije. Prema tome, znajući r H reakciju i konstantu ravnoteže na jednoj temperaturi, možete izračunati konstantu ravnoteže na drugoj temperaturi.
PRIMJERI
CO(g) + 2H 2 (g) = CH 3 OH (g)
na 500 K. f G o za CO(g) i CH 3 OH(g) pri 500 K jednaki su –155,41 kJ. mol –1 i –134,20 kJ. mol –1 odnosno.
Riješenje. idi o reakcije:
r G o= f G o(CH3OH) – f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Primjer 9-2. Konstanta ravnoteže reakcije
jednak K P = 1,64 10 –4 pri 400 o C. Koliki ukupni tlak treba primijeniti na ekvimolarnu smjesu N 2 i H 2 da 10% N 2 prijeđe u NH 3? Plinovi se smatraju idealnima.
Riješenje. Neka mol N 2 reagira. Zatim
| N 2 (g) | + | 3H 2 (g) | = | 2NH3 (g) | |
| Izvorna količina | 1 | 1 | |||
| Ravnotežna količina | 1– | 1–3 | 2 (Ukupno: 2–2) | ||
| Ravnotežni molni udio: |
Stoga, K X =  I K P = K X . P –2
=
I K P = K X . P –2
=  .
.
Zamjenom = 0,1 u dobivenu formulu, imamo
1.64 10 –4 = , gdje P= 51,2 atm.
, gdje P= 51,2 atm.
Primjer 9-3. Konstanta ravnoteže reakcije
CO(g) + 2H 2 (g) = CH 3 OH (g)
na 500 K jednako je K P = 6,09 · 10 –3. Reakcijska smjesa koja se sastoji od 1 mol CO, 2 mol H 2 i 1 mol inertnog plina (N 2) zagrijava se do 500 K i ukupnog tlaka od 100 atm. Izračunajte sastav ravnotežne smjese.
Riješenje. Neka mol CO reagira. Zatim
| CO(g) | + | 2H 2 (g) | = | CH3OH (g) | |
| Izvorna količina: | 1 | 2 | 0 | ||
| Ravnotežna količina: | 1– | 2–2 | |||
| Ukupno u ravnotežnoj smjesi: | 3–2 mol komponente + 1 mol N 2 = 4–2 mol | ||||
| Ravnotežni molni udio | |||||
Stoga, K X =  I K P = K X . P–2 =
I K P = K X . P–2 = ![]() .
.
Dakle, 6,09 10 –3 = ![]() .
.
Rješavanjem ove jednadžbe dobivamo = 0,732. Prema tome, molni udjeli tvari u ravnotežnoj smjesi jednaki su: = 0,288, = 0,106, = 0,212 i = 0,394.
Primjer 9-4. Za reakciju
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
na 298 K K P = 6,0 10 5, a f H o(NH 3) = –46,1 kJ. mol –1 . Procijenite vrijednost konstante ravnoteže pri 500 K.
Riješenje. Standardna molarna entalpija reakcije je
r H o= 2f H o(NH 3) = –92,2 kJ. mol –1 .
Prema jednadžbi (9.14), 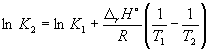 =
=
Ln (6,0 10 5) + ![]() = –1,73, odakle K 2 =
0.18.
= –1,73, odakle K 2 =
0.18.
Imajte na umu da konstanta ravnoteže egzotermne reakcije opada s porastom temperature, što odgovara Le Chatelierovom principu.
ZADACI
- Pri 1273 K i ukupnom tlaku od 30 atm u ravnotežnoj smjesi
- Pri 2000 o C i ukupnom tlaku od 1 atm, 2% vode disocira na vodik i kisik. Izračunajte konstantu ravnoteže reakcije
- Konstanta ravnoteže reakcije
- Konstanta ravnoteže reakcije
- Posuda od 3 litre koja sadrži 1,79 10 –2 mol I 2 zagrijana je na 973 K. Pokazalo se da je tlak u posudi u ravnoteži 0,49 atm. Pretpostavljajući da su plinovi idealni, izračunajte konstantu ravnoteže pri 973 K za reakciju
- Za reakciju
- Za reakciju
- Posuda od 1 litre koja sadrži 0,341 mol PCl 5 i 0,233 mol N 2 zagrijana je na 250 o C. Ukupni tlak u posudi u ravnoteži iznosi 29,33 atm. Pod pretpostavkom da su svi plinovi idealni, izračunajte konstantu ravnoteže na 250 o C za reakciju koja se odvija u posudi
- Konstanta ravnoteže reakcije
- Na 25 o C f G o(NH 3) = –16,5 kJ. mol –1 . Izračunati r G reakcije stvaranja NH3 pri parcijalnim tlakovima N2, H2 i NH3 jednakim 3 atm, 1 atm i 4 atm, redom. U kojem smjeru će se reakcija odvijati spontano u tim uvjetima?
- Egzotermna reakcija
- Konstanta ravnoteže reakcije plinske faze izomerizacije borneola (C 10 H 17 OH) u izoborneol je 0,106 pri 503 K. Mješavina 7,5 g borneola i 14,0 g izoborneola stavljena je u posudu od 5 litara i držana na 503 K dok se ne postigne ravnoteža. Izračunajte molne udjele i mase borneola i izoborneola u ravnotežnoj smjesi.
- Ravnoteža u reakciji
- Izračunajte ukupni tlak koji se mora primijeniti na smjesu od 3 dijela H 2 i 1 dijela N 2 da bi se dobila ravnotežna smjesa koja sadrži 10 % volumena NH 3 pri 400 o C. Konstanta ravnoteže za reakciju
- Pri 250 o C i ukupnom tlaku od 1 atm, PCl 5 disocira 80% reakcijom
- Na 2000 o C za reakciju
- Izračunajte standardnu entalpiju reakcije za koju je konstanta ravnoteže
a) povećava se 2 puta, b) smanjuje se 2 puta kada se temperatura promijeni s 298 K na 308 K. - Ovisnost konstante ravnoteže reakcije 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) o temperaturi između 300 K i 600 K opisana je jednadžbom
CO 2 (g) + C(tv) = 2CO(g)
sadrži 17% (volumenski) CO 2 . Koliki će postotak CO 2 biti sadržan u plinu pri ukupnom tlaku od 20 atm? Pri kojem će tlaku plin sadržavati 25% CO 2?
H2O (g) = H2 (g) + 1/2O2 (g) pod ovim uvjetima.
CO(g) + H 2 O (g) = CO 2 (g) + H 2 (g)
na 500 o C jednaka je Kp= 5,5. Smjesa koja se sastoji od 1 mol CO i 5 mol H 2 O zagrijana je na tu temperaturu. Izračunajte molni udio H 2 O u ravnotežnoj smjesi.
N 2 O 4 (g) = 2NO 2 (g)
na 25 o C jednaka je Kp= 0,143. Izračunajte tlak koji će se uspostaviti u posudi obujma 1 litre u koju je pri toj temperaturi stavljeno 1 g N 2 O 4 .
I 2 (g) = 2I (g).
na 250 o C r G o = –2508 J mol –1. Pri kojem će ukupnom tlaku stupanj pretvorbe PCl 5 u PCl 3 i Cl 2 pri 250 o C biti 30%?
2HI(g) = H 2 (g) + I 2 (g)
konstanta ravnoteže K P = 1,83 10 –2 pri 698,6 K. Koliko grama HI nastaje kada se 10 g I 2 i 0,2 g H 2 zagrije na tu temperaturu u posudi od tri litre? Koliki su parcijalni tlakovi H 2, I 2 i HI?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(g) + 2H 2 (g) = CH 3 OH (g)
na 500 K jednako je K P = 6,09 · 10 –3. Izračunajte ukupni tlak potreban za proizvodnju metanola u prinosu od 90 % ako se CO i H2 uzmu u omjeru 1:2.
CO(g) + 2H 2 (g) = CH 3 OH (g)
je u ravnoteži na 500 K i 10 bara. Ako su plinovi idealni kako će sljedeći faktori utjecati na prinos metanola: a) povećanje T; b) promicanje P; c) dodavanje inertnog plina pri V= konst; d) dodavanje inertnog plina pri P= konst; e) dodavanjem H2 at P= konst?
2NOCl(g) = 2NO(g) + Cl 2 (g)
podešen na 227 o C i ukupni tlak od 1,0 bar kada je parcijalni tlak NOCl 0,64 bara (u početku je bio prisutan samo NOCl). Izračunati r G o za reakciju. Pri kojem ukupnom tlaku će parcijalni tlak Cl 2 biti jednak 0,10 bara?
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
na 400 o C jednaka je K = 1.60 10 –4 .
PCl5 (g) = PCl3 (g) + Cl2 (g).
Koliki će biti stupanj disocijacije PCl 5 ako se u sustav doda N 2 tako da parcijalni tlak dušika bude 0,9 atm? Ukupni tlak se održava na 1 atm.
N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 –3 . Ravnotežna smjesa N 2, O 2, NO i inertnog plina pri ukupnom tlaku od 1 bara sadrži 80% (po volumenu) N 2 i 16% O 2. Koliki je postotak volumena NO? Koliki je parcijalni tlak inertnog plina?
ul K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Godine 1885. francuski fizičar i kemičar Le Chatelier razvio je, a 1887. njemački fizičar Braun potkrijepio zakon kemijske ravnoteže i konstantu kemijske ravnoteže, te proučavao njihovu ovisnost o utjecaju različitih vanjskih čimbenika.
Bit kemijske ravnoteže
Ravnoteža je stanje koje znači da se stvari uvijek kreću. Proizvodi se rastavljaju na reaktante, a reaktanti se kombiniraju u produkte. Stvari se kreću, ali koncentracije ostaju iste. Reakcija je napisana dvostrukom strelicom umjesto znakom jednakosti kako bi se pokazalo da je reverzibilna.

Klasični uzorci
Još u prošlom stoljeću kemičari su otkrili određene obrasce koji omogućuju promjenu smjera reakcije u istoj posudi. Znanje o tome kako se odvijaju kemijske reakcije nevjerojatno je važno, kako za laboratorijska istraživanja, i industrijske proizvodnje. pri čemu veliki značaj ima sposobnost kontrolirati sve te pojave. U ljudskoj je prirodi miješati se u mnoge prirodne procese, posebice one reverzibilne, kako bi ih kasnije iskoristili za vlastitu korist. Poznavanje kemijskih reakcija bit će korisnije ako ovladate polugama za njihovo savršeno upravljanje.
Zakon djelovanja mase u kemiji kemičari koriste za točan izračun brzina reakcija. Jasno daje do znanja da nijedan neće biti dovršen ako se odvija u zatvorenom sustavu. Molekule nastalih tvari su u stalnom i nasumičnom gibanju, a uskoro se može dogoditi obrnuta reakcija u kojoj će se obnoviti molekule polaznog materijala.
Najčešće se koristi u industriji otvoreni sustavi. Posude, aparati i drugi spremnici u kojima se odvijaju kemijske reakcije ostaju otključani. Ovo je neophodno kako bi tijekom ovih procesa bilo moguće ekstrahirati željeni produkt i riješiti se beskorisnih produkata reakcije. Na primjer, ugljen se spaljuje u otvorenim pećima, cement se proizvodi u otvorenim pećima, visoke peći rade sa stalnim dovodom zraka, a amonijak se sintetizira kontinuiranim uklanjanjem samog amonijaka.

Reverzibilne i ireverzibilne kemijske reakcije
Na temelju naziva možemo dati odgovarajuće definicije: reakcije se smatraju nepovratnima ako su dovršene, ne mijenjaju smjer i odvijaju se zadanim putem, bez obzira na pad tlaka i kolebanja temperature. Njihovo razlikovna značajka je da neki proizvodi mogu napustiti područje reakcije. Tako je npr. moguće dobiti plin (CaCO 3 = CaO + CO 2), talog (Cu(NO 3) 2 + H 2 S = CuS + 2HNO 3) ili dr. Također će se smatrati ireverzibilnim ako se oslobodi tijekom procesa veliki broj toplinska energija, na primjer: 4P + 5O 2 = 2P 2 O 5 + Q.
Gotovo sve reakcije koje se događaju u prirodi su reverzibilne. Bez obzira na vanjske uvjete kao što su tlak i temperatura, gotovo svi procesi mogu se odvijati istovremeno u različitim smjerovima. Kao što kaže zakon djelovanja mase u kemiji, količina apsorbirane topline bit će jednaka količini oslobođene, što znači da ako je jedna reakcija bila egzotermna, onda će druga (obrnuta) biti endotermna.
Kemijska ravnoteža: konstanta kemijske ravnoteže
Reakcije su "glagoli" kemije - aktivnosti koje kemičari proučavaju. Mnoge reakcije napreduju do kraja i zatim se zaustavljaju, što znači da se reaktanti potpuno pretvaraju u produkte bez mogućnosti povratka u svoje izvorno stanje. U nekim slučajevima reakcija je doista nepovratna, na primjer kada izgaranje mijenja i fizičke i kemijske. Međutim, postoje mnoge druge okolnosti u kojima je ne samo moguća, već i kontinuirana, budući da produkti prve reakcije postaju reaktanti u drugoj .
Dinamičko stanje u kojem koncentracije reaktanata i produkata ostaju konstantne naziva se ravnoteža. Moguće je predvidjeti ponašanje tvari pomoću određenih zakona koji se primjenjuju na industrije koje žele smanjiti troškove proizvodnje određenih kemikalija. Koncept kemijske ravnoteže također je koristan u razumijevanju procesa koji održavaju ili potencijalno ugrožavaju ljudsko zdravlje. Konstanta kemijske ravnoteže vrijednost je faktora reakcije koja ovisi o ionskoj jakosti i temperaturi, a neovisna je o koncentracijama reaktanata i produkata u otopini.

Izračunavanje konstante ravnoteže
Ova veličina je bezdimenzionalna, odnosno nema određeni broj jedinica. Iako se izračun obično piše za dva reaktanta i dva produkta, funkcionira za bilo koji broj sudionika reakcije. Izračun i tumačenje konstante ravnoteže ovisi o tome uključuje li kemijska reakcija homogenu ili heterogenu ravnotežu. To znači da sve komponente koje reagiraju mogu biti čiste tekućine ili plinovi. Za reakcije koje postižu heterogenu ravnotežu u pravilu ne postoji jedna faza, već najmanje dvije. Na primjer, tekućine i plinovi ili obje tekućine.

Vrijednost konstante ravnoteže
Za bilo koju danu temperaturu postoji samo jedna vrijednost za konstantu ravnoteže, koja se mijenja samo ako se temperatura na kojoj se odvija reakcija promijeni u jednom ili drugom smjeru. Moguće je napraviti neka predviđanja o kemijskoj reakciji na temelju toga je li konstanta ravnoteže velika ili mala. Ako je vrijednost vrlo velika, tada ravnoteža daje prednost reakciji udesno i dobiva se više proizvoda nego što je bilo reaktanata. Reakcija se u ovom slučaju može nazvati "potpuna" ili "kvantitativna".
Ako je vrijednost konstante ravnoteže mala, onda ona pogoduje reakciji lijevo, gdje je broj reaktanata veći od nastalih produkata. Ako ova vrijednost teži nuli, možemo pretpostaviti da se reakcija ne događa. Ako su vrijednosti konstante ravnoteže za naprijed i obrnute reakcije gotovo iste, tada će količina reaktanata i proizvoda također biti gotovo ista. Ova vrsta reakcije smatra se reverzibilnom.

Razmotrimo specifičnu reverzibilnu reakciju
Uzmimo dvije takve kemijski element, poput joda i vodika, koji kada se pomiješaju daju novu tvar - hidrogen jodid.
Uzmimo da je v 1 brzina prednje reakcije, v 2 brzina obrnute reakcije, k konstanta ravnoteže. Koristeći zakon djelovanja mase, dobivamo sljedeći izraz:
v 1 = k 1 * c(H 2) * c(I 2),
v 2 = k 2 * c 2 (HI).
Kada se pomiješaju molekule joda (I 2) i vodika (H 2), počinje njihova interakcija. U početnoj fazi koncentracija ovih elemenata je maksimalna, ali će do kraja reakcije koncentracija novog spoja - jodovodika (HI) biti maksimalna. Sukladno tome, brzine reakcije bit će različite. Na samom početku oni će biti maksimalni. S vremenom dođe trenutak kada se te vrijednosti izjednače, a to je stanje koje se naziva kemijska ravnoteža.
Izraz konstante kemijske ravnoteže obično se označava u uglatim zagradama: , , . Kako su u ravnoteži brzine jednake, tada je:
k 1 = k 2 2 ,
To nam daje jednadžbu za konstantu kemijske ravnoteže:
k 1 /k 2 = 2 / = K.

Le Chatelier-Brownov princip
Postoji sljedeći obrazac: ako se izvrši određeni učinak na sustav koji je u ravnoteži (promijeni uvjete kemijske ravnoteže promjenom temperature ili tlaka, na primjer), tada će se ravnoteža pomaknuti kako bi se djelomično suprotstavilo učinku promjene. Osim za kemiju, ovaj princip vrijedi i za nekoliko različite forme na polja farmakologije i ekonomije.

Konstanta kemijske ravnoteže i metode njezina izražavanja
Izraz ravnoteže može se izraziti preko koncentracija produkata i reaktanata. Samo kemijske tvari u vodenoj i plinovitoj fazi uključeni su u formulu ravnoteže, budući da se koncentracije tekućina i krutina ne mijenjaju. Koji čimbenici utječu na kemijsku ravnotežu? Ako se radi o čistoj tekućini ili čvrsta, smatra se da ima K = 1, te se prema tome prestaje uzimati u obzir, s izuzetkom visoko koncentriranih otopina. Na primjer, čista voda ima aktivnost 1.
Drugi primjer je čvrsti ugljik, koji može nastati reakcijom dviju molekula ugljikovog monoksida ugljični dioksid i ugljik. Čimbenici koji mogu utjecati na ravnotežu uključuju dodavanje reaktanta ili proizvoda (promjena koncentracije utječe na ravnotežu). Dodavanje reagensa može dovesti do ravnoteže s desne strane kemijska jednadžba, gdje se pojavljuje više oblika proizvoda. Dodavanje proizvoda može dovesti do ravnoteže na lijevoj strani kako više oblika reaktanata postaje dostupno.

Ravnoteža se javlja kada reakcija koja se odvija u oba smjera ima konstantan omjer produkata i reaktanata. Općenito, kemijska ravnoteža je statična, jer je kvantitativni omjer produkata i reaktanata konstantan. Međutim, bliži pogled otkriva da je ravnoteža zapravo vrlo dinamičan proces, budući da se reakcija kreće u oba smjera jednakom brzinom.
Dinamička ravnoteža je primjer funkcije stabilnog stanja. Za sustav u stabilnom stanju, trenutno promatrano ponašanje nastavlja se u budućnosti. Stoga, kada reakcija postigne ravnotežu, omjer koncentracija proizvoda i reaktanata ostat će isti, iako se reakcija nastavlja.

Kako jednostavno govoriti o složenim stvarima?
Pojmove kao što su kemijska ravnoteža i konstanta kemijske ravnoteže prilično je teško razumjeti. Uzmimo primjer iz života. Jeste li ikada zaglavili na mostu između dva grada i primijetili da je promet u drugom smjeru nesmetan i redovit, dok ste vi beznadno zapeli u prometu? Ovo nije dobro.
Što ako se automobili kreću glatko i istom brzinom s obje strane? Hoće li broj automobila u oba grada ostati isti? Kada je brzina ulaska i izlaska u oba grada ista, a broj automobila u svakom gradu stabilan tijekom vremena, to znači da je cijeli proces u dinamičkoj ravnoteži.
PRIMJER
Izračunajte konstantu kemijske ravnoteže za reverzibilni homogena reakcija, CO + H 2 O = CO 2 + H 2, na temelju činjenice da je ravnotežna koncentracija tvari:
[CO] p = 0,045 mol/l,
[H 2 O] p = 0,064 mol/l,
[CO2] p = 0,18 mol/l.
dano:
[CO] p = 0,045 mol/l
[H2O] p = 0,064 mol/l
[CO2] p = 0,18 mol/l
Riješenje:
Stoga je molarni omjer produkata reakcije 1:1
[CO2] p = [H2] p = 0,18 mol/l.
Na temelju izraza (2.1) izračunavamo vrijednost konstante kemijske ravnoteže:
Za x.r. = [CO 2 ] p [H 2 ] p / [CO 2 ] p [H 2 O] p = 0,18 0,18/0,045 0,064
Odgovor: 11,25.
2. Izračunavanje ravnotežnih koncentracija iz početnih koncentracija reaktanata i obrnuto
Primjer 1.
Reverzibilna plinska reakcija odvija se prema jednadžbi:
CO + CI 2 = COCI 2.
Početne koncentracije reaktanata:
[CO]O = 0,03 mol/l;
0 = 0,02 mol/l.
Nakon postizanja ravnoteže koncentracija ugljikovog monoksida je postala:
[CO] p = 0,021 mol/l.
Izračunajte ravnotežne koncentracije preostalih tvari i vrijednost konstante kemijske ravnoteže.
dano:
[CO] 0 = 0,03 mol/l
[C12]0 = 0,02 mol/l
[CO] p = 0,021 mol/l
P, p, K x. p – ?
Riješenje:
Do trenutka ravnoteže, promjena koncentracije CO bila je:
∆[CO] = [CO] 0 – [CO] p = 0,03 – 0,021 = 0,009 mol/l.
Budući da je molarni omjer tvari koje sudjeluju u reakciji 1:1:1, promjena koncentracije svih tvari je ista:
[C1 2 ] p = [C1 2 ] 0 – ∆[C1 2 ] = 0,02 – 0,009 = 0,011 mol/l,
[SOS1 2 ] p = 0,009 mol/l,
K x r = [SSO1 2 ] R / [SO] R [S1 2 ] r = 0,009/0,021 · 0,011 = 39.
Rezultate izračuna unijet ćemo u tablicu, gdje znakovi "+" i "–" znače povećanje odnosno smanjenje koncentracije tvari.
Odgovor:[C12] p = 0,011 mol/l; [SOC12] p = 0,009 mol/l; K x p = 39.
Primjer 2.
Ravnotežne koncentracije tvari uključenih u reverzibilnu reakciju 2NO + O 2 = 2NO 2 su sljedeće (mol/l):
P = 0,056;
[O2] = 0,028;
dano:
P = 0,056 mol/l
P = 0,028 mol/l
P = 0,044 mol/l
0 , [O 2 ] 0 – ?
Riješenje:
Početna koncentracija dušikovog oksida (IV) bila je 0 = 0, a njezina promjena u trenutku ravnoteže je ∆ = 0,044 mol/l.
Molarni omjer NO i NO 2 u reakciji je 2:2 (1:1), stoga će početna koncentracija NO biti:
0 = p + 0,044 = 0,056 + 0,044 = 0,1 mol/l.
Molarni omjer O 2 i NO 2 je 1:2, stoga će početna koncentracija O 2 biti:
[O 2 ] 0 = [O 2 ] p + 0,044/2 = 0,028 + 0,022 = 0,05 mol/l.
Rezultati izračuna bilježe se u tablici
Odgovor: 0 = 0,1 mol/l; [O 2 ] 0 = 0,05 mol/l.
Primjer 3.
Reakcija sinteze amonijaka odvija se prema jednadžbi ZN 2 + N 2 = 2NH 3. Početne koncentracije polaznih tvari su jednake (mol/l): vodik – 0,05; dušik – 0,04: konstanta brzine reakcije je 0,3. Izračunajte: a) početnu brzinu reakcije; b) brzinu reakcije kada je koncentracija amonijaka postala 0,02 mol/l.
dano:
a) [H 2 ] 0 = 0,05 mol/l
0 = 0,04 mol/l
b) = 0,02 mol/l
Riješenje:
a) U skladu sa zakonom djelovanja mase nalazimo početnu brzinu reakcije:
υ 0 = k 0 3 0 = 3 10 –1 3 = 1,5 10 –6 mol/l s.
b) Na temelju jednadžbe reakcije molarni omjer vodika i amonijaka je 3:2. Povećanje koncentracije amonijaka za 0,02 mol/l uzrokuje smanjenje koncentracije vodika za 0,03 mol/l (0,02 – 3/2 = 0,03).
Dakle, dok se koncentracija amonijaka povećala za 0,02 mol/l, koncentracija vodika se smanjila na 0,02 mol/l (0,05 – 0,03 = 0,02). Molarni omjer dušika i amonijaka je 1:2. Koncentracija dušika će se smanjiti za 0,01 mol (0,02 – 1/2 = 0,01) i postat će jednaka 0,03 mol/l (0,04 – 0,01 = 0,03). Brzina reakcije također će se smanjiti sa smanjenjem koncentracije reaktanata:
υ = k 3 = 3 10 –1 3 = 7,2 10 –8 mol/l s.
Odgovor: a) 1,5 10 –6 mol/l s; b) 7,2 10 –8 mol/l s.
Primjer 4.
Reakcija se odvija prema jednadžbi 2NO + O 2 = 2NO 2, neko vrijeme nakon početka reakcije koncentracije svih tvari koje sudjeluju u reakciji postale su: = 0,04 mol/l; [02] = 0,01 mol/l; = 0,02 mol/l. Izračunajte početne koncentracije polaznih tvari i početnu brzinu reakcije ako je konstanta brzine reakcije k = 1.
dano:
0,04 mol/l
[O 2 ] = 0,01 mol/l
0,02 mol/l
0 , 0 , x 0 – ?
Riješenje:
Prema jednadžbi reakcije, molarni omjer NO i NO 2 je 2:2 (1:1).
Povećanje koncentracije produkta reakcije NO 2 na 0,02 mol/l uzrokovalo je smanjenje koncentracije NO za 0,02 mol. Stoga je početna koncentracija dušikovog oksida (II) bila:
0 = +0,02 = 0,04 + 0,02 = 0,06 mol/l.
Molarni omjer O 2 i NO 2 je 1:2, pa je porast koncentracije NO 2 na 0,02 mol uzrokovao smanjenje koncentracije kisika za 0,01 mol (0,02 1/2 = 0,01). Kao rezultat toga, početna koncentracija kisika bila je:
[O 2 ] 0 = [O 2 ] + 0,01 = 0,01 + 0,01 = 0,02 mol/l.
Početna brzina reakcije
υ 0 = k 0 2 0 = 1 2 = 7,2 · 10 –5 mol/l·s.
Odgovor: 0 = 0,06 mol/l; [O2]0 = 0,02 mol/l;
x 0 = 7,2 10 –5 mol/l s.
Većina kemijskih reakcija je reverzibilna, tj. teći istovremeno u suprotnim smjerovima. U slučajevima kada se naprijed i obratna reakcija odvijaju istom brzinom, dolazi do kemijske ravnoteže. Na primjer, u reverzibilnoj homogenoj reakciji: H 2 (g) + I 2 (g) ↔ 2HI (g), omjer brzina prednje i obrnute reakcije prema zakonu djelovanja mase ovisi o omjeru koncentracija reaktanata, naime: brzina prednje reakcije: υ 1 = k 1 [H 2 ]. Brzina reverzne reakcije: υ 2 = k 2 2.
Ako su H 2 i I 2 polazne tvari, tada je u prvom trenutku brzina prednje reakcije određena njihovim početnim koncentracijama, a brzina obrnute reakcije je nula. Kako se H 2 i I 2 troše i nastaje HI, brzina prednje reakcije opada, a brzina obrnute reakcije raste. Nakon nekog vremena obje se brzine izjednače i u sustavu se uspostavi kemijska ravnoteža, tj. broj proizvedenih i potrošenih HI molekula u jedinici vremena postaje isti.
Budući da su u kemijskoj ravnoteži brzine prednje i obrnute reakcije jednake V 1 = V 2, tada je k 1 = k 2 2.
Budući da su k 1 i k 2 konstantni na danoj temperaturi, njihov će omjer biti konstantan. Označavajući ga s K, dobivamo:

K se naziva konstanta kemijske ravnoteže, a gornja jednadžba se naziva zakon djelovanja mase (Guldberg - Waale).
U opći slučaj za reakciju oblika aA+bB+…↔dD+eE+… konstanta ravnoteže jednaka je ![]() . Za interakciju između plinovite tvaričesto koriste izraz u kojem su reaktanti predstavljeni ravnotežnim parcijalnim tlakovima p. Za spomenutu reakciju
. Za interakciju između plinovite tvaričesto koriste izraz u kojem su reaktanti predstavljeni ravnotežnim parcijalnim tlakovima p. Za spomenutu reakciju  .
.
Stanje ravnoteže karakterizira granicu do koje se, u danim uvjetima, reakcija odvija spontano (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
Odnos između ravnotežnih koncentracija ne ovisi o tome koje se tvari uzimaju kao početne tvari (npr. H 2 i I 2 ili HI), t.j. stanju ravnoteže može se pristupiti s obje strane.
Konstanta kemijske ravnoteže ovisi o prirodi reagensa i o temperaturi; Konstanta ravnoteže ne ovisi o tlaku (ako je previsok) niti o koncentraciji reagensa.
Utjecaj faktora temperature, entalpije i entropije na konstantu ravnoteže. Konstanta ravnoteže povezana je s promjenom standardnog izobarno-izotermnog potencijala kemijske reakcije ∆G o jednostavnom jednadžbom ∆G o =-RT ln K.
To pokazuje da velike negativne vrijednosti ∆G o (∆G o<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), tada u ravnotežnoj smjesi prevladavaju polazne tvari. Ova jednadžba omogućuje izračunavanje K iz vrijednosti ∆G o, a zatim ravnotežnih koncentracija (parcijalnih tlakova) reagensa. Ako uzmemo u obzir da je ∆G o =∆N o -T∆S o , tada nakon neke transformacije dobivamo ![]() . Iz ove jednadžbe jasno je da je konstanta ravnoteže vrlo osjetljiva na promjene temperature. Utjecaj prirode reagensa na konstantu ravnoteže određuje njezinu ovisnost o faktorima entalpije i entropije.
. Iz ove jednadžbe jasno je da je konstanta ravnoteže vrlo osjetljiva na promjene temperature. Utjecaj prirode reagensa na konstantu ravnoteže određuje njezinu ovisnost o faktorima entalpije i entropije.
Le Chatelierov princip
Stanje kemijske ravnoteže održava se pod zadanim konstantnim uvjetima u bilo kojem trenutku. Kada se uvjeti promijene, stanje ravnoteže se poremeti, jer se u tom slučaju brzine suprotnih procesa mijenjaju u različitim stupnjevima. Međutim, nakon nekog vremena sustav ponovno dolazi u stanje ravnoteže, ali ovaj put u skladu s novonastalim promijenjenim uvjetima.
Pomak ravnoteže ovisno o promjenama uvjeta općenito je određen Le Chatelierovim načelom (ili načelom pomične ravnoteže): Ako se na sustav u ravnoteži utječe izvana promjenom bilo kojeg od uvjeta koji određuju ravnotežni položaj, tada se on pomiče u smjeru procesa čiji tijek slabi učinak proizvedenog učinka.
Dakle, porast temperature uzrokuje pomak ravnoteže u smjeru procesa čiji tijek prati apsorpcija topline, a pad temperature djeluje u suprotnom smjeru. Slično, povećanje tlaka pomiče ravnotežu u smjeru procesa praćenog smanjenjem volumena, a smanjenje tlaka djeluje u suprotnom smjeru. Na primjer, u ravnotežnom sustavu 3H 2 +N 2 2H 3 N, ∆H o = -46,2 kJ, povećanje temperature pojačava razgradnju H 3 N na vodik i dušik, budući da je taj proces endoterman. Povećanje tlaka pomiče ravnotežu prema stvaranju H 3 N, jer se volumen smanjuje.
Ako se određena količina bilo koje od tvari koje sudjeluju u reakciji doda sustavu u stanju ravnoteže (ili, obrnuto, ukloni iz sustava), tada se brzine prednje i obrnute reakcije mijenjaju, ali se postupno ponovno izjednačavaju. Drugim riječima, sustav se vraća u stanje kemijske ravnoteže. U tom novom stanju ravnotežne koncentracije svih tvari prisutnih u sustavu razlikovat će se od izvornih ravnotežnih koncentracija, ali će omjer između njih ostati isti. Dakle, u sustavu u ravnoteži nemoguće je promijeniti koncentraciju jedne od tvari, a da ne izazove promjenu koncentracija svih ostalih.
U skladu s Le Chatelierovim načelom, uvođenje dodatnih količina reagensa u ravnotežni sustav uzrokuje pomak u ravnoteži u smjeru u kojem se koncentracija ove tvari smanjuje i, sukladno tome, povećava koncentracija proizvoda njezine interakcije.
Proučavanje kemijske ravnoteže od velike je važnosti kako za teorijska istraživanja tako i za rješavanje praktičnih problema. Određivanjem položaja ravnoteže za različite temperature i tlakove moguće je odabrati najpovoljnije uvjete za odvijanje kemijskog procesa. Pri konačnom izboru uvjeta procesa u obzir se uzima i njihov utjecaj na brzinu procesa.
Primjer 1. Izračunavanje konstante ravnoteže reakcije iz ravnotežnih koncentracija reaktanata.
Izračunajte konstantu ravnoteže reakcije A + B 2C, ako su ravnotežne koncentracije [A] = 0,3 mol∙l -1; [V]=1,1 mol∙l -1; [C]=2,1 mol∙l -1.
Riješenje. Izraz za konstantu ravnoteže za ovu reakciju ima oblik: . Zamijenimo ovdje ravnotežne koncentracije navedene u tvrdnji problema: =5,79.
Primjer 2. Izračunavanje ravnotežnih koncentracija tvari koje reagiraju. Reakcija se odvija prema jednadžbi A + 2B C.
Odredite ravnotežne koncentracije tvari koje reagiraju ako su početne koncentracije tvari A i B 0,5 odnosno 0,7 mol∙l -1, a konstanta ravnoteže reakcije K p = 50.
Riješenje. Na svaki mol tvari A i B nastaju 2 mola tvari C. Ako pad koncentracije tvari A i B označimo s X mol, tada će porast koncentracije tvari biti jednak 2X mol. Ravnotežne koncentracije reaktanata bit će:
C A = (oko.5-x)mol∙l -1; C B = (0,7-x) mol∙l -1; C C =2x mol∙l -1
x 1 =0,86; x 2 =0,44
Prema uvjetima zadatka vrijedi vrijednost x 2. Stoga su ravnotežne koncentracije reaktanata:
C A =0,5-0,44=0,06 mol∙l -1; C B =0,7-0,44=0,26 mol∙l -1; C C =0,44∙2=0,88mol∙l -1.
Primjer 3. Određivanje promjene Gibbsove energije ∆G o reakcije pomoću vrijednosti konstante ravnoteže K r. Izračunajte Gibbsovu energiju i odredite mogućnost reakcije CO + Cl 2 = COCl 2 pri 700 K ako je konstanta ravnoteže jednaka Kp = 1,0685∙10 -4. Parcijalni tlak svih tvari koje reagiraju jednak je i iznosi 101325 Pa.
Riješenje.∆G 700 =2,303∙RT ![]() .
.
Za ovaj proces:
Budući da ∆Go<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
Primjer 4. Pomak u kemijskoj ravnoteži. U kojem smjeru će se pomaknuti ravnoteža u sustavu N 2 +3H 2 2NH 3 -22kcal:
a) s povećanjem koncentracije N 2;
b) s povećanjem koncentracije H 2;
c) s povećanjem temperature;
d) kada se tlak smanji?
Riješenje. Porast koncentracije tvari na lijevoj strani jednadžbe reakcije, prema Le Chatelierovom pravilu, trebao bi uzrokovati proces koji teži oslabiti učinak i dovesti do smanjenja koncentracija, tj. ravnoteža će se pomaknuti udesno (slučajevi a i b).
Reakcija sinteze amonijaka je egzotermna. Povećanje temperature uzrokuje pomak ravnoteže ulijevo - prema endotermnoj reakciji, slabeći učinak (slučaj c).
Smanjenje tlaka (slučaj d) pogodovat će reakciji koja dovodi do povećanja volumena sustava, tj. prema stvaranju N 2 i H 2.
Primjer 5. Koliko će se puta promijeniti brzina prave i obrnute reakcije u sustavu 2SO 2 (g) + O 2 (g) 2SO 3 (r) ako se volumen plinske smjese smanji tri puta? U kojem smjeru će se pomaknuti ravnoteža sustava?
Riješenje. Označimo koncentracije reaktanata: = A, =b,=S. Prema zakonu o djelovanju mase, brzine prednje i povratne reakcije prije promjene volumena su jednake
v pr = Ka 2 b, v arr = K 1 s 2
Nakon smanjenja volumena homogenog sustava za tri puta, koncentracija svakog od reaktanata će se povećati tri puta: = 3a,[O 2] = 3b; = 3s. Pri novim koncentracijama, brzina v" np prednje i obrnute reakcije:
v" np = K(3a) 2 (3b) = 27 Ka 2 b; v o 6 p = K 1 (3c) 2 = 9K 1 c 2.
![]() ;
; ![]()
Posljedično, brzina prednje reakcije porasla je 27 puta, a obrnute samo devet puta. Ravnoteža sustava pomaknula se prema stvaranju SO 3.
Primjer 6. Izračunajte koliko će se puta povećati brzina reakcije koja se odvija u plinovitoj fazi kada temperatura poraste s 30 na 70 0 C, ako je temperaturni koeficijent reakcije 2.
Riješenje. Ovisnost brzine kemijske reakcije o temperaturi određena je empirijskim Van't Hoffovim pravilom prema formuli
Posljedično, brzina reakcije na 70°C je 16 puta veća od brzine reakcije na 30°C.
Primjer 7. Konstanta ravnoteže homogenog sustava
CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) pri 850°C jednako je 1. Izračunajte koncentracije svih tvari u ravnoteži ako su početne koncentracije: [CO] ISH = 3 mol/l, [H2O] RI = 2 mol/l.
Riješenje. U ravnoteži su brzine prednje i obrnute reakcije jednake, a omjer konstanti tih brzina je konstantan i naziva se konstanta ravnoteže zadanog sustava:
V np = K 1[CO][H2O]; V o b p = DO 2 [C02][H2];
![]()
U postavci zadatka date su početne koncentracije, dok su u izrazu K r uključuje samo ravnotežne koncentracije svih tvari u sustavu. Uzmimo da je u trenutku ravnoteže koncentracija [CO 2 ] P = x mol/l. Prema jednadžbi sustava, broj molova nastalog vodika također će biti x mol/l. Za isti broj molova (X mol/l) CO i H 2 O troše se na nastanak x mola CO2 i H2. Prema tome, ravnotežne koncentracije sve četiri tvari (mol/l):
[CO 2 ] P = [H 2 ] P = X;[CO] P = (3 – x); P = (2x).
Poznavajući konstantu ravnoteže, nalazimo vrijednost X, a zatim početne koncentracije svih tvari:
![]() ; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
Sve kemijske reakcije mogu se podijeliti na reverzibilan I nepovratan. Reverzibilne reakcije uključuju one reakcije koje se pri određenoj temperaturi odvijaju primjetnom brzinom u dva suprotna smjera - naprijed i natrag. Reverzibilne reakcije se ne odvijaju do kraja; niti jedan od reaktanata nije u potpunosti potrošen. Primjer bi bila reakcija
U određenom temperaturnom rasponu ova je reakcija reverzibilna. znak " » je znak reverzibilnosti.
Ireverzibilne reakcije su one reakcije koje se do kraja odvijaju samo u jednom smjeru, tj. dok se jedan od reaktanata potpuno ne potroši. Primjer ireverzibilne reakcije je reakcija razgradnje kalijevog klorata:
Stvaranje kalijevog klorata iz kalijevog klorida i kisika u normalnim je uvjetima nemoguće.
Stanje kemijske ravnoteže. Konstanta kemijske ravnoteže
Napišimo jednadžbu neke reverzibilne reakcije u općem obliku:
Do početka reakcije koncentracije polaznih tvari A i B bile su na svom maksimumu. Tijekom reakcije oni se troše i njihova koncentracija opada. Štoviše, u skladu sa zakonom masovnog djelovanja, brzina izravne reakcije
smanjit će se. (Ovdje i dolje strelica na vrhu pokazuje smjer procesa.) U početnom trenutku koncentracije produkata reakcije D i E bile su jednake nuli. Tijekom reakcije povećavaju se, brzina reverzne reakcije raste od nule prema jednadžbi:
Na sl. 4.5 prikazuje promjenu brzine naprijed i nazad
reakcije tijekom vremena. Nakon vremena t te se brzine izjednače - -» 
Riža. 4.5. Promjena u brzini naprijed (1) i obrnute (2) reakcije tijekom vremena: - u odsutnosti katalizatora: .......... - u prisutnosti katalizatora
To se stanje naziva kemijska ravnoteža. Kemijska ravnoteža je najstabilnije, granično stanje spontanih procesa. Može trajati neograničeno dugo ako se vanjski uvjeti ne promijene. U izoliranim sustavima u stanju ravnoteže entropija sustava doseže maksimum i ostaje konstantna, tj. dS = 0. U izobarno-izotermnim uvjetima pokretačka snaga procesa, Gibbsova energija, u ravnoteži poprima minimalnu vrijednost i dalje se ne mijenja, t.j. dG = 0.
Koncentracije sudionika reakcije u stanju ravnoteže nazivaju se ravnotežom. U pravilu se označavaju formulama odgovarajućih tvari, u uglastim zagradama, na primjer, ravnotežna koncentracija amonijaka označava se za razliku od početne, neravnotežne koncentracije C^NH^.
Budući da su brzine izravnih i obrnutih procesa u ravnoteži jednake, izjednačavamo desne strane jednadžbi (4.44) i
- -^ ja-
- (4.45), zamjenjujući oznaku koncentracije: A: [A]"”[B]" = ?[D] /; )










