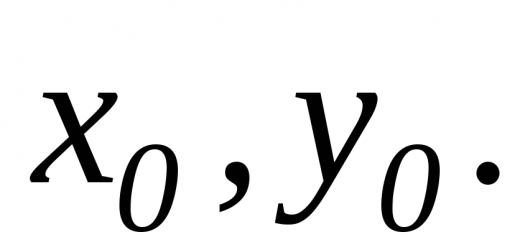DEFINICIJA
Cinkov- trideseti element periodnog sustava. Oznaka - Zn od latinskog "cinka". Smješten u četvrtoj periodi, grupa IIB. Odnosi se na metale. Naboj jezgre je 30.
Glavni prirodni spojevi cinka iz kojih se ekstrahira su minerali galmei ZnCO 3 i cinkova mješavina ZnS. Ukupni sadržaj cinka u Zemljina kora je približno 0,01% (tež.).
Cink je plavkasto-srebrni metal (slika 1). Na sobnoj temperaturi dosta je krhak, ali na 100-150 o C dobro se savija i smota u listove. Zagrijavanjem iznad 200 o C cink postaje vrlo krt. Kada je izložen zraku, prekriva se tankim slojem oksida ili bazičnog karbonata, koji ga štiti od daljnje oksidacije. Voda nema gotovo nikakav učinak na cink.
Riža. 1. Cink. Izgled.
Atomska i molekularna masa cinka
Relativna molekulska masa tvari (Mr) je broj koji pokazuje koliko je puta masa dane molekule veća od 1/12 mase ugljikovog atoma, i relativna atomska masa element (A r)- koliko puta Prosječna težina atomi kemijskog elementa veći su od 1/12 mase atoma ugljika.
Budući da cink u slobodnom stanju postoji u obliku monoatomskih molekula Zn, vrijednosti njegovih atomskih i Molekularna težina podudarati se. One su jednake 65,38.
Izotopi cinka
Poznato je da se krom u prirodi nalazi u obliku pet stabilnih izotopa 64 Zn, 66 Zn, 67 Zn, 68 Zn i 70 Zn. Njihovi maseni brojevi su 64, 66, 67, 68 i 70. Jezgra atoma izotopa cinka 64 Zn sadrži trideset protona i trideset četiri neutrona, a ostali izotopi od nje se razlikuju samo po broju neutrona.
Postoje umjetni nestabilni izotopi cinka s masenim brojevima od 54 do 83, kao i deset izomernih stanja jezgri, među kojima je najdugovječniji izotop 65 Zn s vremenom poluraspada od 243,66 dana.
Ioni cinka
Vani razina energije Atom cinka ima dva elektrona, koji su valentni:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 .
Kao rezultat kemijska interakcija cink predaje svoje valentne elektrone, tj. je njihov donor i pretvara se u pozitivno nabijen ion:
Zn 0 -2e → Zn 2+ .
Molekula i atom cinka
U slobodnom stanju cink postoji u obliku monoatomskih molekula Zn. Evo nekih svojstava koja karakteriziraju atom i molekulu cinka:
Cinkove legure
Slitine cinka s aluminijem, bakrom i magnezijem imaju veliki industrijski značaj. S bakrom cink čini važnu skupinu legura – mjed. Mesing sadrži do 45% cinka. Postoje jednostavni i posebni mesing. Potonji sadrži druge elemente, kao što su željezo, aluminij, kositar i silicij.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Tehnički cink mase 0,33 g tretiran je razrijeđenom otopinom sumporne kiseline. Oslobođeni vodik u normalnim uvjetima zauzima volumen od 112 ml. Izračunajte maseni udio cinka u industrijskom metalu. |
| Riješenje | Napišimo jednadžbu reakcije cinka s razrijeđenom sumpornom kiselinom: Zn + H 2 SO 4 (razrijeđeno) = ZnSO 4 + H 2. Nađimo broj molova vodika koji se oslobađa tijekom reakcije: n (H2) = V (H2)/Vm; n (H2) = 112 × 10 -3 / 22,4 = 0,005 mol. Prema jednadžbi reakcije n (H 2):n (Zn) = 1:1, tj. n (H2) = n (Zn) = 0,005 mol. Tada će masa čistog cinka (bez primjesa) biti jednaka ( molekulska masa- 65 g/mol): m čisti (Zn) = 0,005 × 65 = 0,325 g. Maseni udio cink u tehničkom metalu izračunava se kao: ω(Zn) = m čisti (Zn)/ m tec (Zn) × 100%; ω(Zn) = 0,325/ 0,33 × 100%; ω(Zn) = 98,48 %. |
| Odgovor | Maseni udio cinka u tehničkom metalu je 98,48%. |
PRIMJER 2
| Vježbajte | Izračunajte masu cinka koju je potrebno otopiti u klorovodičnoj kiselini da bi se dobio vodik potreban za redukciju 20 g bakrova (II) oksida u metal. |
| Riješenje | Zapišimo jednadžbe reakcija koje se odvijaju prema uvjetima zadatka: Zn + 2HCl = ZnCl2 + H2 (1); H 2 + CuO = Cu + H 2 O (2). Izračunajmo količinu bakrovog (II) oksida (molarna masa - 80 g/mol): n (CuO) = m (CuO) / M (CuO); n (CuO) = 20 / 80 = 0,25 mol. Prema jednadžbi (2) n (CuO):n (H 2) = 1:1, tj. n (CuO) = n (H 2) = 0,25 mol. Zatim, broj molova cinka koji je reagirao s klorovodična kiselina bit će jednak 0,25 mol, budući da je n (Zn):n (H 2) = 1:1, tj. n(Zn) = n(H2). Masa cinka (molarna masa je 65 g/mol) je: m čisti (Zn) = n (Zn) × M (Zn); m čistoće (Zn) = 0,25 × 65 = 16,25 g. |
| Odgovor | Masa cinka je 16,25 g |
U 18. stoljeću cink je izoliran u svom čistom obliku i od tog trenutka ljudi počinju otkrivati njegova brojna vrijedna svojstva. Danas se ovaj mineral koristi za izradu raznih metalnih legura, za izradu boja, u laserskoj tehnologiji i, naravno, u zdravstvu. Posebni pripravci na bazi cinka djeluju protuupalno i suše. Kada se uzima u sastavu raznih dodataka prehrani, cink pokazuje i druge povoljne učinke na ljudsko zdravlje.
Sadržaj cinka u proizvodima (na 100 g):
Jetra - 4-6 mg
Sir - 3-4 mg
Govedina - 3,2 mg
Grah - 3,2 mg
Grašak - 3,2 mg
Heljda - 2,7 mg
Zobene pahuljice - 2,7 mg
Što je cink?
Cink je neophodan za život. Cink je u najvećim količinama prisutan u mišićima, koži, jetri, krvnim stanicama, a kod muškaraca iu prostati i sjemenoj tekućini. Mineral ima mnogo različitih funkcija, iako se cink u tijelu nalazi u vrlo malim količinama. U ljudskom tijelu ima ga samo oko 2 grama: muškarci nešto više, žene nešto manje.
Hrana bogata cinkom
Mnogi životinjski i biljni proizvodi odlikuju se prisutnošću cinka u svom sastavu. Nalazi se u mesu i peradi, ribi i školjkama. Cink možete dobiti iz mahunarki, orašastih plodova, žitarica, povrća, voća i bobičastog voća.
Dnevna potreba za cinkom
Ljudsko tijelo treba primiti dozu cinka koja odgovara 10-15 mg dnevno. Unos može biti intenzivniji, ali je nepoželjno da doza minerala prelazi 25 mg.
 Povećana potreba za cinkom
Povećana potreba za cinkom
Blago povećanje potrebe za cinkom moguće je kod:
Muškarci s bolestima prostate ili problemima s neplodnošću
Osobe koje se bave intenzivnom tjelesnom aktivnošću (znojenjem se gube mnogi minerali, uključujući i cink)
Trudnice i dojilje.
Apsorpcija cinka iz hrane
Samo mali dio cinka prisutnog u hrani se apsorbira, ali normalno (uz cjelovitu prehranu) ta je količina dovoljna za održavanje potrebnog minimalnog sadržaja cinka u tijelu.
Biološka uloga cinka
Funkcije cinka:
Glavna uloga cinka je da je neophodan sastavni dio mnogi enzimi koji sudjeluju u ogroman broj metaboličke procese i fiziološke reakcije
Kao dio hormona inzulina, neophodan je za održavanje normalnog metabolizma ugljikohidrata, za prevenciju dijabetesa i normalizaciju razine glukoze u krvi.
Sudjeluje u stvaranju proteina, aminokiselina i DNA, te u transformaciji masti i održavanju normalne težine
Potiče rast i razvoj u djetinjstvu i adolescenciji
Sudjeluje u stvaranju spolnih hormona, pomaže u regulaciji procesa puberteta, važan je za trudnoću, za povećanje vitalnosti i poboljšanje svojstava sperme.
Podržava imunološki sustav, ima značajnu ulogu u stvaranju i razvoju imunoloških stanica, povećava otpornost organizma na viruse i bakterije
Pokazuje neovisno protuupalno djelovanje
Ima važno u provedbi metabolizma minerala, pomaže povećati čvrstoću kostiju
Navodno djeluje protiv raka
Djeluje kao antioksidans, sprječava razvoj bolesti i prerano starenje
 . Ima kozmetičko djelovanje: osigurava dobro stanje kose, noktiju i kože
. Ima kozmetičko djelovanje: osigurava dobro stanje kose, noktiju i kože
Povećava otpornost organizma na etilni alkohol
Poboljšava apsorpciju i djelovanje vitamina E i A
Poboljšava stanje zuba
Štiti mozak od bolesti povezanih sa starenjem
Pozitivno utječe na tijek trudnoće i formiranje živčani sustav i drugi organi fetusa
Održava acidobaznu ravnotežu
U interakciji je s bakrom, a zajedno su odgovorni za proizvodnju posebnih krvnih lipoproteina.
Znakovi nedostatka cinka
Upotreba cinka u lijekovima potrebna je osobama koje imaju simptome njegovog nedostatka. Nedostatak cinka uzrokuje simptome kao što su smanjeni osjet okusa i mirisa, oslabljena osjetljivost kože, gubitak i propadanje kose, problemi s noktima, pojava akni na koži, pad imuniteta, što se osjeća čestim oboljevanjem. Oni kojima nedostaje cinka također se žale na sporije zacjeljivanje ozljeda, smanjenu potenciju, neplodnost, neuroze i proljev.
Kada minerala kronično nedostaje, može uzrokovati anemiju, prerano starenje, depresiju i probleme s težinom. Povećava se vjerojatnost raka i alergija. Osim toga, smanjuje se sadržaj joda i bakra u tijelu.
Ako trudnica nema dovoljno cinka, to može uzrokovati krvarenje tijekom poroda, prerano rođenje djeteta i slabost trudova.
Znakovi viška cinka
Ako više od 200 mg cinka odjednom uđe u ljudski organizam, to kod čovjeka izaziva mučninu i povraćanje. Ako dugotrajno uzimate pripravke cinka u visokim dozama, može doći do problema s imunološkim sustavom, razvoja gastritisa, a ponekad i ozbiljnijih poremećaja - erozija, čireva na sluznici.
Uočeno je da pretjerano intenzivan unos cinka povećava vjerojatnost razvoja autoimunih bolesti, uključujući i one česte kao što su sistemski eritematozni lupus, reumatoidni artritis itd.
Višak cinka može nastati u kontaktu s njegovim spojevima pri radu, kao i nepravilnom uporabom pripravaka koji sadrže cink.
Čimbenici koji utječu na sadržaj cinka u proizvodima
Možete kuhati, pržiti i spremati hranu bez ugrožavanja sadržaja cinka u njoj. Međutim, neke vrste obrade još uvijek lišavaju hranu ovog vrijednog elementa. Na primjer, pri izradi brašna (mljevenju žitarica) gubi se i do 80% minerala. Osim toga, cink se uklanja iz hrane tijekom procesa rafiniranja.
Zašto dolazi do nedostatka cinka?
Među razlozima nedostatka minerala su sljedeći:
 . Bolesti popraćene povećanim znojenjem
. Bolesti popraćene povećanim znojenjem
Visoka opterećenja
Uzimanje diuretika
Patologija probavnih organa, sprječavajući normalnu apsorpciju vrijednih elemenata
Zloupotreba alkohola
Intenzivna konzumacija ugljikohidrata
Postoperativna stanja, parenteralna prehrana, razne vrste opeklina
Disbakterioza
. Psorijaza i druge kožne bolesti
Cink: cijena i prodaja
Cink možete kupiti i početi ga uzimati u bilo kojem trenutku – samo trebate odabrati kvalitetan dodatak prehrani koji ga sadrži. Nudimo širok izbor različitih dodataka cinka, a nudimo ih po izvrsnim cijenama koje su pristupačne svima. Dodajte odabrani lijek u svoju košaricu ili nazovite kako biste dovršili kupnju. Za regije postoji besplatni broj 8 800 550-52-96 .
: Sve ovo napravljeno je s . Cink ima jednu vrlo važnu kvalitetu: daje proizvodu antikorozivna svojstva. Zato je naznačeno kemijski element naširoko se koristi u strojarstvu, industriji (osobito kemijskoj) i građevinarstvu.
Dakle, danas ćemo pogledati kemijski sastav cink, njegova struktura, kao i proizvodnja cinka u Rusiji i svijetu.
Pogledajmo cink kao element. U periodičnom sustavu Mendelejeva dodijeljen je cink serijski broj 30. Svježe iskopani cink (neprerađen) sadrži stabilne izotope s masenim brojevima 64, 66 i 67 i elektrone koji su raspoređeni na sljedeći način: 2-8-18-2.
U svjetskim razmjerima cink je na 23. mjestu po zastupljenosti među svim elementima.
U polimetalnim rudama opisani kemijski element nalazi se u obliku sulfida. Osim toga, prirodni cink ima sljedeće nečistoće: Pb, Cd, Fe, Cu, Ag, Au, Bi. Ovisno o kvantitativnom sadržaju samog elementa cinka i nečistoća, cink ima nekoliko stupnjeva. Prema istom periodnom sustavu, atomska masa cinka je 65,409.
U nastavku ćemo govoriti o tome koja je oprema potrebna za proizvodnju cinka i kakvu štetu uzrokuje u proizvodnji.
Video ispod će vam reći o sastavu cinka i njegovoj strukturi:
Proizvodnja metala
Potrebna oprema
Cink ne postoji u svom čistom obliku. Dobiva se iz drugih prirodnih stijena. Tu spadaju polimetalne sulfidne rude i neki minerali: sfalerit, smitsonit, cinkit, smitsonit, hemimorfit, klejofan, kalamin, wurtzit, willemit i drugi. Najčešći mineral je sfalerit.
Ako se cink nalazi u miješanim rudama, onda su njegovi pratioci najčešće talij, kadmij, germanij, galij i indij.
Cink se prerađuje u industrijskim pogonima. Svaki pogon ima svoje tehnološke karakteristike proizvodnje. Stoga se proizvodna linija i oprema mogu razlikovati. U tvornicama cinka može se vidjeti sljedeća oprema:
- Vertikalni mehanizirani rotori.
- Šahtne i lučne električne peći.
- Elektrolitički rotori.
- Transporteri.
- Peći za sušenje.
- Kupke za elektrolizu ili čitavi elektrolizni kompleksi.
Obračun sirovina
Čisti cink dobiva se preradom sulfidnih, cinkovih i polimetalnih ruda. Količina prerađenih sirovina koje sadrže cink ovisi o sposobnosti i kapacitetu postrojenja. Za svakoga je individualno. Stoga se u okviru konkretne proizvodnje mora napraviti točan izračun potrebnih sirovina.
Metode dobivanja
Da bi se izolirao cink, ruda se obogaćuje flotacijom ili gravitacijom. Rezultat takvog obogaćivanja je proizvodnja koncentrata cinka. Osim toga, dobivaju se nusproizvodi, koncentrati pirita i olova.
Izdvojeni koncentrat cinka peče se u peći. Kao rezultat, nastaje cinkov oksid. Ovdje je proces proizvodnje podijeljen u dvije faze. Dobiveni sumporni dioksid koristi se za preradu sumporne kiseline, a cink ide u sljedeću fazu prerade.
Čisti cink se može dobiti na sljedeće načine:
- Prvi način: pirometalurški (destilacija). Suština ove metode proizvodnje je sljedeća: dobiveni koncentrat se prži, sinterira i reducira ugljenom ili koksom. Nastale metalne pare se kondenziraju i izlijevaju u kalupe.
- Drugi način: elektrolitička (hidrometalurška). Bit druge metode je da se nakon pečenja koncentrat tretira sumpornom kiselinom. Dobivena otopina se pročišćava od stranih nečistoća i podvrgava procesu elektrolize.
O pirometalurškoj metodi dobivanja cinka naučit ćete iz videa u nastavku:
Faze
Cink prolazi kroz sljedeće faze proizvodnje:
- Priprema sirovina za preradu.
- Rafiniranje pripremljenih sirovina.
- Priprema za fazu ispiranja.
- Provođenje ispiranja.
- Čišćenje otopine od nečistoća.
- Elektrolitičko taloženje.
- Taljenje katodnog cinka.
Kao primjer, razmotrimo detaljnije slijed proizvodnje cinka u ruskom poduzeću - Čeljabinskoj tvornici cinka.
- Prijem sirovina. Poduzeće se opskrbljuje sirovinama (koncentrat cinka) u željezničkim vagonima. Sirovine od različitih dobavljača se miješaju (za prosjek opće vrijednosti nečistoće) i šalje se duž pokretne trake na pečenje.
- Koncentrat za pečenje. Tvornica koristi pet peći za toplinsku obradu. Na vrlo visokim temperaturama koncentrat oksidira (880-950ºS). Rezultat su dva proizvoda: sumporni dioksid i cinkov pepeo. Sumporni dioksid se pročišćava i šalje u preradu sumporne kiseline. U ložištu se odvijaju egzotermne reakcije uz pomoć kojih se stvorena toplina pohranjuje i ostaje za topljenje.
- Dobivanje sumpora. Dobiva se tijekom procesa pečenja sumporne kiseline se odlaže.
- Ispiranje. Cink se ekstrahira u posebnu otopinu. Međutim, u tekućinu ne ulazi samo cink, već i razne nečistoće. Kada se postigne potrebna koncentracija otopine, smjesa se šalje na pročišćavanje. Međutim, nije moguće izolirati sav cink. Neki dio još uvijek ostaje u otopini. Stoga se otopina podvrgava dodatnoj filtraciji. Nakon toga, cink se šalje u radionicu Waelz. To su pećnice čiji je oblik sličan cilindru. Oni provode rotacijski pokreti. Kroz ovu fazu prolaze dva produkta izgaranja: pepeo i sumporni dioksid.
- Elektroliza cinka. Postupak se odvija u kompleksu elektrolize. Otopine za čišćenje se izvode pomoću cinkove prašine. Nakon čišćenja nastaju proizvodi koji se nazivaju pogače. Kolač se kasnije koristi za proizvodnju kadmija.
- Motanje kolača. Kako bi se maksimalno iskoristio cink iz pogače, spomenuta tvar se miješa s koksnom pogačom i zagrijava na visoku temperaturu (1200 C). Cijeli proces odvija se u rotacijskoj cijevnoj peći. Krajnji produkti u ovoj fazi su Waelzov oksid i bakar. Oksid se pritom sublimira, hladi i hvata posebnim filtrima. Nakon toga, Waelz oksid se koristi za ispiranje, a klinker se šalje kao sirovina poduzećima.
- Hidrometalurški proces. Ovdje se obrada odvija u otopini sumporne kiseline. Proces je neophodan za dobivanje nekoliko vrijednih elemenata: otopina cink sulfata, tehnički cink, koji uključuje indijeve legure, i indija. Voda iz prerade se tretira sa sodom, filtrira pomoću filter preše i ponovno ulazi u tehnološki proces.
- Ljevaonica. Dobivena metalna katoda od cinka tali se u indukcijskim pećima.
- Punionica. Zatim se cink lijeva u blokove od 0,5-1,0 tona i ingote od 25 kg. Postupak se provodi pomoću stroja za centrifugalno lijevanje. Tvornica ima i postrojenje za proizvodnju cinkove prašine koja košta višestruko više od samog cinka.
Poznati proizvođači
 Do samog velike zemlje Zemlje proizvođači cinka uključuju Australiju, Kanadu i Kinu. Ove se zemlje nazivaju i najvećim izvoznicima. Cink se uvozi iz Njemačke, Tajvana i SAD-a.
Do samog velike zemlje Zemlje proizvođači cinka uključuju Australiju, Kanadu i Kinu. Ove se zemlje nazivaju i najvećim izvoznicima. Cink se uvozi iz Njemačke, Tajvana i SAD-a.
SAD je također stvorio zasluženu nišu u proizvodnji cinka. Stvar je u tome što je na sjeverozapadu Aljaske, na udaljenosti od 100 km od obale Čukotskog mora, najviše bogat depozit cink – rudnik Red Dog. Kamenolom cinka nalazi se na vrlo nepristupačnom mjestu. Međutim, Sjedinjene Države vade rudu cinka tijekom cijele godine. U blizini rudnika nalazi se i selo u kojem živi većina radnika.
Što se tiče Rusije, mi kopamo cink na Uralu, kao iu nekim područjima Primorja i Južnog Sibira. U usporedbi sa svjetskom proizvodnjom, ruski udio ostaje samo 1,7%. Jedan od najvećih proizvođača u Rusiji smatra se tvrtka GMK Dalpolimetal, koja se nalazi u istoimenom gradu Dalnegorsk (Primorsky Territory). U odnosu na ostale pogone, ovaj proizvođač proizvodi 15% (od ukupnog udjela) koncentrata cinka.
Postoje još tri velika pogona za proizvodnju cinka:
- CHETSZ (Čeljabinska tvornica elektrolitičkog cinka). Zahvaljujući automatiziranom kompleksu, poduzeće je u mogućnosti proizvoditi cink Visoka kvaliteta(oko 100%).
- DOO "Elektrocink" Tvrtka se nalazi u Vladikovkazu ( Sjeverna Osetija). Tvornica proizvodi oko 100.000 tona proizvoda godišnje. Međutim, svi proizvodi ovog poduzeća idu uglavnom u strane zemlje.
- OJSC Belovsky Zinc Plant ( regija Kemerovo). Poduzeće posluje samo na sirovinama koje mu se isporučuju. Vlastitih depozita nema. Tvornica je uvela elektrotermalnu tehnologiju, uz pomoć koje je moguće prerađivati čak i sirovine niskog stupnja.
Ovaj video će vam reći kako se proizvodi cink na primjeru CHECZ-a:
CINK (kemijski element) CINK (kemijski element)
CINK (lat. Zincum), Zn (čitaj “cink”), kemijski element s atomskim brojem 30, atomske mase 65,39. Prirodni cink sastoji se od mješavine pet stabilnih nuklida: 64 Zn (48,6% težine), 66 Zn (27,9%), 67 Zn (4,1%), 68 Zn (18,8%) i 70 Zn (0,6%). Smješten u četvrtoj periodi u skupini IIB periodni sustav elemenata. Konfiguracija dva vanjska elektronička sloja 3 s 2
str 6
d 10
4s 2
. U spojevima pokazuje oksidacijsko stanje +2 (valencija II).
Polumjer atoma Zn je 0,139 nm, polumjer iona Zn 2+ je 0,060 nm (koordinacijski broj 4), 0,0740 nm (koordinacijski broj 6) i 0,090 nm (koordinacijski broj 8). Sekvencijalne energije ionizacije atoma odgovaraju 9,394, 17,964, 39,7, 61,6 i 86,3 eV. Elektronegativnost prema Paulingu (cm. PAULING Linus) 1,66.
Povijesna referenca
Legure cinka s bakrom - mesing (cm. MJED)- bili su poznati starim Grcima i Egipćanima. Cink je dobiven u 5. stoljeću. PRIJE KRISTA e. u Indiji. rimski povjesničar Strabon (cm. STRABO) u 60-20 pr. e. pisao o dobivanju metalnog cinka ili "lažnog srebra". Naknadno je izgubljena tajna dobivanja cinka u Europi, budući da se cink nastao termičkom redukcijom cinkove rude pretvara u paru na 900°C. Pare cinka reagiraju s kisikom (cm. KISIK) zraka, tvoreći labavi cinkov oksid, koji su alkemičari nazvali "bijela vuna".
Godine 1743. u Bristolu je otvorena prva tvornica metala cinka, gdje se cinkova ruda reducirala u retortama bez pristupa zraku. Godine 1746. A. S. Marggraff (cm. MARGGRAF Andreas Sigismund) razvio je metodu za proizvodnju metala kalciniranjem smjese njegovog oksida i ugljena bez pristupa zraka u retortama, nakon čega slijedi kondenzacija cinkove pare u hladnjacima.
Riječ "cink" pojavljuje se u spisima Paracelsusa (cm. PARACELSUS) i drugi istraživači 16-17 stoljeća. i seže, možda, do drevnog njemačkog "cinka" - plak, rana na oku. Naziv ovog metala mijenjao se nekoliko puta tijekom svoje povijesti. Naziv "cink" postao je uobičajen tek 1920-ih.
Biti u prirodi
Sadržaj cinka u zemljinoj kori iznosi 8,3·10–3% mase, u vodi Svjetskog oceana 0,01 mg/l. Poznato je 66 minerala cinka, od kojih je najvažniji sfalerit (cm. SFALERIT), Kleofan (cm. KLEJOFAN), marmatit (cm. MARMATIT), vurcit, (cm. WURTZITE) smithsonite (cm. SMITHSONITE) ZnCO 3, kalamin (cm. CALAMINA) Zn 4 (OH) 4 Si 2 O 7 H 2 O, cinkit (cm. CINKIT) ZnO, willemit (cm. WILLEMITH). Cink je dio polimetalnih ruda, koje također sadrže bakar, olovo, kadmij ,
indij (cm. INDIJ),
galij (cm. GALIJ),
talij (cm. TALIJ) i drugi. Cink je važan biogeni element: živa tvar sadrži 5·10–4% masenog udjela.
Priznanica
Cink se vadi iz polimetalnih ruda koje sadrže 1-4% Zn u obliku sulfida. Ruda se obogaćuje za dobivanje koncentrata cinka (50-60%). Koncentrati cinka se pale u pećima s fluidiziranim slojem, pretvarajući cinkov sulfid u ZnO. Dva su puta od ZnO do Zn. Prema pirometalurškoj metodi, koncentrat se sinterira, a zatim reducira ugljenom ili koksom na 1200-1300°C. Zatim se pare cinka isparene iz peći kondenziraju.
ZnO + C = Zn + CO.
Glavna metoda dobivanja cinka je hidrometalurška. Spaljeni koncentrati tretiraju se sumpornom kiselinom. Nečistoće se uklanjaju iz dobivene otopine sulfata njihovim taloženjem cinkovom prašinom. Pročišćena otopina se podvrgava elektrolizi. Cink se taloži na aluminijskim katodama. Čistoća elektrolitskog cinka je 99,95%.
Za dobivanje cinka visoke čistoće koristi se zonsko taljenje (cm. ZONA TOPLJENJA).
Fizička i kemijska svojstva
Cink - plavkasto bijeli metal.
Ima šesterokutnu rešetku s parametrima A= 0,26649 nm, S= 0,49468 nm. Talište 419,58°C, vrelište 906,2°C, gustoća 7,133 kg/dm3. Na sobnoj temperaturi je krhak. Na 100-150°C je plastičan. Standardni elektrodni potencijal je –0,76 V, u području standardnih potencijala nalazi se do Fe željeza.
Na zraku je cink obložen tankim filmom ZnO oksida. Kad se jako zagrije, gori stvarajući amfoter (cm. AMFOTERNI) bijeli ZnO oksid.
2Zn + O 2 = 2ZnO
Cinkov oksid reagira s kiselim otopinama:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
i s alkalijama:
ZnO + 2NaOH (fuzija) = Na 2 ZnO 2 + H 2 O
U ovoj reakciji nastaje natrijev cinkat Na 2 ZnO 2 .
Cink obične čistoće aktivno reagira s kiselim otopinama:
Zn + 2HCl = ZnCl2 + H2
Zn + H 2 SO 4 = ZnSO 4 + H 2
i otopine lužina:
Zn + 2NaOH + 2H 2 O = Na 2 + H 2,
stvarajući hidroksinate. Vrlo čisti cink ne reagira s otopinama kiselina i lužina. Interakcija počinje kada se doda nekoliko kapi otopine bakrenog sulfata CuSO 4 .
Kada se zagrijava, cink reagira s halogenima (cm. HALOGEN) uz stvaranje ZnHal 2 halogenida. S fosforom (cm. FOSFOR) cink stvara fosfide Zn 3 P 2 i ZnP 2. Sa sumporom (cm. SUMPOR) i njegovi analozi - selen (cm. SELEN) i telur (cm. TELUR)- razni halkogenidi (cm. KALKOGENIDI), ZnS, ZnSe, ZnSe 2 i ZnTe.
S vodikom (cm. VODIK), dušik (cm. DUŠIK), ugljik (cm. UGLJIK), silicij (cm. SILIKON) i bor (cm. BOR (kemijski element) cink ne reagira izravno. Nitrid Zn 3 N 2 dobiva se reakcijom cinka s amonijakom (cm. AMONIJAK) NH3 na 550-600°C.
U vodenim otopinama nastaju ioni cinka Zn 2+ aqua kompleksi 2+ i 2+.
Primjena
Najveći dio proizvedenog cinka troši se na proizvodnju antikorozivnih premaza za željezo i čelik. Cink se koristi u baterijama i baterijama sa suhim ćelijama. U tiskarstvu se koriste cinkovi limovi. U tehnologiji se koriste legure cinka (mjed, nikal srebro i dr.). ZnO služi kao pigment u cinkovom bijelilu. Spojevi cinka su poluvodiči. Željeznički pragovi impregnirani su otopinom cinkovog klorida ZnCl 2, čime se štite od truljenja.
Fiziološko djelovanje
Cink je dio više od 40 metaloenzima koji kataliziraju hidrolizu peptida, proteina i drugih spojeva u ljudskom tijelu. Cink je dio hormona inzulina. (cm. INZULIN) Cink u ljudski organizam ulazi s mesom, mlijekom i jajima.
Biljke s nedostatkom cinka u tlu obolijevaju.
Metalni cink je malo toksičan. Cink fosfid i oksid su otrovni. Unos topivih cinkovih soli u organizam dovodi do probavnih smetnji i iritacije sluznice. MDK za cink u vodi je 1,0 mg/l.
enciklopedijski rječnik . 2009 .
Pogledajte što je "CINK (kemijski element)" u drugim rječnicima:
Cink (lat. Zincum), Zn, kemijski element II skupine periodnog sustava Mendeljejeva; atomski broj 30, atomska masa 65,38, plavkasto bijeli metal. Postoji 5 poznatih stabilnih izotopa s masenim brojevima 64, 66, 67, 68 i 70; najčešće... ... Velika sovjetska enciklopedija
Srebrov klorid je primarni kemijski izvor struje u kojem je anoda cink, katoda srebrov klorid, a elektrolit je vodena otopina amonijevog klorida (amonijaka) ili natrijevog klorida. Sadržaj 1 Povijest izuma 2 Parametri ... Wikipedia
- (franc. Chlore, njem. Chlor, engl. Chlorine) element iz grupe halogena; njegov znak je Cl; atomska težina 35.451 [Prema Clarkeovom izračunu Stasovih podataka.] na O = 16; Cl 2 čestica, koja se dobro slaže sa svojim gustoćama koje su pronašli Bunsen i Regnault u odnosu na... ...
- (Argentum, argent, Silber), kemij. Ag znak. S. spada u metale poznato čovjeku još u antičko doba. U prirodi se nalazi u rodna država, te u obliku spojeva s drugim tijelima (sa sumporom, npr. Ag 2S... ... Enciklopedijski rječnik F.A. Brockhaus i I.A. Ephron
- (Argentum, argent, Silber), kemij. Ag znak. S. je jedan od metala poznatih čovjeku od davnina. U prirodi se nalazi iu prirodnom stanju iu obliku spojeva s drugim tijelima (sa sumporom, na primjer Ag2S srebro ... Enciklopedijski rječnik F.A. Brockhaus i I.A. Ephron
Enciklopedijski rječnik F.A. Brockhaus i I.A. Ephron
- (platinski francuski, platinski ili um engleski, platinski njemački; Pt = 194,83, ako je O = 16 prema K. Seibertu). P. je obično popraćen drugim metalima, a oni od tih metala koji su uz njega po svojim kemijskim svojstvima nazivaju se... ... Enciklopedijski rječnik F.A. Brockhaus i I.A. Ephron
Enciklopedijski rječnik F.A. Brockhaus i I.A. Ephron
- (brom; kemijski oblik. Br, atomska težina 80) nemetalni element, iz skupine halogena, otkrio ga je 1826. francuski kemičar Balard u matičnim otopinama soli. morska voda; B. je dobio ime od grčke riječi Βρωμος smrad.… … Enciklopedijski rječnik F.A. Brockhaus i I.A. Ephron
- (Soufre francuski, Sumpor ili sumpor engleski, Schwefel njemački, θετον grčki, latinski Sumpor, odakle simbol S; atomska težina 32,06 na O=16 [Odredio Stas iz sastava srebrnog sulfida Ag 2 S]) pripada među naj važni nemetalni elementi.... ... Enciklopedijski rječnik F.A. Brockhaus i I.A. Ephron
Cinkov(lat. Zincum), Zn, kemijski element II skupine periodnog sustava Mendeljejeva; atomski broj 30, atomska masa 65,38, plavkasto-bijeli metal. Postoji 5 poznatih stabilnih izotopa s masenim brojevima 64, 66, 67, 68 i 70; najčešći je 64 Zn (48,89%). Umjetno je dobiven niz radioaktivnih izotopa, među kojima je najdugovječniji 65 Zn s vremenom poluraspada T ½ = 245 dana; koristi se kao izotopski indikator.
Povijesna referenca. Legura cinka i bakra - mesing - bila je poznata starim Grcima i Egipćanima. Dugo vremena nije bilo moguće izolirati čisti cink. Godine 1746. A. S. Marggraf razvio je metodu za proizvodnju metala kalciniranjem smjese njegovog oksida i ugljena bez pristupa zraka u glinenim vatrostalnim retortama, nakon čega je uslijedila kondenzacija cinkove pare u hladnjacima. Taljenje cinka počelo je u industrijskim razmjerima u 17. stoljeću.
Rasprostranjenost cinka u prirodi. Prosječni sadržaj cinka u zemljinoj kori (clarke) je 8,3 10 -3% po težini, u bazičnim magmatskim stijenama nešto je veći (1,3 10 -2%) nego u kiselim stijenama (6 10 -3%). Poznato je 66 minerala cinka, od kojih su najvažniji cinkit, sfalerit, willemit, kalamin, smithsonit, Frank-linit ZnFe 2 O 4 . Cink je energična vodena selica; Posebno je karakteristična njegova migracija u termalnim vodama zajedno s Pb; Iz ovih voda talože se cinkovi sulfidi koji su od velike industrijske važnosti. Cink također snažno migrira u površinskim i podzemnim vodama; glavni taložnik za njega je H 2 S, sorpcija glinama i drugi procesi imaju manju ulogu. Cink je važan biogeni element; živa tvar sadrži prosječno 5·10 -4% Cinka, ali postoje i koncentracijski organizmi (npr. neke ljubičice).
Fizička svojstva cinka. Cink je metal srednje tvrdoće. Kad je hladan, krhak je, ali na 100-150 °C vrlo je plastičan i lako se umotava u listove i folije debljine oko stotinki milimetra. Na 250 °C ponovno postaje krt. Nema polimorfnih modifikacija. Kristalizira u heksagonalnoj rešetki s parametrima a = 2,6594Å, c = 4,9370Å. Atomski radijus 1,37Å; ionski Zn 2+ -0,83Å. Gustoća krutog cinka je 7,133 g/cm 3 (20 °C), tekućeg 6,66 g/cm 3 (419,5 °C); tpl 419,5 °C; vrelište 906 °C. Temperaturni koeficijent linearnog širenja 39,7 10 -3 (20-250 °C), koeficijent toplinske vodljivosti 110,950 W/(m K) 0,265 cal/cm sec °C (20 °C), električni otpor 5,9 10 -6 ohm cm (20 °C), specifična toplina cinka 25,433 kJ/(kg K.). Vlačna čvrstoća 200-250 MN/m2 (2000-2500 kgf/cm2), relativno istezanje 40-50%, Brinellova tvrdoća 400-500 MN/m2 (4000-5000 kgf/cm2). Cink je dijamagnetičan, njegova specifična magnetska osjetljivost je -0,175·10 -6.
Kemijska svojstva cinka. Vanjska elektronička konfiguracija atoma Zn je 3d 10 4s 2. Oksidacijsko stanje u spojevima je +2. Normalni redoks potencijal od 0,76 V karakterizira cink kao aktivni metal i energetski redukcijski agens. Na zraku na temperaturama do 100 °C cink brzo potamni, prekrivajući se površinskim filmom bazičnih karbonata. U vlažnom zraku, posebno u prisutnosti CO 2, dolazi do razaranja metala čak i pri normalnim temperaturama. Kad se jako zagrije na zraku ili kisiku, cink intenzivno gori plavičastim plamenom, stvarajući bijeli dim cinkovog oksida ZnO. Suhi fluor, klor i brom ne reagiraju s cinkom na hladnoći, ali u prisutnosti vodene pare metal se može zapaliti, stvarajući, na primjer, ZnCl 2. Zagrijana smjesa cinkovog praha i sumpora daje cinkov sulfid ZnS. Cinkov sulfid se taloži kada sumporovodik djeluje na blago kiselo ili amonijačno vodene otopine Zn soli. ZnH 2 hidrid se dobiva reakcijom LiAlH 4 sa Zn(CH 3) 2 i drugim spojevima cinka; tvar slična metalu koja se zagrijavanjem raspada na elemente. Nitrid Zn 3 N 2 - crni prah, nastaje kada se zagrije na 600 ° C u struji amonijaka; postojan na zraku do 750 °C, voda ga razgrađuje. Cink karbid ZnC 2 dobiven je zagrijavanjem cinka u struji acetilena. Jake mineralne kiseline snažno otapaju cink, posebno kada se zagrijavaju, da bi se stvorile odgovarajuće soli. U interakciji s razrijeđenom HCl i H 2 SO 4 oslobađa se H 2, a uz HNO 3, NO, NO 2, NH 3. Cink reagira s koncentriranom HCl, H 2 SO 4 i HNO 3, oslobađajući H 2, SO 2, NO odnosno NO 2. Otopine i taline lužina oksidiraju cink, oslobađajući H2 i stvarajući u vodi topive cincite. Intenzitet djelovanja kiselina i lužina na cink ovisi o prisutnosti nečistoća u njemu. Čisti cink manje je reaktivan prema ovim reagensima zbog visokog vodikovog prenapona. U vodi, cinkove soli zagrijavanjem hidroliziraju, oslobađajući bijeli talog Zn(OH) 2 hidroksida. Znan kompleksni spojevi koji sadrže cink, na primjer SO 4 i druge.
Dobivanje cinka. Cink se vadi iz polimetalnih ruda koje sadrže 1-4% Zn u obliku sulfida, kao i Cu, Pb, Ag, Au, Cd, Bi. Rude se obogaćuju selektivnom flotacijom, dobivajući koncentrate cinka (50-60% Zn) i istovremeno koncentrate olova, bakra, a ponekad i pirita. Cinkovi koncentrati se pale u pećima u fluidiziranom sloju, pretvarajući cinkov sulfid u ZnO oksid; nastali sumporni dioksid SO 2 troši se u proizvodnji sumporne kiseline. Dva su puta od ZnO do Zn. Prema pirometalurškoj (destilacijskoj) metodi, koja postoji već duže vrijeme, kalcinirani koncentrat se podvrgava sinteriranju kako bi se dobila granularnost i propusnost plina, a zatim se reducira ugljenom ili koksom na 1200-1300 ° C: ZnO + C = Zn + CO. Nastale metalne pare se kondenziraju i izlijevaju u kalupe. Isprva se redukcija provodila samo u retortama od pečene gline, kojima se upravlja ručno, kasnije su se počele koristiti vertikalne mehanizirane retorte od karborunda, zatim - osovinske i elektrolučne peći; Iz olovno-cinkovih koncentrata Cink se dobiva u visokim pećima. Produktivnost je postupno rasla, ali je cink sadržavao do 3% nečistoća, uključujući dragocjeni kadmij. Destilacija Cink se pročišćava segregacijom (tj. taloženjem tekućeg metala iz željeza i dijela olova na 500 °C), čime se postiže čistoća od 98,7%. Ponekad složenije i skuplje pročišćavanje rektifikacijom proizvodi metal čistoće 99,995% i omogućuje ponovno dobivanje kadmija.
Glavni način dobivanja cinka je elektrolitički (hidrometalurški). Prženi koncentrati se tretiraju sumpornom kiselinom; Dobivena otopina sulfata se čisti od nečistoća (taloženjem cinkovom prašinom) i podvrgava elektrolizi u kupkama koje su iznutra čvrsto obložene olovom ili vinil plastikom. Cink se taloži na aluminijskim katodama s kojih se svakodnevno uklanja (skida) i topi u indukcijskim pećima. Obično je čistoća elektrolitskog cinka 99,95%, potpunost njegove ekstrakcije iz koncentrata (uzimajući u obzir preradu otpada) je 93-94%. Cinkov sulfat, Pb, Cu, Cd, Au, Ag dobivaju se iz proizvodnog otpada; ponekad i In, Ga, Ge, Tl.
Primjena cinka. Otprilike polovica proizvedenog cinka troši se na zaštitu čelika od korozije (pocinčavanje). Budući da je cink rangiran ispred željeza u nizu stresa, kada pocinčano željezo uđe u korozivnu okolinu, cink je podložan uništenju. Zbog dobrih svojstava lijevanja i niskog tališta, cink se koristi za injekcijsko prešanje raznih sitnih dijelova zrakoplova i drugih strojeva. U tehnologiji se široko koriste legure bakra i cinka - mjed, nikal srebro, kao i cink s olovom i drugim metalima. Cink daje intermetalne spojeve sa zlatom i srebrom (netopivi u tekućem olovu) pa se cink koristi za rafinaciju olova iz plemenitih metala. U obliku praha, cink služi kao redukcijsko sredstvo u nizu kemijskih i tehnoloških procesa: u proizvodnji hidrosulfita, tijekom taloženja zlata iz industrijskih otopina cijanida, bakra i kadmija tijekom pročišćavanja otopina cink sulfata i dr. Mnogi spojevi cinka su fosfori, na primjer, tri primarne boje na ekranu kineskopa ovise o ZnS Ag ( Plava boja), ZnSe · Ag (zeleno) i Zn 3 (PO 4) 2 · Mn (crveno). Važni poluvodički materijali su spojevi cinka tipa A II B VI - ZnS, ZnSe, ZnTe, ZnO. Najčešći kemijski izvori struje imaju cink kao negativnu elektrodu.
Cink u tijelu. Cink, kao jedan od biogenih elemenata, stalno je prisutan u tkivima biljaka i životinja. Prosječni sadržaj cinka u većini kopnenih i morskih organizama je tisućinke postotka. Gljive, osobito otrovne, bogate su cinkom, lišajevi, četinari i neki beskralježnjaci morskih životinja, poput kamenica (0,4% suhe težine). U zonama visokog sadržaja cinka u stijenama nalaze se takozvane galmaine biljke koje koncentriraju cink. Cink ulazi u tijelo biljaka iz tla i vode, a životinja - s hranom. Dnevne ljudske potrebe za cinkom (5-20 mg) pokrivaju se pekarskim proizvodima, mesom, mlijekom i povrćem; U dojenčadi se potreba za cinkom (4-6 mg) zadovoljava majčinim mlijekom.
Biološka uloga cinka povezana je s njegovim sudjelovanjem u enzimskim reakcijama koje se odvijaju u stanicama. Dio je najvažnijih enzima: karboanhidraze, raznih dehidrogenaza, fosfataza povezanih s disanjem i drugim fiziološkim procesima, proteinaza i peptidaza uključenih u metabolizam proteina, enzima metabolizma nukleinskih kiselina (RNA i DNA polimeraze) i drugih. Cink ima značajnu ulogu u sintezi molekula messenger RNA u odgovarajućim dijelovima DNA (transkripcija), u stabilizaciji ribosoma i biopolimera (RNA, DNA, neki proteini).
U biljkama, uz sudjelovanje u disanju, metabolizmu bjelančevina i nukleinskih kiselina, Cink regulira rast, utječe na stvaranje aminokiseline triptofana i povećava sadržaj giberelina. Cink stabilizira makromolekule raznih biološke membrane a može biti i njihov sastavni dio, utječe na transport iona i sudjeluje u supramolekularnoj organizaciji staničnih organela. U prisutnosti cinka u kulturi Ustilago sphaerogena, veći broj mitohondrijima, nedostatkom cinka kod Euglene gracilis nestaju ribosomi. Cink je neophodan za razvoj jajeta i embrija (u njegovom nedostatku ne dolazi do stvaranja sjemena). Povećava otpornost biljaka na sušu, toplinu i hladnoću. Nedostatak cinka dovodi do poremećene diobe stanica, raznih funkcionalnih bolesti - izbjeljivanje vrhova kukuruza, rozeta biljaka i dr. Kod životinja, osim što sudjeluje u disanju i metabolizmu nukleinskih kiselina, cink pojačava aktivnost spolnih žlijezda i utječe na formiranje fetalnog kostura. Pokazalo se da nedostatak cinka u štakora koji doje smanjuje sadržaj RNA i sintezu proteina u mozgu te usporava razvoj mozga. Protein koji sadrži cink izoliran je iz sline ljudske parotidne žlijezde; pretpostavlja se da potiče regeneraciju stanica okusnih pupoljaka jezika i podržava njihovu okusnu funkciju. Cink ima zaštitnu ulogu u tijelu kada je okoliš onečišćen kadmijem.
Nedostatak cinka u tijelu dovodi do patuljastog rasta i odgođenog spolnog razvoja; kada uđe u tijelo u prekomjernim količinama, mogući su kancerogeni učinci i toksični učinci na srce, krv, spolne žlijezde itd. (prema eksperimentalnim podacima) Profesionalne opasnosti mogu biti povezane sa štetnim učincima na tijelo kako metalnog cinka tako i njegovih spojeva . Kod taljenja legura koje sadrže cink mogući su slučajevi ljevaoničke groznice. Pripravci cinka u obliku otopina (Cinkov sulfat) i kao dio prašaka, pasta, masti, čepića (Cinkov oksid) koriste se u medicini kao adstrigensi i dezinficijensi.