የኬሚካላዊ ሚዛን እንደዚህ ያለ ሁኔታ የሚቀለበስ ሁኔታ ነው ኬሚካላዊ ምላሽ
aA+ ለለ = ሐሲ+ መመ፣
በጊዜ ሂደት በምላሽ ድብልቅ ውስጥ በተለዋዋጭ ንጥረነገሮች ውስጥ ምንም ለውጥ በማይኖርበት ጊዜ። የኬሚካላዊ ሚዛን ሁኔታ ተለይቶ ይታወቃል የማያቋርጥ የኬሚካል ሚዛን :
የት ሲ i- የንጥረ ነገሮች ትኩረት ሚዛናዊነትፍጹም ድብልቅ.
ሚዛናዊነት ቋሚው በተመጣጣኝ ሞለኪውል ክፍልፋዮችም ሊገለጽ ይችላል። X iአካላት፡-
በጋዝ ደረጃ ውስጥ ለሚከሰቱ ምላሾች, ሚዛናዊውን ቋሚ ከፊል ግፊቶች በተመጣጣኝ ሁኔታ ለመግለጽ ምቹ ነው. P iአካላት፡-
ለ ተስማሚ ጋዞች P i = ሲ i RTእና P i = X እና ፒ፣ የት ፒአጠቃላይ ግፊት ነው, ስለዚህ ኬ ፒ, ኬ ሲእና ኬ ኤክስበሚከተለው ግንኙነት ይዛመዳሉ
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
የተመጣጠነ ቋሚነት ከ ጋር የተያያዘ ነው አር ጂ o ኬሚካላዊ ምላሽ;
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
ለውጥ አር ጂወይም አር ኤፍበኬሚካላዊ ምላሽ በተሰጠው (የግድ ሚዛናዊ አይደለም) ከፊል ግፊቶች P iወይም ትኩረቶች ሲ iክፍሎቹን ስሌት በመጠቀም ሊሰሉ ይችላሉ ኬሚካላዊ ምላሽ isotherms (ቫንት ሆፍ isotherms):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
አጭጮርዲንግ ቶ የ Le Chatelier መርህ, በተመጣጣኝ ስርዓት ላይ የውጭ ተጽእኖ ከተሰራ, ውጫዊ ተፅእኖን ለመቀነስ ሚዛኑ ይቀየራል. ስለዚህ የግፊት መጨመር ሚዛኑን ወደ ጋዝ ሞለኪውሎች ቁጥር ይቀንሳል. ማንኛውንም ምላሽ አካል ወደ ሚዛናዊ ድብልቅ ማከል ሚዛኑን ወደ የዚህ ክፍል መጠን መቀነስ ይለውጠዋል። የሙቀት መጨመር (ወይም መቀነስ) ሚዛኑን ወደ ሙቀት መሳብ (መለቀቅ) ወደ ሚከሰት ምላሽ ይለውጠዋል።
በሙቀት ላይ ያለው ተመጣጣኝ ቋሚ የቁጥር ጥገኝነት በቀመር ይገለጻል። የኬሚካል ምላሽ isobars (ቫንት ሆፍ አይሶባርስ)
![]() (9.9)
(9.9)
እና የኬሚካል ምላሽ isochores (ቫንት ሆፍ ኢሶኮሬስ)
![]() . (9.10)
. (9.10)
እኩልነትን በማዋሃድ (9.9) በሚለው ግምት ውስጥ አር ኤችምላሽ በሙቀት ላይ የተመካ አይደለም (ይህ በጠባብ የሙቀት ክልሎች ውስጥ እውነት ነው) ፣
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
የት ሐ -ውህደት ቋሚ. ስለዚህ, ጥገኛ ln ኬፒ ከ 1 / ቲመስመራዊ መሆን አለበት ፣ እና የቀጥተኛው መስመር ቁልቁል - አር ኤች/አር.
ውስጥ ውህደት ኬ 1 , ኬ 2, እና ቲ 1, ቲ 2 ይሰጣል:
 (9.13)
(9.13)
 (9.14)
(9.14)
ይህንን እኩልነት በመጠቀም, በሁለት የተለያዩ የሙቀት መጠኖች ውስጥ ያለውን ሚዛናዊ ቋሚዎች ማወቅ, እኛ ማስላት እንችላለን አር ኤችምላሾች. በዚህ መሠረት, ማወቅ አር ኤችምላሽ እና ሚዛናዊነት በአንድ የሙቀት መጠን ፣ በሌላ የሙቀት መጠን ሚዛንን ማስላት ይችላሉ።
ምሳሌዎች
CO(g) + 2H 2 (g) = CH 3 OH(g)
በ 500 ኪ. f G oለ CO (g) እና CH 3 OH (g) በ 500 K ከ -155.41 ኪ. ሞል -1 እና -134.20 ኪ. ሞል -1 በቅደም ተከተል.
መፍትሄ። ጂ oምላሽ
ር ጂ o= f G o(CH 3 OH) - f G o(CO) = -134.20 - (-155.41) = 21.21 ኪ.ግ. ሞል -1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
ምሳሌ 9-2 የምላሽ ሚዛን ቋሚ
እኩል ይሆናል ኬ P = 1.64 10 -4 በ 400 o C. N 2 እና H 2 10% የሚሆነው N 2 ወደ NH 3 እንዲቀየር በ N 2 እና H 2 ተመጣጣኝ ድብልቅ ላይ ምን አጠቃላይ ግፊት መደረግ አለበት? ጋዞች ተስማሚ እንደሆኑ ይቆጠራሉ.
መፍትሄ። አንድ ሞለኪውል N 2 ምላሽ ይስጥ። ከዚያም
| ኤን 2 (ግ) | + | 3H 2 (ግ) | = | 2ኤንኤች 3 (ግ) | |
| ኦሪጅናል መጠን | 1 | 1 | |||
| የተመጣጠነ መጠን | 1– | 1–3 | 2 (ጠቅላላ፡ 2–2) | ||
| የተመጣጠነ ሞለኪውል ክፍል; |
ስለዚህም እ.ኤ.አ. ኬ X =  እና K P = K X. ፒ –2
=
እና K P = K X. ፒ –2
=  .
.
በተፈጠረው ቀመር ውስጥ = 0.1 በመተካት, እኛ አለን
1.64 10 –4 = ፣ የት ፒ= 51.2 ኤቲኤም.
፣ የት ፒ= 51.2 ኤቲኤም.
ምሳሌ 9-3 የምላሽ ሚዛን ቋሚ
CO(g) + 2H 2 (g) = CH 3 OH(g)
በ 500 K እኩል ነው ኬ P = 6.09 10 -3. 1 mol CO፣ 2 mol H 2 እና 1 mol inert gas (N 2) የያዘ የምላሽ ድብልቅ እስከ 500 ኪ እና አጠቃላይ 100 ኤቲኤም ግፊት። የተመጣጠነ ድብልቅ ስብጥርን አስሉ.
መፍትሄ። አንድ ሞል CO ምላሽ ይስጥ። ከዚያም
| CO(ግ) | + | 2H 2 (ግ) | = | CH3OH(ግ) | |
| ኦሪጅናል መጠን፡- | 1 | 2 | 0 | ||
| የተመጣጠነ መጠን; | 1– | 2–2 | |||
| አጠቃላይ በተመጣጣኝ ድብልቅ; | 3-2 mol ክፍሎች + 1 mol N 2 = 4-2 mol | ||||
| የተመጣጠነ ሞል ክፍልፋይ | |||||
ስለዚህም እ.ኤ.አ. ኬ X =  እና K P = K X. P–2 =
እና K P = K X. P–2 = ![]() .
.
ስለዚህም, 6.09 10 -3 = ![]() .
.
ይህንን እኩልታ በመፍታት = 0.732 እናገኛለን. በዚህ መሠረት በተመጣጣኝ ድብልቅ ውስጥ የሚገኙት የንጥረ ነገሮች ሞለኪውሎች እኩል ናቸው: = 0.288, = 0.106, = 0.212 እና = 0.394.
ምሳሌ 9-4 ምላሽ ለመስጠት
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
በ 298 ኪ ኬ P = 6.0 10 5, አ f H o(NH 3) = -46.1 ኪጁ. ሞል -1. በ 500 ኪ.ሜ.
መፍትሄ። የምላሹ መደበኛው የመንጋጋ መተንፈስ ነው።
አር ኤች o= 2f H o(ኤንኤች 3) = -92.2 ኪጁ. ሞል -1.
በቀመር (9.14) መሰረት፣ 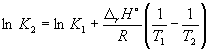 =
=
Ln (6.0 10 5) + ![]() = -1.73፣ ከየት ኬ 2 =
0.18.
= -1.73፣ ከየት ኬ 2 =
0.18.
ከሌ ቻተሊየር መርህ ጋር በሚዛመደው የሙቀት መጠን መጨመር የ exothermic ምላሽ ሚዛን እንደሚቀንስ ልብ ይበሉ።
ተግባራት
- በ 1273 ኪ እና በጠቅላላው የ 30 ኤቲም ግፊት በተመጣጣኝ ድብልቅ
- በ 2000 o C እና አጠቃላይ የ 1 ኤቲም ግፊት, 2% ውሃ ወደ ሃይድሮጂን እና ኦክሲጅን ይከፋፈላል. የምላሹን ሚዛን ቋሚ አስላ
- የምላሽ ሚዛን ቋሚ
- የምላሽ ሚዛን ቋሚ
- 1.79 10 -2 mol I 2 የያዘ ባለ 3-ሊትር እቃ ወደ 973 ኪ.በሚዛን ውስጥ ያለው ግፊት 0.49 ኤቲኤም ሆኖ ተገኝቷል. ጋዞች ተስማሚ ናቸው ብለን በመገመት ለምላሹ በ973 ኪ
- ምላሽ ለማግኘት
- ምላሽ ለማግኘት
- 0.341 mol PCl 5 እና 0.233 mol N 2 የያዘው ባለ 1 ሊትር እቃ ወደ 250 o ሴ.የመርከቡ አጠቃላይ ግፊት 29.33 ኤቲኤም ሆኖ ተገኝቷል። ሁሉም ጋዞች ተስማሚ ናቸው ብለን በማሰብ በመርከቧ ውስጥ ለሚፈጠረው ምላሽ በ 250 o ሴ ላይ ያለውን ሚዛን አስሉ.
- የምላሽ ሚዛን ቋሚ
- በ 25 o ሴ f G o(ኤንኤች 3) = -16.5 ኪ. ሞል -1. አስላ አር ጂ NH 3 ከፊል ግፊቶች N 2 ፣ H 2 እና NH 3 ከ 3 ATM ፣ 1 ATM እና 4 ATM ጋር እኩል የሆነ የ NH 3 ምስረታ ምላሽ። በእነዚህ ሁኔታዎች ምላሹ በድንገት የሚካሄደው በየትኛው አቅጣጫ ነው?
- Exothermic ምላሽ
- የቦርኖል (C 10 H 17 OH) ወደ isoborneol (ሲ 10 ኤች 17 ኦኤች) ወደ isoborneol የጋዝ-ደረጃ ምላሽ ሚዛን 0.106 በ 503 ኪ. የ 7.5 ግራም የቦርኖል እና 14.0 ግራም የኢሶቦርኒዮል ድብልቅ በ 5 ሊትር እቃ ውስጥ ተቀምጧል እና ተይዟል. በ 503 ኪ.ሜ እኩልነት እስኪመጣ ድረስ. በተመጣጣኝ ድብልቅ ውስጥ የቦረኖል እና የኢሶቦርኔኦል ክፍልፋዮችን እና ብዛትን አስላ።
- በምላሽ ውስጥ ሚዛናዊነት
- 10% NH 3 በድምጽ በ 400 o C የያዘ ሚዛናዊ ድብልቅ ለማግኘት በ 3 ክፍሎች H 2 እና 1 ክፍል N 2 ድብልቅ ላይ ሊተገበር የሚገባውን አጠቃላይ ግፊት አስላ።
- በ 250 o C እና አጠቃላይ የ 1 ኤቲኤም ግፊት ፣ PCl 5 በ 80% በምላሹ ተለያይቷል
- በ 2000 o C ምላሽ ለመስጠት
- ሚዛኑ ቋሚ የሆነበት ምላሽ መደበኛ enthalpy አስላ
ሀ) በ 2 እጥፍ ይጨምራል, ለ) የሙቀት መጠኑ ከ 298 ኪ ወደ 308 ኪ.ሜ ሲቀየር በ 2 እጥፍ ይቀንሳል. - የምላሹ ተመጣጣኝ ቋሚ ጥገኝነት 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) በ 300 K እና 600 K መካከል ባለው የሙቀት መጠን ላይ በቀመር ተገልጿል
CO 2 (g) + C (ቲቪ) = 2CO(g)
17% (በመጠን) CO 2 ይዟል. በጠቅላላው በ 20 ኤቲኤም ግፊት ውስጥ የ CO 2 ምን ያህል መቶኛ በጋዝ ውስጥ ይካተታል? በምን ግፊት ጋዝ 25% CO 2 ይይዛል?
በነዚህ ሁኔታዎች H 2 O (g) = H 2 (g) + 1/2O 2 (g).
CO (g) + H 2 O (g) = CO 2 (g) + H 2 (g)
በ 500 o ሴ እኩል ነው ክ.ፒ= 5.5. 1 mol CO እና 5 mol H 2 O ያካተተ ድብልቅ በዚህ የሙቀት መጠን ተሞቅቷል. በተመጣጣኝ ድብልቅ ውስጥ የ H 2 O የሞለኪውል ክፍልን አስላ።
N 2 O 4 (g) = 2NO 2 (g)
በ 25 o ሴ እኩል ነው ክ.ፒ= 0.143. በዚህ የሙቀት መጠን 1 g N 2 O 4 የተቀመጠበት 1 ሊትር መጠን ባለው ዕቃ ውስጥ የሚፈጠረውን ግፊት አስላ።
I 2 (g) = 2I (g)።
በ 250 o ሴ አር ጂ o = -2508 ጄ ሞል -1. በየትኛው አጠቃላይ ግፊት PCl 5 ወደ PCl 3 እና Cl 2 በ 250 o C የመቀየር ደረጃ 30% ይሆናል?
2HI(g) = H 2 (g) + I 2 (g)
ሚዛናዊ ቋሚ ኬ P = 1.83 10 -2 በ 698.6 K. 10 g I 2 እና 0.2 g H 2 በዚህ የሙቀት መጠን በሶስት ሊትር እቃ ውስጥ ሲሞቁ ስንት ግራም ኤችአይአይ ይፈጠራሉ? የ H 2፣ I 2 እና HI ከፊል ግፊቶች ምን ምን ናቸው?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(g) + 2H 2 (g) = CH 3 OH(g)
በ 500 K እኩል ነው ኬ P = 6.09 10 -3. CO እና H2 በ1፡2 ጥምርታ ከተወሰዱ ሜታኖልን በ90% ምርት ለማምረት የሚያስፈልገውን አጠቃላይ ግፊት አስላ።
CO(g) + 2H 2 (g) = CH 3 OH(g)
በ 500 K እና 10 ባር ላይ ሚዛናዊ ነው. ጋዞቹ ተስማሚ ከሆኑ የሚከተሉት ምክንያቶች በሜታኖል ምርት ላይ ምን ተጽዕኖ ያሳድራሉ: ሀ) ይጨምራሉ ቲ; ለ) ማስተዋወቅ ፒ; ሐ) የማይነቃነቅ ጋዝ በ ቪ= const; መ) የማይነቃነቅ ጋዝ በ ፒ= const; ሠ) H 2 በ ላይ መጨመር ፒ= const?
2NOCl(g) = 2NO(g) + Cl 2 (g)
የ NOCl ከፊል ግፊት 0.64 ባር ሲሆን (በመጀመሪያ NOCl ብቻ ነበር) በ 227 o C እና በጠቅላላው 1.0 ባር የተቀመጠው. አስላ ር ጂ oምላሽ ለማግኘት. በየትኛው አጠቃላይ ግፊት የ Cl 2 ከፊል ግፊት ከ 0.10 ባር ጋር እኩል ይሆናል?
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
በ 400 o ሴ እኩል ነው ኬ = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)።
የናይትሮጅን ከፊል ግፊት 0.9 ኤቲም እንዲሆን N 2 ወደ ስርዓቱ ከተጨመረ PCl 5 የመለያየት ደረጃ ምን ያህል ይሆናል? አጠቃላይ ግፊቱ በ 1 ኤቲኤም ይጠበቃል.
N 2 (g) + O 2 (g) = 2NO (g)
K p = 2.5 10 -3. የ N 2, O 2, NO እና የማይነቃነቅ ጋዝ በጠቅላላው የ 1 ባር ግፊት ሚዛን 80% (በድምጽ) N 2 እና 16% O 2 ይይዛል. በድምጽ ምን ያህል መቶኛ አይ ነው? የማይነቃነቅ ጋዝ ከፊል ግፊት ምንድነው?
ln ኬ = –1.04 –1088 /ቲ +1.51 10 5 /ቲ 2 .
እ.ኤ.አ. በ 1885 ፈረንሳዊው የፊዚክስ ሊቅ እና ኬሚስት ሌ ቻቴሊየር ፈጠሩ እና በ 1887 ጀርመናዊው የፊዚክስ ሊቅ ብራውን የኬሚካላዊ ሚዛን ህግን እና የኬሚካላዊ ሚዛን ቋሚ ህግን አረጋግጠዋል እንዲሁም በተለያዩ ውጫዊ ሁኔታዎች ተጽእኖ ላይ ጥገኛነታቸውን አጥንተዋል.
የኬሚካል ሚዛን ይዘት
ሚዛናዊነት ማለት ነገሮች ሁል ጊዜ የሚንቀሳቀሱ ናቸው ማለት ነው። ምርቶች ወደ reactants የተከፋፈሉ ናቸው, እና ምላሽ ሰጪዎች ወደ ምርቶች ይጣመራሉ. ነገሮች ይንቀሳቀሳሉ, ነገር ግን ትኩረታቸው ተመሳሳይ ነው. ምላሹ የሚቀለበስ መሆኑን ለማሳየት በእኩል ምልክት ፈንታ በሁለት ቀስት ነው የተጻፈው።

ክላሲክ ቅጦች
ባለፈው ምዕተ-አመት, ኬሚስቶች በተመሳሳይ መያዣ ውስጥ የአጸፋውን አቅጣጫ የመቀየር እድል የሚሰጡ አንዳንድ ንድፎችን አግኝተዋል. ኬሚካላዊ ምላሾች እንዴት እንደሚከሰቱ ማወቅ በሚያስደንቅ ሁኔታ አስፈላጊ ነው, ለሁለቱም የላብራቶሪ ምርምርእና የኢንዱስትሪ ምርት። በውስጡ ትልቅ ጠቀሜታእነዚህን ሁሉ ክስተቶች የመቆጣጠር ችሎታ አለው. ብዙ የተፈጥሮ ሂደቶችን በተለይም የሚቀለበሱትን በኋላ ላይ ለጥቅም ጥቅም ላይ ለማዋል የሰው ልጅ ተፈጥሮ ነው። ኬሚካላዊ ምላሾችን በትክክል ለመቆጣጠር ማንሻዎቹን በደንብ ከተቆጣጠሩት የኬሚካል ግብረመልሶች እውቀት የበለጠ ጠቃሚ ይሆናል።
በኬሚስትሪ ውስጥ ያለው የጅምላ ድርጊት ህግ በኬሚስቶች የምላሾችን መጠኖች በትክክል ለማስላት ጥቅም ላይ ይውላል. በተዘጋ ስርዓት ውስጥ ቢከሰት ምንም እንደማይጠናቀቅ ግልጽ ያደርገዋል. የተገኙት ንጥረ ነገሮች ሞለኪውሎች በቋሚ እና በዘፈቀደ እንቅስቃሴ ውስጥ ናቸው ፣ እና የተገላቢጦሽ ምላሽ በቅርቡ ሊከሰት ይችላል ፣ ይህም የመነሻ ቁሳቁስ ሞለኪውሎች ወደነበሩበት ይመለሳሉ።
ብዙውን ጊዜ በኢንዱስትሪ ውስጥ ጥቅም ላይ ይውላል ክፍት ስርዓቶች. ኬሚካዊ ግብረመልሶች የሚፈጠሩባቸው መርከቦች፣ መሳሪያዎች እና ሌሎች መያዣዎች ክፍት እንደሆኑ ይቆያሉ። በእነዚህ ሂደቶች ውስጥ የሚፈለገውን ምርት ለማውጣት እና የማይጠቅሙ የምላሽ ምርቶችን ለማስወገድ ይህ አስፈላጊ ነው. ለምሳሌ የድንጋይ ከሰል በክፍት ምድጃዎች ውስጥ ይቃጠላል, ሲሚንቶ በክፍት ምድጃዎች ውስጥ ይመረታል, ፍንዳታ ምድጃዎች የማያቋርጥ የአየር አቅርቦት ይሠራሉ, እና አሞኒያ በተከታታይ አሞኒያ እራሱን በማስወገድ ይሠራል.

ሊቀለበስ እና ሊቀለበስ የማይችል ኬሚካላዊ ግብረመልሶች
በስሙ ላይ በመመስረት ተገቢውን ትርጓሜዎች መስጠት እንችላለን-ምላሾች ከተጠናቀቁ የማይመለሱ ተደርገው ይወሰዳሉ, አቅጣጫቸውን አይቀይሩ እና በተሰጠው መንገድ ይቀጥሉ, የግፊት ጠብታዎች እና የሙቀት መጠን መለዋወጥ. የእነሱ ልዩ ባህሪአንዳንድ ምርቶች የምላሽ አካባቢን ሊለቁ ይችላሉ. ስለዚህም፡ ለምሳሌ፡ ጋዝ (CaCO 3 = CaO + CO 2)፣ የዝናብ (Cu (NO 3) 2+H 2 S = CuS + 2HNO 3) ወይም ሌሎች ማግኘት ይቻላል፡ የማይቀለበስም ይቆጠራል። በሂደቱ ውስጥ ከተለቀቀ ብዙ ቁጥር ያለውየሙቀት ኃይል ለምሳሌ፡- 4P + 5O 2 = 2P 2 O 5 + Q.
በተፈጥሮ ውስጥ የሚከሰቱ ሁሉም ምላሾች ማለት ይቻላል ወደ ኋላ የሚመለሱ ናቸው። እንደ ግፊት እና ሙቀት ያሉ ውጫዊ ሁኔታዎች ምንም ቢሆኑም, ሁሉም ማለት ይቻላል ሁሉም ሂደቶች በተለያዩ አቅጣጫዎች በአንድ ጊዜ ሊከሰቱ ይችላሉ. በኬሚስትሪ ውስጥ ያለው የጅምላ ድርጊት ህግ እንደሚለው, የሚወሰደው የሙቀት መጠን ከተለቀቀው መጠን ጋር እኩል ይሆናል, ይህ ማለት አንድ ምላሽ exothermic ከሆነ, ሁለተኛው (በተቃራኒው) endothermic ይሆናል.
ኬሚካላዊ ሚዛን፡ የኬሚካል ሚዛን ቋሚ
ምላሽ የኬሚስትሪ "ግሶች" ናቸው - ኬሚስቶች የሚያጠኗቸው ተግባራት. ብዙ ምላሾች ወደ ማጠናቀቂያው ይሄዳሉ እና ከዚያ ይቆማሉ፣ ይህ ማለት ምላሽ ሰጪዎቹ ወደነበሩበት ሁኔታ መመለስ ሳይችሉ ሙሉ በሙሉ ወደ ምርቶች ይቀየራሉ ማለት ነው። በአንዳንድ ሁኔታዎች ምላሹ በእውነት ሊቀለበስ የማይችል ነው ፣ ለምሳሌ ማቃጠል አካላዊ እና ኬሚካዊ ለውጦች ሲደረጉ ፣ ግን ፣ የሚቻል ብቻ ሳይሆን ቀጣይነትም የማይሆንባቸው ብዙ ሌሎች ሁኔታዎች አሉ ፣ ምክንያቱም የመጀመሪያው ምላሽ ምርቶች በሁለተኛው ውስጥ ምላሽ ሰጪ ይሆናሉ። .
የ reactants እና ምርቶች ክምችት ቋሚነት ያለው የሚቆይበት ተለዋዋጭ ሁኔታ ሚዛናዊነት ይባላል። የተወሰኑ ኬሚካሎችን ለማምረት ወጪን ለመቀነስ ለሚፈልጉ ኢንዱስትሪዎች የሚተገበሩ አንዳንድ ህጎችን በመጠቀም የንጥረ ነገሮችን ባህሪ መተንበይ ይቻላል። የኬሚካል ሚዛን ጽንሰ-ሀሳብ የሰውን ጤና ለመጠበቅ ወይም አደጋ ላይ ሊጥሉ የሚችሉ ሂደቶችን ለመረዳትም ጠቃሚ ነው። የኬሚካላዊው ሚዛናዊነት ቋሚነት በአዮኒክ ጥንካሬ እና የሙቀት መጠን ላይ የሚመረኮዝ የምላሽ ዋጋ እሴት ነው፣ እና በመፍትሔ ውስጥ ካሉት ሬክታተሮች እና ምርቶች ውህዶች ነፃ ነው።

የተመጣጠነ ቋሚ ስሌት
ይህ መጠን ልኬት የሌለው ነው፣ ማለትም፣ የተወሰነ ቁጥር ያለው አሃዶች የሉትም። ምንም እንኳን ስሌቱ ብዙውን ጊዜ ለሁለት ምላሽ ሰጪዎች እና ለሁለት ምርቶች የተፃፈ ቢሆንም, ለማንኛውም ምላሽ ተሳታፊዎች ቁጥር ይሰራል. የመለኪያ ቋሚ ስሌት እና ትርጓሜ የሚወሰነው የኬሚካላዊው ምላሽ ተመሳሳይነት ያለው ወይም የተለያየ ሚዛንን የሚያካትት ከሆነ ነው. ይህ ማለት ሁሉም ምላሽ ሰጪ አካላት ንጹህ ፈሳሽ ወይም ጋዞች ሊሆኑ ይችላሉ. ለተለያዩ ምላሾች ፣ እንደ አንድ ደንብ ፣ አንድ ደረጃ የለም ፣ ግን ቢያንስ ሁለት። ለምሳሌ ፈሳሾች እና ጋዞች ወይም ሁለቱም ፈሳሾች.

የተመጣጠነ ቋሚ እሴት
ለማንኛውም የሙቀት መጠን, ለተመጣጣኝ ቋሚነት አንድ እሴት ብቻ ነው, ይህም የሚለወጠው ምላሹ የሚከሰትበት የሙቀት መጠን በአንድ አቅጣጫ ወይም በሌላ ከተለወጠ ብቻ ነው. የተመጣጠነ ቋሚው ትልቅ ወይም ትንሽ ከሆነ ስለ ኬሚካላዊ ምላሽ አንዳንድ ትንበያዎችን ማድረግ ይቻላል. እሴቱ በጣም ትልቅ ከሆነ, ሚዛኑ ለትክክለኛው ምላሽ ይደግፋል እና ከተለዋዋጭ አካላት የበለጠ ምርቶች ተገኝተዋል. በዚህ ጉዳይ ላይ ያለው ምላሽ "ሙሉ" ወይም "መጠን" ተብሎ ሊጠራ ይችላል.
የተመጣጠነ ቋሚው እሴት ትንሽ ከሆነ ፣ ከዚያ ወደ ግራ ምላሽን ይመርጣል ፣ የሬክተሮች ብዛት ከተፈጠሩት ምርቶች የበለጠ ነበር። ይህ ዋጋ ወደ ዜሮ የሚሄድ ከሆነ, ምላሹ እንደማይከሰት መገመት እንችላለን. ለቀጣይ እና ለተገላቢጦሽ ምላሾች የተመጣጠነ ሚዛን እሴቶች ተመሳሳይ ከሆኑ ፣ የመለኪያዎች እና ምርቶች መጠን እንዲሁ ተመሳሳይ ይሆናሉ። ይህ ዓይነቱ ምላሽ ሊቀለበስ የሚችል ነው ተብሎ ይታሰባል።

አንድ የተወሰነ ሊቀለበስ የሚችል ምላሽ እንመልከት
ከእነዚህ ውስጥ ሁለቱን እንውሰድ የኬሚካል ንጥረ ነገር, እንደ አዮዲን እና ሃይድሮጂን, ሲቀላቀሉ አዲስ ንጥረ ነገር - ሃይድሮጂን አዮዳይድ ይሰጣሉ.
v 1ን ወደፊት ለሚመጣው ምላሽ መጠን፣ v 2 የተገላቢጦሽ ምላሽ መጠን፣ k ወደ ሚዛናዊነት ቋሚነት እንውሰድ። የጅምላ ድርጊት ህግን በመጠቀም, የሚከተለውን አገላለጽ እናገኛለን:
v 1 = k 1 * c (H 2) * c (I 2)፣
v 2 = k 2 * c 2 (HI).
የአዮዲን (I 2) እና ሃይድሮጂን (H 2) ሞለኪውሎች ሲቀላቀሉ ግንኙነታቸው ይጀምራል. በመነሻ ደረጃ, የእነዚህ ንጥረ ነገሮች ትኩረት ከፍተኛ ነው, ነገር ግን በምላሹ መጨረሻ ላይ የአዲሱ ውህድ ክምችት - ሃይድሮጂን አዮዳይድ (HI) - ከፍተኛ ይሆናል. በዚህ መሠረት, የምላሽ መጠኑ የተለየ ይሆናል. መጀመሪያ ላይ እነሱ ከፍተኛ ይሆናሉ. በጊዜ ሂደት, እነዚህ እሴቶች እኩል ሲሆኑ አንድ አፍታ ይመጣል, እና ይህ የኬሚካል ሚዛን የሚባል ሁኔታ ነው.
የኬሚካላዊ ሚዛን ቋሚ መግለጫ ብዙውን ጊዜ የካሬ ቅንፎችን በመጠቀም ይገለጻል:,,,. በተመጣጣኝ ሁኔታ ፍጥነቱ እኩል ስለሆነ፡-
k 1 = k 2 2 ፣
ይህ ለኬሚካላዊ ሚዛን ቋሚ እኩልታ ይሰጠናል፡-
k 1/k 2 = 2 / = K.

Le Chatelier-ብራውን መርህ
የሚከተለው ንድፍ አለ-በሚዛን ውስጥ ባለው ስርዓት ላይ የተወሰነ ውጤት ከተፈጠረ (ለምሳሌ የሙቀት መጠንን ወይም ግፊትን በመቀየር የኬሚካላዊ ሚዛን ሁኔታዎችን ይቀይሩ) ከዚያም ሚዛኑ የለውጡን ተፅእኖ በከፊል ለመቋቋም ይቀየራል. ከኬሚስትሪ በተጨማሪ, ይህ መርህ ለብዙዎችም ይሠራል የተለያዩ ቅርጾችወደ ፋርማኮሎጂ እና ኢኮኖሚክስ መስኮች.

የኬሚካል ሚዛን ቋሚ እና የመግለፅ ዘዴዎች
የተመጣጠነ አገላለጽ በምርቶች እና በተለዋዋጭ አካላት ክምችት ውስጥ ሊገለጽ ይችላል። ብቻ የኬሚካል ንጥረነገሮችየውሃ እና የጋዝ ደረጃዎች በተመጣጣኝ ቀመር ውስጥ ይካተታሉ, ምክንያቱም የፈሳሽ እና የጠጣር ስብስቦች አይለወጡም. በኬሚካላዊ ሚዛን ላይ ተጽዕኖ የሚያሳድሩ ነገሮች ምንድን ናቸው? ንጹህ ፈሳሽ የሚያካትት ከሆነ ወይም ጠንካራ, እሱ K = 1 እንዳለው ይቆጠራል, እና በዚህ መሰረት ከፍተኛ ትኩረትን ከሚሰጡ መፍትሄዎች በስተቀር ግምት ውስጥ መግባት ያቆማል. ለምሳሌ ንጹህ ውሃ 1 ተግባር አለው።
ሌላው ምሳሌ ሁለት የካርቦን ሞኖክሳይድ ሞለኪውሎች ሲፈጠሩ ሊፈጠር የሚችል ጠንካራ ካርቦን ነው። ካርበን ዳይኦክሳይድእና ካርቦን. ሚዛኑን ሊነኩ የሚችሉ ምክንያቶች ሬአክታንት ወይም ምርት መጨመርን ያካትታሉ (የማጎሪያ ለውጥ ሚዛኑን ይነካል)። ሬጀንት መጨመር በቀኝ በኩል ወደ ሚዛናዊነት ሊያመራ ይችላል። የኬሚካል እኩልታ, ተጨማሪ የምርት ቅጾች በሚታዩበት. ብዙ አይነት ምላሽ ሰጪዎች ስለሚገኙ የምርት መጨመር በግራ በኩል ወደ ሚዛናዊነት ሊያመራ ይችላል።

ሚዛናዊነት የሚከሰተው በሁለቱም አቅጣጫዎች የሚካሄደው ምላሽ የምርት እና ምላሽ ሰጪዎች ቋሚ ሬሾ ሲኖረው ነው። በአጠቃላይ የምርቶች እና አነቃቂዎች የቁጥር ጥምርታ ቋሚ ስለሆነ የኬሚካል ሚዛን የማይለዋወጥ ነው። ይሁን እንጂ ጠጋ ብለን ስንመረምረው ምላሹ በሁለቱም አቅጣጫዎች በእኩል ፍጥነት ስለሚንቀሳቀስ ሚዛናዊነት በእውነቱ በጣም ተለዋዋጭ ሂደት መሆኑን ያሳያል።
ተለዋዋጭ ሚዛን የቋሚ ሁኔታ ተግባር ምሳሌ ነው። በተረጋጋ ሁኔታ ውስጥ ላለው ስርዓት፣ አሁን የሚታየው ባህሪ ወደፊት ይቀጥላል። ስለዚህ፣ ምላሹ ወደ ሚዛናዊነት ከደረሰ በኋላ፣ ምንም እንኳን ምላሹ ቢቀጥልም የምርት እና ምላሽ ሰጪዎች ጥምርታ ተመሳሳይ ይሆናል።

ስለ ውስብስብ ነገሮች በቀላሉ እንዴት ማውራት ይቻላል?
እንደ ኬሚካላዊ ሚዛን እና የኬሚካል ሚዛን ቋሚ ጽንሰ-ሀሳቦች ለመረዳት በጣም አስቸጋሪ ናቸው. ከህይወት ምሳሌ እንውሰድ። በሁለት ከተማዎች መካከል ባለው ድልድይ ላይ ተጣብቀህ ታውቃለህ እና በሌላ አቅጣጫ ያለው ትራፊክ ለስላሳ እና መደበኛ መሆኑን፣ ተስፋ በሌለው መልኩ በትራፊክ ውስጥ እንደተቀረቀረ አስተውለሃል? ይህ ጥሩ አይደለም.
መኪኖች በተቃና ሁኔታ እና በሁለቱም በኩል በተመሳሳይ ፍጥነት ቢንቀሳቀሱስ? በሁለቱም ከተሞች የመኪናዎች ቁጥር ቋሚ ሆኖ ይቆይ ይሆን? ወደ ሁለቱም ከተሞች የመግባት እና የመውጣት ፍጥነት ተመሳሳይ ሲሆን በእያንዳንዱ ከተማ ውስጥ ያሉት የመኪናዎች ቁጥር በጊዜ ሂደት የተረጋጋ ሲሆን ይህ ማለት አጠቃላይ ሂደቱ በተለዋዋጭ ሚዛን ነው ማለት ነው.
ለምሳሌ
ለተገላቢጦሽ የኬሚካል ሚዛኑን ቋሚ ያሰሉ ተመሳሳይ ምላሽ, CO + H 2 O = CO 2 + H 2, በተመጣጣኝ ንጥረ ነገሮች ላይ የተመሰረተ ነው.
[CO] p = 0.045 ሞል/ሊ፣
[H 2 O] p = 0.064 ሞል/ሊ፣
[CO 2] p = 0.18 ሞል / ሊ.
የተሰጠው፡
[CO] p = 0.045 ሞል / ሊ
[H 2 O] p = 0.064 ሞል / ሊ
[CO 2] p = 0.18 ሞል / ሊ
መፍትሄ፡-
የምላሽ ምርቶች ሞላር ሬሾ 1: 1 ነው, ስለዚህ
[CO 2] p = [H 2] p = 0.18 ሞል / ሊ.
በአገላለጽ (2.1) ላይ በመመስረት የኬሚካላዊ ሚዛን ቋሚ ዋጋን እናሰላለን፡-
ለ x.r. = [CO 2] p [H 2] p / [CO 2] p [H 2 O] p = 0.18 0.18/0.045 0.064
መልስ፡- 11,25.
2. የተመጣጠነ ውህዶች ስሌት ከመጀመሪያው የሪአክተሮች ስብስቦች እና በተቃራኒው
ምሳሌ 1.
የሚቀለበስ የጋዝ ምላሽ በቀመርው መሰረት ይቀጥላል፡-
CO + CI 2 = COCI 2.
የመጀመሪያ ምላሽ ሰጪዎች ክምችት;
[CO] 0 = 0.03 ሞል / ሊ;
0 = 0.02 ሞል / ሊ.
ሚዛኑ ከደረሰ በኋላ የካርቦን ሞኖክሳይድ ክምችት መጠን፡-
[CO] p = 0.021 ሞል / ሊ.
የተቀሩትን ንጥረ ነገሮች ሚዛን እና የኬሚካላዊ ሚዛን ቋሚ ዋጋን አስሉ.
የተሰጠው፡
[CO] 0 = 0.03 ሞል / ሊ
[C1 2] 0 = 0.02 ሞል / ሊ
[CO] p = 0.021 ሞል / ሊ
ፒ ፣ ገጽ ፣ ኬ x p -?
መፍትሄ፡-
በተመጣጣኝ ሁኔታ ፣ የ CO ትኩረት ለውጥ የሚከተለው ነበር-
∆ [CO] = [CO] 0 - [CO] p = 0.03 - 0.021 = 0.009 ሞል / ሊ.
በምላሹ ውስጥ የተካተቱት ንጥረ ነገሮች ሞላር ሬሾ 1፡1፡1 ስለሆነ የሁሉም ንጥረ ነገሮች ትኩረት ለውጥ አንድ አይነት ነው።
[C1 2] p = [C1 2] 0 - ∆[C1 2] = 0.02 - 0.009 = 0.011 mol/l,
[SOS1 2] p = 0.009 ሞል/ሊ፣
K x р = [ССО1 2] Р / [СО] Р [С1 2] р = 0.009/0.021 · 0.011 = 39.
የስሌቶቹን ውጤቶች ወደ ጠረጴዛው ውስጥ እናስገባለን, ምልክቶች "+" እና "-" ማለት የንጥረቱ መጠን መጨመር ወይም መቀነስ ማለት ነው.
መልስ፡-[C1 2] p = 0.011 ሞል / ሊ; [SOC1 2] p = 0.009 ሞል / ሊ; K x p = 39.
ምሳሌ 2.
በተገላቢጦሽ ምላሽ 2NO + O 2 = 2NO 2 ውስጥ የተካተቱት የንጥረ ነገሮች ሚዛናዊ ክምችት እንደሚከተለው ነው (ሞል/ል)
P = 0.056;
[ኦ 2] = 0.028;
የተሰጠው፡
P = 0.056 ሞል / ሊ
P = 0.028 ሞል / ሊ
P = 0.044 ሞል / ሊ
0, [О 2] 0 –?
መፍትሄ፡-
የናይትሪክ ኦክሳይድ (IV) የመጀመሪያ ደረጃ 0 = 0 ነበር, እና በተመጣጣኝ ሁኔታ ላይ ያለው ለውጥ ∆ = 0.044 mol / l ነው.
በምላሹ ውስጥ የNO እና NO 2 የሞላር ሬሾ 2፡2 (1፡1) ነው፣ ስለዚህ፣ የNO የመጀመሪያ ትኩረት የሚከተለው ይሆናል፡-
0 = p + 0.044 = 0.056 + 0.044 = 0.1 ሞል / ሊ.
የ O 2 እና NO 2 የሞላር ጥምርታ 1፡2 ነው፣ ስለዚህ የO 2 የመጀመሪያ ትኩረት የሚከተለው ይሆናል፡-
[O 2] 0 = [O 2] p + 0.044/2 = 0.028 + 0.022 = 0.05 ሞል / ሊ.
የስሌቱ ውጤቶች በሰንጠረዥ ውስጥ ተመዝግበዋል
መልስ፡- 0 = 0.1 ሞል / ሊ; [ኦ 2] 0 = 0.05 ሞል / ሊ.
ምሳሌ 3.
የአሞኒያ ውህደት ምላሽ በ ZN 2 + N 2 = 2NH 3 ቀመር ይቀጥላል። የመነሻ ንጥረ ነገሮች የመጀመሪያ ደረጃዎች እኩል ናቸው (ሞል / ሊ): ሃይድሮጂን - 0.05; ናይትሮጅን - 0.04: የምላሽ መጠን ቋሚ 0.3 ነው. አስላ፡ ሀ) የመጀመርያው ምላሽ መጠን; ለ) የአሞኒያ ክምችት 0.02 ሞል / ሊ በሚሆንበት ጊዜ የምላሽ መጠን.
የተሰጠው፡
ሀ) [H 2] 0 = 0.05 ሞል / ሊ
0 = 0.04 ሞል / ሊ
ለ) = 0.02 ሞል / ሊ
መፍትሄ፡-
ሀ) በጅምላ ድርጊት ህግ መሰረት፣ የመጀመሪያውን ምላሽ መጠን እናገኛለን፡-
υ 0 = k 0 3 0 = 3 10 -1 3 = 1.5 10 -6 ሞል / ሊ.
ለ) በምላሹ እኩልታ ላይ በመመስረት የሃይድሮጅን እና የአሞኒያ ሞላር ሬሾ 3: 2 ነው. በ 0.02 mol / l የአሞኒያ መጠን መጨመር የሃይድሮጂን ክምችት በ 0.03 mol / l (0.02 - 3/2 = 0.03) ይቀንሳል.
ስለዚህ, የአሞኒያ ክምችት በ 0.02 mol / l ሲጨምር, የሃይድሮጂን ክምችት ወደ 0.02 mol / l (0.05 - 0.03 = 0.02) ቀንሷል. የናይትሮጅን እና የአሞኒያ ሞላር ሬሾ 1: 2 ነው. የናይትሮጅን መጠን በ 0.01 ሞል (0.02 - 1/2 = 0.01) ይቀንሳል እና ከ 0.03 ሞል / ሊ (0.04 - 0.01 = 0.03) ጋር እኩል ይሆናል. የአጸፋዎች ትኩረት በሚቀንስበት ጊዜ የምላሽ መጠኑ ይቀንሳል።
υ = k 3 = 3 10 -1 3 = 7.2 10 -8 ሞል / ሊ.
መልስ፡-ሀ) 1.5 10 -6 ሞል / ሊ; ለ) 7.2 10 -8 ሞል / ሊ.
ምሳሌ 4.
ምላሹ የሚከናወነው በቀመር 2NO + O 2 = 2NO 2 ነው ፣ ምላሹ ከጀመረ ከተወሰነ ጊዜ በኋላ ፣በምላሹ ውስጥ የሚሳተፉ የሁሉም ንጥረ ነገሮች መጠን: = 0.04 mol / l; [O 2] = 0.01 ሞል / ሊ; = 0.02 ሞል / ሊ. የምላሽ መጠን ቋሚ k ከሆነ የመነሻ ንጥረ ነገሮችን እና የመጀመሪያውን ምላሽ መጠን አስሉ = 1.
የተሰጠው፡
0.04 ሞል / ሊ
[ኦ 2] = 0.01 ሞል / ሊ
0.02 ሞል / ሊ
0 , 0 , x 0 – ?
መፍትሄ፡-
በምላሹ እኩልታ መሰረት፣ የNO እና NO 2 የሞላር ሬሾ 2፡2 (1፡1) ነው።
የምላሽ ምርት NO 2 ወደ 0.02 ሞል / ሊ መጨመር የ NO ትኩረት በ 0.02 ሞል እንዲቀንስ አድርጓል. ስለዚህ የናይትሪክ ኦክሳይድ (II) የመጀመሪያ ትኩረት የሚከተለው ነበር፡-
0 = +0.02 = 0.04 + 0.02 = 0.06 ሞል / ሊ.
የ O 2 እና NO 2 የሞላር ሬሾ 1: 2 ነው, ስለዚህ የNO 2 ክምችት ወደ 0.02 ሞል መጨመር የኦክስጅን መጠን በ 0.01 ሞል (0.02 1/2 = 0.01) እንዲቀንስ አድርጓል. በውጤቱም, የመጀመሪያው የኦክስጂን ክምችት የሚከተለው ነበር.
[ኦ 2] 0 = [ኦ 2] + 0.01 = 0.01 + 0.01 = 0.02 ሞል / ሊ.
የመጀመሪያ ምላሽ መጠን
υ 0 = k 0 2 0 = 1 2 = 7.2 · 10 -5 mol / l · s.
መልስ፡- 0 = 0.06 ሞል / ሊ; [O 2] 0 = 0.02 ሞል / ሊ;
x 0 = 7.2 10 -5 ሞል / ሊ.
አብዛኛዎቹ ኬሚካላዊ ምላሾች ሊቀለበሱ ይችላሉ, ማለትም. በተቃራኒ አቅጣጫዎች በተመሳሳይ ጊዜ ይፈስሳል። ወደ ፊት እና የተገላቢጦሽ ምላሾች በተመሳሳዩ ፍጥነት በሚከሰቱበት ጊዜ ኬሚካላዊ ሚዛን ይከሰታል። ለምሳሌ, በሚቀለበስ ተመሳሳይነት ያለው ምላሽ: H 2 (g) + I 2 (g) ↔ 2HI (g), የጅምላ እርምጃ ህግ መሰረት ወደፊት እና የተገላቢጦሽ ምላሾች ጥምርታ በስብስብ ጥምርታ ላይ የተመሰረተ ነው. የ reactants, ማለትም: ወደፊት ምላሽ መጠን: υ 1 = k 1 [H 2]. የተገላቢጦሽ ምላሽ መጠን፡ υ 2 = k 2 2
H 2 እና I 2 የሚጀምሩት ንጥረ ነገሮች ከሆኑ, በመጀመሪያ ቅጽበት, ወደፊት የሚመጣው ምላሽ መጠን የሚወሰነው በመጀመሪያዎቹ ስብስቦች ነው, እና የተገላቢጦሽ ምላሽ መጠን ዜሮ ነው. H 2 እና I 2 ሲጠጡ እና ኤችአይአይ ሲፈጠሩ, ወደፊት የሚመጣው ምላሽ ፍጥነት ይቀንሳል እና የተገላቢጦሽ ምላሽ ፍጥነት ይጨምራል. ከተወሰነ ጊዜ በኋላ, ሁለቱም መጠኖች እኩል ናቸው, እና የኬሚካላዊ ሚዛን በሲስተሙ ውስጥ ይመሰረታል, ማለትም. በአንድ ክፍል ጊዜ የሚመረቱ እና የሚበሉ የኤችአይአይ ሞለኪውሎች ብዛት ተመሳሳይ ይሆናል።
በኬሚካላዊ ሚዛን ወደፊት እና የተገላቢጦሽ ምላሾች ከ V 1 = V 2 ፣ ከዚያ k 1 = k 2 2 ጋር እኩል ናቸው።
k 1 እና k 2 በተወሰነ የሙቀት መጠን ቋሚ ስለሆኑ ጥምርታቸው ቋሚ ይሆናል. በ K በመግለጽ፣ የሚከተለውን እናገኛለን፡-

K የኬሚካል ሚዛን ቋሚ ይባላል, እና ከላይ ያለው እኩልታ የጅምላ ድርጊት ህግ (ጉልድበርግ - ዋሌ) ይባላል.
ውስጥ አጠቃላይ ጉዳይለቅጽ ምላሽ aA+bB+…↔dD+eE+… ሚዛናዊ ቋሚው እኩል ነው። ![]() . መካከል መስተጋብር ለ የጋዝ ንጥረ ነገሮችብዙውን ጊዜ ምላሽ ሰጪዎች በተመጣጣኝ ከፊል ግፊቶች የሚወከሉበትን አገላለጽ ይጠቀሙ p. ለተጠቀሰው ምላሽ
. መካከል መስተጋብር ለ የጋዝ ንጥረ ነገሮችብዙውን ጊዜ ምላሽ ሰጪዎች በተመጣጣኝ ከፊል ግፊቶች የሚወከሉበትን አገላለጽ ይጠቀሙ p. ለተጠቀሰው ምላሽ  .
.
የተመጣጠነ ሁኔታው በተሰጡት ሁኔታዎች ውስጥ ምላሹ በድንገት የሚከሰትበትን ገደብ ያሳያል (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
በተመጣጣኝ ስብስቦች መካከል ያለው ግንኙነት በየትኞቹ ንጥረ ነገሮች ላይ እንደ መጀመሪያው ንጥረ ነገር (ለምሳሌ H 2 እና I 2 ወይም HI) እንደሚወሰዱ ላይ የተመካ አይደለም, ማለትም. የተመጣጠነ ሁኔታ ከሁለቱም ወገኖች ሊቀርብ ይችላል.
የኬሚካላዊው ሚዛን ቋሚነት በእንደገናዎች ባህሪ እና በሙቀት ላይ የተመሰረተ ነው; የተመጣጠነ ቋሚነት በግፊት (በጣም ከፍ ያለ ከሆነ) ወይም በ reagents ክምችት ላይ የተመካ አይደለም.
የሙቀት, enthalpy እና entropy ምክንያቶች መካከል equilibrium ቋሚ ላይ ተጽዕኖ. ሚዛኑ ቋሚ የኬሚካል ምላሽ ∆G o በቀላል እኩልታ ∆G o =-RT ln K ከመደበኛው የ isobaric-isothermal አቅም ለውጥ ጋር የተያያዘ ነው።
እሱ የሚያሳየው ትልቅ አሉታዊ የ∆G o (∆G o<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >> 0), ከዚያም የመነሻ ንጥረነገሮች በተመጣጣኝ ድብልቅ ውስጥ ይበዛሉ. ይህ እኩልታ K ከ ∆G o እሴት እና ከዚያ የሪኤጀንቶች ሚዛናዊ ውህዶች (ከፊል ግፊቶች) ለማስላት ያስችላል። ያንን ∆G o =∆Н o -Т∆S o ከወሰድን ከተወሰነ ለውጥ በኋላ እናገኛለን። ![]() . ከዚህ እኩልነት መረዳት እንደሚቻለው ሚዛኑ ቋሚ የሙቀት ለውጥ በጣም ስሜታዊ ነው. የሪኤጀንቶች ተፈጥሮ በተመጣጣኝ ሚዛን ላይ ያለው ተጽእኖ በአይነምድር እና ኤንትሮፒ ምክንያቶች ላይ ያለውን ጥገኛ ይወስናል.
. ከዚህ እኩልነት መረዳት እንደሚቻለው ሚዛኑ ቋሚ የሙቀት ለውጥ በጣም ስሜታዊ ነው. የሪኤጀንቶች ተፈጥሮ በተመጣጣኝ ሚዛን ላይ ያለው ተጽእኖ በአይነምድር እና ኤንትሮፒ ምክንያቶች ላይ ያለውን ጥገኛ ይወስናል.
የ Le Chatelier መርህ
የኬሚካል ሚዛን ሁኔታ በማንኛውም ጊዜ በተሰጡ ቋሚ ሁኔታዎች ውስጥ ይጠበቃል. ሁኔታዎች ሲቀየሩ, የተመጣጠነ ሁኔታ ይስተጓጎላል, ምክንያቱም በዚህ ሁኔታ የተቃራኒ ሂደቶች መጠኖች ወደ ተለያዩ ደረጃዎች ይለወጣሉ. ነገር ግን, ከተወሰነ ጊዜ በኋላ, ስርዓቱ እንደገና ወደ ሚዛናዊነት ደረጃ ይደርሳል, ነገር ግን ይህ ጊዜ ከአዲሱ የተቀየሩ ሁኔታዎች ጋር ይዛመዳል.
በሁኔታዎች ላይ በሚደረጉ ለውጦች ላይ ተመስርተው የሚዛን መፈናቀል በአጠቃላይ በ Le Chatelier መርህ (ወይም የመንቀሳቀስ ሚዛን መርህ) ይወሰናል። በተመጣጣኝ ሁኔታ ውስጥ ያለው ስርዓት የውጤቱን አቀማመጥ የሚወስኑትን ማናቸውንም ሁኔታዎች በመለወጥ ከውጭ ተጽእኖ ከተነፈሰ, ወደ ሂደቱ አቅጣጫ ይቀየራል, ይህ ሂደት የተፈጠረውን ተፅእኖ ያዳክማል.
ስለዚህ, የሙቀት መጠን መጨመር በሂደቱ ውስጥ ወደ ሚዛኑ ሂደቶች አቅጣጫ እንዲቀየር ያደርጋል, ኮርሱ ሙቀትን ከመሳብ ጋር አብሮ ይመጣል, እና የሙቀት መጠን መቀነስ በተቃራኒው አቅጣጫ ይሠራል. በተመሳሳይም የግፊት መጨመር ሚዛኑን ወደ ሂደቱ አቅጣጫ ይለውጠዋል እና የድምጽ መጠን ይቀንሳል, እና የግፊት መቀነስ በተቃራኒው አቅጣጫ ይሠራል. ለምሳሌ, በተመጣጣኝ ስርዓት 3H 2 +N 2 2H 3 N, ∆H o = -46.2 ኪጄ, የሙቀት መጨመር የ H 3 N ወደ ሃይድሮጂን እና ናይትሮጅን መበስበስን ያሻሽላል, ይህ ሂደት endothermic ነው. የግፊት መጨመር ሚዛኑን ወደ H 3 N መፈጠር ይቀይረዋል, ምክንያቱም መጠኑ ይቀንሳል.
በምላሹ ውስጥ ከሚሳተፉት ንጥረ ነገሮች ውስጥ የተወሰነ መጠን ያለው ስርዓት በተመጣጣኝ ሁኔታ ውስጥ (ወይም በተቃራኒው ከስርአቱ የተወገደ) ከተጨመረ ወደፊት እና የተገላቢጦሽ ምላሾች ተመኖች ይለወጣሉ ፣ ግን ቀስ በቀስ እንደገና እኩል ይሆናሉ። በሌላ አነጋገር ስርዓቱ ወደ ኬሚካላዊ ሚዛን ሁኔታ ይመለሳል. በዚህ አዲስ ሁኔታ በስርአቱ ውስጥ የሚገኙት የሁሉም ንጥረ ነገሮች ሚዛናዊ ውህዶች ከመጀመሪያው የተመጣጠነ ውህዶች ይለያያሉ, ነገር ግን በመካከላቸው ያለው ጥምርታ ተመሳሳይ ነው. ስለዚህ, በተመጣጣኝ ስርዓት ውስጥ, የሌሎቹን ሁሉ ስብስቦች ሳይቀይሩ የአንዱን ንጥረ ነገር ትኩረት መቀየር አይቻልም.
በ Le Chatelier መርህ መሠረት ፣ የ reagent ተጨማሪ መጠኖችን ወደ ሚዛናዊ ስርዓት ማስተዋወቅ ፣ የዚህ ንጥረ ነገር ክምችት በሚቀንስበት አቅጣጫ ላይ ሚዛናዊ ለውጥን ያስከትላል እና በዚህ መሠረት የግንኙነቱ ምርቶች ብዛት ይጨምራል።
የኬሚካላዊ ሚዛን ጥናት ለንድፈ ሃሳባዊ ምርምር እና ተግባራዊ ችግሮችን ለመፍታት ትልቅ ጠቀሜታ አለው. ለተለያዩ ሙቀቶች እና ግፊቶች የተመጣጠነ አቀማመጥን በመወሰን ለኬሚካላዊ ሂደት በጣም ምቹ ሁኔታዎችን መምረጥ ይቻላል. የሂደቱን ሁኔታዎች የመጨረሻ ምርጫ ሲያደርጉ, በሂደቱ ፍጥነት ላይ ያላቸው ተጽእኖም ግምት ውስጥ ይገባል.
ምሳሌ 1.ከተለዋዋጭ ጨረሮች ሚዛናዊ ክምችት ውስጥ የምላሽ ሚዛን ቋሚ ስሌት።
የ A + B 2C ምላሹን ሚዛን (ሚዛን ቋሚ) አስሉ, የተመጣጠነ ውህዶች [A] = 0.3 mol∙l -1; [V]=1.1ሞል∙l -1; [ሐ]=2.1ሞል∙l -1.
መፍትሄ።ለዚህ ምላሽ የተመጣጠነ ቋሚነት መግለጫው የሚከተለው ቅጽ አለው. እዚህ ላይ በችግር መግለጫው ውስጥ የተመለከቱትን ሚዛናዊ ውህዶች እንተካ፡ = 5.79.
ምሳሌ 2. ምላሽ የሚሰጡ ንጥረ ነገሮች ሚዛናዊ ውህዶች ስሌት። ምላሹ የሚከናወነው በቀመር A + 2B C መሠረት ነው።
የቁሶች A እና B የመጀመሪያ መጠን በቅደም ተከተል 0.5 እና 0.7 mol∙l -1 ፣ እና የምላሽ ሚዛን K p = 50 ከሆነ የአፀፋውን ንጥረ ነገሮች ሚዛን መጠን ይወስኑ።
መፍትሄ።ለእያንዳንዱ ሞለኪውል ንጥረ ነገር A እና B ፣ 2 ሞል ንጥረ ነገር C ይፈጠራሉ ። የቁሶች A እና B መጠን መቀነስ በ X mole የሚታወቅ ከሆነ ፣ የንጥረቱ መጠን መጨመር ከ 2X mole ጋር እኩል ይሆናል። የ reactants ሚዛናዊ ውህዶች እንደሚከተለው ይሆናሉ-
C A = (ስለ.5-x) mol∙l -1; C B = (0.7-x) mol∙l -1; C C =2x mol∙l -1
x 1 = 0.86; x 2 = 0.44
በችግሩ ሁኔታዎች መሰረት, ዋጋው x 2 ትክክለኛ ነው. ስለዚህ የ reactants ሚዛናዊ ውህዶች-
C A =0.5-0.44=0.06ሞል∙l -1; C B =0.7-0.44=0.26ሞል∙l -1; C C =0.44∙2=0.88ሞል∙l -1.
ምሳሌ 3.የጊብስ ኢነርጂ ለውጥ መወሰን ∆G o የምላሽ ምላሽ በተመጣጣኝ ቋሚ K r እሴት። የጊብስ ሃይልን ያሰሉ እና የ CO + Cl 2 = COCl 2 በ 700 K ሚዛን ቋሚው ከ Kp = 1.0685∙10 -4 ጋር እኩል ከሆነ ምላሽ ሊሰጥ እንደሚችል ይወስኑ። የሁሉም ምላሽ ሰጪ ንጥረ ነገሮች ከፊል ግፊት ተመሳሳይ እና ከ 101325 ፓ ጋር እኩል ነው.
መፍትሄ።∆G 700 =2.303∙RT ![]() .
.
ለዚህ ሂደት፡-
ከ ∆ ሂድ<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
ምሳሌ 4. የኬሚካል ሚዛን መለዋወጥ. በስርዓቱ N 2 +3H 2 2NH 3 -22kcal ውስጥ ሚዛኑ በምን አቅጣጫ ይቀየራል
ሀ) የ N 2 ትኩረትን በመጨመር;
ለ) የ H 2 ትኩረትን በመጨመር;
ሐ) እየጨመረ በሚሄድ የሙቀት መጠን;
መ) ግፊቱ ሲቀንስ?
መፍትሄ።በምላሽ እኩልታ በግራ በኩል ያለው የንጥረ ነገሮች ክምችት መጨመር በ Le Chatelier ህግ መሰረት ውጤቱን የሚያዳክም እና የስብስብ መጠንን ወደ መቀነስ የሚያመራ ሂደትን ሊያስከትል ይገባል, ማለትም. ሚዛኑ ወደ ቀኝ ይቀየራል (ጉዳይ ሀ እና ለ)።
የአሞኒያ ውህደት ምላሽ exothermic ነው. የሙቀት መጠን መጨመር ወደ ግራ የሚመጣጠን ለውጥ ያመጣል - ወደ ኤንዶተርሚክ ምላሽ, ውጤቱን ያዳክማል (ኬዝ ሐ).
የግፊት መቀነስ (ጉዳይ መ) የስርዓቱን መጠን ለመጨመር የሚያመጣውን ምላሽ ይደግፋል, ማለትም. ወደ N 2 እና H 2 ምስረታ.
ምሳሌ 5.የጋዝ ድብልቅ መጠን በሦስት እጥፍ ከቀነሰ በስርዓቱ 2SO 2 (g) + O 2 (g) 2SO 3 (r) ውስጥ ያለው ወደፊት እና የተገላቢጦሽ ምላሽ ምን ያህል ጊዜ ይለወጣል? የስርአቱ ሚዛናዊነት ወደ የትኛው አቅጣጫ ይቀየራል?
መፍትሄ።የ reactants ትኩረትን እንጠቁም: = አ፣ =ለ፣=ጋር።በጅምላ ድርጊት ህግ መሰረት, የድምፅ መጠን ከመቀየሩ በፊት ወደፊት የሚደረጉ እና የተገላቢጦሽ ምላሾች እኩል ናቸው
v pr = Ka 2 b፣ v arr = K 1 s 2
የአንድን ተመሳሳይ ስርዓት መጠን በሦስት እጥፍ ከቀነሰ በኋላ የእያንዳንዳቸው ምላሽ ሰጪዎች ትኩረት ሦስት ጊዜ ይጨምራል። 3ሀ፣[ኦ 2] = 3 ለ; = 3 ሰ.በአዲስ ትኩረት፣ ወደፊት እና የተገላቢጦሽ ምላሾች የፍጥነት v" np፡
v" np = ኬ(3ሀ) 2 (3ለ) = 27 ካ 2 ለ፤ v o 6 p = K 1 (3c) 2 = 9K 1 c 2።
![]() ;
; ![]()
በውጤቱም ፣የወደፊቱ ምላሽ መጠን 27 ጊዜ ጨምሯል ፣ እና የተገላቢጦሽ ምላሽ ዘጠኝ ጊዜ ብቻ። የስርዓቱ ሚዛናዊነት ወደ SO 3 ምስረታ ተሸጋግሯል።
ምሳሌ 6.የሙቀት መጠኑ ከ 30 እስከ 70 0 ሴ ሲጨምር በጋዝ ደረጃ ውስጥ የሚከሰተው ምላሽ ምን ያህል ጊዜ እንደሚጨምር አስሉ ፣ የምላሹ የሙቀት መጠን 2 ከሆነ።
መፍትሄ።የኬሚካላዊ ምላሽ መጠን በሙቀት ላይ ያለው ጥገኛ የሚወሰነው በቀመርው መሠረት በተጨባጭ የቫንት ሆፍ ደንብ ነው
በዚህ ምክንያት በ 70 ዲግሪ ሴንቲግሬድ ውስጥ ያለው ምላሽ በ 30 ዲግሪ ሴንቲግሬድ ውስጥ ካለው ምላሽ በ 16 እጥፍ ይበልጣል.
ምሳሌ 7.የተመጣጣኝ ስርዓት ሚዛን ቋሚ
CO (g) + H 2 O (g) CO 2 (g) + H 2 (g) በ 850°C ጋር እኩል ነው 1. የሁሉንም ንጥረ ነገሮች መጠን በተመጣጣኝ መጠን አስላ የመነሻ ውህዶች ከሆነ፡ [CO] ISH = 3 ሞል / ሊ, [H 2 O] RI = 2 ሞል / ሊ.
መፍትሄ።በተመጣጣኝ ሁኔታ ፣የወደፊት እና የተገላቢጦሽ ምላሾች እኩል ናቸው ፣እና የእነዚህ ተመኖች ቋሚዎች ሬሾ ቋሚ እና የተሰጠው ስርዓት ሚዛናዊ ቋሚ ይባላል።
ቪ np = ክ 1[CO][H 2 O]; ቪ o b p = ለ 2 [CO 2][H 2];
![]()
በችግር መግለጫው ውስጥ የመጀመሪያዎቹ ትኩረቶች ተሰጥተዋል K rበሲስተሙ ውስጥ ያሉትን ሁሉንም ንጥረ ነገሮች ሚዛናዊነት ብቻ ያካትታል. እስቲ እናስብ በሚዛንበት ጊዜ ትኩረትን [CO 2] P = Xሞል/ሊ. በስርዓቱ እኩልነት መሰረት፣ የተፈጠሩት የሃይድሮጂን ሞሎች ብዛትም ይሆናል። Xሞል/ሊ. ለተመሳሳይ የሞሎች ብዛት (ኤክስ mol/l) CO እና H 2 O ለመፈጠር ይበላሉ Xየ CO 2 እና H 2 ሞሎች። ስለዚህ የአራቱም ንጥረ ነገሮች ሚዛን (ሞል / ሊ)
[CO 2] P = [H 2] P = X;[CO] P = (3 - x); P = (2x)።
ሚዛኑን ቋሚ ማወቅ, ዋጋውን እናገኛለን ኤክስ፣እና ከዚያ የሁሉም ንጥረ ነገሮች የመጀመሪያ ትኩረት;
![]() ; x 2 = 6-2x-3x + x 2; 5x = 6, l = 1.2 mol/l.
; x 2 = 6-2x-3x + x 2; 5x = 6, l = 1.2 mol/l.
ሁሉም ኬሚካላዊ ግብረመልሶች ሊከፋፈሉ ይችላሉ ሊቀለበስ የሚችልእና የማይቀለበስ.የተገላቢጦሽ ምላሾች በተወሰነ የሙቀት መጠን፣ በሁለት ተቃራኒ አቅጣጫዎች በሚታይ ፍጥነት የሚቀጥሉ ምላሾችን ያጠቃልላል - ወደ ፊት እና ወደ ኋላ። የተገላቢጦሽ ምላሾች ወደ ማጠናቀቅ አይቀጥሉም ፣ አንዳቸውም ምላሽ ሰጪዎች ሙሉ በሙሉ ጥቅም ላይ አይውሉም። አንድ ምሳሌ ምላሽ ሊሆን ይችላል
በተወሰነ የሙቀት ክልል ውስጥ, ይህ ምላሽ የሚቀለበስ ነው. ይፈርሙ" » የተገላቢጦሽ ምልክት ነው.
የማይመለሱ ምላሾች በአንድ አቅጣጫ ብቻ ወደ ማጠናቀቅ የሚሄዱ ምላሾች ናቸው፣ ማለትም አንድ ምላሽ ሰጪዎች ሙሉ በሙሉ እስኪጠጡ ድረስ. የማይቀለበስ ምላሽ ምሳሌ የፖታስየም ክሎሬት የመበስበስ ምላሽ ነው፡-
ከፖታስየም ክሎራይድ እና ኦክሲጅን የፖታስየም ክሎሬት መፈጠር በተለመደው ሁኔታ የማይቻል ነው.
የኬሚካላዊ ሚዛን ሁኔታ. የኬሚካል ሚዛን ቋሚ
በአጠቃላይ መልኩ የአንዳንድ ሊቀለበስ ምላሽ እኩልነት እንፃፍ፡-
ምላሹ በጀመረበት ጊዜ የመነሻ ንጥረ ነገሮች A እና B ከፍተኛው ከፍተኛው ደረጃ ላይ ነበር። በምላሹ ጊዜ ይጠጣሉ እና ትኩረታቸው ይቀንሳል. ከዚህም በላይ በጅምላ ድርጊት ህግ መሰረት, ቀጥተኛ ምላሽ መጠን
ይቀንሳል። (እዚህ እና በታች, ከላይ ያለው ቀስት የሂደቱን አቅጣጫ ያሳያል.) በመነሻ ጊዜ, የምላሽ ምርቶች D እና E ውህዶች ከዜሮ ጋር እኩል ናቸው. በምላሹ ይጨምራሉ ፣ የተገላቢጦሽ ምላሽ መጠን በቀመርው መሠረት ከዜሮ ይጨምራል።
በስእል. 4.5 ለውጡን ወደፊት እና በተቃራኒው ፍጥነት ያሳያል
በጊዜ ሂደት ምላሽ. ከጊዜ በኋላ እነዚህ ፍጥነቶች እኩል ይሆናሉ - -» 
ሩዝ. 4.5.በጊዜ ሂደት ወደ ፊት (1) እና የተገላቢጦሽ (2) ምላሾች ለውጥ: - ቀስቃሽ በሌለበት: .......... - ቀስቃሽ በሚኖርበት ጊዜ
ይህ ሁኔታ ኬሚካላዊ ሚዛን ይባላል. የኬሚካላዊ ሚዛን በጣም የተረጋጋ, የድንገተኛ ሂደቶች ሁኔታን የሚገድብ ነው.ውጫዊ ሁኔታዎች ካልተቀየሩ ላልተወሰነ ጊዜ ሊቆይ ይችላል. በተመጣጣኝ ሁኔታ ውስጥ ባሉ ገለልተኛ ስርዓቶች ውስጥ, የስርአቱ ኢንትሮፒ ከፍተኛ ደረጃ ላይ ይደርሳል እና ቋሚ ሆኖ ይቆያል, ማለትም. dS = 0. በ isobaric-isothermal ሁኔታዎች, የሂደቱ አንቀሳቃሽ ኃይል, የጊብስ ኢነርጂ, በተመጣጣኝ ሁኔታ አነስተኛውን እሴት ይወስዳል እና ተጨማሪ አይለወጥም, ማለትም. ዲጂ = 0.
በተመጣጣኝ ሁኔታ ውስጥ ያሉ የምላሽ ተሳታፊዎች ስብስቦች ሚዛናዊነት ይባላሉ።እንደ ደንቡ ፣ እነሱ በተዛማጅ ንጥረ ነገሮች ቀመሮች ይገለጻሉ ፣ በካሬ ቅንፎች ውስጥ ተዘግተዋል ፣ ለምሳሌ ፣ የአሞኒያ ሚዛናዊ ትኩረት ከመጀመሪያው ፣ nenequilibrium ትኩረት C ^ NH ን በተቃራኒ ይገለጻል ።
በተመጣጣኝ ሁኔታ ውስጥ ያሉት ቀጥተኛ እና የተገላቢጦሽ ሂደቶች ተመኖች እኩል ስለሆኑ የቀኝ እጆችን የእኩልታዎች (4.44) እና እኩል እናደርጋለን
- -^ እኔ-
- (4.45)፣ የማጎሪያ ስያሜውን በመተካት፡ A፡ [A]""[B]" =?[D] /; )










